骨骼肌-肝脏轴在运动干预非酒精性脂肪性肝病中的作用机制研究进展
袁馨梦 项梦奇 孙雯 徐晔 刘宇婷 陆矫 张媛,2
1 南京体育学院运动健康学院(南京 210014)
2 上海交通大学系统生物医学教育部重点实验室,上海交通大学系统生物医学研究院运动转化医学中心(上海 200240)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是较为常见的一类慢性代谢性疾病,其可诱发肝脏炎症反应,肝细胞纤维化、肝硬化等严重病变,甚至癌变。调查显示,截至2019年,全球约37%的成年人可能患有NAFLD[1]。NAFLD成为被严重低估的重大健康威胁,其不仅与2型糖尿病、肥胖症等慢性代谢性疾病密切相关,还加剧胰岛素抵抗诱发动脉硬化及心脑血管疾病,甚至可能诱发肌少症,导致肌肉质量和数量下降[2-4]。Hong 等[5]研究表明,NAFLD 患者中约有20%患有肌少症,并伴有不同程度的肌细胞含量减少和高脂肪浸润。骨骼肌脂肪浸润率的提高与NAFLD 患病风险呈正相关。越来越多的证据显示,生活方式改变,包括膳食营养与运动干预是防治NAFLD的有效措施。随着整合生理学研究不断深入,近些年来,对运动干预的靶组织、靶器官的认识已不再局限于运动执行器官(骨骼肌、心肌等),而延伸至肝脏、脂肪、肾脏等运动代谢器官,大脑、神经等运动中枢系统。其中,运动是目前预防和治疗NAFLD 的重要手段,适宜运动不仅通过降低肝脂肪含量,改善肝脏纤维化程度、炎症、细胞凋亡和氧化应激等延缓NAFLD 发生发展[6,7],还可通过作用于其他组织器官,间接调节肝脏糖、脂代谢。例如骨骼肌是参与运动的重要供能器官,运动可刺激肌肉合成与分泌多种因子,这些因子不仅可以参与调节骨骼肌质量控制与物质、能量代谢[8],还通过血液循环发挥“远程交互作用”(distant crosstalk)效应,参与调节外周组织葡萄糖的摄取、肝糖异生、脂肪酸氧化分解及全身炎症反应等生理功能[9]。研究发现:运动刺激骨骼肌释放白细胞介素-6(interleukin 6,IL-6)可增加肝脏葡萄糖生成与输出[10]。肌肉因子鸢尾素(irisin)可通过抑制肝细胞中的甾醇调节结合蛋白2(human sterol regulatory element binding protein2,SREBP2)减少肝脏脂质积累和降低胆固醇水平,进而抑制脂肪生成[11]。提高骨骼肌功能、调节骨骼肌代谢可能成为有效干预NAFLD 发生发展的关键环节。因此,本文基于“骨骼肌-肝脏轴(muscle-liver axis)”参与运动干预NAFLD发生发展的生物学机制进行综述,分析NAFLD发展进程中骨骼肌组织结构功能变化特征,聚焦运动应激下运动执行器官(骨骼肌)与代谢器官(肝脏组织)的交互作用机制,揭示运动应激下组织器官间交互调控的应答规律,为运动防治NAFLD提供新视角及理论依据。
1 骨骼肌--运动中最主要的“通讯器”(communicator)
骨骼肌是运动中最主要的“通讯器”。早在20世纪30年代就有学者发现运动使血液中物质含量和肺通气功能发生改变[12]。近些年来越来越多的证据表明[13-16],骨骼肌在收缩过程中通过释放肌肉因子与各组织器官形成交互作用,在预防疾病和延缓慢性病病程中发挥作用[17]。
1.1 骨骼肌的内分泌功能
20世纪60年代,有学者推测骨骼肌可能不仅是保持姿势和维持运动的器官,其在调节机体葡萄糖稳态方面亦发挥重要作用[18]。直到21世纪初骨骼肌的内分泌功能才逐渐受到关注。IL-6是最早被发现的明星肌肉因子。1988年,Steensber 等[19]通过单侧动态膝关节伸肌运动实验证明,人体骨骼肌长期运动可释放大量IL-6,并具有调节骨骼肌糖、脂代谢的作用[20]。
随后,脑源性神经营养因子(brain derived neurotrophic factor,BDNF)[21]、成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)[22]、胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)[23]等肌肉因子相继被发现。1997年,Lee实验室[24]发现肌生长抑制素(myostatin),其可抑制骨骼肌的生长,并参与调节脂肪组织的功能和质量。近些年,更多肌肉因子逐渐被发现,越来越多研究表明运动时骨骼肌释放的肌肉因子在调节骨骼肌,及其他组织代谢中均发挥重要作用。Mahajan 等[25]发现了一种新的运动性葡萄糖稳态调节激素,并以希腊女神伊利斯金的名字命名为Irisin,其结构在人类与小鼠之间高度同源,可使皮下脂肪组织发生褐变,具有抗肥胖、抗糖尿病的作用[26]。除上述较为熟悉的肌肉因子外,目前采用细胞外囊泡纯化和无标记定量蛋白质组学技术,对运动时机体动静脉血的研究发现存在600多种潜在的肌细胞因子[27]。
1.2 运动应激下肌肉因子与其他组织器官的交互作用
运动对肌肉因子的调节作用已成为当下的研究热点。肌肉因子被认为是调节机体多种组织器官生理功能的关键信使,运动刺激骨骼肌收缩时肌肉因子被释放入血液或淋巴液中,再通过细胞外囊泡被运输至靶组织器官。诸多研究证实:运动性肌肉因子的释放与大脑、心脏、脂肪、骨骼、肠道及肝脏等多个组织器官均存在交互作用机制(图1)[28]。在大脑组织中,动物实验研究发现,运动可提高机体含Ⅲ型纤连蛋白域蛋白5(recombinant fibronectin type III domain containing protein 5,FNDC5)/鸢尾素水平,显著改善阿尔兹海默病(alzheimer disease,AD)小鼠的突触可塑性和记忆能力[15],运动还可以诱导蛋白酶B(cathepsinB)释放进而增加海马体的记忆功能[16]。其次,在心血管功能方面,鸢尾素通过激活靶细胞内丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及解偶联蛋白1(uncoupling protein-1,UCP-1)等信号通路增强线粒体功能,促进心肌再生、血管新生,改善血管舒张,降低心肌纤维化[29]。在运动过程中,卵泡素样蛋白1(follistatin like 1,FSTL1)通过激活内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)改善内皮功能,促进血管再生[30]。运动还可刺激爱帕琳肽(Apelin)释放,改善胰岛素敏感性,并通过促进血管舒张,增强心肌收缩力,促进血管新生[31]。对于脂肪组织,肌肉收缩可诱导血液循环中鸢尾素[32]、β-氨基异丁酸(β-aminoisobutyric acid,BAIBA)[32]、流星样蛋白[33]等肌肉因子水平升高,促进白色脂肪棕色化和脂肪酸β-氧化[34,35],增强胰岛素敏感性,提高脂联素和瘦素等的分泌水平[36]。同样,肌肉因子在骨骼与肌肉交互作用中也发挥重要作用,影响骨的形成、修复和维持。外周髓鞘蛋白22(peripheral myelin sheath protein 22,PMP22)被鉴定为运动诱导的新型肌肉因子,可抑制破骨细胞形成[37]。运动还诱导IGF-1[38],在促进骨细胞分化和骨形成方面发挥重要作用[39]。此外,近些年有研究报道肌肉因子与肠道菌群之间的关联机制,Backhed等[40]提出了“肌肉-微生物群轴(muscle-microbiota axis)”;Choi等[41]研究发现,运动组与安静组小鼠的肠道菌群共有2510 个显示出差异,这种差异变化可能与运动过程中特异性肌肉因子的分泌有关。在肝脏组织中,骨骼肌收缩刺激肌细胞分泌的β-氨基异丁酸不仅与脂肪组织有交互作用功能,还可激活过氧化物酶体增殖物激活受体α(peroxisome proliferator- activated receptorα,PPARα)减少肝脏脂肪生成,通过AMP 依赖的蛋白激酶[adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPK]途径减弱肝内质网应激和细胞凋亡,从而改善2型糖尿病(T2DM)小鼠的葡萄糖/脂质代谢紊乱[42]。鸢尾素通过抑制肝细胞中的SREBP2 以减少脂质积累和降低胆固醇水平,进而抑制脂肪生成[43];也可通过维持糖异生和糖原之间的平衡,在控制葡萄糖稳态方面发挥作用[44]。FGF21 能通过抑制糖尿病动物肝脏中的糖异生,刺激葡萄糖吸收并减少葡萄糖释放[45,46]。由此可见,运动性肌肉因子释放与外周组织器官之间的交互作用机制在机体多组织器官代谢中发挥着重要的调节作用。

图1 骨骼肌-器官(组织)交互作用[25]
2 “骨骼肌-肝脏轴”与NAFLD
NAFLD 发生发展的病理生理机制涉及多器官系统,骨骼肌在这一过程中所发挥的作用逐渐被广泛重视。基于骨骼肌在调节机体胰岛素抵抗和全身炎症方面所表现的显著优势,及近些年来提出的“骨骼肌-肝脏轴”机制,提高骨骼肌功能、调节骨骼肌代谢将成为有效干预NAFLD发生发展的关键环节。
2.1 “骨骼肌-肝脏轴”的提出
有关骨骼肌-肝脏交互作用机制的研究最早出现在1947年,即Cori 夫妇提出的Cori 循环(也称乳酸循环)理论[47],这一理论表明,骨骼肌-肝脏交互作用在维持体内葡萄糖稳态及调节肝脏能量代谢中扮演着重要角色。
骨骼肌是负责葡萄糖代谢[42]和能量平衡[48]的主要器官,是影响NAFLD等系统性代谢性疾病发病的核心组织[49]。Romijn 等发现[2],骨骼肌脂肪异位沉积,线粒体含量降低,间接导致肝脏甘油三酯的积累,可引起肝脏脂肪变性。这一发现表明,肝脏可能被动地适应与肌肉相关的脂肪酸代谢变化。由此,“骨骼肌-肝脏轴”的概念被提出[2],为深入揭示NAFLD 发生发展的生物学机制提供新的思路。
2.2 NAFLD中骨骼肌结构与功能变化
诸多研究表明,NAFLD 的发生发展与肌少症密切关联[50-55]。“肌少症”指的是老年人中与年龄相关的肌肉质量下降现象[56]。肌少症患者主要表现在肌肉数量和质量的下降,肌肉内脂肪浸润率提高,肌肉力量下降,进而导致肌肉功能障碍,甚至残疾、虚弱、自主活动能力丧失,并导致跌倒和死亡的风险增加[3,57]。Forsgren等[58]利用核磁共振成像(magnetic resonance imaging,MRI)技术对1204名NAFLD 患者进行肌肉成分测量发现,NAFLD患者的肌肉脂肪含量显著高于非NAFLD患者,骨骼肌中存在脂肪浸润,并伴有不同程度的肌细胞含量减少。并且在NAFLD 受试者中同时伴有不良肌肉成分(adverse muscle composition,AMC)的患者,日常生活功能较差,表现为握力下降、步行速度慢、不能爬楼梯、易摔倒等[58]。电子握力测功仪测量分析发现,握力(grip strength,GS)与NAFLD 呈负相关[59]。MRI和CT等断层图像高精度体积测量发现,伴随着肝脏纤维化的发展,非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)患者腰肌内脂肪堆积增加,四肢肌肉的横断面减小,肌肉密度显著下降15%~20%[58]。此外,NAFLD患者肌肉质量减少导致骨骼肌葡萄糖转运体4(glucose transporter type 4,GLUT4)表达量降低,易诱发胰岛素抵抗[60,61]。循环中游离脂肪酸含量增加,导致肝脏摄取脂肪酸负荷增大,同时脂质及其衍生物在肌细胞内、肌细胞间异位沉积,诱导线粒体功能障碍,干扰脂肪酸β氧化,增强活性氧(reactive oxygen species,ROS)的产生,导致脂毒性[62],这些表现使胰岛素抵抗及炎症反应进一步加剧。因此,深入探究NAFLD与肌少症之间的分子机制对于以骨骼肌为靶点干预NAFLD发生发展意义重大。
2.3 骨骼肌-肝脏交互作用机制
研究发现,胰岛素抵抗、合成代谢抵抗和全身炎症等是导致NAFLD伴随肌少症的关键病理生理过程(图2)[63]。聚焦骨骼肌-肝脏交互作用的靶点或通路,提高肌肉数量、质量及功能,可能是干预NAFLD/NASH发生发展的有效措施。

图2 骨骼肌-肝脏轴作用机制[63]
2.3.1 胰岛素抵抗
胰岛素在骨骼肌能量代谢中发挥着重要作用,通过介导细胞膜GLUT4促进葡萄糖摄取[64],激活p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)和雷帕霉素机械靶蛋白(mechanistic target of rapamycin,mTOR),促进肌肉蛋白合成基因mRNA 翻译[64],增强肌细胞内蛋白质合成,抑制蛋白质水解,并刺激骨骼肌中氨基酸的运输[65,66]。此外,胰岛素还发挥其血管舒张特性,增加了肌肉的营养供应,在血流动力学和代谢稳态间发挥生理耦合作用[67]。然而,在胰岛素抵抗状态下胰岛素效应减弱,并可能导致蛋白质合成减少[68-70],加之葡萄糖摄取受损,易导致全身葡萄糖稳态失调、肌少症恶化。肌少症患者常伴随脂肪异位沉积,甘油三酯在肝脏组织异常积累,导致肝脏炎症、氧化和内质网应激、线粒体功能障碍并诱发肝脏损伤[71]。因此,胰岛素抵抗也是NAFLD 发病机制的潜在驱动因素,并使NAFLD与肌少症直接关联[72,73]。
2.3.2 蛋白质合成代谢抵抗(Anabolic Resistance)
氮稳态失调是肝脏代谢受损的导火索[74],合成代谢抵抗是指细胞对各种合成刺激(如膳食、运动)的反应降低,从而导致蛋白合成代谢减慢。合成代谢抵抗可能是NAFLD 患者常见的肌肉质量损失的主要原因。在NASH、肝硬化和肝移植后或衰老的情况下,机体合成蛋白质的能力减弱[75],易出现负氮平衡。
骨骼肌蛋白质合成与氨基酸(amino acids,AAs)、激素(如胰岛素、生长激素和IGF-1)以及肌肉机械收缩刺激等因素相关[76]。亮氨酸可激活哺乳动物mTOR 复合物1[77],精氨酸可通过合成一氧化氮增加肌肉血流以提高底物供应[78]。相反,机体能量摄入不足或发生炎症反应时会加快蛋白质分解[55]。因此,合成代谢抵抗可能与氨基酸供应或输送不足、胰岛素抵抗和/或全身炎症相关。一项研究表明[79],调整体内氨基酸比例能够有效改善体成分和肝脏衰弱指数,以及握力、站立和平衡等综合能力。组织学实验同样证实[80],为期8周以上的耐力与力量相结合的运动训练可提高NASH患者肌肉力量,改善肝脏脂肪变性(脂肪肝指数下降),纤维生成(procollagen-3 减少)及纤维蛋白溶解(C4M2 增加)。综上所述,蛋白质合成代谢抵抗可能是影响NASH患者身体组成、生理功能和肝脏纤维化进程的核心因素,而运动训练可调节机体蛋白代谢,缓解蛋白合成代谢抵抗的水平。
2.3.3 全身炎症
研究认为,NAFLD 伴随亚临床炎症状态[81,82]。这一切源于肥胖引起的游离脂肪酸过量,肥胖患者血液循环中炎症细胞水平以及内脏脂肪含量增加,从而导致促炎细胞因子与脂肪因子分泌增多[60]。NAFLD中肝脏组织脂肪酸代谢过载,线粒体脂肪酸氧化增强伴随氧自由基产生增多,脂质过氧化现象明显,诱导促炎细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)和转化生长因子-β(transforming growth factorβ,TGFβ)[83]合成增加。此外,这些促炎细胞因子刺激蛋白质分解代谢,降低肌肉质量,诱发肌少症。有研究报道显示:在肌少症者中,肝脏组织c反应蛋白(c-reactive protein,CRP)水平升高[84],CRP 与Fc 受体(Fcreceptor,FcR)的相互作用导致单核细胞/巨噬细胞产生促炎细胞因子和活性氧,同时抑制嗜中性粒细胞功能,从而增强炎症反应,进一步刺激肝脏脂肪变性的发生[85]。因此,肥胖引发的炎症反应可能是NAFLD 病程发展的重要驱动因素。
3 运动诱导骨骼肌-肝脏交互作用
3.1 运动诱导肌肉因子分泌调节肝脏代谢
肌肉因子包括肌肉分泌的蛋白质、肽和代谢物,这些肌肉因子在肌肉收缩刺激下分泌增多,对肝脏代谢产生一定的影响[86]。目前调节肝脏代谢的主要肌肉因子包括Irisin、IL-6、FGF21、BAIBA、Myostatin等(表1)。

表1 运动性肌肉因子对肝脏代谢的影响
Irisin是一种新发现的肌肉因子,研究表明,运动刺激骨骼肌释放的鸢尾素在肝脏糖、脂代谢过程中发挥着不可替代的作用。鸢尾素通过AMPK 激活,可改善胰岛素抵抗状态下的肝脏糖、脂代谢失调。在分化的骨骼肌细胞中,鸢尾素以AMPK 依赖性方式激活p38 MAPK,并且比色吸光度测定显示,鸢尾素刺激GLUT4易位到质膜,但p38 MAPK 的抑制阻断了鸢尾素诱导的葡萄糖摄取[87]。So等[88]在HepG2细胞实验中发现,鸢尾素通过肝激酶B1(liver kinase B1,LKB1)刺激AMPK 和乙酰辅酶a 羧化酶(acetyl CoA carboxylase,ACC)的磷酸化,改善了高糖高胰岛素条件下诱导的肝胰岛素抵抗以及HepG2细胞的糖、脂代谢。
除了鸢尾素外,白细胞介素也具有减少NAFLD 脂滴的作用,其中以IL-6最具代表性。IL-6不仅可以由脂肪组织分泌,骨骼肌在运动过程中也可释放IL-6[101],并有研究证明IL-6 血清水平在有氧运动后增加,运动时间是主要影响因素[91,102]。但其信号通路是复杂的,骨骼肌细胞产生IL-6激活肝细胞中的信号转导因子和转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,导致微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)和自噬相关7(recombinant autophagy related protein 7,ATG7)等自噬相关分子的表达[103]。肝脏自噬维持了机体代谢稳态,但据报道[104],在高脂喂养的小鼠中,ATG7 表达受损可抑制肝细胞脂质分解,促进NAFLD 发生发展。然而,IL-6对肝脏脂质代谢的作用机制还有待深入研究。
FGF21是一种24kDa蛋白,由经典的FGF受体FGFR1c和FGF共受体β-klotho组成的细胞表面受体复合体发出信号[105],其表达和分泌受到丝苏氨酸激酶(australasian kidney trials,Akt)的调控[106]。FGF21 在啮齿动物和人类的肝脏中均高表达[107]。NAFLD 中FGF21水平上调可缓解脂质沉积诱导的不良反应,例如脂毒性、氧化应激和内质网应激[108]。运动刺激FGF21 分泌至血液循环,作用于肝脏AMPK信号通路,对肝细胞脂噬发挥重要作用[107]。值得注意的是,血浆FGF21 升高与FGF21 关键共受体klotho 蛋白β(beta-klotho,Klb)的表达下降有关,提示存在FGF21抵抗效应[108]。
另外,研究发现,在慢性运动小鼠收缩的骨骼肌中,释放的BAIBA可减少肝脏脂肪生成,并促进肝脏脂肪酸β-氧化[91]。一项研究报道[109],运动促进骨骼肌过氧化物酶体增殖物激活受体-γ共激活因子-1α(peroxisome proliferators-activated receptor γ coactivator α,PGC-1α)表达,进而通过增加BAIBA 诱导PPARα增强肝脏β-氧化水平。Kitase 等[110]发现,BAIBA 在生物系统中有两个对映体:D-BAIBA 和L-BAIBA,在肌肉收缩期间,L-BAIBA产生增加,进而刺激肝细胞游离脂肪酸氧化酶活性增强,进而血浆游离脂肪酸降低,肝脏甘油三酯和极低密度脂蛋白降低[111],但D-BAIBA的作用机制尚不明确。
与上述肌肉因子相比,肌肉生长抑制素(Myostatin)的分泌量与肌肉质量呈负相关。运动可降低Myostatin表达水平,避免代谢紊乱,降低肝脏脂肪沉积诱发的肌少症发生率[112]。综上所述,肌肉因子在肝脏脂代谢过程中发挥重要作用,但具体作用机制尚不明确,仍有待进一步研究。
3.2 运动诱导肝脏因子分泌影响肌肉功能
运动不仅促进肌肉因子分泌,同时对肝脏组织的分泌活动也具有一定影响,表现为血液循环中肝脏因子的浓度随运动发生变化[106]。大多数研究发现:运动诱导肝脏因子分泌,一方面可缓解肝脏糖、脂代谢紊乱,提高胰岛素敏感性;另一方面可缓解脂肪变性,减少血浆甘油三酯含量,从而使肝内脂肪含量减少[113]。近年来,部分学者还发现肝脏因子与骨骼肌形成交互作用,对肌肉质量、代谢等方面产生一定的影响[114,115](表2)。

表2 运动性肝脏因子对骨骼肌代谢的影响
IGF-1 是一种独特的肽,在大多数组织中以内分泌/旁分泌和自分泌的方式发挥作用。IGF-1被认为主要由肝脏分泌,并以多种方式作为增殖因子和分化因子发挥作用[114]。IGF-1 是调节骨骼肌合成、分解代谢的关键生长因子。在运动训练中,IGF-1水平增加介导骨骼肌生长和修复过程中生长激素浓度的降低[114],它通过PI3K/Akt/mTOR 和PI3K/Akt/GSK3β通路增加骨骼肌蛋白质合成[116]。同时,IGF-1/Akt 可下调核因子κB(nuclear factor kappa-B,NF-κΒ)和Smad通路抑制肌肉萎缩诱导的细胞因子和肌肉生长抑素信号转导[117]。另外,IGF-1还可刺激成肌细胞复制、肌原性分化和肌管肥大[112]。在对大鼠和人类的研究中发现[118-120],运动训练可增强IGF-1 mRNA 表达,调节骨骼肌生长和修复中生长激素的浓度[114],从而改善肝脏胰岛素抵抗[121]。由此可以看出,肝脏因子IGF-1 对维持骨骼肌质量具有重要性。
此外,肝脏因子胎球蛋白A(FetuinA)和白细胞源性趋化蛋白2(leukocyte cell-derived chemotaxin 2,LECT2)与肌肉糖代谢功能有关,研究证明FetuinA 和LECT2的浓度与胰岛素抵抗呈正相关[112]。体内高浓度FetuinA会抑制胰岛素受体和酪氨酸激酶的激活,并在骨骼肌和肝细胞中引起胰岛素抵抗[122]。动物实验表明,小鼠在进行运动训练后,血清FetuinA 增加的量减少[128]。在2 型糖尿病和NAFLD 患者中,以有氧运动为主的运动训练通常可减少循环FetuinA含量[129]。因此,运动训练可降低FetuinA分泌,缓解骨骼肌和肝细胞胰岛素抵抗[122]。与FetuinA 不同,运动训练对肝脏分泌LECT2 的作用尚不清楚,但实验发现LECT2 基因敲除鼠骨骼肌中胰岛素信号通路被显著上调,提示小鼠LECT2基因缺失可增加骨骼肌胰岛素敏感性[114]。
研究表明,肝源性分泌蛋白硒蛋白P(selenoprotein-P,SeP)过量产生,会诱导肝脏和骨骼肌胰岛素抵抗[132]。实验显示[132],运动通过调节SeP分泌,进一步调控小鼠肝脏和骨骼肌胰岛素样生长因子-1(IGF-1)通路,改善小鼠骨骼肌质量和胰岛素分泌水平。综上所述,运动分泌的肝脏因子与骨骼肌代谢及胰岛素调控密切相关,但不同运动状态对骨骼肌代谢的影响还有待进一步探究。
3.3 运动激活肝脏-肌肉组织交互作用
运动诱导肌肉和肝脏之间发生复杂的交互作用。运动不仅可诱导肌肉分泌肌肉因子[133],还可诱导肝脏因子的释放,这些物质在控制肝脏与其他组织代谢中发挥重要作用[133-135]。
如图3所示,运动诱导肝脏释放多种肝脏因子,通过调控循环中肝脏因子浓度,促进肌细胞的功能,改善肌肉对胰岛素的反应以及其他生理机能,并且在一定程度上逆转NAFLD,抑制其他组织代谢功能障碍的发生。另一方面,运动后肌肉向血液循环中释放影响肝脏糖、脂代谢的肌肉因子,增加相关肌肉因子的基因表达,促进肝脏游离脂肪酸的β-氧化,减少脂肪生成和脂肪在肝脏的异位沉积,从而改善NAFLD。此外,肌肉因子与肝脏因子共同降低促炎因子水平,形成骨骼肌-肝脏轴的良性代谢循环。
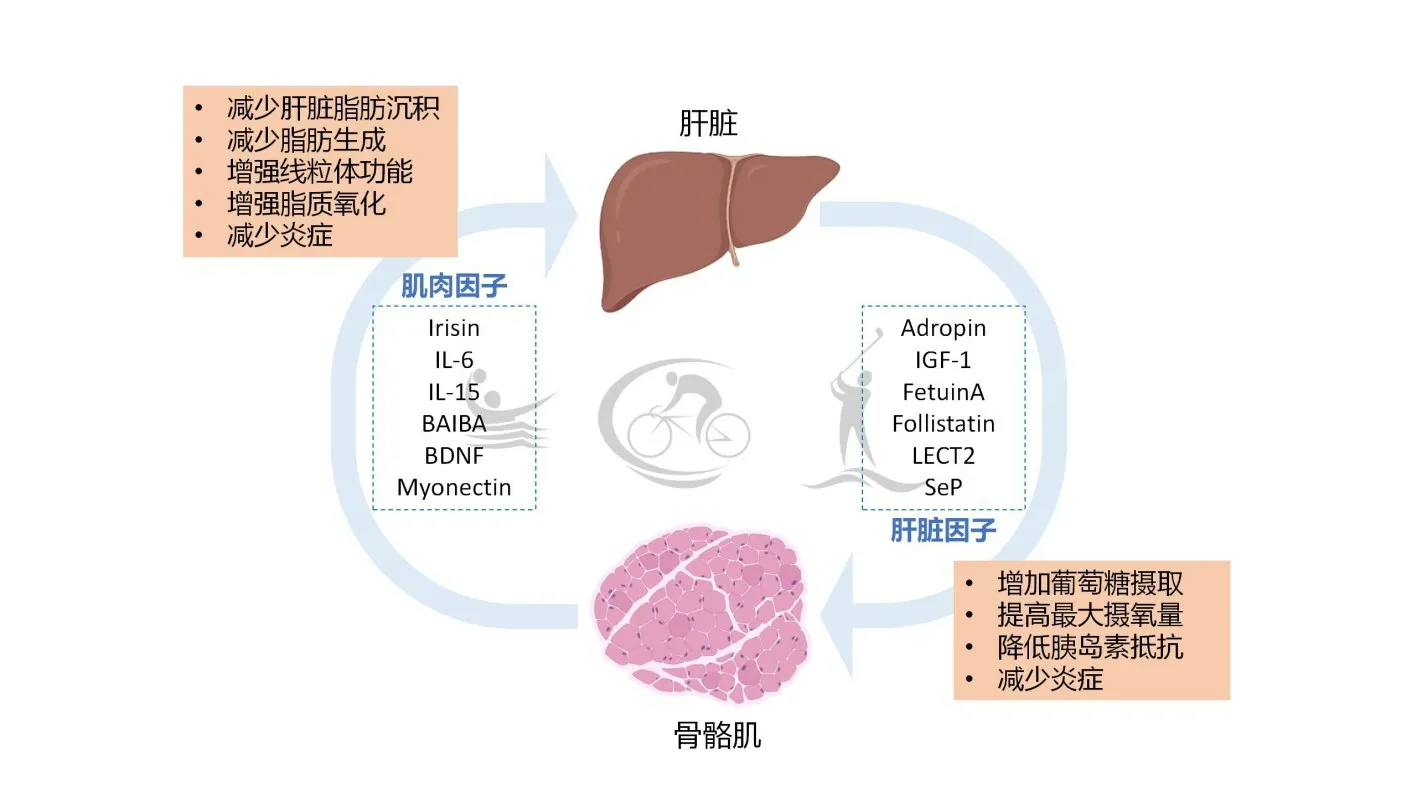
图3 运动激活骨骼肌-肝脏轴[136]
4 结论与展望
运动在NAFLD 发生发展中的作用备受关注,运动诱导细胞因子作为调控身体代谢稳态的新机制已成为当今研究热点。近些年来越来越多的研究表明,运动促进肌肉因子和肝脏因子分泌使骨骼肌和肝脏之间产生交互作用,形成“骨骼肌-肝脏轴”,为NAFLD的机制研究开辟了新的道路。也有学者发现,可能不仅存在骨骼肌与肝脏之间的交互作用,骨骼肌和肝脏还与脂肪组织存在一定联系。然而,迄今为止,人们对骨骼肌-肝脏之间交互作用机制的研究还存在局限,细胞因子如何在运动刺激下被分泌、释放,以及作用于靶器官的生物学机制还有待进一步研究。

