不同经颅脉冲电刺激方案对体力-认知混合任务疲劳消除的效果
武庆昌 房国梁 娄虎 赵杰修 申阳阳 刘建
1 苏州大学(苏州 215006)
2 国家体育总局体育科学研究所(北京 100061)
3 南通大学(江苏南通 226019)
疲劳是机体对持续和剧烈活动的一种正常的生理体验和认知反应[1],常常伴随着运动的发生而出现。当运动量超过个体负荷时,个体就会产生体力疲劳和(或)认知疲劳,其中体力疲劳是指机体的生理过程不能持续维持在某一特定水平或各器官不能维持预定的运动强度[2],认知疲劳通常被定义为一种主观状态,在长时间执行一项认知任务后,运动或工作表现下降[3]。在实际的体育运动中,疲劳的诱因、场景常常交叉出现,几乎所有的体育项目均有体力和认知的参与,产生的疲劳也是“混合型”的;同时,由于个体参与运动的程度不同,产生的疲劳程度也存在差异,因此,实际运动中产生的疲劳往往是不同程度的混合型疲劳[4]。运动后疲劳的消除一直是研究的热点问题。经颅电刺激(transcranial electrical stimulation,TES)是消除疲劳的新方法,包括经颅直流电刺激(transcranial direct current stimulation,tDCS)、经颅脉冲电刺激(transcranial pulsed current stimulation,tPCS)等,其中tDCS 在疲劳消除方面已有广泛应用研究。Williams 和Cogiamanian等[5-6]发现,tDCS 干预能提高个体的抗疲劳能力,Dissanayaka 等[7]的实验表明了tPCS 对疲劳的消除作用。但是,目前少有研究关注tPCS的刺激方案,针对不同程度混合任务疲劳状态下tPCS刺激方案的研究则更为不足。TES 的刺激方案通常包括刺激强度和刺激时间,TES刺激的总体效果和方向常常受到电流刺激强度和刺激时间的影响,其中刺激强度在刺激时间上的累计称作“刺激剂量”[8]。Peterchev 和Woods 研究表明针对个体不同疲劳状态实施差异化TES刺激方案是非常有必要的[9-10]。在大多数TES 研究中,刺激强度为1 mA(47.22%)、1~2 mA(45.83%),刺激时间为15~20 分钟(68.66%)、21~30分钟(8.96%)[11]。有学者发现,TES的干预效果具有时间依赖性,认为30分钟干预时间能产生更好的干预效果[12],也有学者从“刺激剂量”的角度研究,认为长时间的干预会降低神经元的兴奋性,反而降低了干预效果[13]。同样,对于TES合适的电流强度的探索也一直在进行[14]。由于颅骨和脂肪厚度的差异,个体对刺激的耐受性不同,不同个体存在不同强度的感觉电流,有研究表明,相同的刺激强度在儿童和成人身上引起的效果是相反的,在专业和非专业运动员身上的作用也有所不同,因此,固定的刺激强度可能是僵化的选择[15-17],探究不同刺激方案对疲劳消除的效果尤为有价值。Wallace 等[18]在研究中指出,合适的刺激强度应该以受试者个体的感觉电流强度为宜,当受试者处于适宜刺激时鼻根有震颤感、电极下的针刺感可耐受、无光视眩晕等其他异常感觉,认为个体刺激舒适度的上限是较为合适的电流强度;Chew 等[19]的实验进一步表明增加幅度为0.2 mA 的刺激强度更能使受试者产生大的皮层兴奋反应。可见,刺激强度为感觉强度或感觉强度+0.2 mA均有可能增大皮层的兴奋性。
心率变异性(heart rate variability,HRV)和功能近红外技术(functional near infrared spectroscopy,fNIRS)是反映疲劳状态的常用技术。HRV通过对自主神经系统(autonomic nervous system,ANS)的监测来反映疲劳,因其便捷、无创等优势,现已得到广泛的应用[20-21]。功能近红外技术是一种无创光学技术,通过监测脑部氧合血红蛋白(oxyhemoglobin,HbO2)浓度,进而推测疲劳状态。目前这两项技术在体育领域已有所应用,且在体力疲劳和认知疲劳的研究中取得了一定的成果[23-24]。
鉴于上述,本研究以篮球二级运动员为研究对象,采用不同的tPCS刺激方案对中度混合疲劳和重度混合疲劳的被试进行刺激,筛选对中度和重度混合疲劳消除效果最好的tPCS刺激方案,并从tPCS刺激方案的角度为不同程度混合疲劳的消除提供新的思路和理论依据,也为今后在实践中应用tPCS提供参考。同时,基于TES 不同“刺激剂量”对疲劳消除的效果可能存在差异,本研究提出如下假设:①不同tPCS刺激方案对不同程度的混合疲劳干预效果有差异;②方案B(30 min,感觉刺激强度)对中度体力-认知混合任务疲劳的消除效果最好;③方案A(30 min,感觉刺激强度+0.2 mA)对重度体力-认知混合任务疲劳的消除效果最好。
1 对象与方法
1.1 研究对象
被试为30 名某大学篮球二级运动员。所有被试身体状态良好,无心血管疾病,无认知类疾病,半年内无下肢受伤史,在实验前一周没有参加影响体力疲劳或认知疲劳的活动,均自愿参加本实验,对实验意图有清晰的认识,清楚实验流程并签署知情同意书,经过主观疲劳量表((ratings of perceived exertion,RPE)筛选后,最终20名被试完整地参加了实验,分为Ⅰ组(中度体力-认知混合疲劳程度,RPE评分5~7分)和Ⅱ组(重度体力-认知混合疲劳程度,RPE 评分8~10 分),每组10人(表1)。本研究严格遵守《赫尔辛基宣言》且获南通大学伦理委员会批准[南通大学伦审2020(1号)]。

表1 受试者基本信息
1.2 实验设计与流程
1.2.1 实验设计
本实验是一项随机双盲实验,研究对象不知晓刺激方案,tPCS 由能够熟练操作仪器但不知晓实验内容的人员进行干预。采用2(组别:实验组、对照组)×5(刺激方案:A、B、C、D、E)×2(测量时间:干预前、干预后)的三因素混合实验设计。刺激方案的刺激强度设置3个梯度,分别为假刺激、感觉刺激强度、感觉刺激强度+0.2 mA;刺激时间设置两个梯度,分别为20 分钟和30分钟,本研究共制定5 套刺激方案(编号A、B、C、D、E,表2)。

表2 tPCS刺激方案
1.2.2 实验流程
30 名受试者随机平均分为Ⅰ’、Ⅱ’两组,每组各15人,其中Ⅰ’组按照中度体力-认知混合疲劳的运动方案进行功率自行车阻力运动和数学计算,Ⅱ’组按照重度体力-认知混合疲劳的运动方案进行功率自行车运动和数学计算,直至被试达到预定疲劳程度。其中,中度混合疲劳程度标准为RPE 评分5~7 分,重度混合疲劳程度标准为RPE评分8~10分[25]。从两组中各选出符合要求的10 名被试,分别为Ⅰ组和Ⅱ组,随后开展正式实验,成功建立疲劳模型后立即进行HRV测试和fNIRS 测试,测试完毕后两组均实施tPCS 刺激方案,完成tPCS干预后立刻进行HRV测试和fNIRS测试。为避免两次测试之间的疲劳或刺激效应的影响,相隔48小时后重复疲劳建模、HRV测试、fNIRS测试、tPCS干预、HRV测试、fNIRS测试,直至所有符合RPE条件的被试均完成5种刺激方案[26](图1)。
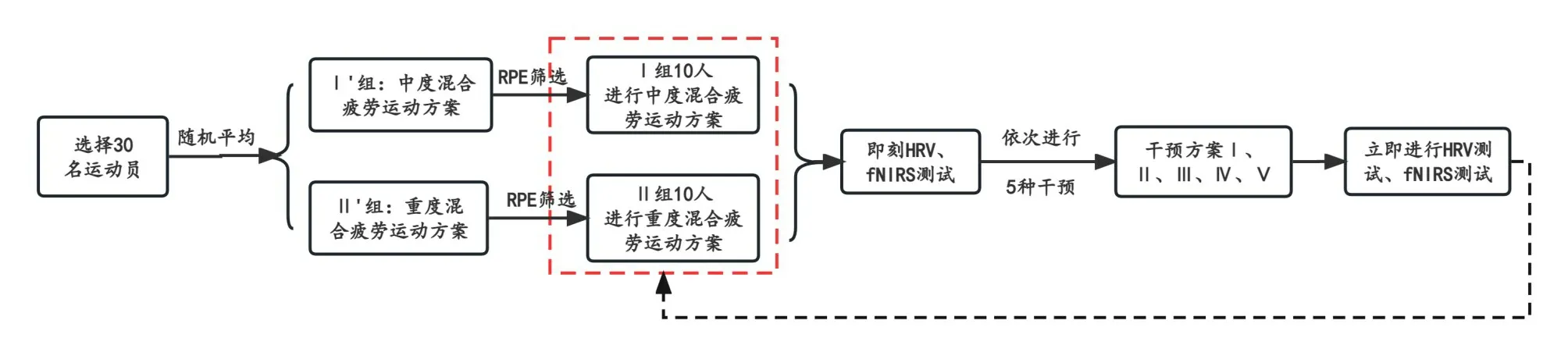
图1 实验测试流程图
1.3 体力-认知疲劳运动方案
体力疲劳采用世界卫生组织建议的踏车方案[27]。被试先体会1 分钟的零负荷运动,随后正式进入负荷阶段,起始负荷50 W,然后每3 分钟递增50 W,当负荷递增至200W后不再递增,直到受试者达到实验设计所要求的疲劳程度,其中Ⅰ组的疲劳标准为RPE 评分5~7 分,Ⅱ组的疲劳标准为RPE 评分8~10 分。在完成体力疲劳任务的同时完成认知疲劳任务,被试连续不断地完成心算任务,其中包含加法等式(如:67+79=142)和减法等式(如96-58=44),为保证任务的顺利进行,被试只需口头回答对错。
1.4 tPCS刺激干预方案
tPCS 仪器由操作熟练且未参与本研究的人员进行,为确保被试安全,所有操作遵循哥本哈根会议所达成的共识[28]。首先,单只电极放置在矢状线前额叶眶上区,双支电极放置在双耳乳突附近,并使用弹性绷带固定。在刺激开始后,电流强度在30 秒内由0 mA 上升至目标强度,目标强度由感觉强度和感觉强度+0.2 mA构成。感觉强度为受试者在tPCS干预下,鼻根有震颤感、电极下可耐受的针刺感,无光视眩晕等其他异常感觉。刺激结束时将电流在30 秒内调至0 mA,所有操作均由同一人员完成。假刺激方案进行相同的刺激时间、刺激强度和电流加速过程,但在初始加速之后30秒便将电流强度调至0 mA,各组不同刺激方案的具体电流数值见表2。在整个干预过程中,受试者如出现不良反应(疼痛、眩晕)则立即停止实验,每次刺激结束后,受试者填写一份刺激感觉问卷,记录自身感觉。
1.5 测试方法与指标
1.5.1 实验仪器
经颅脉冲电刺激仪:采用项目组(国家重点研发计划项目科技冬奥专项,编号:2019YFF0301604)自主研发的经颅脉冲电刺激仪进行刺激。tPCS 基本参数如下:刺激电流为60~80 Hz 的双极性电流,脉冲波形为方波,占空比29.7%,刺激时间间隔为3.75±0.25 ms,电流强度为0~2 mA;三片矩形电极片,一片大小为(5×9)cm2,两片大小为(5×5)cm2,刺激时间由刺激方案确定;本仪器已于2021年4月17日通过深圳华通威国际检验有限公司的安全认证,获得国家安全认证证书,报告编号为CHTSM21040049。
心率变异测试仪:心率变异性(HRV)指标由芬兰公司(Firstbeat Technologies Ltd)提供的Firstbeat Sports型HRV测试仪测得。
功能近红外光谱成像仪:本实验采用荷兰Artinis公司制造的OctaMon+便携式无线近红外脑成像系统对大脑的额叶HbO2浓度进行监测。OctaMon由光源发射器和光源接收器组成,其中光源发射极有8个,发射极发射760 nm 和850 nm 的光波,发射的光束经过大脑皮层后被2个光源探测器接收,采样频率为50 Hz。根据国际10-20系统脑电极标准导联,将fNIRS探测器放置于左前额叶皮质区(left prefrontal cortex,LPFC)和右前额叶皮质区(right prefrontal cortex,LPFC),左右两侧各1个光源探头和4个接收探头(图2)。

图2 功能近红外布局图
功率自行车:日本COMBI功率自行车(型号:POWERMAX-V Ⅱ)。
数学计算题:采用Klaassen 等学者推荐的数学计算任务[29-30]。
RPE 问卷:采用疲劳等级分法,RPE 评分为5~7 分时处于中度疲劳状态;RPE 评分为8~10分时处于重度疲劳状态。RPE 对疲劳程度的评估信度已得到验证,组间的相关系数为0.71~0.90[31-32]。
1.5.2 测试指标
HRV和fNIRS测试均采用坐立位测试。其中HRV的测试指标包括:(1)时域指标:正常窦性R-R 间期均值标准差(standard deviation of normal R-R intervals,SDNN)、相邻R-R 间期差值的均方根(root mean square successive difference,RMSSD);(2)频域指标:高频(high frequency,HF)、低频(low frequency,LF);fNIRS指标为HbO2浓度。
1.6 数据分析与处理
首先,使用nirsLABv2013.1 软件将收集到的原始数据转换成Matlab 格式数据,然后通过微分DIFF函数排除通道中超过25%的无效平线信号时的通道信号。随后采用Butterworth 滤波来减少信号中高频噪声(0.3 Hz呼吸和1 Hz心率)和低频噪音(小于0.01 Hz的代谢震颤)的干扰,提高信噪比。接着使用主成分分析法去除运动伪迹。最终纳入3 分钟的HbO2浓度监测,将得到的HbO2浓度数据依照改进后比尔-伯朗定律计算前额叶HbO2浓度的变化[33];通过Polar 软件剔除异常波动、干扰和伪差后,选取5min 信号样本进行HRV 时域和频域分析。
应用SPSS22.0软件和Microsoft Excel 2019公式进行统计分析,所得参数均采用平均值±标准差(±s)表示。采用重复测量三因素方差(Three-Way ANOVA,SPSS 22.0)分析各自变量(疲劳程度×刺激方案×测量时间)对HRV 各指标和HbO2的影响,实验的组内变量为刺激方案(刺激方案A、刺激方案B、刺激方案C、刺激方案D、刺激方案E)、测量时间(干预前测、干预后测),组间变量为疲劳程度(中度混合疲劳、重度混合疲劳)。采用事后检验以分析各指标在干预前后的差异,效应量用Cohen’s d表示,<0.19为弱效应,0.20~0.49为低效应,0.50~0.79为中效应,>0.8为高效应。显著性水平α设为0.05。
2 结果
本研究20名被试均完成所有实验流程,在干预前Ⅰ组和Ⅱ组受试者进行同质性检验,结果显示HRV和fNIRS数值在干预前均无显著性差异。
2.1 时域指标测试结果
方差分析显示,RMSSD和SDNN在组别、刺激方案和测量时间中均不存在交互效应,时间主效应显著,分别为RMSSD[F(1,18)=71.37,P=0.00],SDNN [F(1,18)=95.44,P=0.00]。事后检验发现,在RMSSD 中,Ⅰ组方案B、C、D干预效应显著,Ⅱ组方案A、B、C、D干预效应显著(图3a,表3);在SDNN中,Ⅰ组和Ⅱ组方案A、B、C、D 干预效应均显著(图3b,表3)。计算各指标变化率得知,在SMSSD 中,Ⅰ组方案D 干预后变化率最大,为23.59%,且Cohen’s d 值最大,为0.93;Ⅱ组方案C干预后变化率最大,为38.81%,且Cohen’s d值最大,为1.19(图4a,表3)。在SDNN中,Ⅰ组方案D干预后变化率最大,为35.46%,且Cohen’s d 值最大,为1.44;Ⅱ组方案A 干预后变化率最大,为43.75%,Cohen’s d 值为1.49(图4b,表3)。

图3 tPCS干预体力-认知混合任务疲劳后HRV和HbO2的变化
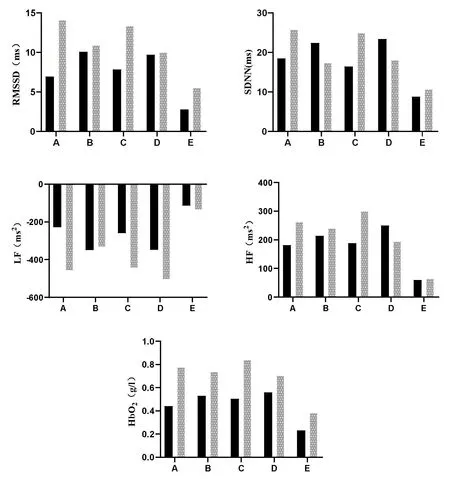
图4 tPCS干预体力-认知混合任务疲劳后HRV和HbO2差值比较

表3 tPCS干预不同程度体力-认知混合任务疲劳后生理指标变化
2.2 频域指标测试结果
方差分析显示,LF 和HF 在组别、刺激方案和测量时间中均不存在交互效应,时间主效应显著,分别为LF[F(1,18)=137.12,P=0.00],HF[F(1,18)=73.30,P=0.00]。事后检验发现,在LF中,Ⅰ组和Ⅱ组方案A、B、C、D 干预效应均显著(图3c,表3);在HF 中,Ⅰ组和Ⅱ组方案A、B、C、D 干预效应显著(图3d,表3)。计算各指标变化率得知,在LF中,Ⅰ组方案B干预后变化率最大,为-19.31%,Cohen’s d值为0.94;Ⅱ组方案A干预后变化率最大,为-58.73%,且Cohen’s d 值最大,为1.39(图4c,表3)。在HF中,Ⅰ组方案D干预后变化率最大,为26.09%,且Cohen’s d 值最大,为0.92;Ⅱ组方案C 干预后变化率最大,为36.60%,且Cohen’s d 值最大,为0.93(图4d,表3)。
2.3 HbO2测试结果
方差分析显示,HbO2在组别、刺激方案和测量时间之间不存在交互效应,时间主效应显著[F(1,18)=88.14,P=0.00]。事后检验发现,Ⅰ组和Ⅱ组方案A、B、C、D 干预效应均显著,(图3e,表3)。计算指标变化率得知,Ⅰ组方案D干预后变化率最大,为211.06%,且Cohen’s d 值最大,为1.58;Ⅱ组方案C 干预后变化率最大,为90.10%,且Cohen’s d 值最大,为1.64(图4e,表3)。
3 讨论
研究发现,疲劳的产生会降低脑部的HbO2浓度,且HbO2降低与疲劳程度成正相关[34]。当脑部HbO2浓度下降时会抑制神经元冲动,削弱人体的运动功能和认知功能[35]。本研究中,由于体力认知任务的存在,人体对脑部血氧的需求增大,但血氧的供应并没有改善,因此会造成脑灌注的相对不足,最终导致大脑工作效率降低,引发疲劳[36]。事实上,大脑的血流量也受到心输出量的限制,当副交感神经活力下降时,会降低心输出量,这也是疲劳产生的另一原因。Dissanayaka 等[37]在研究中发现,tPCS在额叶的刺激能够促进HbO2浓度的升高,原因在于tPCS 的刺激增强了皮质脊髓的兴奋性,增强了大脑对HbO2的转运能力,因此测得的HbO2的数值会上升[38]。也有学者认为在前额叶的tPCS刺激可通过额叶对副交感神经和交感神经系统进行调节,tPCS 的脉冲刺激增大了副交感神经的活力,而副交感神经与心输出量有着强相关关系,副交感神经活力的增加能增加心输出量,进而增大脑血流量和HbO2浓度,因此反映额叶氧合血红蛋白浓度的HbO2也出现上升,这与本实验的结果一致[38-40]。本研究中,受试者在经过tPCS 干预后,反映副交感神经活力的RMSSD、HF指标和大脑状态的HbO2指标均有所上升。有研究发现,额叶是负责认知功能的主要脑区,也是“疲劳网络”的中心区域,当疲劳产生后,各脑区之间的联系降低,而tPCS 刺激能够以脉冲的形式促进神经元放电,因此加强了脑区之间的联系,提高了大脑的运作效率,促进了疲劳的消除[41]。在本研究中,各组的tPCS 刺激方案均能对疲劳的消除有积极作用,但消除的大小却有所不同。
3.1 不同tPCS方案对中度混合疲劳消除的效果
在中度混合疲劳中,5种方案对疲劳的消除均有作用,其中方案E 为自然恢复,其干预效果不具有显著性,而方案B、C、D 干预效果显著,但效果大小各不相同,方案D(20 min,感觉强度)干预效果最大。有研究表明,当疲劳产生后,个体的主观舒适度、认知能力和感觉均有一定程度的下降,疲劳程度越大则下降程度越大[42]。当受试者处于中度混合疲劳的状态时,其主观舒适度和感觉的变化相较于重度混合疲劳下降较低,而刺激强度为感觉强度+0.2 mA 的电流可能超过了个体的耐受度,引发了个体更多的不适感从而降低了tPCS 的干预效果[43]。当过高的电流引发了不适感,刺激时间越长对受试者的疲劳消除并非越有利,因此在所有方案中,方案D(20 min,感觉强度)干预效果最好,而方案A(30 min,感觉强度+0.2 mA)干预效果则相对较差。这与Workman等的研究结果一致,Workman[44]的研究表明,当tDCS的输出电流过高时,会诱发受试者的“保护机制”,从而导致“高”强度的干预效果反而不如“低”强度的干预效果。Batsikadze等[45]则从干预时间的角度证实了此结论。Batsikadze发现,长时间的tDCS高强度刺激会使原本的促进作用转变成抑制作用,原因可能在于长时间高强度刺激破坏了神经突触的稳定状态,因此在中度混合疲劳中,长时间的高电流刺激会导致干预作用下降,而低强度电流干预效果较好。同时,我们推测,在进行长周期干预时,方案A(30 min,感觉强度+0.2 mA)要优于方案D(20 min,感觉强度),原因可能在于,人体对一定范围内的电流具有适应性,当人体适应这种“高”强度的电流后,只有高强度电流才能尽快使神经突触处于稳态状态,恢复人体机能,消除疲劳。
混合疲劳由体力疲劳和认知疲劳组成,当受试者处于中度混合疲劳的状态时,受试者的体力与认知均处于疲劳状态,且体力疲劳与认知疲劳能够相互影响[46-47]。当干预电流强度高于中度混合疲劳受试者的耐受度时,会通过额叶皮质抑制受试者的认知状态,进而影响体力疲劳的消除。Hoy 等[48]的研究结果也证实了以上推测。Hoy 等在研究中发现,使用tDCS 改善认知任务时,“低”(1 mA)的电流强度要好于“高”(2 mA)的电流强度。Hoy 认为大脑状态在离正常状态越接近时,增加tDCS 强度并不会引起更大或更持久的影响,因此处于中度混合疲劳的受试者在接受刺激强度为感受强度+0.2 mA 的电流时可能不利于认知疲劳的消除,进而影响到整个混合疲劳的消除。这一结果与Krupitsky 等[49]提出的人体稳态调节是一致的。Krupitsky 在研究中发现,当身体状态离正常状态越远时,则需要较大的刺激强度,当身体状态离正常状态越近时,则需要较小的刺激强度。所以,在中度混合疲劳中使用感觉电流强度比感觉电流+0.2 mA的强度更加合适。
Vöröslakos等[14]的研究则与上述有所不同,Vöröslakos 认为2 mA 以下的电流无法超过头皮/颅骨分流的消耗,并有足够的残余电流来可靠地影响皮质兴奋,因此可能需要更大强度的电流才能充分克服皮肤/颅骨电流分流。也有研究发现,只有较高强度(4 mA)的刺激才会在受试者中引起反应。以上研究结果的不同可能在于受试者之间差异,与大脑解剖结构、大脑活跃程度和个体颅骨厚度等因素有关[50]。
3.2 不同tPCS方案对重度混合疲劳消除的效果
在重度混合疲劳中,5种干预方案对疲劳的消除均有作用,其中方案E为自然恢复,在干预效果上不具有显著性,而在真刺激方案中,方案A、B、C、D 干预效果显著,其中方案C(20 min,感觉强度+0.2 mA)干预效果最大。而方案D(20 min,感觉强度)在所有真刺激方案中干预效果最弱,在干预前后差值也最小。这一结果与Moliadze 等[51]的研究一致。Moliadze 在研究中发现,当使用低强度(0.4 mA)电流进行干预时,神经活动可能受到抑制;使用中间强度(0.6~0.8 mA)的干预电流对受试者没有影响;而当使用1 mA 电流时,神经活动即刻出现兴奋。其原因可能在于低强度电流刺激一些锥体束神经元产生了“短间隔皮质内抑制范式”,使神经处于反射抑制状态,限制了电流通路,影响干预效果的提升;当干预的电流强度加大时,会使抑制作用减弱,甚至能增加神经的兴奋性,因此在重度混合疲劳中感觉强度+0.2 mA 的干预效果较大。Tergau 等[52]的研究也支持这一结果,其在研究中发现,当疲劳程度越高时,被试的皮层兴奋性则越低,此时,电流强度越大则引起的兴奋性越大;在重度混合疲劳中,大脑资源被极度消耗,因此需要较高强度的电流才能引走足够的兴奋来抵消疲劳所导致的不利影响。事实上,对于适度加大电流强度来增加干预效果的研究一直在进行[14]:Boggio 等[53]在研究中发现,2 mA 的电流相较于1 mA的电流更能提高受试者工作记忆的水平;Workman[15]在研究中发现,由于脂肪层和颅骨等原因,即使4mA的电流强度也是安全的,因此没有理由不增加电流强度以增强干预效果;也有学者认为增加TES 的刺激强度能加大干预效果的证据并不确凿[54];Batsikadze、Monte-Silva 等[55-56]发现,当电流强度大于2 mA 时,干预效应由兴奋变为抑制。造成这种区别的原因可能在于,受试者疲劳程度不同,当受试者的疲劳程度较轻时,高的电流强度起到抑制作用;而当受试者疲劳程度较高时,高的电流强度起到促进作用。而电流强度的高低应基于受试者当时的大脑兴奋状态。
在体力-认知混合任务疲劳中,体力疲劳和认知疲劳能相互影响。Holtzer 等[57]在研究中发现,认知任务所产生的疲劳负荷等因素能影响体力疲劳;而Lorist等[58]发现,体力疲劳发生后前额叶中的氧合血红蛋白含量降低,体力疲劳会削弱前额脑区相关的生理和认知加工。Zhou[59]的研究则表明,同时进行体力任务和认知任务时,大脑的不同区域会发生竞争,因此大脑必须协调相关脑区,对有限的大脑资源进行合理分配,提高大脑效率。在本研究中,tPCS直接刺激额叶区域,使认知疲劳的消除进程先于体力疲劳,当认知疲劳开始消除后,大脑的闲置资源则相对增多,进而促进了体力疲劳的消除,最终缩短了重度混合疲劳消除的时间,因此我们推测这可能是tPCS 干预重度混合疲劳时,相同刺激强度下20分钟的干预效果较大的原因。同时,亦有研究证实刺激时间并非越长越好,Teo[60]在研究中发现,20 分钟的电刺激能有效改善认知功能中的工作记忆,但是进行40分钟的刺激时,并没有发现工作记忆的进一步改善,甚至有所降低。其原因可能在于个体接受的刺激剂量存在一个“容量极限”,当刺激剂量接近容量极限时,进一步刺激并不能提高工作记忆水平。相反,过长时间的刺激会增加刺激剂量,使受试者局部大脑释放内源性神经保护递质,降低神经元的兴奋性,致使长时间的刺激效果小于短时间的刺激效果[13]。然而,干预时长对干预效果的影响并不是简单的线性关系,Teo[60]在研究中发现,使用tDCS进行干预时,只有干预的时间足够长,受试者的工作记忆才有显著改善,且干预的时间越长则干预效果的维持越好。造成这种区别的原因可能在于受试者任务的不同,Teo在进行认知任务训练时所消耗的认知资源较多,因此需要较长的刺激时间产生足够的刺激剂量消除疲劳。
刺激方案的效果是由受试者疲劳类型、疲劳程度、刺激强度和刺激时间等要素共同决定的,在确定刺激方案时应综合分析各个要素。在本实验中,相比于中度混合疲劳,重度混合疲劳时的体力资源与认知资源消耗更大,经过tPCS干预后,重度混合疲劳在干预前后的恢复幅度也越大。这一结果与Lebedev 等[61]的研究结果一致,Lebedev等在研究中发现,疲劳程度越高,则TES 的干预效果越好,同时也发现,TES 的干预效果与被试干预前的疲劳状态有关。因此,我们推测tPCS 干预时间的长短取决于受试者疲劳后所需的刺激剂量。目前,越来越多的证据表明,分析TES对混合任务疲劳的消除时需要将疲劳类型分开理解。体力疲劳对认知疲劳有影响,认知疲劳对体力疲劳同样有影响[62],且在大脑资源有限的前提下,先消除一种疲劳能一定程度上促进另一种疲劳的消除[63]。因此,将刺激时间和刺激强度简单看作两种相互独立的干预要素不利于干预效果的提升。在决定刺激时间前应首先确定刺激强度,同时,对受试者的疲劳类型和程度进行分类,避免受试者接受不符合自身疲劳状态的刺激强度。在本研究中,刺激强度的选择符合我们的预期,这意味着刺激强度贴近受试者的感觉阈值上限是合理的,且疲劳程度越大,受试者所能接受的刺激强度越大。因此,在重度混合疲劳中,增加0.2 mA 的刺激强度,既能充分激活神经元的兴奋性,也能避免“抑制效应”。由于额叶处于“疲劳网格”的中心区域,在混合疲劳中,tPCS对额叶的刺激能使体力疲劳和认知疲劳相互影响,提高疲劳的消除效率,加速疲劳的消除。因此,在本研究中,体力认知任务疲劳的消除时间,不是开始假设的30分钟,而是时间相对较短的20分钟;相反,过长的干预时间(30 分钟)超过了个体的“容量极限”,使干预效果下降。最终,本研究的假设与结论在刺激时间上相异,在刺激强度上相同。
4 研究局限性
第一,本研究缺少对疲劳消除效果的持续监测,无法观察到效果大小在时间线上的变化,也无法知道tPCS 干预效果的时长,这不利于在干预周期内对tPCS刺激强度和时间进行动态调节,以保证对使用者的干预效应始终保持在高水平状态。第二,本研究尚未对受试者中的性别进行分类研究,因此限制了tPCS 的应用性,降低了实验结果的概括性。例如,有学者发现,女性经过TES干预后,决策能力得到提升,但男性没有[64]。这提示我们,性别可能是未来制定tPCS 刺激方案的重要考虑因素,在制定更加细致的tPCS 刺激方案时应将性别因素纳入其中,以提高tPCS的应用场景。
5 小结
本研究得出以下两点结论:第一,运动员在产生体力-认知混合任务疲劳后,不同的tPCS 刺激方案对体力-认知混合任务疲劳的消除效果强弱存在差异,但对于每种程度的体力-认知混合任务疲劳可能存在一个最适“刺激剂量”。第二,5种干预方案对运动员体力疲劳消除的效果表现为:对运动员中度体力-认知混合任务疲劳的消除,tPCS方案D(20 min,感觉强度)效果最好;对运动员重度体力-认知混合任务疲劳的消除,tPCS方案C(20 min,感觉强度+0.2 mA)效果最好。

