不同剂量地西他滨联合CAG方案治疗骨髓增生异常综合征的疗效及安全性
吴 霞 蔡奕峰
骨髓增生异常综合征(MDS)是异质性后天性克隆型疾病,临床研究认为主要是因克隆性造血细胞发育异常所致无效造血、病态造血[1],患者会有感染、出血所致死亡风险,晚期可发展为白血病[2]。目前,临床治疗MDS的方案较多,其中以CAG化疗方案最为常见,近年来研究发现MDS发生与患者体内DNA异常甲基化造成抑癌基因失活相关[3]。地西他滨为DNA甲基化转移酶抑制剂之一[4],通过抑制DNA甲基转移酶,减少DNA的甲基化,从而抑制肿瘤细胞增殖。但其具体剂量及联合用药方法,目前国内外还没有统一结论[5]。本研究就不同剂量地西他滨联合CAG方案治疗MDS的疗效及安全性进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2021年12月南通大学附属医院及分院收治的86例中高危MDS患者作为研究对象,按照随机数字表法分为观察组与对照组,各43例。观察组男23例,女20例;年龄58~82岁,平均(65.33±8.48)岁;体重指数(BMI)为21.89~28.22 kg/m2,平均(23.76±1.17)kg/m2;RCMD型13例,RAEB-1型15例,RAEB-2型15例。对照组男24例,女19例;年龄57~82岁,平均(66.45±9.14)岁;BMI为21.54~28.18 kg/m2,平均(24.02±1.21)kg/m2;RCMD型15例,RAEB-1型14例,RAEB-2型14例。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。
纳入标准:1)经骨髓、免疫学、细胞遗传学等检查确诊,符合MDS诊断标准[5];2)心、肝、肾等功能正常;3)认知水平正常,可配合研究。排除标准:1)药物禁忌证;2)语言沟通障碍,无法遵医嘱用药;3)临床资料不完整。
1.2 治疗方法
两组患者行常规治疗(基础的补充、替代治疗),针对患者可能出现的感染症状,给予不同抗生素或抗病毒、抗真菌药物治疗,针对贫血和血小板减少,可使用红细胞生成素和血小板生成素或白细胞介素-Ⅱ类药物。
对照组予以标准剂量地西他滨(江苏正大天晴药业股份有限公司,国药准字H20120067,25 mg/瓶)联合CAG方案治疗,地西他滨剂量20 mg/m2,静脉滴注5 d,CAG方案具体如下:阿柔比星(深圳万乐药业有限公司,国药准字H10910092,20mg/瓶)6 mg/m2,静脉滴注8 d;阿糖胞苷(海正辉瑞制药有限公司,国药准字H20054695,100 mg/瓶)10 mg/m2,皮下注射,2次/d,第1~14天;粒细胞集落刺激因子(齐鲁制药有限公司,国药准字S20033040,150 μg/支)200 μg/m2,皮下注射,1次/d,第1~14天,当白细胞计数(WBC)>20×109/L时立即停药。每个疗程28 d,共治疗4个疗程。
观察组采用小剂量地西他滨联合CAG方案治疗,地西他滨剂量20 mg/m2,静脉滴注3 d,CAG方案具体方法同对照组。疗程同对照组。
1.3 观察指标
1)疗效判定标准:患者临床症状及体征全部消失,骨髓原始细胞低于5%为完全缓解(CR);症状以及体征明显改善,骨髓原始细胞较治疗前降低大于50%为部分缓解(PR);未达PR标准,但病情无进展达8周以上为疾病稳定(SD):病情恶化转化为急性髓系白血病(AML)或死亡为疾病进展(PD)[6-7]。缓解率(%)=(CR例数+PR例数)/总例数×100%。2)血液学毒性:检测两组患者WBC、中性粒细胞(NE)、血小板计数(PLT)及血红蛋白(Hb)变化情况。3)不良反应:观察并记录患者治疗期间不良反应发生情况,包括感染、出血、恶心呕吐、肝功能异常、低血压、心脏不良事件等。
1.4 统计学分析
采用SPSS 20.0统计软件进行数据分析,计数资料以百分率表示,组间比较采用χ2检验,计量资料以±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 治疗效果
观察组治疗有效率与对照组比较差异无统计学意义(P>0.05)。见表1。
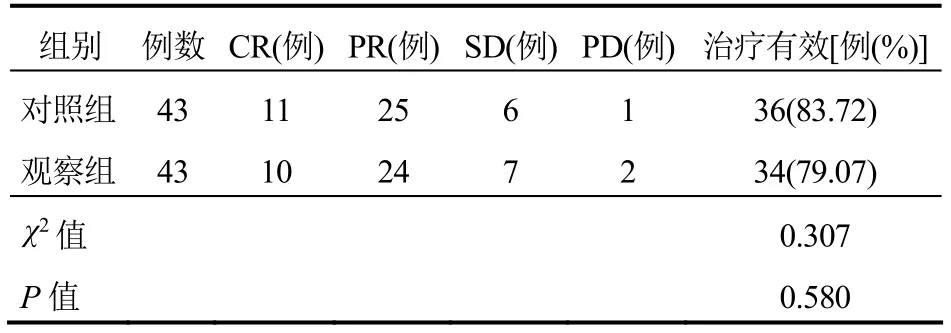
表1 两组患者治疗效果比较
2.2 血液学毒性
两组化疗第1天WBC、NE、Hb、PLT比较差异无统计学意义(P>0.05);化疗第14天时观察组WBC、NE、Hb、PLT高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者血液学毒性比较(±s)
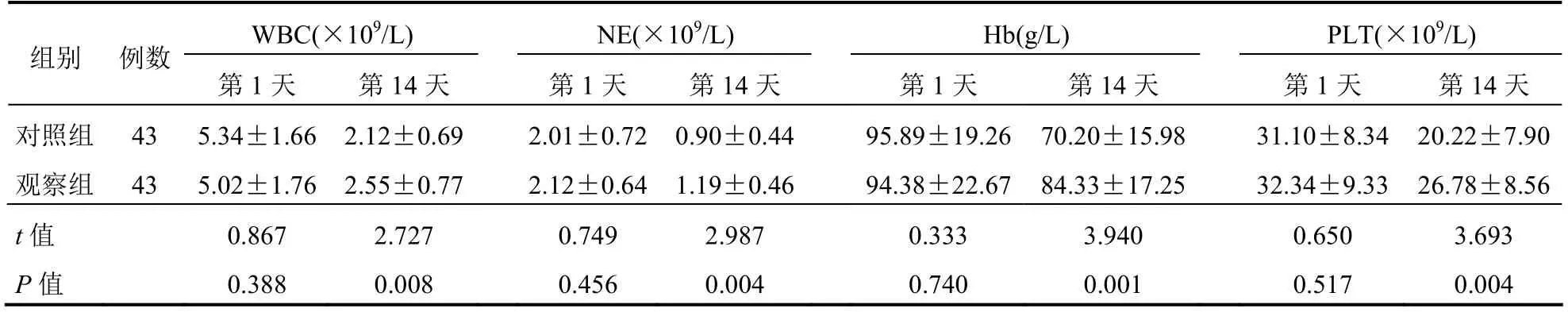
表2 两组患者血液学毒性比较(±s)
组别 例数WBC(×109/L) NE(×109/L) Hb(g/L) PLT(×109/L)第1天 第14天第1天 第14天 第1天 第14天第1天 第14天对照组 43 5.34±1.66 2.12±0.69 2.01±0.720.90±0.4495.89±19.2670.20±15.98 31.10±8.34 20.22±7.90观察组 43 5.02±1.76 2.55±0.77 2.12±0.641.19±0.4694.38±22.6784.33±17.25 32.34±9.33 26.78±8.56 t值 0.867 2.727 0.749 2.987 0.333 3.940 0.650 3.693 P值 0.388 0.008 0.456 0.004 0.740 0.001 0.517 0.004
2.3 不良反应
观察组不良反应发生率低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者不良反应比较
3 讨论
MDS是一种常见的血液系统疾病,其主要特征为血细胞数量降低、病态造血等,随着病情的发展恶化其可逐渐进展为AML,严重影响患者预后[8],诱发因素为强电磁场、电离辐射,长期与杀虫剂、细胞毒类化疗药物、有机溶剂及重金属接触等,其发病率随着年龄增长而上升[9]。临床上关于MDS的治疗需结合患者自身情况对其进行分层次治疗,低危型MDS主要予以支持治疗,以提高骨髓造血功能,提升免疫力;高危型MDS在给予患者上述基础治疗方案的同时联合异基因干细胞移植、去甲基化治疗或化疗[10]。标准化疗方案会出现较大不良反应,骨髓抑制较重,存在较多的并发症,老年人耐受性较差,采用异基因造血干细胞移植疗法,可提升MDS的治疗效果[11],但40%老年MDS患者在移植治疗过程中死亡,移植对于总体生存率无明显影响,因此需要寻求更安全、更有效的治疗方案[12]。
CAG治疗方案作为预激方案目前已广泛用于MDS患者的治疗中,其中阿糖胞苷通过干扰细胞DNA的复制合成[13],阿柔比星能够诱导DNA理化性质改变,抑制核酸合成,粒细胞集落刺激因子能够诱导恶性细胞凋亡,从而抑制白血病细胞克隆生长。目前,CAG方案治疗白血病在国内应用较广泛[14],但阿柔比星具有相应的心脏毒性,所以有心脏病史或中老年患者在使用时应慎重,并且由于受治疗耐受性差及老年患者骨髓造血功能自然衰减等因素的影响,单独实施该种治疗方案无法获得良好效果[15]。
MDS发生机制复杂,受遗传因素以及环境因素影响,近年来临床研究发现遗传因素在该病发生与发展中起到了重要作用,其中异常DNA甲基化是此类患者遗传改变的主要特征,DNA甲基化与DNA突变相比,可以采用药物干预来逆转,也为该病的临床治疗提供了新的方向[16]。地西他滨是一种特异性DNA甲基化转移酶抑制剂,该药物主要作用于细胞S周期,给药后由脱氧胞苷激酶激活并形成活性代谢物,代谢活性物可替代胞嘧啶与甲基化转移酶结合从而降低DNA甲基化,加速肿瘤细胞凋亡,该药物在2006年经美国食品药品监督管理局(FDA)批准上市,在国内外大量研究中表现出了较好的治疗效果,能够有效延缓患者的病情进展,降低死亡率。针对治疗剂量,也有不少报道显示地西他滨5 d疗法可以获得更好的效果[17-19],但因地西他滨在较大剂量具有细胞毒作用,可产生严重的骨髓抑制及相应并发症,因而其最适治疗剂量尚无定论。本研究采取了3 d小剂量及5 d标准剂量地西他滨联合CAG治疗,结果显示观察组治疗有效率与对照组比较差异无统计学意义,而在感染、恶心呕吐、肝功能异常、低血压、心脏不良事件等不良反应方面,观察组发生率低于对照组,具有较高的安全性,且血液学毒性比较化疗第14天时观察组WBC、NE、Hb、PLT高于对照组,血液学毒性低,提示采用小剂量用药方式,能够进一步降低不良反应发生情况。
综上所述,小剂量地西他滨联合CAG方案治疗MDS,具有良好的效果及安全性,可作为此类患者的一线治疗方案,但因本研究病例数有限,且属于单中心研究,结论具有较大的局限性,尚需要扩大样本量进一步证实。

