脊柱外科术后并发应激性溃疡5 例临床病例分析
张存鑫 孙磊 王倩 吕超亮 靳留忠
应激性溃疡(stress ulcer, SU)是一种急性消化道黏膜病变, 主要表现为胃肠道黏膜的糜烂、溃疡、穿孔、出血等病理改变[1]。其临床症状轻重不一, 部分患者可表现为无症状、内镜下发现的浅表病变或隐匿性溃疡, 也可有腹痛、烧心等表现, 伴随呕吐咖啡样胃内容物、黑便或者柏油样变, 严重者可伴有消化道大出血危及生命[2]。脊柱外科手术诱发的SU 病例相对较少,但文献报道其致死率高达23.07%[3]。本研究回顾性分析2017 年1 月~2022 年12 月在济宁市第一人民医院脊柱外科行全麻手术治疗的患者, 发现5 例患者术后发生SU, 其中2 例(40.00%)患者死于消化道大出血导致的失血性休克, 报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2017 年1 月~2022 年12 月在济宁市第一人民医院脊柱外科行全麻手术治疗的患者, 其中5 例患者术后发生SU, 患者年龄(59.60±8.59)岁;男3 例, 女2 例;腰椎间盘突出症2 例, 颈椎病2 例, 颈部脊髓损伤1 例;均在全麻下行手术治疗;1 例患者术前存在胃穿孔术后史, 1 例患者有慢性胃炎病史, 其余患者既往均无消化道溃疡病史;手术时间(127.00±26.38)min, 术中出血量(142.00±104.19)ml;2 例患者采取术中自体血回输治疗, 其余患者术中出血较少, 未采用自体血回输;术后3 例患者因失血性休克采取输血治疗, 2 例患者无输血及血液制品治疗;5 例患者均出现明显症状, 表现为腹痛、腹胀、恶心、呕吐, 呕吐物呈现咖啡色, 并伴有黑便, 生化检查均发现血红蛋白呈下降趋势。
1.2 辅助检查 本组患者在术后2~7 d 确诊SU。2 例患者伴有血红蛋白下降、胃管内抽出咖啡样液或黑便确诊。1 例患者在完善胃肠镜后确诊, 镜下见食管、胃底静脉曲张、破裂出血。1 例因急腹症完善腹部CT 后确诊, CT检查提示十二指肠穿孔。1例患者因黑便确诊,经治疗后复黄, 拒绝进一步检查, 未能明确出血部位。
2 结果
5 例患者中, 2 例患者给予胃肠减压、止血药物、质子泵抑制剂、保护胃黏膜等保守治疗后病情逐渐控制, 粪便常规检查大便隐血试验阴性。1 例患者因急腹症行十二指肠溃疡穿孔修补术治疗, 手术后康复出院。2 例患者因持续血红蛋白降低, 给予输血、胃肠减压、应用止血药物、质子泵抑制剂、保护胃黏膜等治疗, 病情加重后转入ICU进一步抢救治疗, 但病情危重,因失血性休克死亡。
3 讨论
SU 多表现为急性消化道黏膜损伤和浅表出血, 也可能导致严重的消化道大出血等临床症状[4]。其发病机制主要是应激通过破坏促进损伤的侵袭性因子和保护黏膜的防御性因子之间的平衡而引起消化道黏膜侵蚀而形成[5]。脊柱外科术后并发SU 相对罕见, 一项纳入30000 例腰椎间盘切除术的研究显示, 术后消化道穿孔的发生率仅为0.016%[6]。Lin 等[3]回顾了24026 例接受脊柱外科择期手术治疗患者的临床资料,仅有13 例(0.05%)患者出现SU, 其中3 例死亡。本研究在回顾了15000 余例患者的临床资料后, 发现也仅有5 例(0.03%)患者确诊为SU, 其中2 例(40.00%)死亡。鉴于脊柱外科术后并发SU 起病隐匿、发展迅速、后果严重, 因此积极预防和治疗术后SU 对保证患者围手术期的生命安全至关重要。
3.1 脊柱外科术后SU 的发病机制 SU 的发病机制可简单理解为复杂的致病因素导致消化道黏膜防御机制的崩溃, 引起了胃肠道管壁的损伤。研究表明, 前列腺素、粘蛋白、水、碳酸氢盐、三叶因子家族肽、磷脂和热休克蛋白等, 对维持消化道黏膜的结构完整和损伤后修复具有重要调节作用[7]。因此, 能够影响上述保护因素的应激环境(包括精神、心理、药物、创伤、感染等)均可以导致SU 的发生。研究发现, 胃肠道黏膜缺血是诱导SU 的主要原因[8]。患者在手术应激状态下, 会通过各种调节机制导致胃肠道黏膜血供减少,如:应激状态下的血液再分配;麻醉状态下心输出量减少、低血压;交感神经系统兴奋, 儿茶酚胺释放增加导致的胃肠道血管收缩等。因此, 维持患者术中及术后血压稳定对预防SU 有一定的作用。此外, 本研究总结发现, 在本组5 例患者中, 4 例采取了俯卧体位接受手术, 由于重力的作用和手术医师的操作, 导致患者腹部压力始终高于其他部位。这也进一步加重了胃肠道黏膜缺血的程度, 成为诱发SU 的重要原因。
3.2 脊柱外科术后SU 的危险因素
3.2.1 药物相关因素
3.2.1.1 术前用药 非甾体药物通常用于减少疼痛、发烧和炎症, 是脊柱退行性疾病的首选药物。在全球范围内, 与非甾体药物相关的溃疡患病率为9%~22%,每年服用非甾体药物的患者发生严重出血或穿孔的比例约为1%[9,10]。非甾体药物导致SU 的机制主要包括以下4 种:①直接损害消化道黏膜;②影响消化道黏膜的血供;③抑制血小板的凝集, 干扰人体的凝血机制;④影响人体免疫调节功能等[11]。糖皮质激素具有强大的抗炎作用, 通常用于治疗各种免疫和炎症性疾病[12]。糖皮质激素除了其本身的副作用外, 更为重要的是可以显著增加非甾体药物的致溃疡作用。当两种药物合用时, 其致溃疡作用会被叠加放大。此外, 由于多数老年患者常合并其他心脑血管疾病, 具有长期口服抗凝药物病史, 也大大增加了术后SU及出血的风险。
3.2.1.2 术中用药 研究发现, 多种麻醉用药, 如丙泊酚、依托咪酯、芬太尼、右美托咪定等, 均可诱发恶心、呕吐等胃肠道反应[13-16]。特别是在镇痛泵中的应用, 可能会导致患者持续数小时乃至数十小时的恶心、呕吐症状, 使消化道肌群长期处于痉挛、缺血状态,诱发SU。此外, 术中使用的多种抗生素均会影响凝血而增加手术出血和SU 出血风险。见表1。为了减轻手术操作对脊髓和神经根的激惹, 术中往往使用激素冲击治疗, 进一步增加了手术SU 的风险。
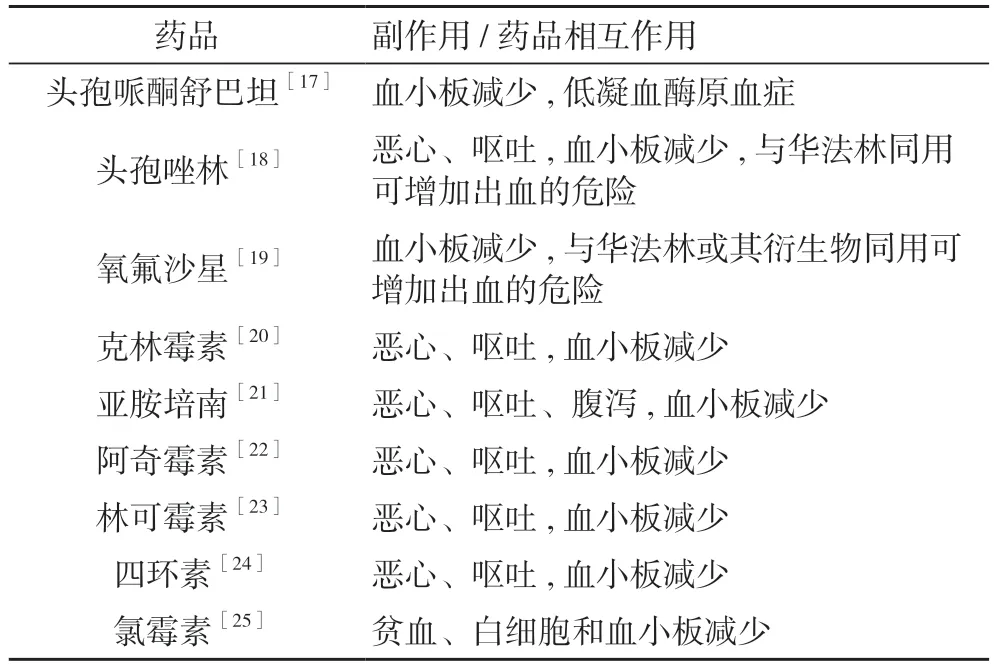
表1 各种抗生素的消化和血液系统毒副作用
3.2.1.3 术后用药 患者术后用药之间的相互作用往往容易被医生忽视。糖皮质激素类药物和非甾体药物合用显著增加了致溃疡作用[17,18]。为了预防深静脉血栓的形成, 预防性地使用抗凝药物已经成为共识。但是当肝素钙与非甾体药物、右旋糖酐、双嘧达莫合用时, 会增加患者的出血危险, 诱发消化道大出血[19-21]。脊柱外科全麻术后患者的用药品类多、药量大, 且多为静脉用药[22-25]。因此, 术后用药要充分考虑药品的作用、副作用及药品之间的相互作用, 避免不良后果的产生, 而这也往往是外科医师的薄弱之处。在本组患者中, 均在术后同时使用了非甾体药物、糖皮质激素类药物、抗凝药物和抗生素。这些药物的组合应用,显著增加了患者术后SU 及消化道出血的风险。
3.2.2 心理相关因素 研究表明, 大脑和肠道之间的相互作用与胃肠道疾病的发生密切相关[26]。中枢神经系统和胃肠道之间存在双向信号调节网络, 即脑-肠轴[27], 这一概念阐述了神经系统(包括中枢神经系统、自主神经系统和肠道神经系统)、内分泌系统和免疫系统之间相互串扰的理论[28]。研究表明, 心理应激与肠道的通透性、运动性、敏感性和分泌、肠道微生物组成以及肠道炎症的发生、再激活密切相关[29,30]。心理应激可以激活人体神经内分泌调节网络, 促进下丘脑分泌过多的促肾上腺皮质激素释放激素, 导致垂体前叶释放过多的促肾上腺皮质激素。而促肾上腺皮质激素又刺激肾上腺皮质分泌过多的糖皮质激素[31]。此外, 心理应激还可以通过刺激交感神经系统来控制自主神经反应, 促进肾上腺素和去甲肾上腺素的释放,诱导中枢和外周组织分泌过多的炎症介质/促炎细胞因子, 促进炎症核因子-κB 信号通路的激活, 加速胃肠道黏膜的损伤[32]。由此可见, 心理应激与SU 的发生密切相关。患者面对手术产生的心理应激主要表现为恐惧、焦虑、抑郁、烦躁等, 这些负面情绪不仅给患者带来精神上的困扰, 而且增加了手术风险[33]。因此,术前专业的心理辅导可能会有效减少术后SU 的发生。
3.2.3 自身疾病因素 患者自身健康状况对脊柱外科术后SU 的发生有直接作用, 特别是既往存在消化道疾病史的患者。研究表明, 15%~30%的消化道溃疡患者不会表现出任何明显的症状, 特别是老年人。因此, 详细的询问病史和必要的辅助检查对预防术后SU 至关重要。此外, 患者凝血功能、肝肾功能、骨髓造血功能异常均会增加SU 出血的风险, 自身免疫性疾病患者术后SU 的发生率显著升高。
3.2.4 手术相关因素 脊柱外科手术, 特别是侧弯矫正、肿瘤切除、上颈椎等手术, 具有创伤大、出血多、风险高等特点, 手术时间往往在数小时以上。研究表明, 当手术时间>3 h, 其各种风险均显著增加。此外,患者的俯卧体位会影响胃肠道黏膜血液回流, 导致胃肠道黏膜缺血, 诱发SU。
3.3 脊柱外科术后SU 的诊断 脊柱外科术后SU 的诊断主要依赖于症状体征、实验室和影像学检查以及内镜检查等。SU 最常见的症状为不明原因的黑便。对无显性症状的患者, 若出现胃液或粪便潜血试验阳性,或者不明原因血红蛋白浓度降低≥20 g/L, 应考虑有SU伴出血的可能。严重的SU 可伴随呕吐、呕血、腹胀、腹痛、肠鸣音活跃/亢进等表现, 有胃肠道穿孔时可伴腹膜刺激征, X 线或CT 检查可见液平面或气腹征。X 线钡餐检查可见壁龛或龛影。胃肠镜检查可见消化道糜烂、溃疡或者穿孔。伴有消化道大出血的患者可表现为呕血、便血、低血容量休克等表现。虽然在胃肠镜下发现消化道溃疡、穿孔是SU 诊断的金标准, 但不适用于所有患者。大便常规+潜血虽不能明确溃疡的确切部位, 但其灵敏度高, 可作为常规的筛查手段。
3.4 脊柱外科全麻术后SU 的治疗 多数SU 患者经抑制胃酸分泌、保护胃黏膜等治疗可有效缓解。对于伴有消化道出血的患者需在抑制酸保胃治疗的基础上,给予抗感染、抗休克, 纠正低蛋白血症、电解质和酸碱平衡紊乱, 静脉营养支持和抗炎等对症治疗。适量的镇静药或安定剂可安抚患者的紧张情绪, 必要时给予胃肠减压、胃内注入凝血酶、输血输液补充循环血量等治疗。同时需要定期监测胃液pH 值, 必要时动态监测胃内pH 值, 定期监测血红蛋白水平及粪便隐血试验。对于持续消化道活动性出血的SU 可采取胃肠镜下电凝、套扎止血等治疗。内镜治疗难以治愈的出血性溃疡可能需要对相应血管进行栓塞术以缓解出血。当进行内镜或血管栓塞治疗后, 症状仍未得到缓解或血流动力学仍未得到稳定, 则需要外科手术干预。
3.5 脊柱外科术后SU 的预防 全面预防术后SU 的发生对提升患者围手术期安全性非常重要。本研究认为预防脊柱外科术后SU 的发生包括术前、术中及术后3 个方面。具体内容如下。
3.5.1 术前预防 术前详细询问病史, 明确是否存在消化道溃疡病史、相关药物史、胃肠道手术病史等。常规完善大便潜血试验, 排除隐匿性溃疡。如有相关危险因素, 可进一步完善胃肠镜检查明确诊断。既往存在活动性溃疡的患者可经治疗后再择期手术。术前对患者进行心理辅导, 降低患者的心理应激水平。
3.5.2 术中预防 与麻醉医师紧密配合, 术前合理规划手术方案, 减少手术操作和麻醉时间。术中严密观察患者生命体征, 避免出现低血压、低心率, 导致腹腔脏器灌注不足。严格使用体位垫摆放体位, 特别是俯卧位手术, 注意腹部悬空, 减轻腹压。严格遵守无菌操作和抗生素使用原则, 避免抗生素滥用。术中轻柔操作,置钉过程减少对脊柱的剧烈按压和对软组织的破坏。术中及时止血, 推荐采用自体血回输以减少失血。
3.5.3 术后预防 术后用药充分考虑药物的适应证、不良反应及药物之间的相互作用。避免使用或少用致溃疡药物。严格控制术后疼痛, 减少疼痛刺激。对存在以下危险因素的患者, 术后及时应用抑酸药, 相关危险因素包括:①手术困难、复杂, 手术时间>3 h;②凝血功能障碍或有服用抗凝药物史;③既往有溃疡或消化道出血病史;④肝肾功能衰竭;⑤术中出现休克或持续低血压;⑥严重感染或心理创伤等。术后病情允许时尽早恢复饮食。密切观察患者的生命体征,注意患者是否存在反酸、嗳气、腹痛、腹胀、黑便等症状, 同时注意观察患者切口引流情况, 明确是否存在出血倾向。此外, 还要对患者进行宣教, 指导患者自我观察是否有牙龈出血、黑便等隐匿性症状, 做好心理疏导, 减轻患者心理应激水平。
脊柱外科术后SU 起病隐匿、发展迅速、后果严重,需要医生、护士和患者共同防治, 对于术后存在SU 风险的患者应积极采取预防, 对于术后确诊SU 的患者应积极采取措施, 做到早发现、早治疗, 努力挽救患者生命并提高预后。
4 附病例报告
患者, 男, 53 岁, 因腰椎间盘突出症在全麻下行腰椎后路减压融合内固定术, 术后第2 天进食后出现腹痛、腹胀、恶心、呕吐。腹部CT 检查见腹腔大量积气,提示十二指肠穿孔。行腹腔镜下十二指肠溃疡穿孔修补术, 术中于十二指肠窦处发现直径约0.6 cm 的溃疡穿孔。患者腹部CT 检查见图1。
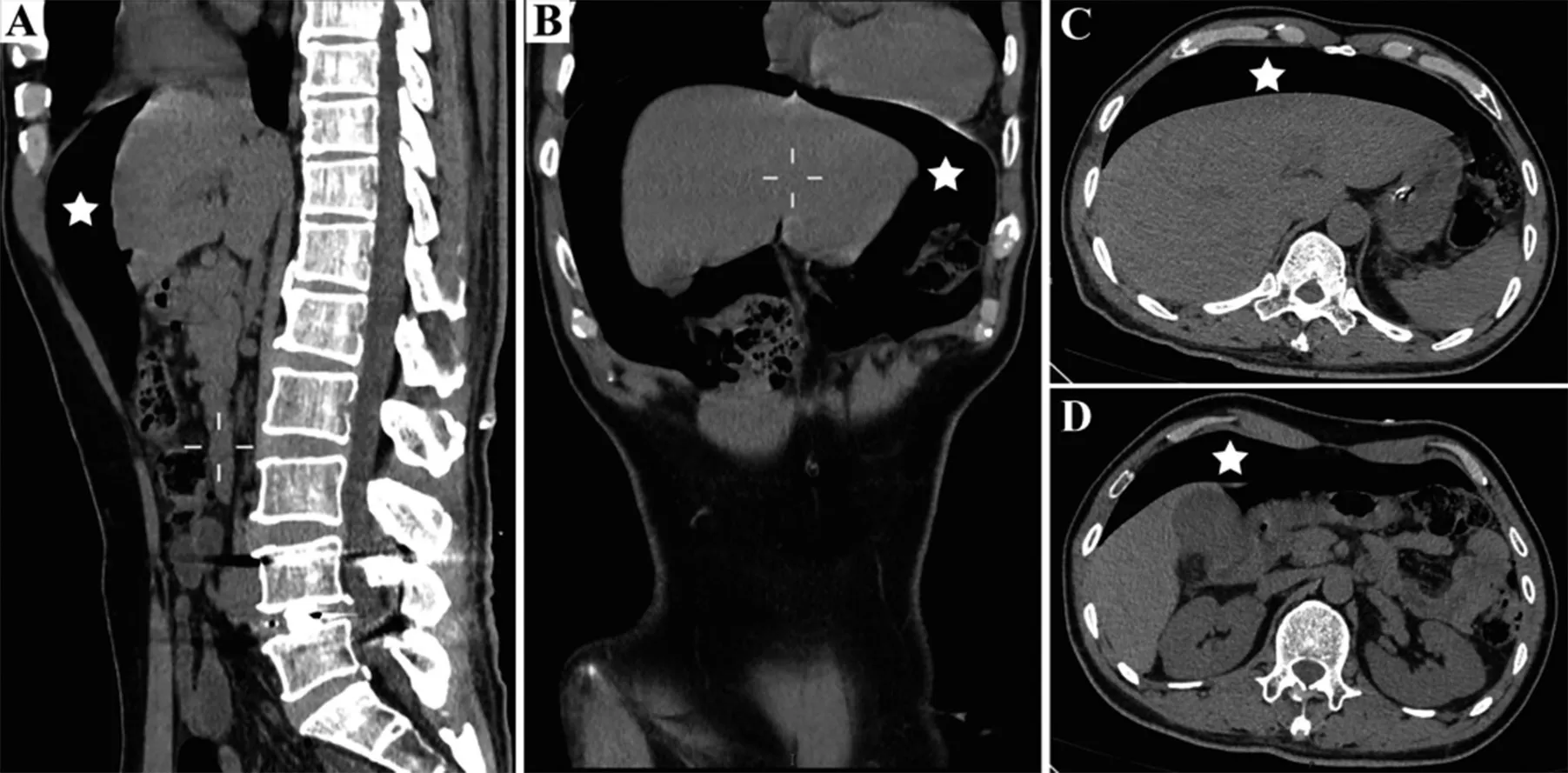
图1 1 例腰椎术后消化道穿孔患者的CT 影像资料注:A:矢状位见上腹部、肝脏前方大量积气;B:冠状位肝脏周围积气;C、D:T11 和L1 水平横断面见腹腔大量积气;☆:积气

