术前MRI影像组学模型预测子宫内膜癌风险分层
孔 伟,余裕珍,王 康,陈 龙,胡运祥,陈卫国
(1.南方医科大学南方医院放射科,广东 广州 510515;2.南方医科大学附属韶关市第一人民医院医学影像科,广东 韶关 512000)
子宫内膜癌(endometrial carcinoma, EC)为女性常见生殖系统恶性肿瘤[1],可根据术后病理结果分为高风险EC及低风险EC[2]:具有下列任一高风险因素,包括G3级子宫内膜样癌、非子宫内膜样癌、淋巴血管间隙侵犯(lymphovascular space invasion, LVSI)、国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)Ⅰb期及以上者为高风险EC,否则为低风险EC[3-4];其间治疗方案及预后均存在差异,使得术前评估EC风险分层并制定个体化治疗方案具有重要临床意义。影像组学可通过提取医学图像中的高通量特征而反映肿瘤内部情况[5-7]。本研究观察术前MRI影像组学模型预测EC风险分层的价值。
1 资料与方法
1.1 研究对象 回顾性分析2018年6月—2022年2月219例于南方医科大学南方医院及韶关市第一人民医院接受手术治疗的EC患者,年龄30~76岁、平均(54.9±8.6)岁。其中104例为高风险EC(高风险组),年龄34~76岁、平均(56.2±8.3)岁;115例为低风险EC(低风险组),年龄32~76岁、平均(53.8±8.8)岁。分别以于2018年6月—2020年12月、2021年1月—2022年2月接受检查者归入训练集(n=153)及测试集(n=66)并于集内划分亚组:训练集74例高风险(高风险亚组)、79例低风险(低风险亚组),测试集分别为30例及36例。纳入标准:接受盆腔MR检查;此前1个月内未接受侵入性检查、治疗以及放射或化学治疗;MR检查后2周内行全子宫+双侧附件切除术;术后病理证实为EC。排除标准:①MRI质量不佳;②肿瘤最大径<5 mm或边界不清;③其他恶性肿瘤。本研究经院伦理委员会批准[韶一医伦审(2020)44号、NFEC-2023-541],术前患者及家属均签署知情同意书。
1.2 仪器与方法 采用Philips Achieva 1.5T/3.0T MR仪或GE Signa EXCITE 3.0T MR仪、体部相控阵线圈,嘱患者仰卧,自盆底扫描至脐水平采集轴位及矢状位脂肪抑制(fat suppression, FS)T2WI;参数:TR 3 000~4 000 ms,TE 85~100 ms,层厚3~4 mm,层间距0.5~1 mm,FOV 350 mm×380 mm,矩阵256×256或512×512;EC病灶较大时酌情扩大扫描范围,对屏气不佳者采用呼吸门控。完成平扫后经肘静脉以2.0~3.0 ml/s流率注射钆喷酸葡胺(0.2 mmol/kg体质量),以三维梯度回波(three-dimensional gradient echo, 3D-GRE)序列采集轴位及矢状位增强FS-T1WI;参数:TR 3.0~3.6 ms,TE 2.0~2.3 ms,层厚3~4 mm,FOV 350 mm×380 mm,矩阵256×256或380×380;选取平衡期(120~180 s)图像进行分析。
1.3 评估图像 由分别具有5年(医师1)、10年(医师2)及20年(医师3)腹盆腔影像学诊断经验的医师参照文献[8-9]方法以盲法独立分析测试集MRI所示EC特征,包括肿瘤大小、信号、子宫肌层浸润深度、宫颈间质浸润、淋巴结转移及宫外侵犯;绘制受试者工作特征(receiver operating characteristic, ROC)曲线,预测EC风险分层。
1.4 处理图像及提取特征 采用3D Slicer 5.0.2对平扫轴位及矢状位FS-T2WI和增强轴位及矢状位FS-T1WI进行数据洗脱;利用Python程序及Simple ITK软件包依次对图像进行N4偏置场校正及重采样(1 mm×1 mm×1 mm)。将所获图像再次导入3D Slicer,由医师1在医师3指导下沿病灶边缘逐层手动勾画ROI,以高斯拉普拉斯滤波及小波滤波提取1 130个影像组学特征。按照1∶10比例随机抽取21例患者,由医师1重复勾画ROI,将结果用于一致性检验。
1.5 构建模型 采用Z-score法对提取数据进行标准化。对训练集影像组学特征行独立样本t检验,保留差异有统计学意义(P<0.05)者。利用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法分别于轴位、矢状位平扫FS-T2WI和轴位、矢状位增强FS-T1WI特征中筛选12、14、16及12个影像组学特征,共获得54个联合MRI特征;再以LASSO降维并选出25个联合LASSO特征,包括1个形态特征、6个一阶特征、4个灰度共生矩阵、5个灰度游程矩阵、4个灰度区域矩阵、1个邻域灰度差分矩阵及灰4个度相关矩阵。基于极度随机树(extremely randomized trees, ET)算法分别将以各序列特征、联合MRI特征及联合LASSO特征构建模型。采用10折交叉验证获得准确度、F1评分;绘制ROC曲线,计算曲线下面积(area under the curve, AUC),比较各模型预测效能。以测试集比较各模型预测效能。具体流程见图1。
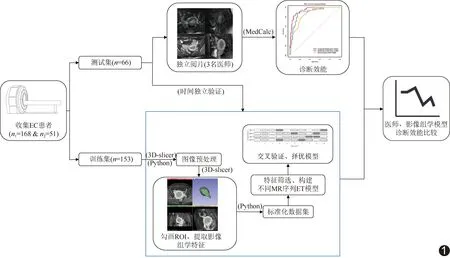
图1 构建术前医师、MRI影像组学模型预测EC风险流程图
1.6 统计学分析 采用Python 3.8及MedCalc 19.0统计分析软件。以±s表示符合正态分布的计量资料,行独立样本t检验;以中位数(上下四分位数)表示不符合正态分布者,行Mann-WhitneyU检验。以χ2检验或Fisher精确概率法比较计数资料。以组内相关系数(intra-class correlation coefficient, ICC)行观察者内一致性检验,以ICC>0.75为一致性良好。计算针对测试集主观阅片及各影像组学模型的敏感度、特异度及AUC,并以DeLong检验进行比较。P<0.05为差异有统计学意义。经Bonferroni校正后,比较医师联合主观阅片与最优影像组学模型预测EC风险的效能,P<0.025为差异有统计学意义。
2 结果
2.1 一般资料与肿瘤MRI及病理特征 训练集与测试集患者年龄、FIGO分期,EC病理类型、病理分级、LVSI、子宫深肌层受累(子宫肌层浸润深度≥50%)、宫颈间质浸润、淋巴结转移及宫外侵犯差异均无统计学意义(P均>0.05),见表1。
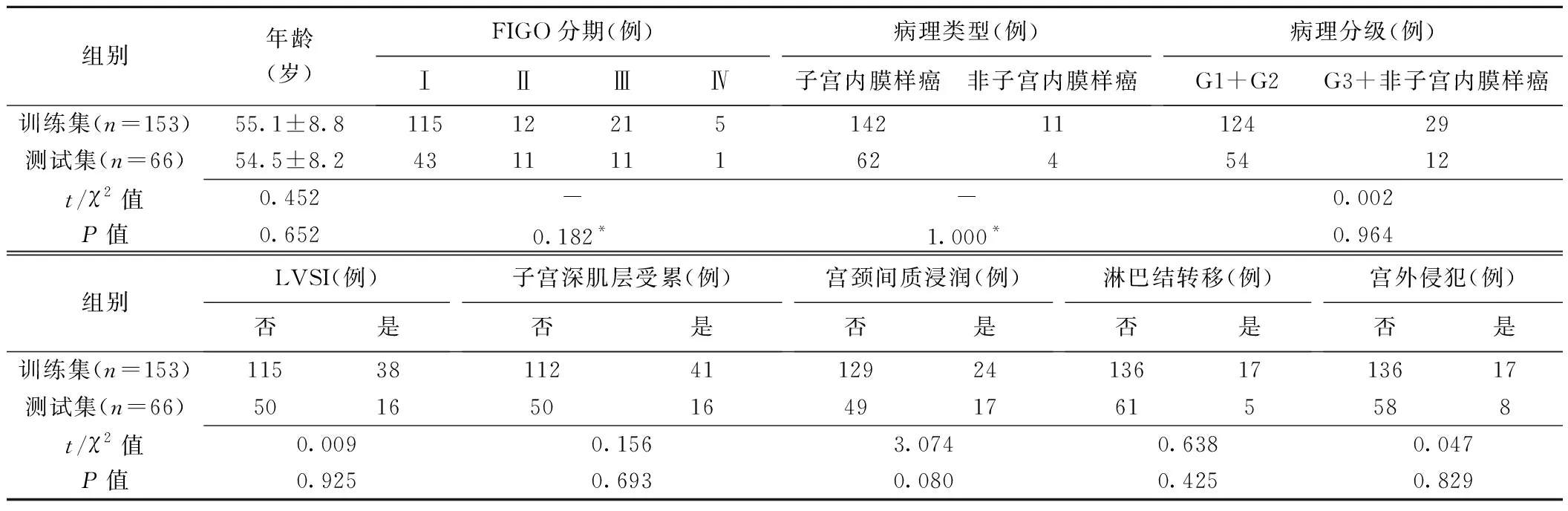
表1 训练集与测试集219例EC患者一般资料及肿瘤MRI与病理特征比较
2.2 医师主观阅片预测效能 两两比较,3名医师预测EC风险分层结果整体差异无统计学意义(P均>0.05);医师1、2与3名医师共同预测结果差异均有统计学意义(P均<0.05),医师3与3名医师共同预测结果差异无统计学意义(P>0.05)。见表2。
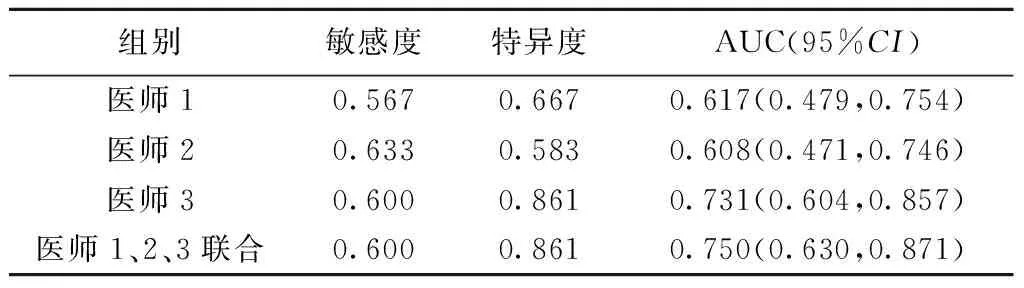
表2 医师主观阅片预测效能比较
2.3 训练集各影像组学模型预测效能 观察者内勾画ROI的一致性良好(ICC>0.75)。联合MRI模型与联合LASSO模型的准确度、F1评分及AUC均高于各单一序列模型;联合LASSO模型预测效能高于联合MRI模型,为最佳模型。见表3、图2。
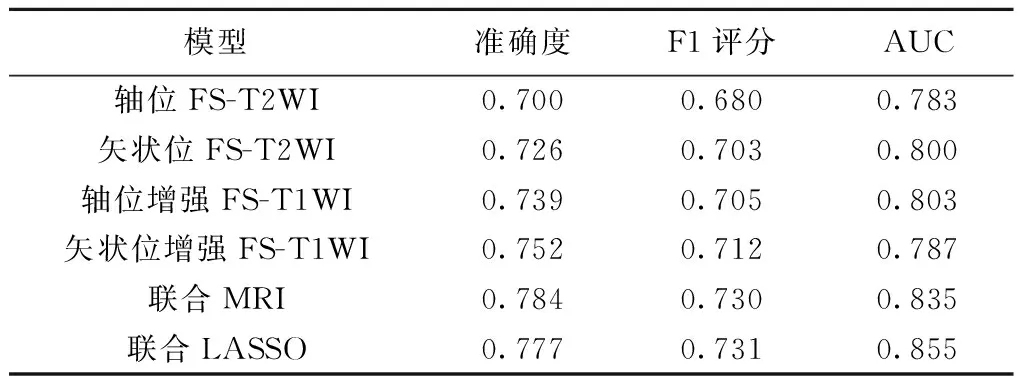
表3 各影像组学模型预测训练集EC风险的效能
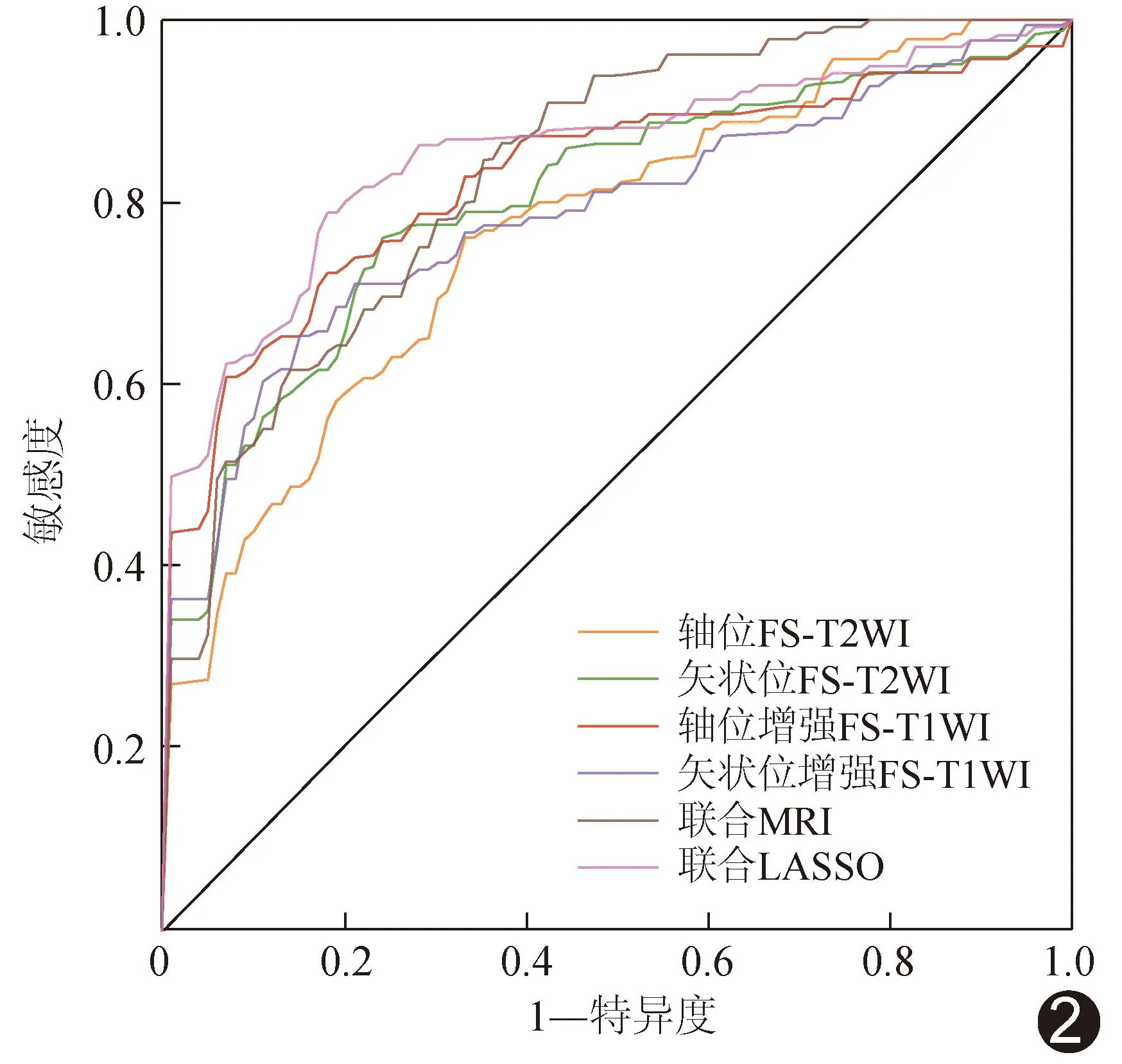
图2 各影像组学模型预测训练集EC风险的ROC曲线
2.4 医师主观阅片与各影像组学模型预测测试集EC风险的效能 联合MRI模型及联合LASSO模型的AUC均高于各医师主观阅片(P均<0.025);联合LASSO模型的AUC高于3名医师联合(P均<0.025)。联合LASSO模型预测效能最佳(AUC为0.934)。见表4。
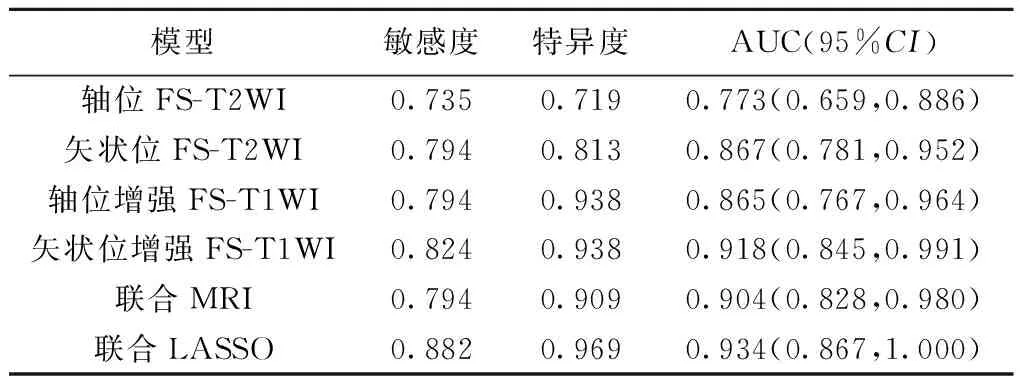
表4 各影像组学模型预测测试集EC风险效能
3 讨论
MRI软组织分辨率高、可多平面成像,为预测EC风险分层的首选影像学手段[9]。本研究针对相同序列正交平面图像的分析结果显示,尽管3名医师联合预测效能高于单一医师,但AUC仅为0.750,提示凭借医师主观阅读MRI难以准确预测EC风险分层。
YAN等[5]以临床及影像组学特征联合列线图预测EC风险分层,其AUC为0.877~0.919。LEFEBVRE等[10]基于盆腔MRI构建随机森林(random forest, RF)模型,术前预测EC风险分层的AUC为0.74~0.81。本研究采用ET方法构建的MRI影像组学模型在训练集和测试集预测EC风险分层的AUC分别为0.783~0.855及0.773~0.934,与列线图[5]结果相符而高于RF模型[10];可能原因在于相比RF模型,ET模型样本利用率、决策树间差异性及随机性均较高,能有效处理多维数据集并自动选择特征[11];且本研究以10折交叉验证后的准确度、F1评分及AUC为模型评价指标,可更好地体现模型稳定性及预测效能。本研究结果显示,联合MRI模型及联合LASSO模型各项指标均高于各单一序列模型,且联合LASSO模型预测效能最佳,提示可通过精简影像组学特征提高模型的预测效能。经Bonferroni校正对比分析,影像组学模型与主观阅片预测测试集结果更为准确,而联合LASSO模型的预测效能显著优于医师主观阅片(P<0.025)。
本研究所获联合LASSO模型的影像组学特征以纹理特征(24/25,96.00%)为主;其中的一阶纹理特征描述ROI内像素或体素强度分布,高阶纹理特征描述图像体素灰度间的空间排列关系,均与肿瘤细胞异质性存在一定相关性[12]。
综上所述,术前MRI影像组学模型可有效预测EC风险分层。但本研究为回顾性研究,缺乏大规模外部数据验证,有待通过前瞻性研究进一步观察。

