基于倾向性评分匹配对比肝切除并微波消融与TACE治疗多发性肝癌的临床效果
贾哲,张海涛,李培鑫,刘坤,马超
首都医科大学附属北京友谊医院普外科,北京 100050
目前,肝癌已成为我国第4 位常见恶性肿瘤和第2 位肿瘤致死原因,是严重威胁我国居民身体健康和生命安全的恶性肿瘤之一[1]。肝癌早期往往无特异性症状,大多数患者就诊时已进展至中晚期,错过了最佳治疗时机,预后较差[2]。手术切除是肝癌的首选治疗方法,通过切除肿瘤病灶,减轻肿瘤负荷,控制病情进展[3]。但现阶段对于多发性肝癌能否手术治疗尚存在争议。随着医学技术不断进步,介入治疗逐渐成为临床治疗肝癌的重要手段[3]。经导管肝动脉化疗栓塞术(TACE)、射频消融术、微波消融术等介入治疗方法均能使肝癌患者生存获益[4]。多发性肝癌患者肝脏内有多个肿瘤病灶,即使能手术切除,大部分也只能进行姑息性手术,无法达到根治的目的。因此,TACE 被认为是多发性肝癌的首选治疗方法。虽然TACE 能够直接作用于病灶,但仍旧无法避免术后复发和转移。微波消融术是利用微波热效应杀灭肿瘤细胞的介入微创治疗方法,但由于其热能是从能量源向周围发散,离能量源越远,消融温度越低,并且容易受到组织碳化、电阻抗改变以及周围血管引起的“热沉效应”影响,导致肿瘤组织残余,难以实现完全消融。因此,对于多发性肝癌提倡多学科综合治疗。本研究基于倾向性评分匹配对比了肝切除并微波消融与TACE 治疗多发性肝癌的临床效果。现报告如下。
1 资料与方法
1.1 临床资料 选择2018 年3 月—2020 年3 月首都医科大学附属北京友谊医院普外科收治的多发性肝癌患者225例。纳入标准:①符合原发性肝癌的诊断标准[1],并且肿瘤病灶≥2个;②年龄≥18岁;③肝功能Child-Pugh 分级A、B 级;④初诊,既往无任何抗肿瘤治疗史;⑤预计生存期>3 个月;⑥Karnofskyf 评分>60 分。排除标准:①合并其他部位恶性肿瘤者;②有手术相关禁忌证者;③合并精神失常者;④伴局部或全身感染者;⑤临床资料或随访资料不完整者;⑥既往有药物滥用史或吸毒史者。其中,接受TACE 治疗102 例(TACE 组),接受肝切除并微波消融治疗123 例(肝切除组)。本研究经首都医科大学附属北京友谊医院伦理委员会批准,所有研究对象或其家属知情同意并签署书面知情同意书。
1.2 治疗方法 TACE 组完善相关检查后予TACE治疗。患者取仰卧位,术中全程予心电监护和血氧饱和度监测。在数字减影血管造影监视下采用Seldinger 技术经股动脉穿刺,将导管插入肝动脉后行血管造影,明确肿瘤的部位、大小、数目以及供血动脉。然后以导丝导管法选择性插管至肿瘤的供血动脉,首先用碘化油+吡柔比星乳剂栓塞肿瘤末梢血管,然后再灌注吡柔比星+丝裂霉素+顺铂,最后用明胶海绵栓塞肿瘤供血动脉近端。再次血管造影,病灶染色消失,供血动脉中断,即可结束手术。
肝切除组完善相关检查后予肝切除并微波消融治疗。左半肝手术取平卧位,取上腹部左肋缘下斜切口,右半肝手术取平卧位或向左倾斜15°位,取上腹部右肋缘下斜切口。切开皮肤和皮下组织,逐层进腹,探查肝脏,结合术前影像学检查确定肿瘤位置,采取第一肝门阻断法阻断肝血流,每阻断15~20 min开放5 min。对于较大病灶(肿瘤直径>3 cm),沿肿瘤边界距肿瘤>1 cm 处切开肝包膜,由前向后、由浅入深离断肝实质。对于其他较小病灶(肿瘤直径≤3 cm)行微波消融术,在B超引导下选择合适的穿刺点及进针路线,将一次性无菌微波天线穿刺进入病灶,依据病灶体积选择布置1根或2根微波天线,微波发生器频率为2 450 MHz,微波消融时间为1~10 min,B 超下可见病灶被强回声完全覆盖,拔出微波天线并行针道凝血。术后留置腹腔引流管,逐层关腹。
两组麻醉和手术均由同一团队完成。
1.3 观察指标
1.3.1 临床疗效 术后1 个月,根据WHO 实体瘤疗效评价标准1.1版[5]评价临床疗效。完全缓解:所有病灶完全消失;部分缓解:所有病灶长径之和缩小>30%;疾病稳定:所有病灶长径之和有所缩小,但未达到部分缓解标准;疾病进展:所有病灶长径之和有所增长,或出现新的病灶。以完全缓解、部分缓解、疾病稳定作为疾病控制,计算疾病控制率。
1.3.2 肝功能 术前和术后1 个月,采集所有研究对象空腹外周静脉血5 mL,3 000 r/min离心10 min、离心半径8 cm,留取上层血清。采用PUZS-600A 全自动生化分析仪检测血清ALT、AST、白蛋白(ALB)、总胆红素(TBIL)。
1.3.3 肿瘤标志物 术前和术后1 个月,采集所有研究对象空腹外周静脉血5 mL,3 000 r/min 离心10 min、离心半径8 cm,留取上层血清。采用AXSYM免疫发光分析仪检测血清甲胎蛋白(AFP)、血管内皮生长因子(VEGF)、糖链抗原199(CA199)。
1.3.4 生存时间及无瘤生存率和复发率 术后通过门诊复查、电话、微信等形式定期随访3 年,随访截至2023 年3 月,记录所有研究对象生存时间以及无瘤生存和复发情况,计算术后1、2、3 年无瘤生存率以及术后3年复发率。
1.4 统计学方法 采用SPSS20.0 统计软件。倾向性评分匹配采用Stata12.5 软件。符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验。计数资料比较采用χ2检验。生存分析采用Kapan-Meier法,生存率比较采用Log-rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组倾向性评分匹配前后基线资料比较 以手术方式为分组变量,以基线资料为自变量,通过Logistic 回归模型估计倾向性评分值,按1∶1 临近匹配法进行匹配,卡钳值设定为0.02。经倾向性评分匹配,两组共90对患者匹配成功。两组倾向性评分匹配后基线资料比较差异均无统计学意义(P均>0.05),见表1。
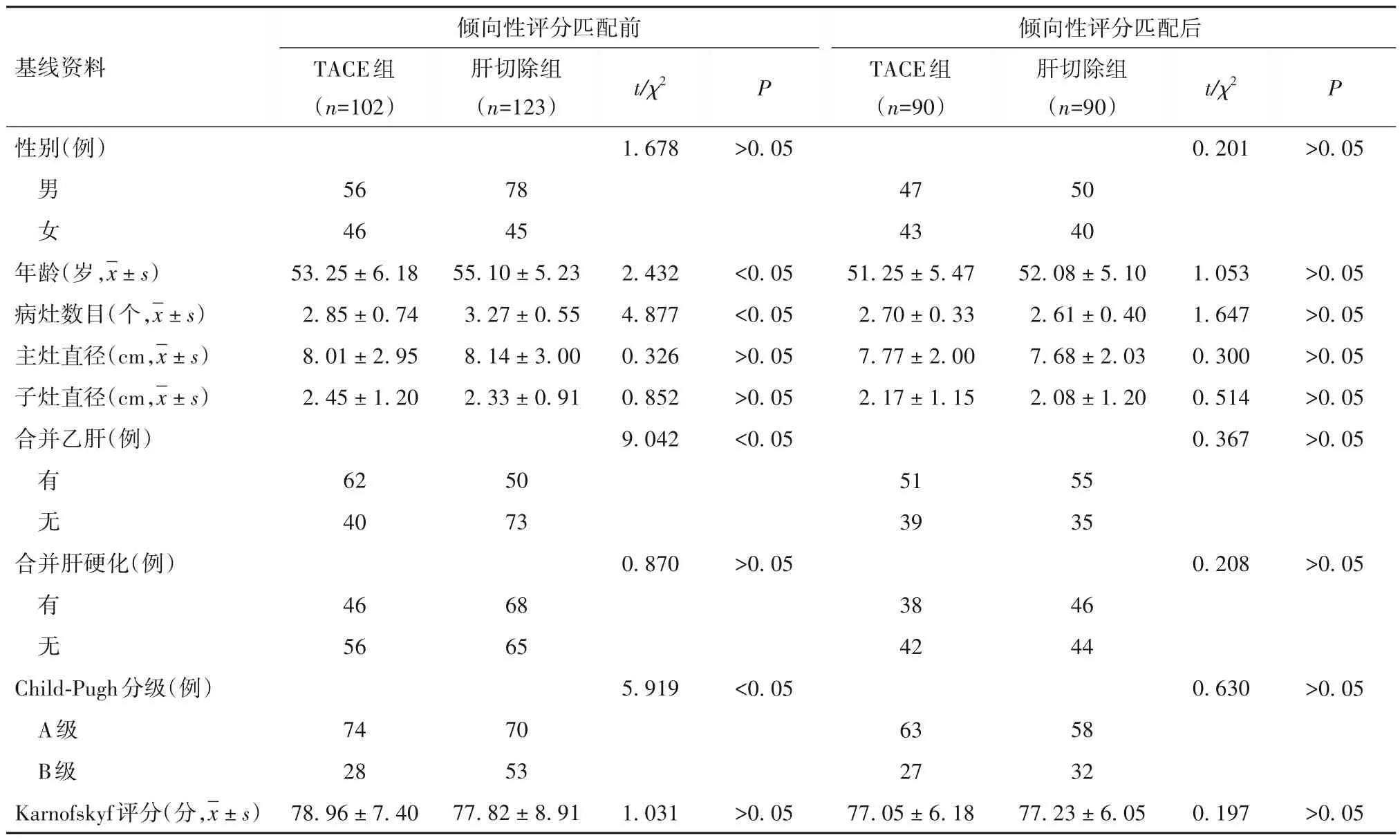
表1 两组倾向性评分匹配前后基线资料比较
2.2 两组倾向性评分匹配后临床疗效比较 TACE组完全缓解20 例、部分缓解24 例、疾病稳定38 例、疾病进展8 例,疾病控制率为91.11%(82/90);肝切除组完全缓解19 例、部分缓解24 例、疾病稳定37例、疾病进展10 例,疾病控制率为88.89%(80/90)。两组疾病控制率比较差异无统计学意义(χ2=0.247,P>0.05)。
2.3 两组倾向性评分匹配后肝功能比较 见表2。
表2 倾向性评分匹配后两组治疗前后肝功能比较(±s)
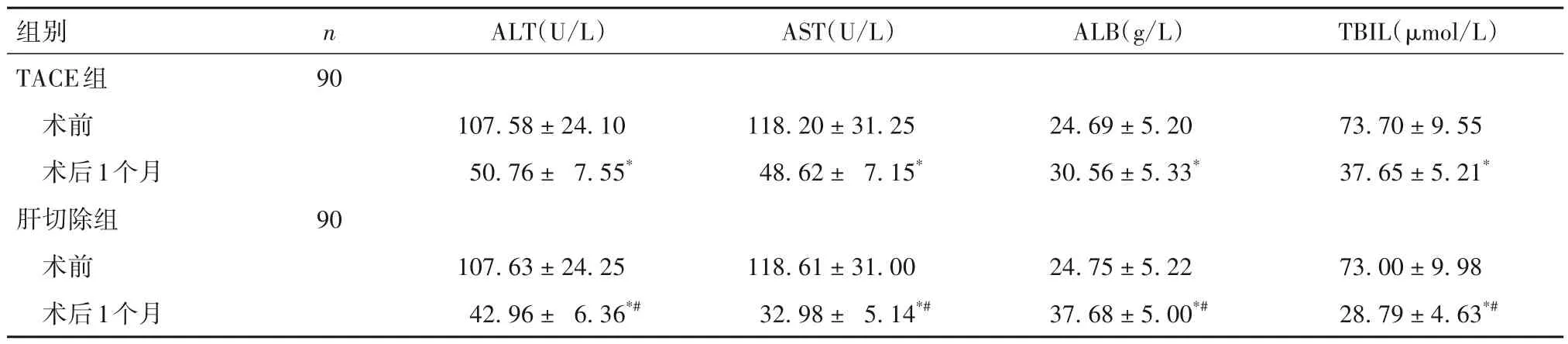
表2 倾向性评分匹配后两组治疗前后肝功能比较(±s)
注:与同组术前比较,*P<0.05;与TACE组术后1个月比较,#P<0.05。
组别TACE组n ALT(U/L)AST(U/L)ALB(g/L)TBIL(µmol/L)90术前术后1个月肝切除组90 107.58 ± 24.10 50.76 ± 7.55*118.20 ± 31.25 48.62 ± 7.15*24.69 ± 5.20 30.56 ± 5.33*73.70 ± 9.55 37.65 ± 5.21*术前术后1个月73.00 ± 9.98 28.79 ± 4.63*#107.63 ± 24.25 42.96 ± 6.36*#118.61 ± 31.00 32.98 ± 5.14*#24.75 ± 5.22 37.68 ± 5.00*#
2.4 两组倾向性评分匹配后血清AFP、VEGF、CA199水平比较 见表3。
表3 倾向性评分匹配后两组治疗前后血清AFP、VEGF、CA199水平比较(±s)
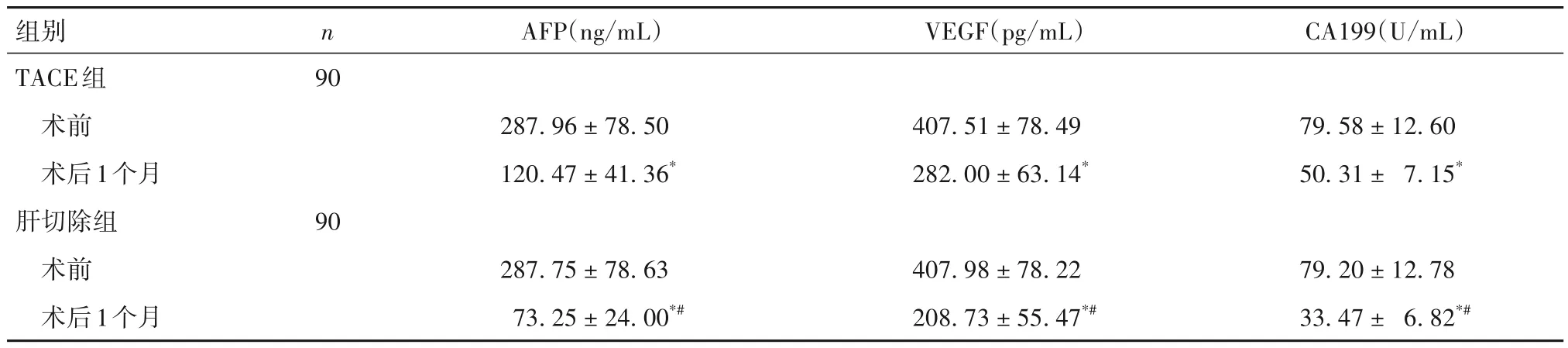
表3 倾向性评分匹配后两组治疗前后血清AFP、VEGF、CA199水平比较(±s)
注:与同组术前比较,*P<0.05;与TACE组术后1个月比较,#P<0.05。
组别TACE组n AFP(ng/mL)VEGF(pg/mL)CA199(U/mL)90术前术后1个月肝切除组90 287.96 ± 78.50 120.47 ± 41.36*407.51 ± 78.49 282.00 ± 63.14*79.58 ± 12.60 50.31 ± 7.15*术前术后1个月79.20 ± 12.78 33.47 ± 6.82*#287.75 ± 78.63 73.25 ± 24.00*#407.98 ± 78.22 208.73 ± 55.47*#
2.5 两组倾向性评分匹配后生存时间以及无瘤生存率和复发率比较 术后随访3年,TACE 组与肝切除组生存时间分别为(12.30 ± 0.64)、(22.90 ± 0.51)个月,肝切除组生存时间长于TACE 组(Log-rankχ2=59.349,P<0.05)。TACE 组术后1、2、3 年无瘤生存率分别为75.56%(68/90)、41.11%(37/90)、22.22%(20/90),肝切除组分别为87.78%(79/90)、56.67%(51/90)、35.56%(32/90),肝切除组术后1、2、3 年无瘤生存率均高于TACE 组(χ2分别为4.490、4.358、3.894,P均<0.05)。TACE组与肝切除组术后3年复发率分别为47.78%(43/90)、33.33%(30/90),肝切除组术后3 年复发率低于TACE 组(χ2=3.985,P<0.05)。
3 讨论
肝癌是消化系统常见的恶性肿瘤之一。据统计,在所有恶性肿瘤中肝癌的死亡率居第3位[6-7],仅次于肺癌、胃癌。肝癌多发生于患有慢性乙型或丙型肝炎以及肝硬化人群。作为乙型肝炎的高发国,我国肝癌的发病率也较高。肝癌早期往往无特异性症状,很难被早期发现,大多数患者就诊时已进展至中晚期,错过了最佳治疗时机,预后较差[2]。
目前,手术切除仍然是肝癌的首选治疗方法,但并非所有肝癌能够接受手术切除[8]。像多发性肝癌,肝脏内有多个肿瘤病灶,即使能手术切除,大部分也只能进行姑息性手术,无法达到根治的目的。另外,肝切除术中肝断面的处理也是临床关注的一个热点问题。受肝功能、肿瘤位置和大小等因素限制,肝切除术无法获得满意的切缘宽度,术后复发率较高,以切缘局部复发为主[9]。随着影像学技术和微创技术不断发展,介入治疗逐渐成为临床治疗肝癌的重要手段[3]。介入治疗主要有血管性介入治疗和非血管性介入治疗两种。TACE 作为血管性介入治疗的代表[10],其通过栓塞肿瘤供血动脉使肿瘤缺血坏死,加之灌注高浓度化疗药物,能够最大程度地杀灭肿瘤细胞。临床实践证实,TACE 能够有效控制肝癌生长,延长患者生存时间[11]。但肿瘤血供、病理分期、大体分型、门静脉癌栓等因素均会影响TACE 的治疗效果。另外,由于肝脏的血供非常丰富,肝动脉生理解剖变异以及肿瘤侧支循环建立使TACE 的治疗效果大打折扣[12],单一治疗效果较为有限。微波消融术是利用微波热效应杀灭肿瘤细胞的介入微创治疗方法,但由于其热能是从能量源向周围发散,离能量源越远,消融温度越低,并且容易受到组织碳化、电阻抗改变以及周围血管引起的“热沉效应”影响,导致肿瘤组织残余,难以实现完全消融[13]。因此,对于多发性肝癌提倡多学科综合治疗。
当前临床研究肝癌不同方法的治疗效果多存在混杂因素以及分布不均情况,影响了研究结果的可信性。倾向性评分匹配是通过事后随机化尽可能实现混杂因素均衡可比,能够最大限度地减少处理效应的偏倚度[14-15]。本研究基于倾向性评分匹配对比了肝切除并微波消融与TACE 治疗多发性肝癌的临床效果。结果发现,两组倾向性评分匹配后疾病控制率比较差异无统计学意义,说明肝切除并微波消融与TACE 治疗多发性肝癌的临床效果相当。倾向性评分匹配后,两组术后1 个月ALT、AST、TBIL 均低于术前,ALB 高于术前,以肝切除组术后1 个月变化较为显著;两组术后1 个月血清AFP、VEGF、CA199 水平均低于术前,以肝切除组术后1 个月变化较为显著。表明两种治疗方法均能改善肝功能、降低肿瘤标志物水平,但肝切除并微波消融的效果较好。进一步研究发现,倾向性评分匹配后,肝切除组生存时间长于TACE组;肝切除组术后1、2、3年无瘤生存率均高于TACE 组,而术后3 年复发率低于TACE 组。表明两种治疗方法均能提高远期预后,但肝切除并微波消融的效果较好。究其原因,经肝切除术解除了肿瘤压迫的同时减轻了肿瘤负荷,从而有效抑制肿瘤进展;而对于无法手术切除的肿瘤病灶,微波消融术则能有效灭活肿瘤组织,抑制肿瘤复发和转移[16]。
综上所述,肝切除并微波消融与TACE 治疗多发性肝癌的临床效果相当,但在改善肝功能、降低肿瘤标志物水平以及提高远期预后方面,肝切除并微波消融的效果较好。

