NLRP3炎症小体在糖尿病肾病发病机制中的研究进展
李梦洁 梁栋 邢文华 林千愉 张慧 张晓敏
滨州医学院附属医院肾内科,滨州 256603
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者常见的微血管并发症,且为终末期肾脏病的常见病因[1]。导致DN 进展的常见因素有脂代谢紊乱、高血糖、高血压、氧化应激、肾素-血管紧张素-醛固酮系统过度激活等。尽管DN 是非免疫性疾病,但炎症反应仍是DN 的重要病理生理机制[2]。其中,炎症小体是炎症反应的关键介质,并与许多信号轴密不可分。核苷酸结合寡聚化结构域样受 体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体活化是DN 肾脏固有细胞炎症性损伤中的“关键开关”。DN 时NLRP3 炎症小体被激活,诱发的炎症级联反应可通过释放炎症因子、损伤内皮细胞、抑制足细胞自噬等参与DN的发展。此外,国内外学者还发现,许多药物可以通过抑制NLRP3炎症小体,从而改善DN 炎症性损伤,延缓患者进展至终末期肾病的时间。但目前需要更多的研究明确其发挥作用的机制,本文对NLRP3 炎症小体在DN 中的作用及其相关药物研究进展两方面进行综述。
NLRP3炎症小体在DN中的作用
NLRP3 炎症小体是一种多蛋白复合物,它是由NLRP3 蛋白、凋亡相关斑样点蛋白及含半胱氨酸的天冬氨酸蛋白水解酶-1(cysteinyl aspartate specific proteinase -1,caspase-1)前体所构成的多聚蛋白复合物。NLRP3 是复合物中的核心蛋白,它含有3 个不同的结构域,即N 端的热蛋白结构域、中间的NACHT 结构域及C 端的亮氨酸富集重复结构域[3]。NLRP3 可以接受大多数病原微生物、多种结构域识别病原相关分子模式、危险相关分子模式和环境因子的刺激。NLRP3的激活主要有两个方面:其一,激活模式识别受体诱导NLRP3 炎症小体和白细胞介素(interleukin,IL)1β前体依赖的核因子κB(nuclear factor-κB,NF-κB)转录上调,从而促使IL-1β 前体和NLRP3 炎症小体蛋白过表达[4];其二,NLRP3炎症小体形成复合物,促使caspase-1及IL-1β等效应分子产生;NLRP3 炎症小体由NLRP3、ASC 和caspase1 组成。一旦存在诱导因子,活化的caspase-1 会剪接前IL-1β 和前IL-18,分别形成 IL-1β 和IL-18,发挥其作用(图1)。IL-1β和IL-18是由NLRP3炎症小体激活后释放的下游效应蛋白,它们在DN的发生和发展中扮演着重要的角色,其可以诱导肾脏足突细胞发生焦亡。相关实验证明,DN 动物模型中NLRP3、ACS 和caspase-1 的过度表达,导致IL-1β 和IL-18 升高,随后肾损伤恶化。IL-1β、IL-18 也可以进一步诱导IL-6和肿瘤坏死因子-α等炎症介质,加重 DN的炎症反应引起肾损伤。IL-1β细胞因子是DN炎症反应的主要调节器[5]。DN患者的IL-1β表达水平在肾组织中明显上调,且IL-1β 其水平与DN 患者的尿蛋白水平密切相关。此外,IL-18表达水平的升高与DN患者肾功能减退的程度呈正相关。以上研究均说明,NLRP3炎症小体在DN中起重要作用。

图1 NLRP3炎症小体的组成和活化过程
NLRP3炎症小体活化的信号调控途径及其相关药物
NLRP3 炎症小体活化受多条信号传导通路的影响,如活性氧(reactive oxygen species,ROS)-硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)通路、NF-κB 通路、核转录因子E-2 相关因子-2(nuclear factor erythroid-related factor 2,Nrf2)通路、丝裂原激活蛋白激酶(mitogen-acti-vated protein kinases,MAPKs)通路等[6]。
1.ROS-TXNIP--NLRP3通路
TXNIP 是体内NLRP3 炎症小体激活的关键调节因子。ROS-TXNIP-NLRP3 信号通路目前在DN 的肾脏损伤中被高度关注,多项研究表明NLRP3 的活化与TXNIP 相关。ROS 是NLRP3 炎症小体活化的上游信号及触发因素,TXNIP 对ROS 高度敏感。在生理情况下,硫氧还蛋白(thioredoxin,TRX)与TXNIP 结合而抑制其活性,因此不激活NLRP3;在病理情况下,胞内ROS 含量增加时,TRX/TXNIP 复合物解离,TXNIP 与NLRP3 的亮氨酸富集重复结构域结合而激活NLRP3 炎症小体,进而生成并释放IL-1β[7]。研究发现,在高糖处理的大鼠系膜细胞中,ROS、TXNIP、NLRP3、caspase-1 及IL-1β 的表达水平均有所提高,表明ROS-TXNIP-NLRP3 信号通路活化;当沉默TXNIP或敲除TXNIP 可抑制高糖诱导的ROS-TXNIP-NLRP3 信号通路的活性[8]。An 等[9]研究发 现,通过阻 断ROS-TXNIP-NLRP3,DN小鼠模型可以抑制细胞发生焦亡,从而缓解DN 进展。高糖诱导的足细胞可以通过沉默TXNIP 表达来减轻炎症反应[10]。故ROS-TXNIP-NLRP3 在DN 中发挥了重要作用,而相关药物可能通过抑制该通路活化,对肾脏损伤起保护作用。其中,通过降低TXNIP 与NLRP3 的共域性,中药汤参方可缓解肾损伤[11]。毛柳甙是红景天中的一种成分,它可以减缓高糖作用对大鼠肾小球系膜细胞的增殖影响。通过降低ROS 水平,可以有效减少TXNIP、NLRP3 炎症小体以及caspase-1 的表达。还有一些中草药提取物可通过抑制ROS-TXNIP-NLRP3 信号通路的激活发挥肾脏保护作用,例如:加味升降散、肉桂、千金藤素、胡椒碱、姜黄素等[12-15]。
2.NF-κB-NLRP3炎症小体通路
NF-κB 是一种重要的炎症刺激因子,NF-κB 的抑制因子(inhibitor kappa B,IκB)调控NF-κB 两个亚基:p50 和p65 的激活[16]。在DN 状态下,炎症小体通过细胞内或细胞外受体激活NF-κB,促进大量IL-1β 的产生,并参与调节肿瘤坏死因子受体相关因子家族作为信号传递器。肿瘤坏死因子受体相关因子作用于NF-κB 诱导激酶,NF-κB 诱导激酶作用于IκBα 激酶的上游。并且,在DN 状态下,小泛素相关修饰因子(small ubiquitin-related modifier,SUMO)起着重要作用。其中包括SUMO1 和SUMO2/3 的表达增加,SUMO1 和SUMO2/3 作为细胞中的应激蛋白,当SUMO2/3 诱导的IκBα的变化占主导地位并显著降低IκBαSUMO化时,这些因子可能通过改变IκBαSUMO 化与非SUMO 化之间的平衡来调控NF-κB 的功能,IκBα 的表达降低,并且在随后的步骤中激活NF-κB 信号传导,激活的NF-κB 易位至细胞核以调节下游基因,包括细胞间黏附分子-1 和转化生长因子(transforming growth factor,TGF)β1。综 上,NF-κB 是免疫应答的重要介质,在形成预激活的NLRP3 炎症小体过程中扮演着重要角色[17]。当炎症小体被高浓度葡萄糖刺激激活时,会产生大量的IL-1β,IL-1β 与细胞膜表面的受体相互作用,随后是TRAF 激活和NIK 刺激,NIK 绕过SUMO 通路来调节NF-κB的激活;在正常情况下,非活性的NF-κB 与细胞质中的κB 抑制因子(IκBα、IκBβ、IκBγ)非共价结合,IκBα 在刺激后被泛素化,允许激活的NF-κB 易位到细胞核,并与目标DNA 的特定增强子或启动子结合,导致这些基因的激活;TGF-β1、ICAM-1 等基因过表达,导致DN 的发生发展(图2)。研究发现,通过对小鼠肾脏组织进行检测,糖尿病组小鼠与非糖尿病组小鼠相比,NLRP3炎症小体及NF-κB 的表达升高。但是,如果应用抑制剂下调NF-κB,就可以降低NLRP3 炎症小体的表达[18]。以上均提示NF-κB/NLRP3 这一信号通路异常对足细胞造成的伤害可能是DN发生发展的关键点。相关体内或体外实验表明,通过这一途径,许多药物能够缓解DN 对肾脏的损害。例如,黄葵胶囊在体内通过抑制肾脏组织NLRP3 炎症小体的活化和 NF-κB 来缓解DN 肾小管上皮-间充质的分化[19]。甘草素可以减轻高糖引起的细胞外基质积聚、氧化应激和炎症反应,这是通过抑制NF-κB/NLRP3 炎症途径实现的[20]。吡格列 酮通过下调NF-κB 的表达,使NLRP3、IL-18 和IL-1β 的水平进一步降低[18]。深入研究NF-κB 信号通路及药物作用机理,或许能够找到一种有效的方法来抑制NLRP3激活,这将成为一项非常重要的研究领域。
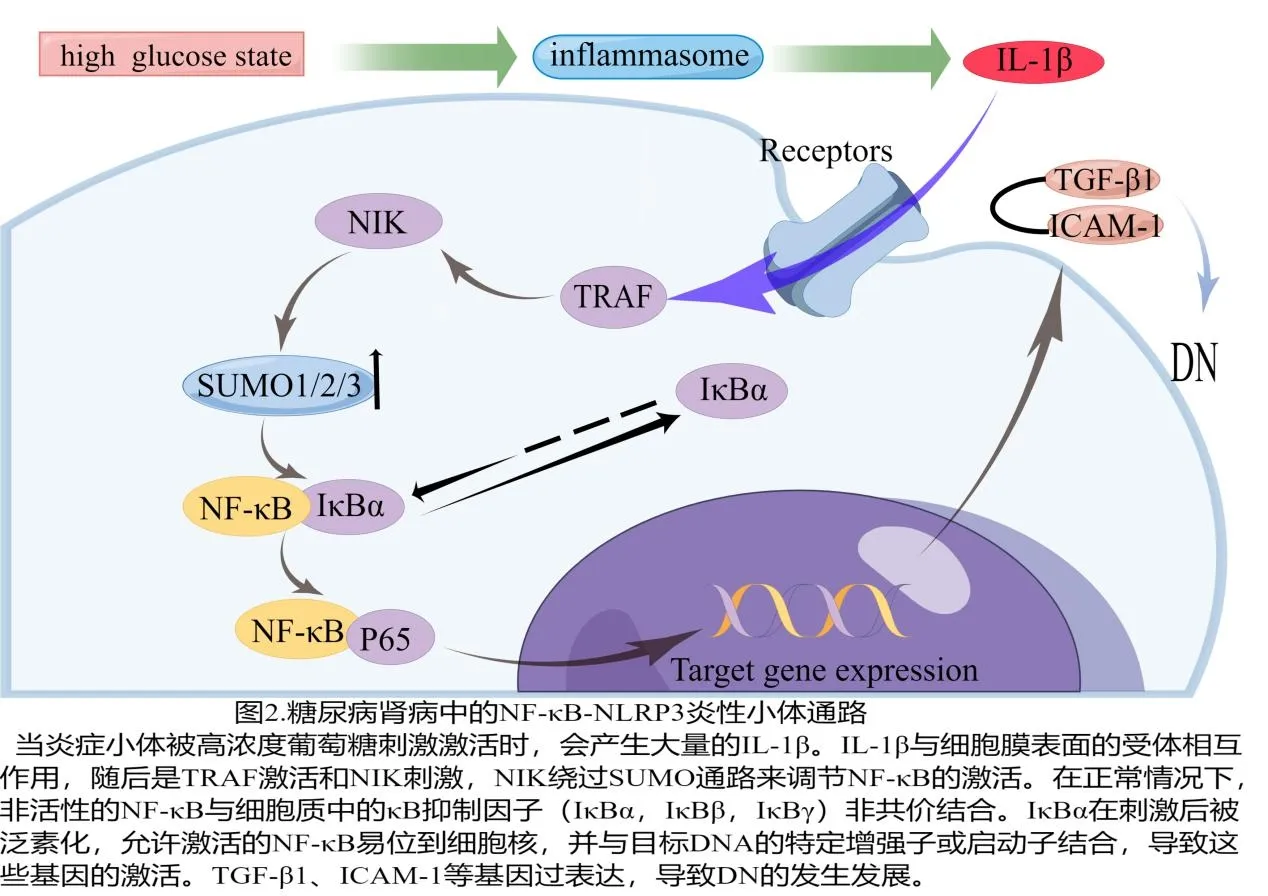
图2 糖尿病肾病中的NF-κB-NLRP3炎性小体通路
3.Nrf2-NLRP3炎症小体通路
Nrf2 是一种转录因子,其敏感性受到氧化还原状态的影响。但当机体受到ROS 等刺激时,Nrf2 与Kelch 样ECH关联蛋白1 分离并移至细胞核,使Nrf2/抗氧化反应元件序列结合基因的表达提高,进而发挥Nrf2 的抗氧化作用[21]。Nrf2 可以调节NLRP3 介导的炎症表达,通过应急反应蛋白和多种抗氧化酶来消除过多的ROS[22]。通过调节下游的抗氧化因子,Nrf2-NLRP3 炎症小体通路发挥了抗氧化的作用,并通过抑制促炎因子的表达来减轻肾脏损伤,目前已成为DN治疗的新靶点,提供了治疗DN的新可能。目前,针对该途径进行了多项药物研究,其中,在米诺环素药物研究中发现,DN 的小鼠通过诱导Nrf2 表达的增加,可以抑制NLRP3 炎症小体活化,进而提高肾功能;反之,米诺环素不能降低Nrf2 敲除的DN 小鼠中NLRP3 的表达[23]。此外,中药成分如白藜芦醇、白皮杉醇、木犀草素、葛花总黄酮、五味子醇提液、冠心丹参方、丹皮酚等,均可通过激活Nrf2,启动抗氧化机制,使肾脏细胞内炎症小体NLRP3水平降低[24-27]。
4.MAPKs通路
DN受MAPK信号通路的调节。MAPK信号通路主要包括3 条:p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MAPK)通路、细胞 外信号调节激酶(extracellular-signal regulated protein kinase,ERK)通路和c-Jun N 末端激酶(c-Jun Nterminal kinas,JNK)通路[28]。
p38MAPK 的主要作用是对一些应激因子和细胞因子进行调控,以诱导凋亡。高糖可以导致p38MAPK 信号通路成分的磷酸化,使系膜细胞分泌增殖增强;抑制p38MAPK通路会使系膜细胞的细胞外基质下降,从而使肾小球基底膜增厚 速度减 慢,引 起DN 的进程延缓[29]。ATP 作 为NLRP3 炎症小体的激动剂也能激活p38MAPKs。p38MAPK激活和mRNA 表达受上游激动剂丝裂原活化蛋白激酶和丝裂原活化蛋白激酶激酶控制[30]。p38MAPK 的磷酸化被认为是通过一个苏氨酸-甘氨酸-酪氨酸基序来实现双重磷酸化。因此,p38 蛋白TGY 基序中酪氨酸和苏氨酸的磷酸化导致了p38 蛋白的激活。在炎症体激活时,p38MAPK 可通过增加TGF-β 的基因表达来对p38MAPK 信号传导进行正反馈调节,进而出现恶性循环[31]。同 时,激 活p38MAPKs 还能增强活化转录因子2 的基因表达,导致NLRP3 介导的IL-1β 和IL-18 的分泌明显增加,并释放其他炎症因子的释放,如IL-6 和IL-8,促使DN 的发生。
ERK 在细胞信号传导过程中扮演着至关重要的角色,对多种参与细胞反应的基因的整合和转录产生了显著的影响[32]。在正常情况下,ERK1/2位于细胞质内,在高糖和各种生长因子等分子刺激后被磷酸化。激活的ERK1/2 进入细胞核,影响转录因子,促使基因转录和表达,参与细胞增殖分化。ERK1 介导的翻译后修饰可能会让NLRP3 炎症小体对第二信号ATP 做出反应[33]。在DN 中,NLRP3炎症小体被激活并进一步激活RAF-1,导致MEK1/2的激活,随后导致ERK1/2 的激活。ERK1/2 磷酸化细胞内中磷脂酶A2从而促进花生四烯酸和二十烷醇类物质的释放,这可能会对DN 肾血流动力学产生影响。ERK1/2 激活的信号通路可通过多种因素如蛋白激酶C、酪氨酸蛋白激酶和糖基化终末产物受体等促进系膜细胞增殖,从而引发肾小球肾炎[6]。
JNK是信号转导的重要信号分子,位于胞质内。高糖条件下JNK可调节多种炎症因子的产生及氧化应激反应。转化生长因 子活化激酶1(transforming growth factor kinase 1,TAK1)位于JNK 的上游,是一种丝氨酸/苏氨酸激酶。TAK1-JNK通路通过溶酶体断裂激活,是一种应激反应性的MAPK 信号通路。该通路的激活是NLRP3炎症小体通过适配器蛋白凋亡相关斑样点蛋白寡聚而完全激活所必需的[34]。近些年,相关实验已证实,JNK 通路可以促进肾脏炎症反应,加重肾损害。以上都说明MAPKs 通路对于DN 来说是至关重要的,所以,阻断该信号通路对于DN 来说是一个有效的防治策略。相关研究发现,黄芪总提取物能通过抑制阿霉素介导的ROS-ERK1/ 2-NLRP3中ERK1/2信号转导,抑制NLRP3 的激活,起到其肾脏保护作用[35]。其他一些中药复方也能显著抑制p38MAPK 活性,进而阻止DN 的发生,如尿毒清颗粒、糖肾平胶囊、黄葵胶囊、通心络、肾康丸、玉液汤、藿朴夏苓汤、丹红化瘀口服液、黄连解毒汤、补肾活血汤、芪地糖肾颗粒、消渴平合剂等[36]。
展 望
NLRP3 炎症小体是近年来发现的重要蛋白复合物,在DN 进展过程中,NLRP3 炎症小体活化与DN 肾损伤有很大关系。NLRP3 通过多种途径调节体内多种因子,尽管其激活机制和传导方式尚未明确,但其介导炎症反应在DN的发展中发挥重要作用已达成共识。当前以NLRP3为中心的信号调控途径相关实验已广泛开展,如ROS-TXNIP 通路、NF-κB通路、Nrf2通路、MAPKs通路等。一些新的药物或是成分被发现能对NLRP3 炎症小体进行特异性抑制,其中许多中药成分为治疗DN 提供了新的途径。但我们仍需对NLRP3的激活机制和作用通路进行深入研究,对DN的发病机制进一步挖掘,寻找DN治疗的新方向。
作者贡献声明李梦洁:文章撰写、对文章的知识性内容作批评性审阅;梁栋、张晓敏:对文章的知识性内容作批评性审阅、指导、支持性贡献;邢文华、林千愉、张慧:指导、支持性贡献

