肿瘤患者血小板输注疗效影响因素及HLA-Ⅰ类抗体特异性分析∗
赛娟 万珊珊 田力△
(1.中国医学科学院北京协和医学院输血研究所,四川 成都 610052,2.中国医学科学院输血不良反应研究重点实验室,3.四川省肿瘤医院)
血小板输注是各种血液病及肿瘤患者放/化疗所致血小板减少的有效支持疗法,可减少或降低患者的严重并发症及死亡率。然而反复输注血小板患者常常出现临床症状未明显改善或血小板计数未明显升高等情况,不仅导致血小板资源的浪费,而且延误患者的病情。统计结果显示恶性肿瘤及血液病患者输注无效率达7%~34%[1]。研究发现血小板抗体降低血小板输注效果,其中HLA-Ⅰ类抗体最常见[2]。我们通过分析肿瘤患者血小板抗体产生和输注疗效影响因素及HLA-Ⅰ类抗体特异性,以期探索更科学合理的血小板输注策略,现报道如下。
1 资料与方法
1.1 一般资料收集 四川省肿瘤医院2019 年11 月至2021年7 月申请输注血小板的住院患者142 名,输血前常规筛查血小板抗体,收集送检患者临床资料(性别、年龄、身高、体重、血小板计数、血小板输注剂量等。本研究经输血研究所伦理审查委员会审批通过(2021007 号)。
1.2 血小板输注原则 根据WS/T 623—2018«全血和成分血使用»,行椎管内麻醉者,输注阈值为Plt≤80×109/L,中心静脉导管置入及急性失血或有创操作者(择期诊断性腰椎穿刺和非神经轴索手术等),输注阈值为Plt≤50×109/L,病情不稳定(如伴有发热或感染等)的非出血患者,输注阈值为Plt≤20×109/L,病情稳定的非出血患者,为预防自发性出血,输注阈值为Plt≤10×109/L。血小板制品为辐照滤白机采血小板,均由成都市血液中心统一提供。
1.3 主要仪器与试剂 血小板抗体检测试剂(长春博德),HLA-Ⅰ类抗体检测试剂(美国One Lambda 公司),HLA-Ⅰ类抗体特异性鉴定试剂(美国One Lambda 公司),Bio-Plex 200 流式细胞仪(美国Bio-Rad 公司)。
1.4 方法
1.4.1 血小板抗体筛查 血小板抗体筛查采用固相红细胞黏附技术(SPRCA),严格按照血小板抗体检测试剂盒说明书操作和判读结果。
1.4.2 HLA-Ⅰ类抗体检测 采用Luminex 单抗原微珠包被法,将待测血清与包被了HLA 特异性抗原的微珠加入微孔板中孵育,若血清中存在HLA-Ⅰ类抗体则可与微珠上的抗原结合,洗涤、染色、孵育后,通过Luminex 平台获取特异性结合微珠的荧光信号。依据说明书判读结果。
1.4.3 HLA-Ⅰ类抗体特异性鉴定 操作步骤同上。阳性结果强度判读:MFI≥10 000 为强阳性,5000≤MFI<10 000 为阳性,500≤MFI<5 000 为弱阳性(MFI:mean fluorescence intensity,荧光强度均值)。
1.5 血小板输注疗效评价参数的计算 输注疗效依据校正患者血小板计数增值(corrected count increment,CCI)CCI =0.0061×患者身高(cm)+0.012 8×患者体重(kg)-0.152 9],若CCI(24h)<4.5×109/L 提示输注无效。
1.6 统计学处理 一般信息和临床特征应用描述性统计,计数资料以“例数(%)”表示,计量资料以“均数±标准差”表示,组间血小板抗体筛查阳性率、HLA-Ⅰ类抗体阳性率及输注无效率的比较采用χ2检验,多因素回归分析及多因素方差分析应用SPSS26 统计软件,检验水准α=0.05。
2 结果
2.1 患者的基本情况 自2019 年11 月至2021 年7 月,进行血小板抗体筛查的肿瘤患者合计270 名(共输注血小板383次),经过筛选后,研究最后纳入了142 名肿瘤患者(神经内分泌肿瘤1 名,神经母细胞瘤1 名,间叶组织肿瘤4 名,头颈部肿瘤20 名,乳腺癌1 名,呼吸系统肿瘤15 名,消化系统肿瘤32名,泌尿系统肿瘤7 名,生殖系统肿瘤39 名,造血系统肿瘤22名),患者一般特征如表1 所示,其中抗体筛查阳性者50 例,抗体筛查阴性者92 例。所有研究对象住院期间共输注142 次血小板,142 名肿瘤患者输注前血小板计数均值为(23.11±16.509)×109/L,血小板输注数据用于评估血小板输注疗效。排除标准及数据筛选流程如图1。
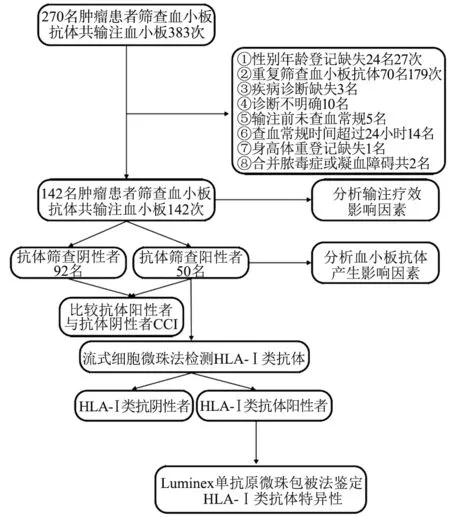
图1 血小板抗体及输注疗效分析流程图
2.2 血小板抗体筛查结果及影响因素分析 肿瘤患者血小板抗体阳性率为35.2%(50/142),女性高于男性(χ2 =13.235,P<0.001),年龄、输血史差异无统计学意义(P>0.05)(表1)。多因素Logistics 结果显示性别为血小板抗体产生独立危险因素(χ2=12.608,P<0.001,OR=3.800,95%CI:1.819~7.940)(表2)。
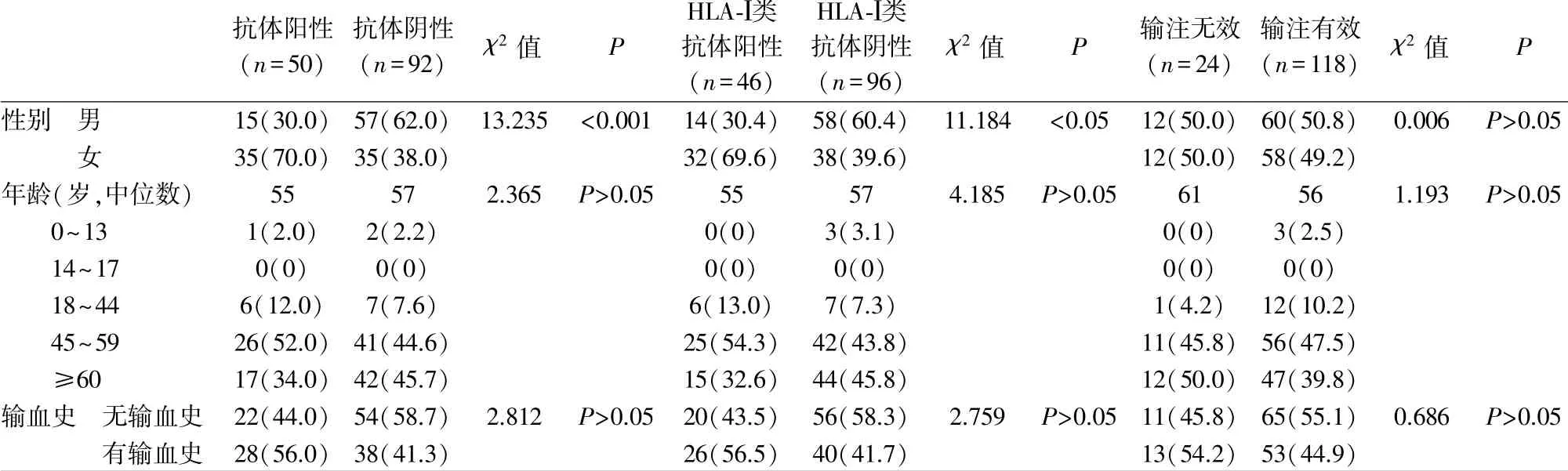
抗体阳性(n=50)抗体阴性(n=92)χ2 值P HLA-Ⅰ类抗体阳性(n=46)HLA-Ⅰ类抗体阴性(n=96)χ2 值P输注无效(n=24)输注有效(n=118)χ2 值P性别 男15(30.0) 57(62.0) 13.235 <0.001 14(30.4) 58(60.4) 11.184<0.05 12(50.0) 60(50.8) 0.006 P>0.05 35(70.0) 35(38.0)32(69.6) 38(39.6)12(50.0) 58(49.2)年龄(岁,中位数)55572.365 P>0.0555574.185 P>0.0561561.193 P>0.05 0~131(2.0)2(2.2)0(0)3(3.1)0(0)3(2.5)14~170(0)0(0)0(0)0(0)0(0)0(0)18~446(12.0)7(7.6)6(13.0)7(7.3)1(4.2) 12(10.2)45~5926(52.0) 41(44.6)25(54.3) 42(43.8)11(45.8) 56(47.5)≥6017(34.0) 42(45.7)15(32.6) 44(45.8)12(50.0) 47(39.8)输血史 无输血史 22(44.0) 54(58.7) 2.812 P>0.05 20(43.5) 56(58.3)2.759 P>0.05 11(45.8) 65(55.1) 0.686 P>0.05女有输血史 28(56.0) 38(41.3)26(56.5) 40(41.7)13(54.2) 53(44.9)
2.3 HLA-Ⅰ类抗体检测及特异性鉴定结果 肿瘤患者HLA-Ⅰ类抗体阳性率为32.4%(46/142),女性高于男性(χ2=11.184,P<0.05),年龄、输血史差异无统计学意义(P>0.05)(表1)。46 例HLA-Ⅰ类抗体阳性者平均产生(40±23.7)种抗体,强阳性、阳性及弱阳性HLA-Ⅰ类抗体检出率分别为69.6%(32/46)、80.4%(37/46)及97.8%(45/46),检出率最高的抗体为抗-B∗15 ∶12、抗-B∗57 ∶03、抗-B∗57 ∶01、抗-B∗13 ∶02、抗-B∗49 ∶01、抗-B∗50 ∶01、抗-A∗25 ∶01、抗-B∗15 ∶01、抗-B∗15 ∶02、抗-B∗44 ∶02(表3)。97 种HLA-Ⅰ类特异性抗体的MFI 均值及其检出频数如图2,MFI 均值≥10 000的HLA-Ⅰ类抗体如图2 图注。
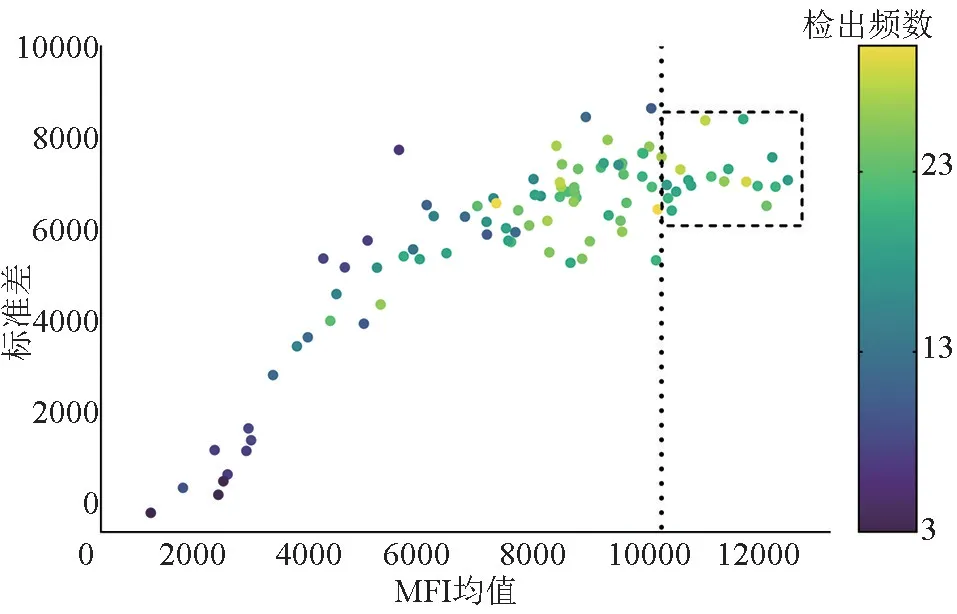
图2 97 种HLA-Ⅰ类特异性抗体的MFI 值及检出频数
2.4 血小板结果输注及影响因素分析 肿瘤患者输注无效率为16.9%(24/142),性别、年龄及输血史差异无统计学意义(P>0.05)(表1)。血小板抗体阳性者输注无效率为30.0%(15/50),高于血小板抗体阴性者[9.8%(9/92)](χ2=9.428,P<0.05),多因素Logistics 结果显示血小板抗体为输注疗效独立危险因素(χ2=8.648,P<0.05,OR=3.952,95%CI: 1.581~9.878)。Wilcoxon 检验示HLA-Ⅰ类抗体阳性者(n=46)CCI 值低于HLA-Ⅰ类抗体阴性者(n=96)(P<0.05)。
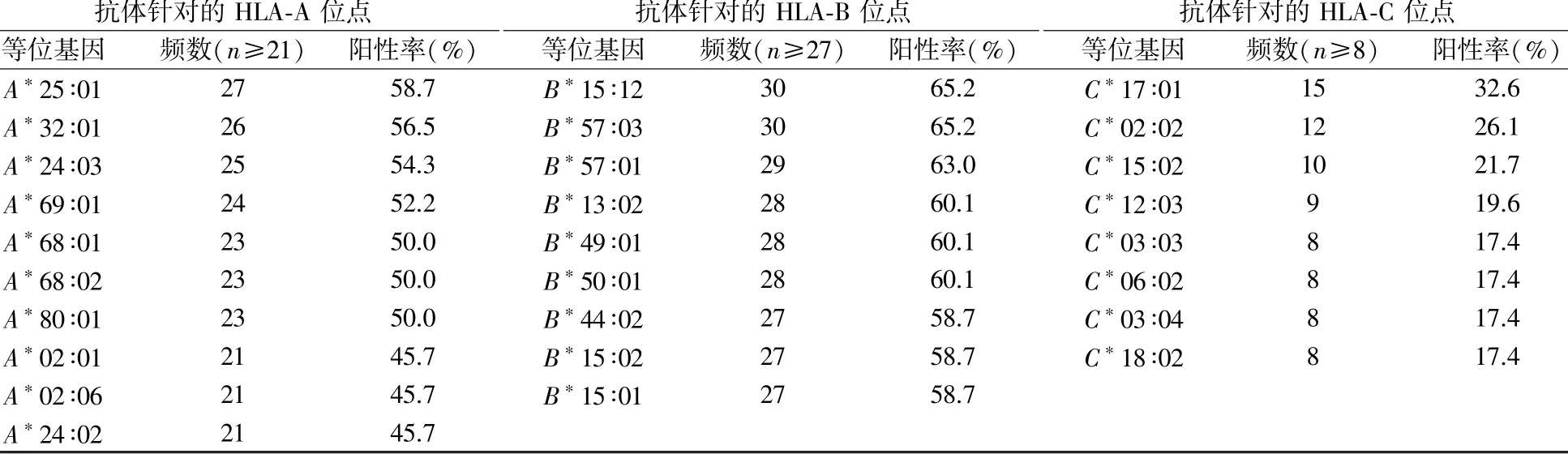
抗体针对的HLA-A 位点抗体针对的HLA-B 位点抗体针对的HLA-C 位点等位基因频数(n≥21)阳性率(%)等位基因频数(n≥27)阳性率(%)等位基因频数(n≥8)阳性率(%)A∗25 ∶012758.7B∗15 ∶123065.2C∗17 ∶011532.6 A∗32 ∶012656.5B∗57 ∶033065.2C∗02 ∶021226.1 A∗24 ∶032554.3B∗57 ∶012963.0C∗15 ∶021021.7 A∗69 ∶012452.2B∗13 ∶022860.1C∗12 ∶03919.6 A∗68 ∶012350.0B∗49 ∶012860.1C∗03 ∶03817.4 A∗68 ∶022350.0B∗50 ∶012860.1C∗06 ∶02817.4 A∗80 ∶012350.0B∗44 ∶022758.7C∗03 ∶04817.4 A∗02 ∶012145.7B∗15 ∶022758.7C∗18 ∶02817.4 A∗02 ∶062145.7B∗15 ∶012758.7 A∗24 ∶022145.7
3 讨论
血小板输注因其可降低出血风险而作为接受强化化疗或同种异体移植患者的标准管理[2]。现已明确血小板抗原-抗体的免疫反应与血小板清除密切相关,抗体的存在可能导致血小板存活时间明显缩短,输注后血小板计数不能达到预期效果[3]。输注随机供者血小板时,若供受者抗原不相合,受者发生免疫应答产生同种抗体,血小板抗体与供者血小板抗原结合,导致IgG 调理血小板的形成,由清除细胞例如巨噬细胞等清除循环中此类血小板。
本研究发现,女性为血小板抗体产生独立危险因素,与董晓锋等[4]一致,然而针对输血史,本研究未得出与其一致的结果,推测可能的原因如下:实际有输血史者因各种原因未按实际情况陈述,而部分此类患者血小板抗体筛查为阳性则同时导致:1)有输血史者阳性率偏低,2)无输血史者阳性率偏高。国外1 项研究结果显示女性抗体产生率随怀孕次数增加而增高,多次输血者血小板抗体产生率高达42%[5]。由此可见,输血史与抗体的产生关系仍需扩大样本进一步研究。本研究发现女性相比男性更容易产生HLA-Ⅰ类抗体,推测与怀孕有关。女性在怀孕期间或怀孕后产生HLA 抗体的比例占15%~50%,比例高低取决于怀孕次数[6]。含有胎儿HLA 抗原的白细胞碎片脱落进入母体循环,诱导母体产生针对白细胞表面HLA 抗原的抗体[7]。
存在血小板抗体为血小板输注疗效独立危险因素,Song等[8]Meta 分析表明血小板抗体为影响输注疗效的高危因素。血小板仅表达HLA-Ⅰ类分子,主要表达HLA-A 和HLA-B,每个血小板细胞携带50 000~120 000 个HLA-Ⅰ类分子[7],供者来源的血小板HLA-Ⅰ类分子主要引起体液性IgG 同种免疫:受者抗原递呈细胞(antigen presenting cells,APCs)内化供者来源血小板并将其抗原递呈至HLA-Ⅱ类分子,此同种肽/HLA 复合物通过同源相互作用激活受体CD4+T 细胞,受体B 细胞识别供体抗原后内化供体细胞并呈递供体来源的肽,该肽使得CD4+T 细胞辅助诱导B 细胞分化为浆细胞并介导类别转换最终使受体产生IgG 抗体[9]。在随后的血小板输注中,IgG 抗体与外源血小板表面HLA-Ⅰ型抗原结合,形成抗原-抗体复合物,诱导脾巨噬细胞或其他清除细胞通过Fcγ 受体(FcγRs)的连接来摄取抗原并清除血小板[9-10]。
国内分析血小板抗体及输注疗效各自影响因素研究较多,但研究结果并非全部一致,推测原因可能为:1)标本例数及研究对象不一致,各研究间不满足同质性,2)各标本中位年龄不同,即患者免疫系统产生血小板抗体的能力强弱不同,3)女性怀孕史的实际数据难以获取且仅有怀孕史而无输血史的女性患者例数较少,4)此前研究[11]证实,影响血小板输注疗效的各因素间存在复杂的交互作用,各研究间影响因素的交互作用无法量化,5)存在不同种类/程度的非免疫性因素及放/化疗次数等不可控因素。本研究HLA-Ⅰ类强阳性及阳性抗体检出率分别为69.6%及80.4%,与刘瑛等[12]结果相近,19.6%(19/97)的HLA-Ⅰ类抗体MFI 值>10 000 且均为HLA-A 抗体和HLA-B 抗体,提示肿瘤患者IgG 型HLA-A 抗体和HLA-B抗体强度高。研究证实仅高滴度抗体与血小板的清除有关,高滴度抗体Fc 段结合C1q 蛋白,启动补体激活经典途径,导致膜攻击复合物(membrane attack complex,MAC)的形成、钙内流和血小板的溶解[13]。张兵等[14]报道的血小板输注无效患者HLA-Ⅰ类特异性抗体与图2 图注中抗-B∗27 ∶05、抗-B∗27∶08、抗-B∗38 ∶01 相同,提示本研究MFI≥10 000 的19 种HLA-Ⅰ类特异性抗体可能与肿瘤患者血小板输注效果差有关。赵娜娜等[15]报道了血小板输注无效(platelet transfusion refractoriness,PTR)患者频率最高的HLA-Ⅰ类特异性抗体为抗-B∗57∶01、抗-A∗23 ∶01、抗-B∗40 ∶01、抗-B∗27 ∶08、抗-B∗27 ∶03、抗-B∗58 ∶01、抗-B∗13 ∶02、抗-A∗24 ∶02、抗-A∗24 ∶03、抗-B∗07 ∶02,本研究与赵娜娜等[15]检出的相同的抗体为抗-B∗57 ∶01、抗-B∗13 ∶02。抗体阳性组输注疗效明显低于抗体阴性组(图2),提示改善血小板输注效果关键在于:1)避免新血小板抗体的产生,2)避免抗原-抗体的结合。HLA-Ⅰ类抗体阳性者血小板输注策略包括:1)抗体特异性预测(antibody specificity prediction,ASP)策略:为HLA-Ⅰ类抗体阳性者选择受者HLA-Ⅰ类抗体靶向抗原阴性血小板,2)抗原特异性配合策略:对受者HLA 进行基因分型后寻找与之配合的血小板供血者。前述两种策略均基于建立足够数量的HLA 基因分型血小板供者信息库。
为了提高血小板输注疗效,提出以下建议:首先,严格掌握血小板输注指征,避免不必要的输注,减少输注次数。其次,建议血液科、肿瘤科等需要反复输注血小板的科室应针对需要反复输注血小板患者常规开展血小板抗体及HLA-Ⅰ类抗体的筛查,对HLA-Ⅰ类抗体阳性者采用抗原特异性配合策略和/或ASP 策略选择血小板。最后,建立一定规模的血小板供者信息库,为长期输注血小板患者及HLA 高度致敏患者提供血小板,一定程度上减少血小板资源的浪费。
利益冲突:所有作者均声明不存在利益冲突。

