注射用奈达铂致90例严重不良反应报告分析
唐芳,邹舒鹏,张锦文,陈云舟
(华中科技大学同济医学院附属同济医院药学部,武汉 430030)
奈达铂属第二代有机铂类抗肿瘤药,结构式为顺铂分子上的2个氯离子被替换为乙醇酸,其优点在于化学稳定性较高、水溶性好、抗肿瘤活性强等。与一代化疗药顺铂相比,其毒性和胃肠道反应也较低,耳毒性和神经毒性少见。但目前奈达铂使用中仍存在不良反应(adverse drug reation,ADR)甚至严重不良反应(serious adverse drug reaction,SADR)的发生。为了提升临床化疗方案的安全性,本研究作者采取回顾性分析,对近十年我院上报至国家不良反应监测中心的奈达铂相关的SADR进行统计分析[1]。
1 资料与方法
1.1资料来源 回顾性分析2012年1月-2021年12月在华中科技大学同济医学院附属同济医院注射奈达铂后发生的严重不良反应90例患者临床资料。
1.2方法
1.2.1病例的纳入与排除 纳入所有的病例均为药物导致的SADR,其临床表现为用药后不同系统出现的严重损伤,排除原患疾病及食物的影响,排除病程资料不全(用药信息不全,临床表现描述不清楚)的病例。
1.2.2关联性评价标准 纳入可能、很可能和肯定相关的SADR病例,严重不良反应因果关系判定标准,采用由原国家食品药品监督管理局、国家药品不良反应监测中心推荐的关联性评价[2],即肯定有关、很可能有关、可能有关、可能无关、待评价和无法评价。
1.2.3分析项目 发生严重不良反应患者的性别、年龄、原患疾病、药品用法用量等基础情况,以及严重不良反应发生时间和临床表现进行统计分析[3]。
1.2.4数据处理方法 采用Excel软件对提取的数据进行统计学分析。
2 结果
2.1转归及关联性结果 90例SADR的转归结果见表1。依据不良反应关联性原则,肯定35例,很可能49例,可能6例。
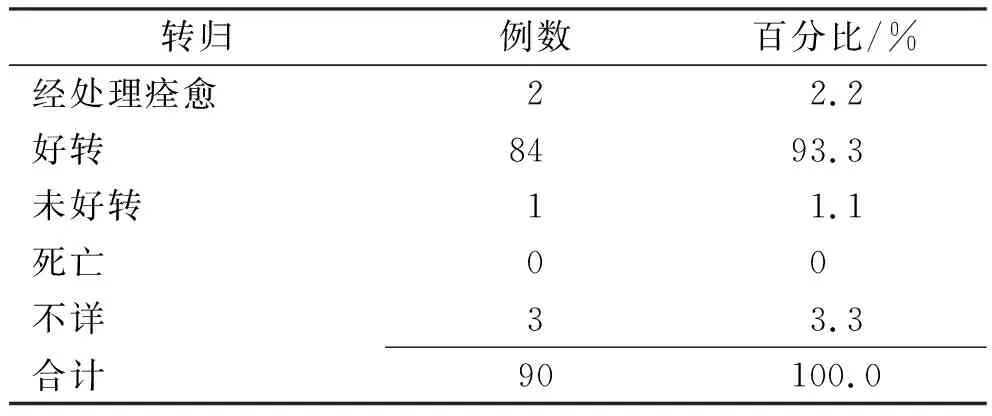
表1 奈达铂SADR的转归结果Tab.1 Outcomes of serious adverse reactions of nedaplatin
2.2SADR患者性别、年龄等基础情况 在90例SADR报告中,年龄分布在32~79岁,总样本的平均年龄(52.7±9.51)岁。男性43例,平均年龄(55.6±10.90)岁;女性47例,平均年龄(52.7±9.63)岁。患者原患疾病中,卵巢腺癌、宫颈鳞癌、子宫内膜细胞癌、盆壁鳞癌、子宫恶性肿瘤等妇科肿瘤37例(41.1%),肺癌占25例(27.8%),腹腔肿瘤、食道癌、胃癌、肝癌等消化系统肿瘤占15例(16.7%),鼻咽肿瘤占9例(10.0%),其他恶性肿瘤占4例(4.4%)[4]。
2.3化疗方案及药品用法用量 90例患者中,5例采用小剂量<30 mg多次给药方案;72例采用剂量30~60 mg单次给药方案;13例采用大剂量100~140 mg 单次给药方案。其中,首次使用39例(占43.3%),再次用药51例(占56.7%),所有病例均用0.9%氯化钠溶液500 mL配置后静脉缓慢滴注。90例SADR患者具体使用情况见表2,奈达铂单用占比38.9%,其中首次使用26例(占比74.3%),奈达铂联用占比61.1%,其中首次使用19例(占比34.5%),见表2。另外,在各组的平均剂量中,奈达铂与培美曲塞联用时的平均剂量最大,为66.7 mg。
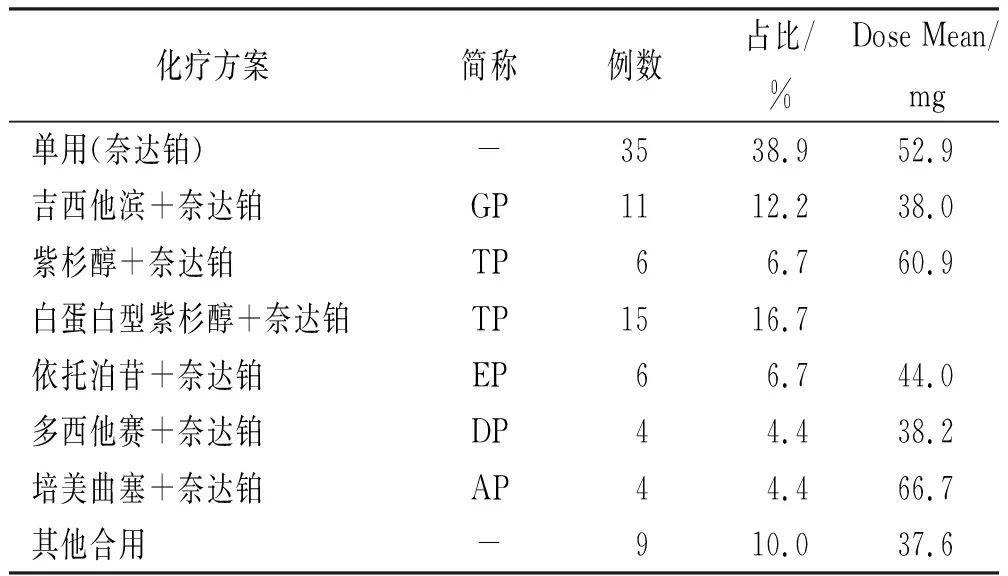
表2 发生SADR患者的化疗方案Tab.2 Chemotherapy regimens of patients with severe adverse drug reation
2.4SADR发生时间 90例患者均报告ADR发生时间,见表3,SADR最快在5 min内发生,最迟有1个月发现,超过15 d的SADR均为不同程度的骨髓抑制[5]。
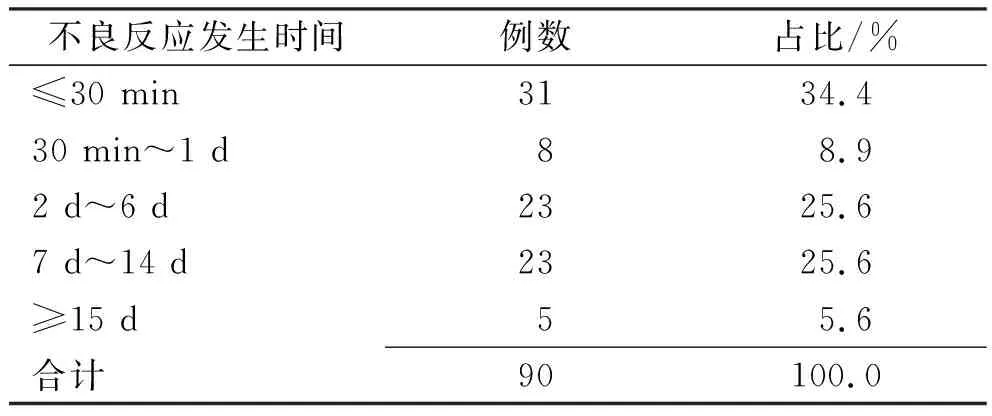
表3 SADR发生时间Tab.3 The occurrence time of patients with severe adverse drug reation
2.5SADR临床表现 90例SADR报告中(见表4),主要表现为骨髓抑制,胸闷、呼吸困难、心悸、血压上升等严重过敏反应甚至是过敏性休克。奈达铂所致的SADR以血液系统损害为主,如骨髓抑制等,占42.4%,其中Ⅲ级骨髓抑制31例,Ⅱ级骨髓抑制10例,IV级骨髓抑制9例,常伴随血红蛋白减少、血小板减少等。其次是呼吸系统,呼吸困难、胸闷为主要表现,占19.2%,常伴随发热、皮疹等过敏反应。过敏性休克患者占7例,均在30 min以内发生。

表4 SADR临床表现Tab.4 Severe SADR involved clinical manifestations
2.6患者治疗SADR的处理情况 所有发生SADR的患者均进行对症治疗。所有中重度骨髓抑制的患者均使用重组人粒细胞刺激因子,部分患者使用重组人促红素注射液、重组人血小板生成素注射液。所有过敏性休克患者进行紧急抢救,以地塞米松静脉推注,多巴胺升压,平衡液扩容等,并给予吸氧处理后均逐渐好转[6]。
3 讨论
作者对我院十年间上报的SADR报告进行汇总统计,从一般资料、用药情况、发生时间、临床表现以及处理预后几个方面来分析奈达铂引发SADR的规律,从而对突发情况做好预警措施[7]。
90例SADR患者中,男女比例(1:1.09),无明显差异,表明注射用奈达铂SADR的发生与性别无明显关联。该样本平均年龄在53岁,其中50~60岁患者占41.1%,大部分SADR发生在中老年人群,这与多数患者患有基础疾病,各器官代谢功能减退有关。在YOSHIDA等的临床试验中,老年患者(≥70岁)3/4级血液学毒性、肌酐升高的发生率显著高于年轻患者,但年老组和年轻组在无进展生存期(P=0.27)和总生存期(P=0.46)方面差异无统计学意义[8]。
90例患者的SADR中,奈达铂单用占比38.9%,其中首次使用26例(占比74.3%)。奈达铂单用中,首次使用引发SADR的比例明显高于非首次(P<0.01),表明在患者初次化疗使用奈达铂时应该密切关注ADR的发生。一项回顾性研究表明普通铂剂过敏史的患者在初次使用奈达铂时,发生超敏反应的几率会明显增加[9]。
从ADR发生时间看,30 min内以及2~14 d的发生率最高,30 min内发生的SADR(占34.4%)均为过敏性休克以及呼吸困难、胸闷、血压升高等过敏样症状。同样,一项在日本的回顾性研究中,8例单用奈达铂的超敏不良反应中,有5例(63%)在10分钟内观察到,最常见的症状是脸红和呼吸不适[9]。其次,该样本超过2天发生的不良反应为Ⅱ至Ⅳ骨髓抑制,少部分为肝功能异常。表明在2天内应密切关注患者的过敏症状,以及出院后叮嘱患者定期检查血常规,防止骨髓抑制[3]。
人们提出了多种机制来解释铂类药物依赖性超敏反应。首先,普通铂剂重度超敏反应与IgE依赖性超敏反应之间存在相关性,在普通铂剂超敏反应史的患者中,外周血嗜碱性粒细胞IgE受体ⅰ型Fc片段(Fcε RI)表达水平及Fcε RI的 mRNA水平均显著高于没有过敏史的患者[10]。其次,在普通铂剂超敏史患者中发现特异性IgE,而奥沙利铂没有,可能与普通铂剂存在和奥沙利铂不存在伯胺基团(表位)有关[11]。因此,监测嗜碱性粒细胞FcεRI表达的药效学变化或者询问铂剂过敏史对预防奈达铂高危过敏患者有重要意义。
在SADR应对方案中,除了停药以外,大部分为对症治疗。例如药物热采取物理降温以及退热处理,过敏症状服用抗过敏药物或者静脉注射地塞米松。过敏性休克,予以地塞米松静脉注射,异丙嗪肌肉注射、肾上腺素静脉注射,严重者继续呼吸面罩通气,给予抗感染、护心、护胃、护肝、补液对症治疗[12]。骨髓抑制患者采取升白处理。
综上所述,在应用奈达铂作为化疗方案时,应密切关注用药30 min内以及2周的不良反应发生,做好抢救应急预案和定期血常规检查。目前临床仍存在给药方案不规范、患者血常规检测未受重视、不良反应发生时间未掌握等情况,临床应用时需加强管理,有助于提升用药安全性。
——再论奈达对翻译本质属性的认知

