肠外营养支持中添加结构脂肪乳对胃癌患者术后胃肠功能恢复、免疫功能及肝功能的影响
丁晓平,侯艳,姜如月
(青岛市市立医院东院营养科,山东 青岛 266071)
近年来,我国胃肠道肿瘤发病率升高,临床主要通过手术治疗[1]。胃癌患者因为肿瘤消耗严重,普遍存在营养摄入不足的情况,患者往往伴有进行性体重下降,免疫功能下降,并在经历术前禁食、手术创伤后,营养和免疫状态进一步恶化,不利于患者术后恢复[2]。肠外营养支持干预有利于患者术后营养维持,促进创伤愈合,降低并发症风险,因此被广泛用于胃肠道肿瘤手术患者中[3]。作为肠外营养重要组成部分,脂肪乳可减少葡萄糖用量,加强脂肪乳供能,提高氨基酸利用水平,改善氮平衡。随着研究深入,不同配方脂肪乳剂产品相继被应用于肠外营养支持中,结构脂肪乳将中链、长链脂肪酸混合并降解,在酶的催化下形成新型脂肪乳剂,克服二者独立代谢缺点[4]。本研究将结构脂肪乳应用于胃癌术后肠外营养中,并通过与物理混合的中/长链脂肪乳剂比较,试阐述结构脂肪乳应用价值。
1 资料与方法
1.1 一般资料
回顾性分析2019年5月至2022年11月青岛市市立医院收治的186例胃癌行手术治疗患者的临床资料。根据肠外营养支持脂肪乳剂配方,将给予结构脂肪乳的患者纳入A组(n=95);给予物理混合的中/长链脂肪乳者纳入B组(n=91)。两组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较
1.2 纳入标准
(1)符合《胃癌规范化诊疗指南》胃癌诊断[5],经病理活检确诊,并于本院接受腹腔镜根治手术;(2)影像学显示未发生肿瘤远处转移;(3)术前无肺部与其他脏器感染;(4)入组前未接受放疗和化疗等;(5)预计生存期在3个月以上;(6)医院伦理委员会批准,患者及家属同意并签字。
1.3 排除标准
(1)入组前接受放化疗治疗;(2)合并其他类型肿瘤;(3)合并其他严重器质疾病;(4)合并严重肠道感染、肠梗阻等;(5)合并急性胰腺炎、胆囊炎等;(6)合并免疫或血液系统疾病;(7)合并糖脂代谢异常等代谢性疾病。
1.4 方法
两组患者术后均给予等氮、等热量肠外营养,肠外营养总非蛋白质由葡萄糖、脂肪乳提供,总热量83.68 kJ·kg-1·d-1,葡萄糖和脂肪热量比为1∶1,脂肪1.0 g·kg-1·d-1。B组采用20%物理混合中/长链脂肪乳(中链、长链脂肪乳各占50%,贝朗制药有限公司);A组给予20%结构脂肪乳注射液(中链脂肪乳36%,长链脂肪乳64%,华瑞制药有限公司)。所有氮源均由复方氨基酸注射液提供(8.5%乐凡命,华瑞制药有限公司),氮量(g):非蛋白质热量(kcal) 为1∶133。“全合一”营养液中心(周围)静脉输注,第1d输注营养需要量的1/2,2~6 d全量输注,每日持续输注18~20 h,连续6 d。
1.5 观察指标
患者肠外营养支持前(营养输注前)、肠外营养支持6 d后采集外周静脉血5 mL,仪器为日本日立公司7600型全自动生化分析仪及美国BECTON公司 FACS流式细胞仪。(1)营养指标:采用速率散射免疫比浊法检测血清总蛋白(Total protein,TP)、转铁蛋白(transfer-rin,Trf)、前白蛋白(prealbumin,Palb)、白蛋白(albumin,Alb)水平。(2)胃肠激素指标:通过放射免疫法检测胃动素(MOT)、促胃液素(GAS)、胃蛋白酶原Ⅰ/Ⅱ(PGⅠ/Ⅱ)水平,计算PGⅠ/ PGⅡ比值。(3)免疫功能:采用流式细胞仪检测患者血液样本CD3+,CD4+,CD8+水平,计算CD4+/CD8+水平。(4)炎性指标:酶联免疫吸附法检测血清白细胞介素6 (interleukin-6,IL-6)、肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)、C反应蛋白(C-reactive protein,CRP)水平。(5)肝功能指标:丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)和直接胆红素(direcrt bilirubin,DBIL)含量检测采用酶偶联法。(6)不良反应:比较两组患者患者不良反应发生情况。
1.6 统计学分析

2 结果
2.1 两组患者营养指标比较
两组患者支持前血TP、ALB、TFN、Hb水平比较,差异均无统计学意义(P>0.05)。肠外营养支持6 d后,A组TP、ALB、TFN、Hb水平均高于B组(P<0.05)。见表2。
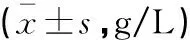
表2 两组患者营养指标比较
2.2 两组患者胃肠激素水平比较
两组患者支持前血浆胃肠激素水平比较,差异均无统计学意义(P>0.05)。两组患者肠外营养支持6 d后,血浆MOT、GAS、PGⅠ、PGⅠ/PGⅡ水平较支持前均升高(P<0.05),且A组高于B组(P<0.05)。见表3。

表3 两组患者血浆胃肠激素水平比较
2.3 两组患者免疫功能比较
两组患者支持前细胞免疫功能比较,差异均无统计学意义(P>0.05)。肠外营养支持6 d后,A组血CD3+、CD4+及CD4+/CD8+水平均高于B组(P<0.05)。见表4。

表4 两组患者免疫功能比较
2.4 两组患者炎性指标水平比较
两组患者支持前炎性指标水平比较,差异均无统计学意义(P>0.05)。肠外营养支持6 d后,两组患者炎性指标TNF-α、IL-6、CRP水平均降低,且A组低于B组(P<0.05)。见表5。

表5 两组患者炎性指标水平比较
2.5 两组患者肝功能指标水平比较
两组患者支持前肝功能指标水平无统计学差异(P>0.05)。肠外营养支持6 d后,A组ALT、AST、TBiL、DBiL水平均低于B组(P<0.05)。见表6。

表6 两组患者肝功能指标比较
2.6 两组患者不良反应发生情况比较
B组中6例患者出现腹泻,经治疗后好转,3例患者出现腹胀,自行缓解;A组中5例患者出现腹泻,1例出现腹胀,经治疗后好转。两组患者不良反应发生率比较,差异无统计学意义(χ2=0.801,P=0.371)。
3 讨论
据调查[6]显示,胃癌在全球的分布主要集中在东亚地区,中国是胃癌的高发区,据调查统计显示我国新增胃癌人数以及由于胃癌导致死亡的人数占全球40%以上。目前胃癌治疗临床主要通过根治性手术切除和胃周淋巴结清扫,然而胃癌手术范围较大,术后患者恢复较为困难。胃癌患者食量、消化功能均较差,肿瘤促进免疫抑制因子分泌,手术也在一定程度上损害机体免疫,患者均发生不同程度的营养不良,影响其术后恢复[7]。
营养支持是治疗创伤、感染、中毒等一系列危重症的重要举措,脂肪乳剂属于较为理想的供能物质之一[8]。目前,临床应用的中/长链混合的脂肪乳剂包括两种,一种为中/长链脂肪乳剂,另一种则是结构脂肪乳,二者理化性质、代谢均存在明显差异[9]。长链肪乳剂可为机体提供能量以及必需的脂肪酸;中链脂肪乳剂在人体内具有水解氧化速度快、代谢过程不需肉毒碱参与、对免疫系统影响较小等一系列优点[10]。中/长链脂肪乳剂在人体是中链、长链脂肪乳的分别代谢,二者在体内的代谢可能彼此干扰,中链水解后会抢占水解酶,使长链水解过程变慢[11]。结构脂肪乳属于新型脂肪乳,即将中链、长链脂肪乳经高温、催化剂作用,水解后再酯化,形成6种结构的甘油三酯,其中4种同时包含中链、长链脂肪酸,其均一性明显优于中/长链脂肪乳剂[12]。
本研究中两种肠外营养支持均能促进机体营养状况改善,但结构脂肪乳患者在支持后TP、ALB、TFN、Hb水平均高于中/长链脂肪乳剂营养支持患者,与李玉芹等[13]研究结果一致,这可能是由于结构脂肪乳水解速度快且氧化较为完全,供能迅速,提示在蛋白质代谢方面结构脂肪乳更优。本研究中两组患者术后A组支持后6 d时血浆胃肠激素指标MOT、GAS、PGⅠ、PGⅠ/PGⅡ水平高于B组,表明结构脂肪乳相较于物理混合的中/长链脂肪乳更有利于,促进胃肠蠕动,促进患者胃肠功能恢复,改善患者营养状态。一项Meta分析[14]证实,与中长链脂肪乳比较,结构脂肪乳的应用更为安全有效,且对肝功能有益。本研究把结构脂肪乳应用于胃癌术后营养支持患者,发现A组支持后ALT、AST、TBiL、DBiL水平低于B组,这可能是因为中长链脂肪乳不均衡代谢使得甘油三酯等蓄积,加重肝脏以及肾脏负担;结构脂肪乳水解匀速,对肝功能影响较小。
相关临床研究[15]表明,与中长链脂肪乳剂相比,结构脂肪乳可纠正胃肠道肿瘤患者术后免疫抑制,对提高细胞免疫功能具有重要意义。CD3+、CD4+、CD8+是最常见的 T 淋巴细胞亚群,CD4+与CD8+二者相互诱导、制约,CD4+下降、CD8+水平增加或CD4+/CD8+降低时,机体淋巴细胞活化辅助、 B 淋巴细胞抗体生成协助功能下降、抑制性T淋巴细胞增多,致使机体免疫下降[16]。本研究结果显示,A组支持后血CD3+、CD4+以及CD4+/CD8+水平均高于B组,也提示结构脂肪乳剂更有利于术后患者机体细胞免疫功能恢复,与上述研究结果一致。机体炎症不利于患者术后康复,胃癌术后,机体炎症主要与手术创伤有关。CRP是机体敏感的炎症指标;IL-6参与炎症反应的发生和进展;TNF-α是一种由活化的单核细胞分化出来的细胞因子,具多种免疫功能,可介导炎症反应过程。本研究中A组支持后TNF-α、IL-6、CRP水平低于B组,这一结果提示,胃癌根治术后,采用结构性脂肪乳作为肠外营养支持物质能更好地减轻术后机体炎症状态,这与结构性脂肪乳免疫改善、术后营养水平提升,同时不引起炎症反应有关。
综上,结构脂肪乳用于胃癌术后肠外营养相较于物理混合的中/长链脂肪乳可改善患者营养状态,加快胃肠功能恢复,减轻患者炎性反应,提高免疫功能,患者术后肝功能异常风险降低。

