流式细胞术测定食蟹猴血清中抗间充质干细胞抗药抗体及其应用*
庄炜平,胡芹,姜宏梁 ,黄建耿,武栋成
(1.武汉生物技术研究院,武汉 430073;2.武汉宏韧生物医药股份有限公司,武汉 430073;3.华中科技大学同济医学院药学院,武汉 430030;4.武汉汉密顿生物科技股份有限公司,武汉 430073)
间充质干细胞(mesenchymal stem cells,MSC)是一种存在于多种人体组织中具有自我更新和多向分化潜能的多能干细胞,其来源广泛,可在骨髓、脂肪、脐带血和胎盘中分离得到,并被广泛应用于细胞治疗和器官移植等方面,在治疗移植物抗宿主病、类风湿关节炎和软骨及心肌损伤方面都有很好的疗效[1-4]。虽然MSC具有低免疫原性的特点,但其作为治疗药物能否引起免疫原性还值得我们进一步去探索。
药物的免疫原性是指药物诱发对自身或相关蛋白的免疫应答或免疫相关事件的能力。免疫原性影响广泛,可能会影响药物的药动学特征、药效学、安全性和有效性,更严重的时候还会产生严重的副作用甚至危及生命[5-6]。鉴于此,生物药的研发过程中,中国、美国和欧盟等相关法规均要求在临床前和临床研发阶段开展免疫原性的检测和评估。
对于蛋白类药物,如抗体、融合蛋白、多肽和ADC药物等,免疫原性的检测可以用配体结合试验的方法,通过电化学发光技术(meso scale discovery,MSD)、酶联免疫吸附实验(enzyme-linked immunospecific assay,ELISA)、放射免疫分析(radio immunoassay,RIA)等平台进行检测[7-8];对于基因编辑的基因治疗产品,如AAV载体,CAR-T细胞等,也可以同样用配体结合试验来检测引入的外源蛋白的免疫原性[9-11]。然而,MSC药物的免疫原性检测一直是一个挑战:首先,经典的配体结合试验并不适用于细胞的检测;其次,与CAR-T细胞不同,MSC本身也并未引入外源基因,因而也不能通过检测表达的外源蛋白的免疫原性来评估MSC药物的免疫原性。
目前,现有技术中,对于MSC免疫原性评估均是通过间接的方法评估整个免疫系统的反应,比如通过免疫分型检测T/B/NK细胞的比例,或者通过检测细胞因子、趋化因子、黏附因子等生物标志物的水平来反应免疫系统的激活状态等[12-15]。这些方法都是通过其他指标侧面反映MSC是否刺激机体产生了免疫原性,并不能直接检测到抗MSC的抗体水平。本文旨在建立一种可快速准确且直接检测抗MSC抗药抗体的方法,可用于临床前和临床MSC免疫原性的研究。
1 仪器、试剂耗材与动物
1.1主要仪器 流式细胞仪(BD FACS CanoII,美国BD公司),微孔板振荡器(88880024,Thermo fisher),涡旋混合仪(MX-S,Dragon LAB),纯水仪(Master-S15UV,HHitech),细胞计数仪(LUNA-II,logosbio),二氧化碳培养箱(Thermo Forma 311,Thermo fisher)。
1.2试剂耗材 Anti-CD44 antibody(Sino Biological,批号:HB06AP2601-B,浓度1.00 mg·mL-1);Protein L-PE(Sino Biological,货号:11044-H07E-P,批号:HR16JA1001,浓度0.1 mg·mL-1);1×PBS缓冲液(Gibco,规格/货号:C10010500BT/500 mL);人脐带MSC(武汉汉密顿生物科技股份有限公司,批号:UC0046)。水为去离子水;96孔稀释板(NUNC,货号:267245)。
1.3动物 食蟹猴,普通级,30只,雌雄各半,动物年龄为3~5岁,体质量2.4~5.0 kg。动物来源于永福县康顺生物科技有限公司。实验动物生产许可证号:SCXK(桂)2018-0006。实验动物使用许可证号:SYXK(鄂)2021-0090。实验动物质量合格证:No.0005086和No.0005088。动物管理、使用和相关操作均经过湖北天勤生物科技有限公司武汉分公司实验动物管理和使用委员会(IACUC)审核与批准(SOP编号:SOP/IAC/002/03),批准文号:IACUC(准)-2022-140。
2 方法
2.1样品孵育 取约每孔1.2×105个人脐带MSC悬液于96孔板中,300 ×g离心5 min,弃上清液,之后每孔加入PBS 200 μL洗涤细胞,300×g离心5 min,弃上清液;于96孔板中加入使用PBS溶液1:10稀释后的阳性质控(anti-CD44 antibody)或待测样品溶液,贴好封板膜后置于微孔板振荡器上350 r·min-1室温孵育30 min。然后,于96孔板中每孔加入PBS 200 μL洗涤细胞,300×g离心5 min,弃上清液,重复该步骤3次后于96孔板中每孔加入Protein L-PE溶液(使用前用PBS溶液进行10倍稀释)100 μL,贴好封板膜后置于微孔板振荡器上350 r·min-1,室温避光孵育15 min。最后,于96孔板中每孔加入PBS 200 μL洗涤细胞,300×g离心5 min,弃上清液,重复该步骤3次。
2.2流式检测方法 将“2.1节”步骤中的细胞每孔加入1×PBS 200 μL重悬细胞,采用流式细胞仪高通量的进样方法进行上样,检测PE荧光信号,PE通道电压设为250 V,FSL通道电压设为100 V,SSC通道电压设为320 V,收集细胞数量为10 000个。
2.3人脐带MSC在食蟹猴体内免疫原性研究 30只食蟹猴按体质量分层随机分为3组,每组10只,雌雄各半,分别为空白对照组(氯化钠注射液组)及人脐带MSC小剂量组(细胞2.4~2.5×106个·kg-1)和大剂量组(细胞4.8~5.0×106个·kg-1)。分别于第1天、第8天和第15天,通过膝关节腔注射每周给药1次,共给药3次,首次给药日为试验第一天。样品采集:其中第1天、第8天和第15天对各组所有动物分别进行1次血样采集;第22天、第29天、第36天和第43天对各组4只动物分别进行1次血样采集,收集全血至含促凝剂和分离胶的采血管中,待血液凝结后室温离心,1 800×g,离心10 min。收集血清,放置于-80 ℃超低温冰箱保存待测。
3 结果
3.1专属性 使用鼠抗人的Anti-CD44 antibody作为阳性对照,使用空白混合食蟹猴血清配制低浓度质控(100.00 ng·mL-1)、中浓度质控(500.00 ng·mL-1)和高浓度质控(5 000.00 ng·mL-1)的样品与空白血清一起按“2.1节”样品孵育步骤进行孵育,之后按“2.2节”流式细胞术进行上机检测,收集细胞10 000个后统计平均的PE荧光强度,见图1,其中空白血清平均荧光强度为55,低浓度质控平均荧光强度为160,中浓度质控平均荧光强度为632,高浓度质控平均荧光强度为5 229,结果表明不同质控浓度的样品平均荧光强度区分明显。

图1 空白血清、低浓度质控、中浓度质控和高浓度质控流式分析图Fig.1 Flow chromatograms of blank serum,low,middle and high concentration quality control samples
3.2筛选临界值和滴度临界值 对于非临床研究,临界值的建立应选择至少15个空白个体基质由至少2位分析员在至少3 d进行的3个分析批的响应值进行统计分析获得。在本研究中筛选临界值和滴度临界值的建立是通过对30个给药前食蟹猴空白血清,由3位实验人员重复测定2次,产生的180个检测信号值进行计算。首先对产生的每个个体的信号与该个体所在分析批的平均空白血清信号进行S/N和Log10(S/N)归一化处理。然后采用箱式图法进行离群值的排除。之后运用JMP 软件进行正态分布判断,S/N和Log10(S/N)数据均为非正态分布。筛选临界值因子(PSCPF)则基于统计学的单侧上限99%的百分位数,通过Excel中的Percentile公式进行计算为2.76,滴度临界值因子(TCPF)则基于统计学的单侧上限99.9%的百分位数,计算为2.85。PSCPF和TCPF将用于后续样品分析批中筛选临界值(PSCP)和滴度临界值(TCP)的计算,其公式分别为:PSCP=PSCPF×空白血清信号值,TCP=TCPF×空白血清信号值。样品筛选分析中,信号值高于PSCP 的样品将被判定为阳性。滴度分析中,阳性样品将被进行梯度稀释,稀释至信号值刚好高于或等于TCP的稀释倍数将被定义为样品的滴度。
3.3分析灵敏度和LPC(低浓度质控)浓度定值 分析灵敏度和LPC浓度定值则通过3位实验人员在3 d内分析12套滴度稀释样品获得,每套滴度稀释样品是HPC(高浓度质控)经过系列稀释依次得到,浓度分别为5 000.00、500.00、250.00、62.50、31.25、15.63 ng·mL-1。该实验中共12条滴度稀释曲线符合要求,每条稀释曲线采用两点直线回归模型来拟合,通过筛选临界值计算对应的抗体浓度,计算公式:(高于PSCP浓度-低于PSCP浓度)×(PSCP-低于PSCP信号值)/(高于PSCP信号值-低于PSCP信号值)+低于PSCP浓度。本实验共计算产生12个浓度,临界值对应的平均浓度值为88.50 ng·mL-1,临界值对应浓度的标准偏差为15.055。分析灵敏度将由PSCP对应滴度曲线中抗体浓度的95%置信区间确定,计算公式为分析灵敏度=临界值对应的平均浓度+t0.05×临界值对应浓度的标准偏差,其中t0.05由T分布数确定,t0.05=1.796,为95%置信区间对应的常数[n=12 和df(n-1)=11],df为用于计算的样品的自由度。通过计算得分析灵敏度为115.54 ng·mL-1,满足指导原则要求的非临床试验灵敏度一般需达到250~500 ng·mL-1的要求。根据1.0%分析批失败率,LPC的浓度通过以下公式计算:LPC浓度=临界值对应的平均抗体浓度+t0.01×临界值对应浓度的标准偏差,t0.01=2.718,为99%置信区间对应的常数[n=12 和df(n-1)=11],计算得LPC浓度为129.42 ng·mL-1,为配制方便,精密度考察中将按照130.00 ng·mL-1配制。
3.4精密度实验 使用混合食蟹猴血清配制3个质控HPC(高浓度质控),MPC(中浓度质控)和LPC(低浓度质控),配制浓度分别为5 000.00、500.00和130.00 ng·mL-1,每个浓度5套,配好后分装冻存在-80 ℃冰箱至少12 h。之后由3位实验人员分别在3 d进行了6次测定,计算批内和批间精密度,见表1。

表1 猴血清中抗MSC抗体测定方法的精密度Tab.1 Precision of method for anti-mesenchymal stem cell antibody in monkey serum
3.5稀释线性和勾状效应 制备高浓度的质控样品50 000.00 ng·mL-1,然后系列稀释得到10 000.00、2 000.00、400.00和80.00 ng·mL-1浓度的样品。样品测试结果:高于HPC浓度的样品响应值为13 776.0,高于HPC所对应的响应值5 120.0,无钩状效应。
3.6选择性 选择性测试了正常基质、溶血基质和高脂基质的影响。分别使用10个空白食蟹猴血清、5个2%溶血血清和5个3.00 mg·dL-1的高脂血清配制LPC 浓度的样品和空白样品同时进行测定。检测结果显示添加阳性对照抗体的样品测试结果均为阳性,未添加阳性对照抗体的空白样品测试结果均为阴性,溶血和高脂并不对方法产生影响。
3.7短期稳定性 考察样品为HPC和LPC,分别进行了冻融稳定性、室温稳定性和冷藏稳定性考察。冻融稳定性:样品在-60~-90 ℃条件下首次冷冻至少24 h,之后的每次冷冻时间至少12 h,室温条件下融解,反复冻融6次后,检测结果稳定。室温稳定性:样品在室温放置至少27 h后测试结果稳定。冷藏稳定性:样品在在2~8 ℃条件下放置至少47 h结果可接受。
3.8免疫原性研究 对30只食蟹猴,共计138个样本使用上述验证的方法进行样品的筛选分析,筛选分析为阳性的样本进行滴度检测。结果见图2,空白对照组动物所有采血点筛选分析信号值并没有随着采样时间的增加而增加,且低于筛选分析临界值,因此筛选分析均为阴性,未检测到抗药抗体;小剂量组和大剂量组,从给药后第15天开始筛选分析检测到的信号值大幅度增加,高于筛选分析临界值,筛选分析为阳性,可检测到抗药抗体产生。之后对筛选分析为阳性的样本进行滴度分析,小剂量组滴度值在20~1 000,大剂量组滴度值高于低剂量组,在40~4 000内,且小剂量组和大剂量组中均呈现了随着采样时间的增加滴度值也增加的现象。实验结果证实,人脐带MSC食蟹猴骨关节腔注射后可诱导食蟹猴体内产生抗人脐带MSC抗体,且与人脐带间充质细胞剂量呈正相关。
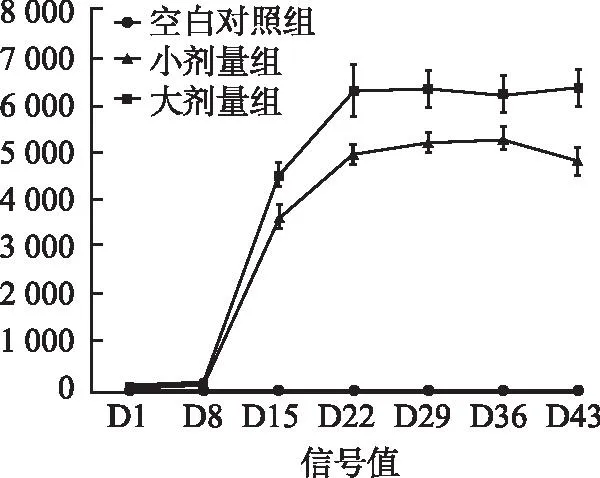
图2 空白对照组、小剂量组和大剂量组筛选分析信号值Fig.2 Signal values of screening analysis for blank control group,low dose group and high dose group
4 讨论
本文建立的流式细胞法检测抗MSC抗体,能够特异、灵敏、快速且准确地测定食蟹猴血清中产生的抗药抗体。与传统的通过评价免疫分型T/B/NK细胞的比例,或者检测细胞因子、趋化因子、黏附因子等生物标志物的水平变化来反映免疫系统的激活状态,从而间接评价MSC免疫原性相比[12-15],该方法能够更直接地检测到抗药抗体,阐明其产生时间、浓度水平以及持续时间,从而更直观地反映产生的抗药抗体对动物的毒性反应。
文献[16-17]报道,采用流式细胞法检测猴血清中抗MSC抗体,其原理是将样品与MSC孵育后,加入生物素标记的鼠抗猴IgG抗体的二抗,之后加入FITC标记的链霉素,最后上流式检测FITC 的荧光信号。由于FITC属于弱荧光,因此该方法灵敏度较低。由于二抗的特殊性,该方法只能检测产生的IgG抗体,且往往因缺少合适的阳性对照抗体而难以遵循药物免疫原性研究技术指导原则进行方法学的验证[18-19],从而存在技术风险。本研究对基于流式细胞法检测抗MSC抗体进行改进。首先,基于MSC CD105、CD166、CD29和CD44阳性的共同特征[20],选取了鼠抗人CD44的抗体作为该实验的阳性对照抗体。在二抗的选择中,采用了PE 标记的Protein L 作为检测试剂,PE作为较亮的荧光标记,可以显著提高方法的灵敏度,同时Protein L与鼠和人源化的IgG、IgM、IgA、IgD和IgE 均能够结合[21],从而实现了对不同型抗MSC抗体的检测。本研究遵循药物免疫原性研究技术指导原则进行了方法学的验证。验证中建立了筛选分析临界值和滴度临界值,由于方法的特殊性,本实验并未进行确证实验,因为未建立确证临界值,对统计方法进行了改进,未使用指导原则推荐的5%的假阳性率,而是采用更严格的1%的假阳性率进行分析临界值的计算,从而去减少假阳性的产生。相较于传统的蛋白类药物免疫原性的验证,本研究基于实际情况也未进行药物耐受的考察。其MSC与传统药物相比不同,其不会残留于血清中,因此不存在药物干扰的影响。
通过对食蟹猴血清给药前和给药后的血清进行检测发现,空白对照组信号值均低于筛选分析临界值,未产生抗药抗体,而小剂量组和大剂量组均在第15天产生了较高的荧光信号值,随着采样时间增加,荧光信号值也增加,且大剂量组的荧光信号值高于小剂量组,符合抗药抗体产生的规律,也直接证明该方法可成功用于检测食蟹猴体内产生的抗药抗体,解决通过传统间接法检测MSC免疫原性的局限性。笔者将基质换成人血清后,进行了方法学的测试,其方法的性能与食蟹猴血清无明显区别。因此该方法未来可进一步验证并用于人体临床中MSC免疫原性的研究。

