肝门部胆管癌手术疗效与安全性的影响因素分析
杨大龙 陆海明,2 钟鉴宏,3 齐鲁楠,3 陈祖舜,3 向邦德,3 黎乐群,3 马良,3
作者单位:530021 南宁1广西医科大学附属肿瘤医院肝胆胰脾外科;545000 柳州2柳州市人民医院急诊医学科;
530021 南宁3广西肝癌诊疗工程技术研究中心
肝门部胆管癌(hilar cholangiocarcinoma,HC)在中国和泰国的发病率是高收入国家的40 倍[1],且手术是唯一根治的手段。但由于疾病的隐匿性和肿瘤的高度侵袭性,大多数患者确诊时已为局部晚期或已出现远处转移[2],仅15%~30%的患者具有根治性手术切除的机会[3]。HC 手术切除难度大,为达到根治性切除常需联合多个肝段切除,血管切除重建,甚至胰十二指肠切除,因此手术时间长。此外,多数患者术前常合并营养不良、高胆红素血症及肝功能不全等,这进一步诱发了HC 围手术期并发症及死亡的发生。既往研究[4]显示,≥Ⅲa级围手术期并发症发生率约70%,包括胆漏、肝衰竭、出血及腹腔感染等。为降低围手术期死亡率并提高远期生存率,本研究通过单中心临床数据分析HC 患者围手术期发生≥Ⅲa 级手术并发症的危险因素,并探讨影响术后总生存率的因素,以期更好地指导临床决策,最终提高手术切除的有效性及安全性。
1 资料与方法
1.1 研究对象
选择2010 年6 月至2022 年3 月首次就诊于广西医科大学附属肿瘤医院并行手术治疗的HC患者为研究对象。纳入标准:⑴符合手术相关指征并接受肝外胆管切除或联合肝切除、区域淋巴结清扫、胆肠吻合等手术;⑵术后组织病理学确诊为HC;⑶患者临床基线资料和生存随访资料完整。排除标准:⑴肿瘤已出现远处转移;⑵既往有腹部手术史;⑶合并其他肿瘤。回顾性收集接受手术治疗HC 患者的临床资料,包括基本资料(性别、年龄),术前临床指标,如总胆红素、白蛋白、CA19-9 等,术前胆道引流方式、手术资料(手术方式、手术时间、术中出血量等),病理资料(肿瘤分期、肿瘤分型、肿瘤分化水平、血管侵犯、淋巴结转移、神经侵犯、肿瘤直径等)以及围手术期并发症等。本研究已获得广西医科大学附属肿瘤医院伦理委员会(LW2023178)批准,并遵循人体研究指南。由于本研究为回顾性分析,患者知情同意被豁免。
1.2 术前管理及手术方式
本研究纳入患者均行HC 肿瘤切除,包括根治性切除(R0 切除)及姑息性切除(R1/R2 切除)。R0 切除:术后病理报告镜下切缘无肿瘤细胞,即无肿瘤残留;R1 切除:术中肉眼无肿瘤残留,但镜下切缘有肿瘤细胞;R2 切除:术中肉眼可见肿瘤灶残留。对术前血清总胆红素>200 μmol/L 的患者行经皮肝穿刺胆管引流(percutaneous transhepatic cholangial drainage,PTCD)术,并常规口服胆汁回输。手术方式主要为肝外侵犯胆管切除或肝外侵犯胆管联合部分肝叶切除,部分患者联合全尾状叶或半尾状叶切除,并行空肠胆管重建。所有患者术中常规进行区域淋巴结清扫,包括肝十二指肠韧带、肝总动脉旁及胰头后淋巴结等,具体切除范围根据术中肿瘤侵犯情况、患者全身状态及术中切缘冰冻病理结果决定。手术由广西医科大学附属肿瘤医院肝胆胰脾外科团队完成。
1.3 相关定义
按Clavien-Dindo 外科手术并发症分级系统对围手术期并发症进行分级[5]。术后若出现以下任何一种情况则定义为胆漏[6]:术后3 d 及以后,腹腔引流液胆红素测定浓度高于同期血清胆红素浓度的3 倍以上;因胆汁聚集或胆汁性腹膜炎需行介入或手术治疗。术后第5天及以后,国际标准化比值(international normalized ratio,INR)延长和出现高胆红素血症(高于正常值上限,一般指大于50 µmol/L),则诊断为术后肝功能不全、衰竭[7]。依据Bismuth-Corlette 分型进行肿瘤分型。按AJCC分期第八版分期系统进行术后病理分期。围手术期死亡定义为术后90 d内的死亡[5]。
1.4 随访
本研究主要通过查阅术后复诊病历资料及电话进行随访,随访截止时间为2022年12月31日,以手术日期为患者术后生存起始时间,终点事件为患者死亡,随访至患者死亡或截止时间。总生存期(overall survival,OS)定义为从手术到任何原因死亡或最后一次随访的日期。随访内容主要包括患者术后生存状态及复发情况。对于死亡的患者,记录其死亡时间及原因。
1.5 统计学方法
采用SPSS 26.0 软件分析数据,以n(%)表示计数资料,计数资料样本组间比较采用卡方检验;计量资料描述为均数±标准差,根据资料分布类型采用独立样本t检验、单因素方差分析或秩和检验进行组间比较;术后并发症的危险因素分析时,首先采用单因素logistic回归分析筛选出相关危险因素,然后对其中P<0.1的因素进行多因素分析;生存分析采用Kaplan-Meier 法,使用log-rank检验比较组间差异;Cox回归模型用于单因素和多因素预后分析,将单因素分析差异有统计学意义的变量(P<0.05)纳入多因素Cox回归分析。本研究以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
回顾2010 年6 月至2022 年3 月符合手术指征进行开腹手术探查的HC患者,共62例HC患者接受手术探查,其中13例患者被认为不可切除。最终共49例行手术切除的HC 患者被纳入本研究,其中男性36 例,女性13 例,平均年龄(64±11)岁;R0 切除35 例,R1 切除14 例。根据患者术前影像学资料、术中探查和术后病理结果判定Bismuth-Corlette分型,其中Ⅰ型3 例,Ⅱ型10例,Ⅲa型11例,Ⅲb型21例,Ⅳ型4例。术后辅助治疗措施均为卡培他滨(1 250 mg/m2,每天2 次,口服,连用14 d,停用7 d,持续6个月)。
2.2 术后并发症
49例HC患者术后总体并发症发生率为73.5%(36/49)。按照Clavien-Dindo并发症分级系统,发生≥Ⅲa级术后并发症23 例(46.9%)。各类≥Ⅲa 级并发症累计37 次(表1),术后胆漏发生率为36.7%(18/49)。围手术期死亡率为10.2%(5/49),其中4(8.2%)例患者术后30 d内死亡,1(2.0%)例患者术后90 d内死亡。
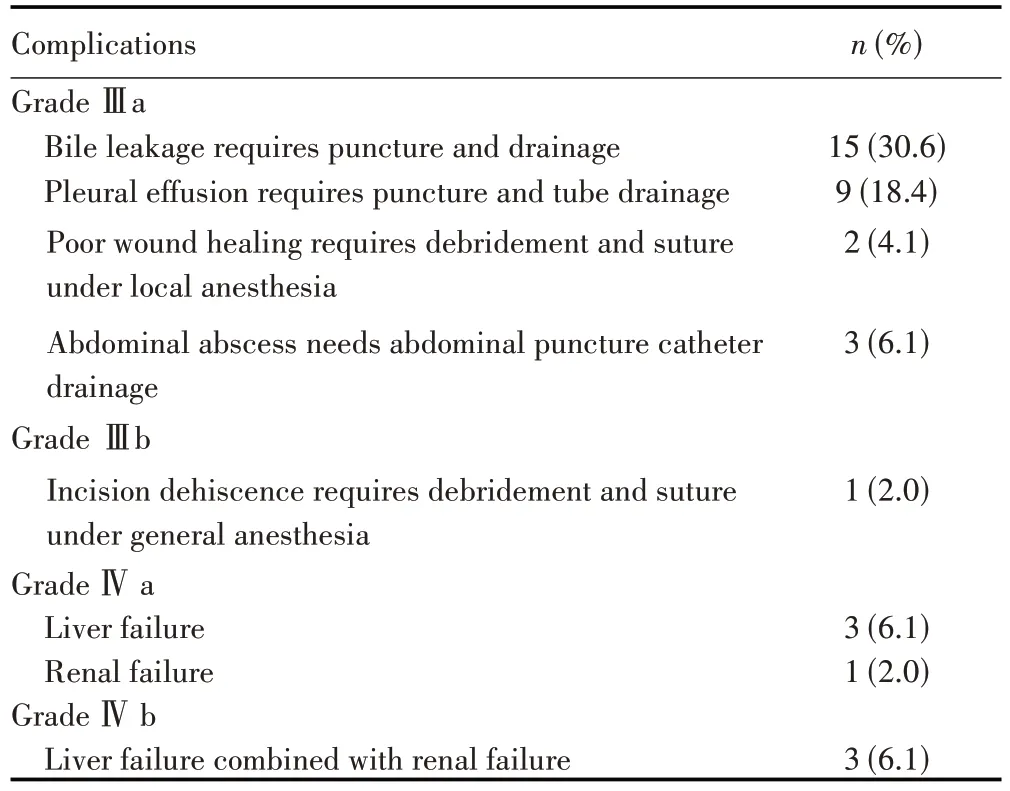
表1 49例患者中发生≥Ⅲa级手术并发症情况Tab.1 Grade ≥Ⅲa surgical complications occurred in 49 patients
2.3 术后发生≥Ⅲa级手术并发症的危险因素分析
通过对比发生和未发生≥Ⅲa 级并发症HC 患者的临床资料,发现术前白蛋白>35 g/L、术前胆红素>200µmol/L、行非全尾状叶切除、术中出血量>500 mL、AJCC 分期≥ⅢA 期是HC 患者手术切除术后发生≥Ⅲa级并发症的潜在影响因素(均P<0.1),见表2。多因素分析显示,术中出血量>500 mL、AJCC 分期Ⅲ/Ⅳ期是HC 患者术后发生≥Ⅲa 级并发症的独立危险因素(均P<0.05),见表3。
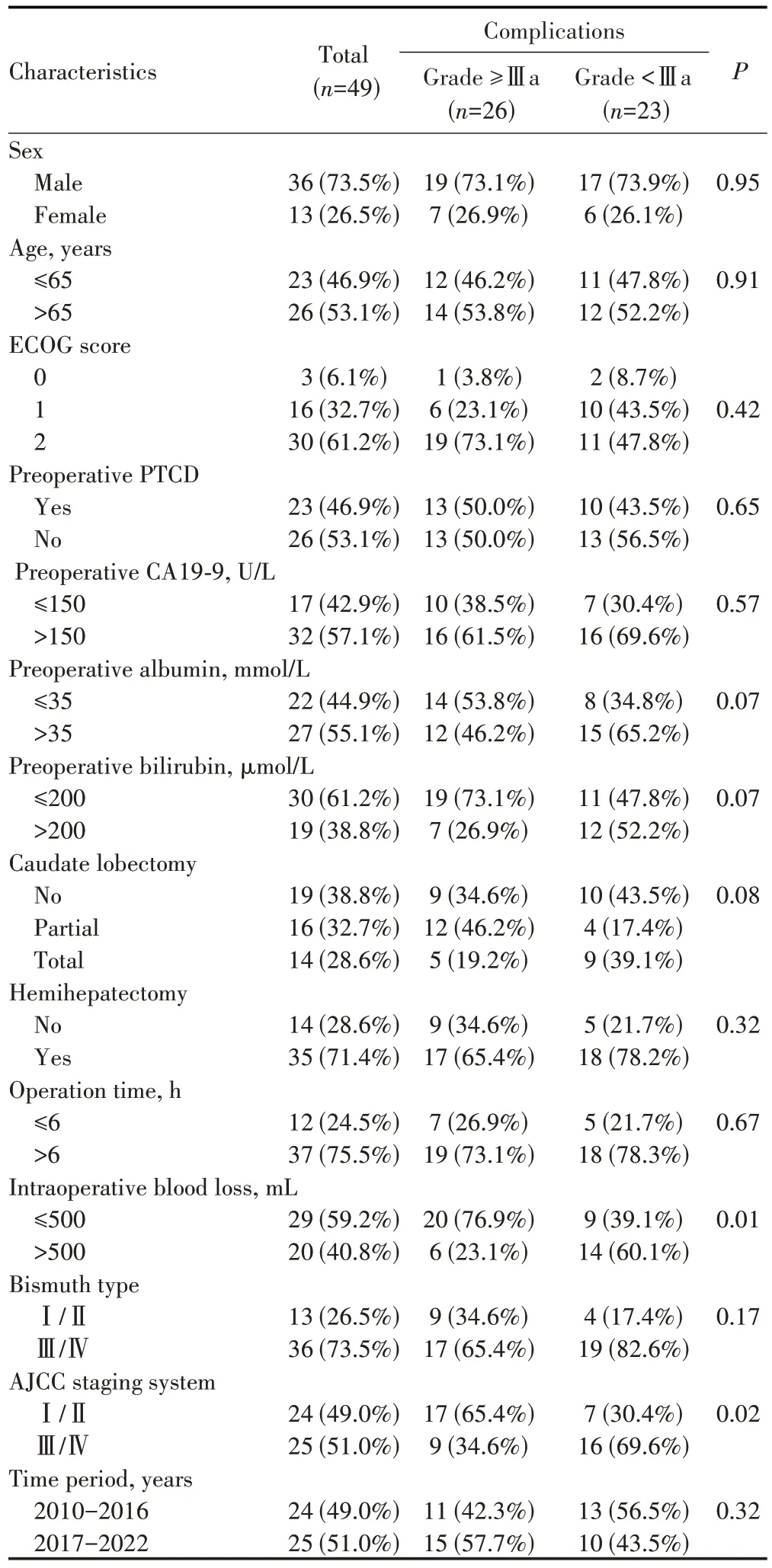
表2 影响HC切除术后发生≥Ⅲa级手术并发症的单因素分析[n(%)]Tab.2 Univariable analysis of postoperative complications of Grade Ⅲa and above after HC resection[n(%)]
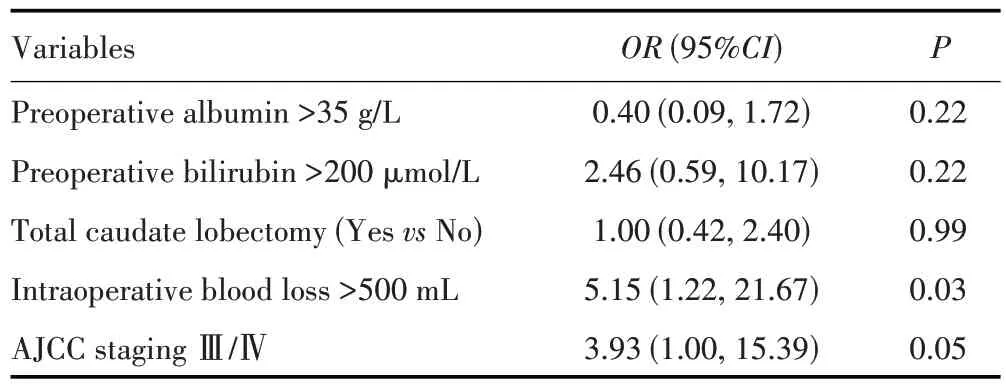
表3 影响HC切除术后发生≥Ⅲa级手术并发症的多因素分析Tab.3 Multivariable analysis of postoperative complications of Grade Ⅲa and above after HC resection
2.4 术后生存情况及影响因素分析
至随访截止日期,共有37 例患者死亡,术后中位OS 为24.0 个月,术后1、3、5 年总生存率分别为73%、49%和20%(图2A)。单因素分析显示,术前CA19-9≥150 U/L、全尾状叶切除是影响HC 患者术后OS 的潜在影响因素(表4 和图2B~C)。多因素Cox 回归分析显示,术前CA19-9≥150 U/L 是术后OS 的独立危险因素,全尾状叶切除是术后OS的独立保护因素(表5)。
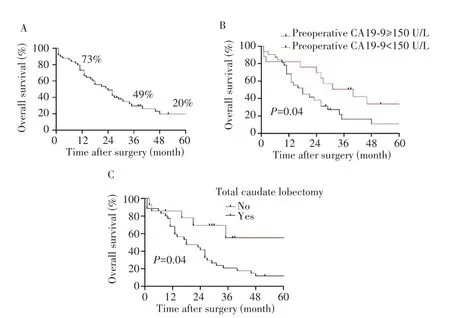
图2 HC患者的总生存曲线Fig.2 Overall survival curves of HC patients
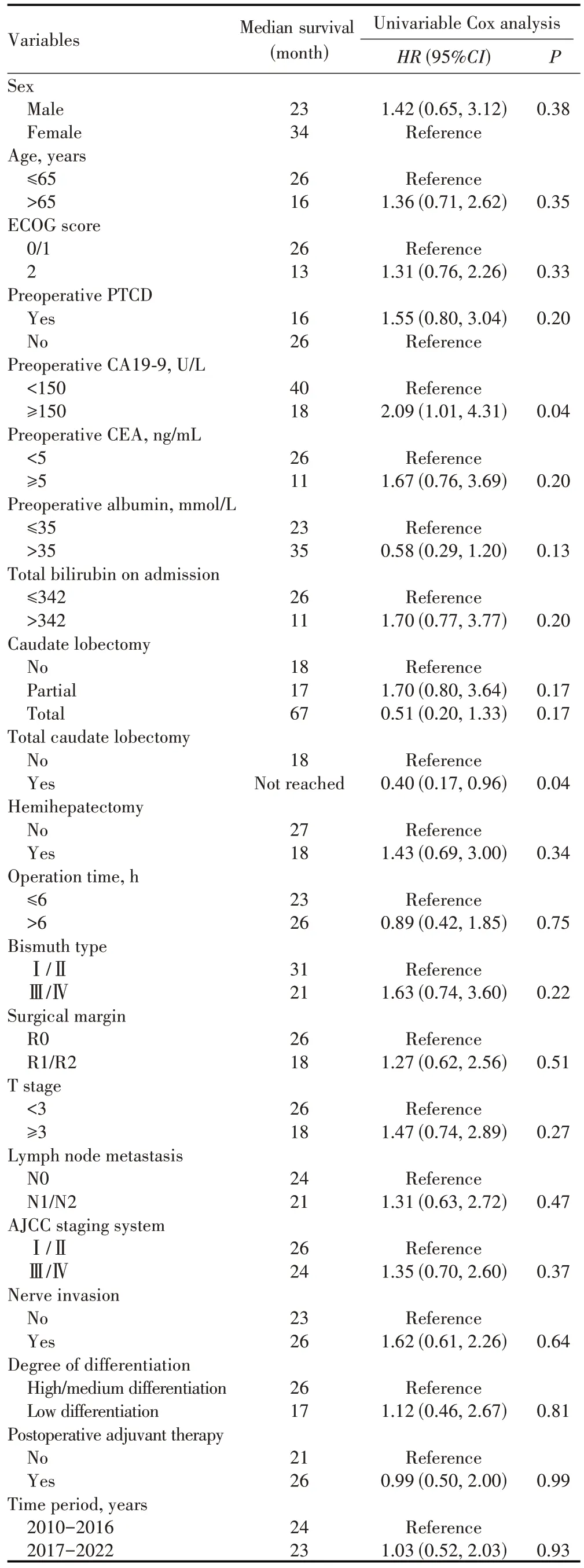
表4 影响HC切除术后总生存期的单因素分析Tab.4 Univariable analysis of overall survival after HC resection

表5 影响HC切除术后总生存期的多因素分析Tab.5 Multivariable analysis of overall survival after HC resection
3 讨论
HC 是一种罕见且具有高度侵袭性的胆道恶性肿瘤,术后中位OS 仅为25~40 个月[3,8-9],R0 切除后5 年总生存率仅为30.1%[10]。本研究发现HC 术后围手术期并发症发生率为73.5%,其中46.9%为Ⅲa级或以上;另外,围手术期死亡率高达10.2%。最常见的围手术期并发症为胆漏(36.7%),与其他中心报道的结果相近[9,11]。术中出血量>500 mL、AJCC分期Ⅲ/Ⅳ期是术后发生≥Ⅲa 级并发症的独立危险因素。LIU等[12]研究发现,HC 患者术后并发症发生的危险因素包括手术出血量>500 mL、肥胖及糖尿病。NAGINO等[11]研究中,术前胆管炎、肝功能不良、手术出血量>2 500 mL 是发生围手术期死亡的独立危险因素。NUZZO 等[9]则认为术中输血是发生围手术期并发症的危险因素之一。对于AJCC 分期Ⅲ/Ⅳ期的HC 患者,手术难度大、手术时间长、手术切除范围广、出血量多等多方面因素可能是引起术后≥Ⅲa 级并发症发生率升高的原因。此外,HC 患者术前常合并胆汁淤积性肝硬化,一定程度上导致凝血功能异常,也可能导致术中出血难以控制[13]。因此,术前对凝血功能的改善值得关注。术前有效影像学评估有利于设计合理的手术方案,术中仔细操作,减少术中出血量对降低术后≥Ⅲa级并发症的发生具有重要意义。
本研究中71.4%的HC 患者获得根治性切除,术后中位OS 为24.0 个月,术后1、3、5 年总生存率均与既往研究[11]接近。术前CA19-9≥150 U/L 和全尾状叶切除是影响患者术后生存的独立影响因素,这与既往研究发现一致[14-16]。也有研究显示,手术前后CA19-9水平变化可用于评估肿瘤切除的彻底性[17]。由于肝门部特殊解剖关系,肿瘤可沿Glisson 鞘的结蹄组织侵犯尾状叶组织[18]。既往研究显示,全尾状叶切除可以提高Bismuth Ⅲ/Ⅳ型HC 患者的R0 切除率及术后总生存率[19]。本研究中全尾状叶切除患者的术后中位OS 高于未行全尾状叶切除患者,但行部分尾状叶切除患者与未行尾状叶切除患者的术后OS 无明显差异,且全尾状叶切除并不会增加术后≥Ⅲa级并发症的发生,这与其他研究结果类似[20]。因此,HC 手术中常规实施全尾状叶切除可能有利于延长患者的OS。手术切缘、淋巴结转移和组织分化水平也被认为是影响HC 患者切除术后长期生存的主要危险因素[21]。本研究中R0 切缘患者的中位OS 优于R1/2 切缘患者,高/中分化患者的中位OS 优于低分化患者,淋巴结阴性患者的中位OS 优于淋巴结阳性,但均未达到统计学差异,可能与本研究样本量较小和随访时间较短有关。因此,对预后危险因素的探索仍需更大样本量、随访时间更长的前瞻性研究。
术前黄疸与术后出血、胆漏、肝功能衰竭等并发症的发生率增加相关[22]。有效的术前胆道引流有助于改善肝功能和凝血功能,缓解胆管炎,改善患者的全身状态。本研究中,尽管未发现术前PTCD是术后≥Ⅲa级手术并发症的危险因素,但是发现近5 年患者PTCD减黄的应用率更高,术前总胆红素大于200 µmoL 的比例更低,而术中出血量亦低于前5 年。区域淋巴淋巴结清扫是根治性切除的重要组成部分,仔细的淋巴结清扫以获取足够的淋巴结数对准确评估术后病理N分期和改善患者预后有重要意义[23]。有研究报道,清扫淋巴结数<4 个可能是术后复发的不良因素[24]。术中确认远处淋巴结转移的HC患者不应采用扩大淋巴结切除术。对于这些患者,根治性切除联合术后辅助化疗似乎是更好的选择[25]。
本研究具有一定的局限性。⑴本研究的回顾性和单中心设计可能会导致一些偏倚,包括患者回忆偏倚和误分类偏倚。⑵在本研究中,近5 年送检的淋巴结枚数较多,但术后中位总生存率未见提高;此外近5 年患者合并全尾状叶切除率亦比较高,但两组患者的中位生存率未见差异,可能与样本量较小有关,后续仍需开展多中心大样本前瞻性队列研究。
综上所述,AJCC分期Ⅲ/Ⅳ期和手术出血>500 mL是HC 切除术后发生≥Ⅲa 级手术并发症的独立危险因素,术前CA19-9≥150 U/L 是术后OS 的独立危险因素,全尾状叶切除则是术后OS 的保护因素。本研究对肝胆外科医师提高此类疾病的R0切除率、延长患者生存期及防治术后并发症有一定的参考意义。此外,术前发现影响HC患者围手术期并发症及术后长期生存的独立危险因素,有助于实现对该疾病的精准化、综合化治疗,进而提高手术切除的安全性及疗效。

