痉挛型脑瘫患儿髋脱位的相关因素
白惠中,徐林,刘港,于睿钦,左心玮,任敬佩,赵毅,胡传宇,穆晓红
(北京中医药大学东直门医院,北京 100010)
脑性瘫痪(cerebral palsy,CP)是导致儿童运动障碍的最常见原因,每1 000 名儿童中便有2~3 名儿童受累[1]。髋关节脱位仅次于马蹄内翻足畸形,是CP 患儿常见的骨骼畸形。CP 患儿的髋脱位往往在发育过程中呈进行性加重,早期仅表现为髋关节向外侧移位,后发展为半脱位,甚至全脱位[2]。髋关节脱位会引起行走、坐姿平衡等运动障碍及疼痛、骨关节炎等严重问题,显著影响了CP 患儿的生活质量[3]。目前针对CP 患儿髋脱位的措施以早期筛查为主,及时的预防措施可以有效减缓髋关节脱位的进展,如何早期预测髋脱位的发生是亟待解决的关键问题。股骨头外移百分比(migration percentage,MP)是临床诊断髋脱位的主要标准,但其对髋脱位早期的预测能力不足[4]。因此了解CP 患儿更多临床因素与MP 相关性,寻求对CP 髋脱位高危群体的筛查对疾病的治疗有重要意义。本文以大样本CP 患儿影像学及临床资料为基础,回顾性分析多种临床因素及影像学指标与CP 髋关节脱位之间的相关性,以探讨CP 髋脱位的高危因素,为早期预防髋脱位提供更多的依据。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)2014年1月—2021年12月就诊于本科的CP 患儿,符合全国脑瘫康复指南制定的痉挛型脑瘫诊断标准[5];(2)年龄2~14 岁;(3)可获得标准的骨盆正位X 线片;(4)可获得可靠的电子病例记录;(5)可以配合完成粗大运动功能分级测定者。
排除标准:(1)排除CP 以外合并其他骨骼、肌肉系统疾病的患儿;(2)排除有骨科手术史或接受过肉毒杆菌素注射治疗的患儿;(3)排除既往因外伤、感染、肿瘤等其他原因引起的髋关节畸形的患儿;(4)临床资料不完整者。
1.2 一般资料
病例资料来源于2014年1月—2021年12月就诊于本科的痉挛型CP 患儿,共235 例患者符合上述标准,纳入本研究,其中男172 例,女63 例。入院后对患儿进行骨盆正位X 线片拍摄,后期由研究者统一进行影像学测量,共测量髋关节470 侧。由同一医师对CP 患儿的粗大运动功能进行分级记录。筛选后的患儿按GMFCS 分级为Ⅰ级44 例,Ⅱ级82 例,Ⅲ级68 例,Ⅳ级41 例。入组患儿的平均年龄(8.3±3.2)岁。本研究获得北京中医药大学东直门医院医院伦理委员会审核批准,所有患者家属均知情同意。
1.3 检查方法与数据获取
1.3.1 临床检查
资料来源于从北京中医药大学脑瘫中心数据库。提取相关病历并记录患儿年龄、性别、GMFCS 分级等基本信息。由临床经验丰富的同一医师对CP 患儿的粗大运动功能进行分级(Gross Motor Function Classification System,GMFCS),并记录上传。
1.3.2 影像检查
患者取仰卧位,双下肢保持中立位,髌骨垂直向上,维持骨盆水平无倾斜,股骨没有明显旋转。对于骨盆明显前凸的患儿在两腿间放置海绵垫以克服体位不正。为确保统计资料的独立性,减少随机化偏倚对结果的影响,选取每个患儿双侧髋关节中MP 值较大的一侧进行数据分析。
1.3.3 测量指标
(1)MP:用直线水平连接两髂骨最内侧Y 软骨,即为H 线。从髋臼外侧缘起,做与H 线垂直的参考线,即P 线。MP 为股骨头外侧缘与P 线之间的距离(A)除以股骨头内侧缘与外侧缘之间的距离(B)×100%;(2)头干角(head-shaft angle,HSA):沿股骨干中轴做一条直线,另一条直线垂直于股骨近端并穿过股骨近端骨骺的中心,这两条直线构成的角度即为HAS(图1);(3)颈干角(neck-shaft angle,NSA):测量穿过股骨干中轴的直线与通过股骨头中心和股骨颈中点的另一条线之间的角度,该角度为NSA(图1);(4)髋臼指数(acetabular index,AI):取双侧髋臼内下缘顶点做一条直线记作H 线,髋臼外上缘顶点和髋臼内下缘顶点连线与H 线所成夹角为AI。

图1 骨盆正位X 线影像学测量。HSA:股骨干中轴线与股骨近端骨骺中心垂线的夹角;NSA:股骨干中轴线与股骨颈轴线之间的角度。
影像学指标结果由两名研究员从骨盆正位X 线中独立完成上述测量后汇总取平均值,当两名研究员测量结果偏差较大时,请求第三人协商并确定测量值。
1.4 评价指标
MP 参考标准按大小分为4 级,1 级(正常):MP<25%;2 级(风险)25%<MP<33%;3 级(半脱位):33%<MP<50%;4 级(全脱位):MP>50%。将MP 分级1~2 级的患儿设置为未脱位组,3~4 级患儿设为脱位组[6,7]。
GMFCS 评定参照标准分为5 级,Ⅰ级:不受限制行走,在完成更高级的运动技巧上受限;Ⅱ级:不需要使用辅助器械行走,在室外和社区内行走受限;Ⅲ级:使用辅助器械行走,在室外和社区内的行走受限;Ⅳ级:自身移动受限,需要被转动或者在室外和社区内使用电动移动器械行走;Ⅴ级:即使在使用辅助技术的情况下,自身移动仍然严重受限[8]。
1.4 统计学方法
使用SPSS 26.0 对所有数据进行统计分析。计量数据以±s表示。资料呈正态分布时,两组间比较采用独立样本t检验,资料呈非正态分布时,采用Mann-whitneyU检验。计数资料采用x2检验或Fisher精确检验。等级资料两组比较采用Mann-whitneyU检验。以是否脱位为因变量,其他资料为自变量行二分多因素逻辑回归。P<0.05 为差异具有统计学意义。
2 结果
2.1 临床结果
共测量CP 患儿骨盆正位X 线片235 例,髋关节470 个。其中,未脱位组共162 例,其中男119 例,女43 例,平均年龄(8.6±3.3)岁;脱位组共73例,其中男53 例,女20 例,平均年龄(7.7±3.1)岁。髋脱位患儿占总数的31.1%。脱位组GMFCS 分级情况为Ⅰ级2 例,Ⅱ级26 例,Ⅲ级22 例,Ⅳ级23 例;未脱位组GMFCS 分级为Ⅰ级42 例,Ⅱ级56例,Ⅲ级46 例,Ⅳ级18 例。
2.2 是否脱位的单项因素比较
按是否脱位,将患者分为脱位组和未脱位组,两组间单项因素比较见表1。两组间性别的差异无统计学意义(P>0.05);脱位组年龄显著小于未脱位组(P<0.05),脱位组GMFCS 分级显著高于未脱位组(P<0.05),脱位阻MP、HSA、AI 显著高于未脱位组(P<0.05),NSA 明显上升(P=0.018<0.05)。
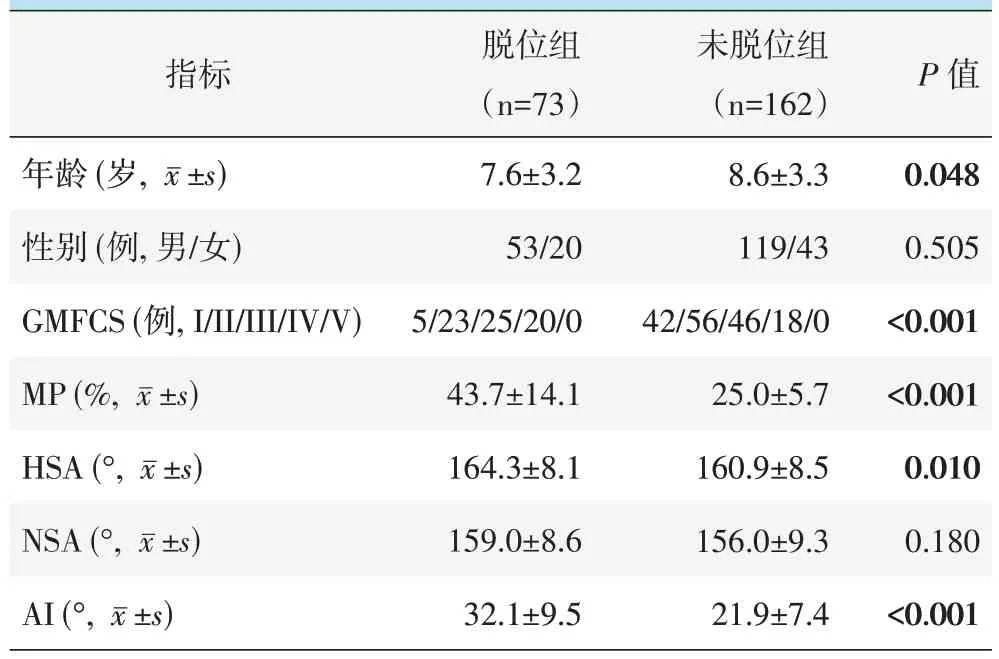
表1 是否发生脱位两组患者的单项因素比较
2.3 是否脱位的多因素逻辑回归分析
以是否脱位为因变量,选择与脱位单项因素分析中HSA、NSA、AI、GMFCS 等阳性因素为自变量行二元多因素逻辑回归分析,设置方程为向前逐步回归,多因素逻辑回归分析结果见表2。模型分类能力为36.7%,经卡方检验模型有效(x2=9.982,P=0.266)。结果显示: AI(OR=1.131,95%CI1.080~1.184,P<0.001)、 HSA (OR=1.076,95%CI1.027~1.128,P=0.002)、GMFCS(OR=1.478,95%CI1.029~2.121,P=0.003)是发生脱位的独立危险因素,NSA不是发生髋脱位的独立危险因素(P>0.05)。说明高HSA、高AI 以及高GMFCS 分级会增大CP 患儿发生髋脱位的风险。
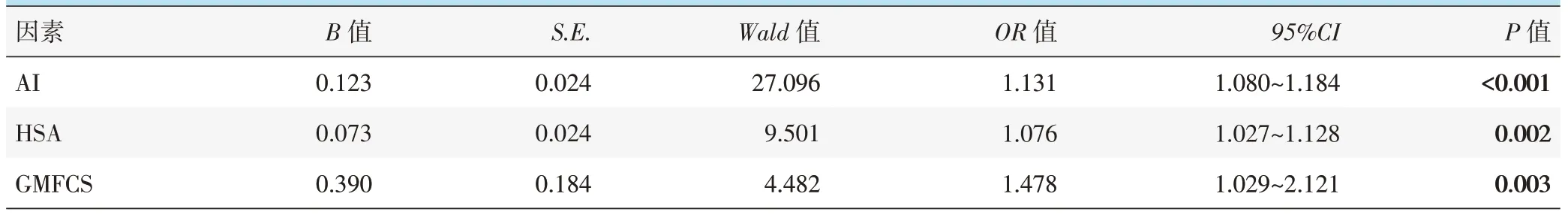
表2 是否脱位的多因素逻辑回归分析结果
2.4 临床与影像指标的单项相关分析
通过Pearson或Spearman分析将年龄、GMFCS等临床结果与MP、HSA、NSA、AI 等影像学指标进行相关性分析,结果见表3。结果显示,年龄与MP具有负相关性(r=-0.187,P=0.004),年龄与HSA 具有负相关性(r=-0.287,P<0.001),年龄与NSA 具有负相关性(r=-0.306,P<0.001),年龄与AI 具有负相关性(r=-0.264,P<0.001);GMFCS 的升高与MP 具有正相关性(r=0.375,P<0.001),GMFCS 与HSA 具有正相关性(r=0.192,P=0.003),GMFCS 与NSA 具有正相关性(r=0.235,P<0.001)、GMFCS 与AI 具有正相关性(r=0.355,P<0.001)。
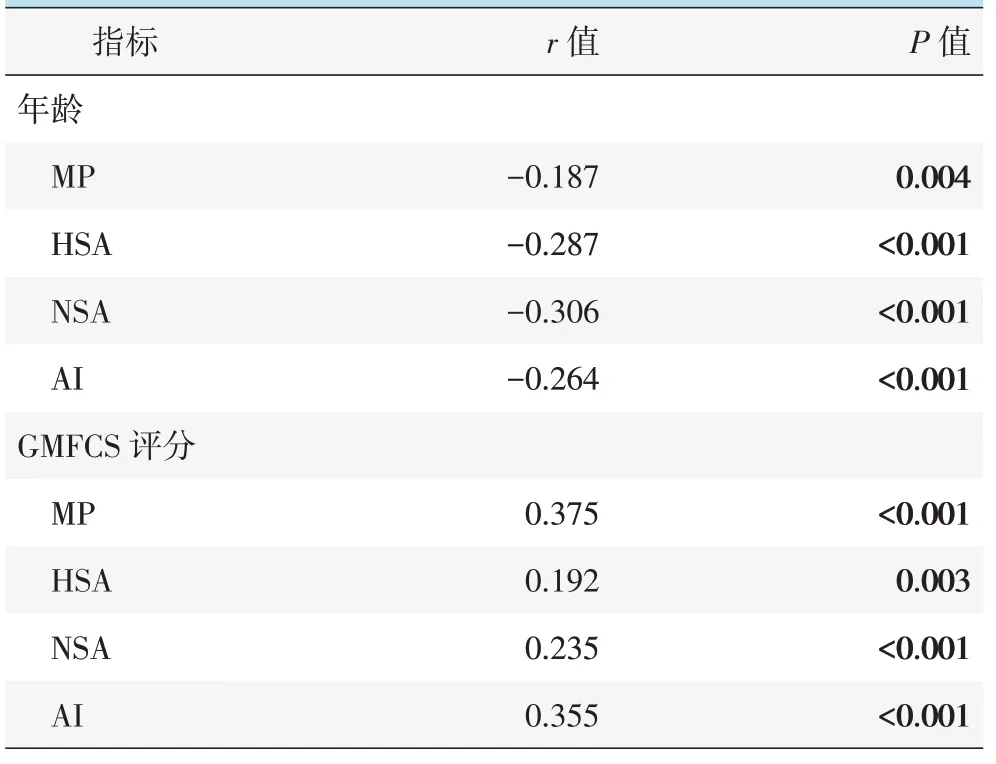
表3 470 髋临床与影像测量的单项相关分析
3 讨论
CP 是一种继发于发育早期静止性脑病的运动障碍综合征[9]。患儿出生时髋关节解剖正常,然而随着年龄增长常出现进行性加重的髋关节脱位,这一现象在无行走能力的CP 儿童中更加明显[10]。在痉挛型CP 患儿髋关节发育中,痉挛的髋屈肌、内收肌与肌力较弱的伸肌和外展肌之间的不平衡会促进股骨头向外侧移位的力,这被认为是引起髋脱位的主要原因[11]。同时,早期骨骼发育迟缓和负重活动的减少会引起股骨近端及髋臼解剖结构的发育异常,这是造成髋脱位的其他重要原因[12]。MP 作为评价髋脱位的首要标准,具有临床可靠性显著,数据直观易统计等优势,故本研究中选取MP 作为诊断髋脱位的指标[13]。GMFCS 可根据年龄将CP 儿童的粗大运动功能进行等级分类,其有效性、稳定性已在20 余年的临床应用中得到了充分验证[14]。基于CP 人群的研究表明,CP 髋关节脱位风险与神经损害的严重程度、行走能力受限有关,高GMFCS 分级代表了粗大运动功能低下,这往往与髋脱位的高风险直接相关[15]。本研究结果提示高GMFCS 等级是CP 髋脱位的独立风险因素。即随着粗大运动功能的下降,髋脱位的发生率明显升高。本研究中总体髋脱位发生率为31%,这也与既往报道研究结果相似[16]。
Hueter-Volkmann 定律指出,骨骼生长与机械应力影响密不可分[17]。CP 患儿因下肢肌肉痉挛常造成发育过程中股骨的受力异常,这种长期机械应力往往会导致股骨近端生长方向异常,加重髋脱位的发生。本研究统计结果提示,HSA、NSA 等指标的升高均与高髋脱位的风险呈正相关,其中HSA 是髋脱位的独立危险因素,相较于NSA 对髋脱位敏感性更高。这可能是因为与HSA 相比,NSA 补充了股骨头与股骨颈的相对位置,具有测量中受股骨前倾、股骨头选择的影响较小、并且可以反映生长板方向等优势[18]。
近年来,多项研究强调了HSA 在CP 髋脱位中的重要性,提出HSA 对于CP 儿童的髋关节脱位有一定的预测作用。Chougule 等[19]通过研究GMFCSⅢ~Ⅴ级、年龄3~18 岁的CP 儿童,发现HSA 与MP显著相关。而Van der List[20]和Hermanson 等[21]研究表明两岁时的HSA 对8 岁时的髋关节移位具有预测价值。Foroohar 等[18]研究发现与正常儿童髋关节相比,CP 儿童的HSA 更高,并且在合并髋脱位的儿童中升高更加明显。
本研究统计分析发现AI 是髋脱位的独立风险因素之一。AI 是临床诊断髋臼发育不良的重要指标,随着病情进展常伴有髋关节半脱位、全脱位的发生。Hagglund 等[22]发现,对于4 岁以上的CP 患儿,AI>30°对预测髋关节脱位具有明显可靠性。
本研究发现高GMFCS 与高HSA、NSA、AI、MP数值密切相关。说明CP 儿童粗大运动功能的下降可能与股骨近端骨骺发育方向畸形、髋臼发育不良等情况密切相关,最终共同引起髋脱位的发生。
既往研究表明在正常髋关节结构中HSA、NSA、AI 等指标数值常随着年龄增长而下降[23,24]。本研究数据结果发现,在CP 患儿中HSA、NSA、AI 等指标大小与年龄呈负相关。CP 伴有髋脱位的患儿随着年龄增长其脱位程度常进行性加重[25]。本研究中年龄与MP 值呈负相关,这可能与本研究非患儿自身前后对照研究有关,后续有待进一步开展关于CP 患儿自身前后对照研究以提升数据预测度的可靠性。
本研究认为高GMFCS 分级、高HSA、AI 的痉挛型CP 患儿发生髋脱位的风险更高,宜尽早、定期行X 线检查,以监测髋关节发育。

