草乌幼苗形成期叶绿体发育的转录组分析





摘要:为确定草乌(Aconitum kusnezoffii Reichb.)苗期生长发育过程中的转录组特征,本研究利用Illumina测序对草乌从种子萌发到幼苗建成涉及到的四个时期(T1,T2,T3,T4)进行转录分析,挖掘草乌幼苗形成期叶绿体发育关键基因。结果显示,4个时期的6个差异分类检测到的差异基因数量依次为:16 379,28 155,16 100,34 368,38 250和44 568个。GO富集分析显示T3vsT4差异表达基因主要富集到对几丁质的反应,光合系统Ⅰ等。KEGG富集分析显示差异表达基因显著富集的通路主要是光合生物中的碳固定,植物激素信号转导等。草乌幼苗形成期叶绿体发育过程中,19个差异表达基因注释光信号调控叶绿体发育通路上,如GLK1/2,PIFs,HY5基因等。44个差异表达基因注释植物激素信号转导通路上,如AUX/IAA,ARF,DELLA基因等。本研究挖掘到一部分草乌幼苗形成期叶绿体发育相关基因,为进一步研究草乌生长发育相关分子机制提供理论基础。
关键词:草乌;转录组;幼苗形成;叶绿体发育
中图分类号:Q943.2""" 文献标识码:A"""" 文章编号:1007-0435(2024)06-1779-10
Transcriptome Analysis of Chloroplast Development during the Formation
Stage of Aconitum kusnezoffii Seedlings
JIA Chun-he1, LYU Li-juan2, LI Xiao-jie1, ZHANG Xiao-ming1, MU Ying-tong1, FAN Dong-chang1,
LYU Yan-min3, SHI Jia-yi1, WANG Jun-jie1*
(1.Key Laboratory of Grassland Resources, College of Grassland and Resources Environment, Inner Mongolia Agricultural
University, Ministry of Education, Hohhot, Inner Mongolia 010019; 2.Hohhot Forestry and Grassland Bureau, Hohhot, Inner
Mongolia 010019; 3.Horqin Right Wing Middle Banner forestry and grassland Bureau, Horqin Right Wing Middle, Inner Mongolia 029400)
Abstract:In order to obtain the transcriptome characteristics of Aconitum kusnezoffii Reichb. during seedling growth and development in this study,Illumina sequencing was used to transcriptionally analyse key genes for chloroplast during the four periods (T1,T2,T3,T4) involved in the development of Aconitum kusnezoffii from seed germination to seedling establishment. The results showed that the number of differentially expressed genes detected in the six differential classifications of the four periods was 16 379,28 155,16 100,34 368,38 250 and 44 568,respectively. GO enrichment analysis showed that the differentially expressed genes in T3vsT4 were enriched in responses to chitin,photosynthetic system I,etc. KEGG enrichment analysis showed that the pathways significantly enriched in differentially expressed genes were mainly carbon fixation in photosynthetic organisms,plant hormone signal transduction,etc. For the development of chloroplasts during the formative stage of Aconitum kusnezoffii seedlings,nineteen differentially expressed genes,such as GLK1/2,PIFs, HY5 genes,are annotated to the light signaling pathway regulating chloroplast development. Forty-four differentially expressed genes annotated were in plant hormone signaling pathways,such as AUX/IAA,ARF,DELLA genes,etc. This study identified some genes related to chloroplast development during the formation stage of Aconitum kusnezoffii seedlings,providing a theoretical basis for further research on the molecular mechanisms related to the growth and development of Aconitum kusnezoffii.
Key words:Aconitum kusnezoffii Reichb;Transcriptome;Seedling formation;Chloroplast development
草乌(Aconitum kusnezoffii Reichb.)为毛茛科的多年生草本,别名北乌头,广泛分布于我国东北、华北地区。传统蒙医药中,草乌块根、叶、花及芽等部位分开入药[1]。附子是北乌头的干燥块根,可入药,具有祛风除湿、温经止痛之功效[2]。草乌的干燥叶、幼芽、花等用于治疗风寒湿痹、关节疼痛、心腹冷痛及麻醉止痛等[3]。
光是影响植物生长和发育的关键环境因子之一,光作为能量来源为植物生长发育提供营养,还作为信号参与植物生命周期的调控,在植物幼苗形成过程中经历了光形态建成及叶绿体发育。光参与调控植物细胞的生长、分化,使植物细胞结构、功能发生变化,汇聚成植物组织和器官,这个过程称为植物的光形态建成[4]。植物的光形态构建过程可人为按照最有效的光谱范围分成两种:红光反应和蓝光反应。植物叶子的增大主要靠红光反应,而气孔打开、叶绿体分化与运动是蓝光反应[5]。在感知红光时,光敏色素通过触发磷酸化和蛋白酶体降解来抑制(Phytochrome-interacting factors,PIFs)的功能,PIFs是一类可以与光敏色素相互作用的螺旋-环-螺旋(helix-loop-helix)家族转录因子,进而减轻PIFs对叶绿素生物合成和光合系统相关基因的抑制[6]。此外,光敏色素还抑制光信号传导的另一种抑制因子,即E3泛素连接酶复合物COP1-SPA1,从而驱动PhANGs的转录[7-8]。叶绿体正常发育的重要条件是光,一系列能够感受特定波长的蛋白可感知光,蛋白通过构象变化会与下游信号分子互相作用。光敏色素(Phytochrome A/B,phyA/B)、隐花色素(Cryptochrome,cry)被认为是调节光形态建成的两类光受体[9]。当幼苗从土壤覆盖中出现时,光引发了从暗生长的光形态建成到光生长的光形态建成的形态和生理巨变[10-11],包括下胚轴伸长抑制、顶端弯钩展开、子叶张开和膨大以及黄化体到叶绿体的转变[12-14]。在光下PhyB能够转到核内并与PIF3结合,以此自身磷酸化开启,调控光形态建成相关基因的转录[9,15],PIF3负调节编码叶绿素合成调节酶基因HEMA1、GUN5以及光合系统PSI中LHCA1、PsaE1基因的表达[16-17]。光形态建成受PIFs家族基因抑制,尤其是叶绿体的发育[18]。叶绿体的生物发生通过大量信号转导在细胞核和叶绿体之间进行协调,以此来促进功能叶绿体的组装和生物合成[19]。
激素在调控叶绿体发育过程中同样起着重要的作用。PIFs作为光信号调控叶绿体发育的重要调控因子,BZR1与PIF4的N端结构域结合形成异源二聚体,从而共同抑制GLK1、GLK2和几个叶绿素生物合成基因的表达。HY5与去磷酸化状态BZR1形成异源二聚体,减弱了BZR1的活性,进而促进了叶绿体发育相关基因的表达,使叶绿体的发育不再受到抑制。DELLA蛋白是GA信号转导的抑制子,当感受到GA信号时,DELLA蛋白经26S蛋白酶体降解失活。当DELLA蛋白不响应GA信号时,DELLA蛋白结合PIF并通过泛素-蛋白酶体途径诱导其降解,以此降低PIF活性,进而削弱了PIF对叶绿体发育相关基因的转录抑制[20]。
目前草乌的研究多集中在栽培技术和生物碱含量等方面,关于草乌叶绿体发育方面的研究未见报道。叶绿体不光是植物细胞的重要器官,还是维持植物生命活动的关键因子,植物进行光合作用的主要场所是叶绿体,而光合作用的进行依赖叶绿体的正常发育,因此,叶绿体的正常发育对草乌生长发育具有重要意义。本文通过对草乌种子萌发及幼苗建成涉及到的四个时期进行转录测序,挖掘草乌幼苗形成期叶绿体发育相关基因,为进一步研究草乌生长发育调控过程以及乌头属植物进化提供依据。
1 材料与方法
1.1 材料来源
草乌(Aconitum kusnezoffii Reichb.)种子于2020年在内蒙古自治区赤峰市巴林右旗赛罕乌拉自然保护区采集。选取颗粒饱满、大小一致的种子用清水浸泡48 h,种子与砂土按1∶3拌匀,置于容器中封好,砂土湿度(15%~20%),置于-5℃/4℃变温环境下每 7 d交替一次,相对湿度 50%低温培养箱中层积。第0 d(CK)、14 d(种子吸胀)、42 d(种子露白)取样,待种子露白后,放置于15℃光照培养箱中催芽处理,14 d后取样(种子子叶露出,并且变为绿色),各时期称取0.5 g新鲜样品,3次重复,分别用T1,T2,T3和T4表示。
1.2 RNA提取和转录组测序
采用Trizol法提取样品总RNA[21],得到草乌总RNA后用Agilent 2100检测RNA的质量,质量合格后一部分-70℃保存用于qRT-PCR,一部分送往上海欧易生物科技有限公司进行上机测序。原始数据(raw data)用Fastqc质量评估后用trim-galore对原始数据进行剪切得到clean data。使用Trinity[22]软件采用paired-end方法对clean data进行无参转录组从头组装(de novo)得到转录本,选择最长的转录本作为Unigene,用CD-HIT[23]软件去冗余得到最终的Unigene,作为后续分析的参考序列。
1.3 草乌的unigenes的功能注释和叶绿体发育相关基因的鉴定
为获得草乌的unigene功能信息,将测序得到的Unigene比对Nr、Nt、KOG/COG、Swiss-Prot、KO和GO数据库[24],使用HMMER[25]软件对Pfam数据库进行Unigene的功能分析。利用FPKM法计算基因的表达水平,利用DESeq2软件分析T3vsT4时期差异表达,筛选条件为qlt;0.05 且差异倍数(foldChange)gt; 2为差异表达基因。
1.4 实时荧光定量qRT-PCR验证
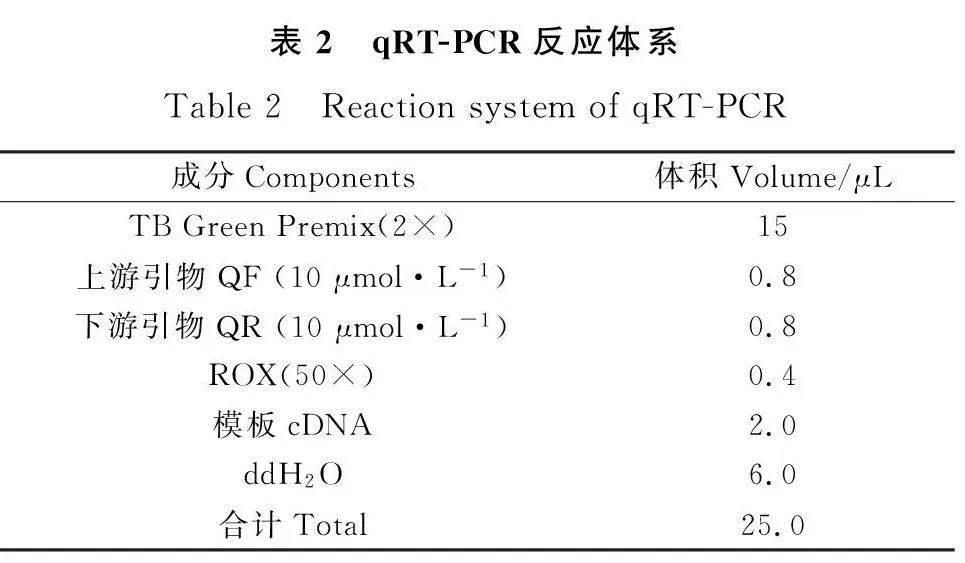
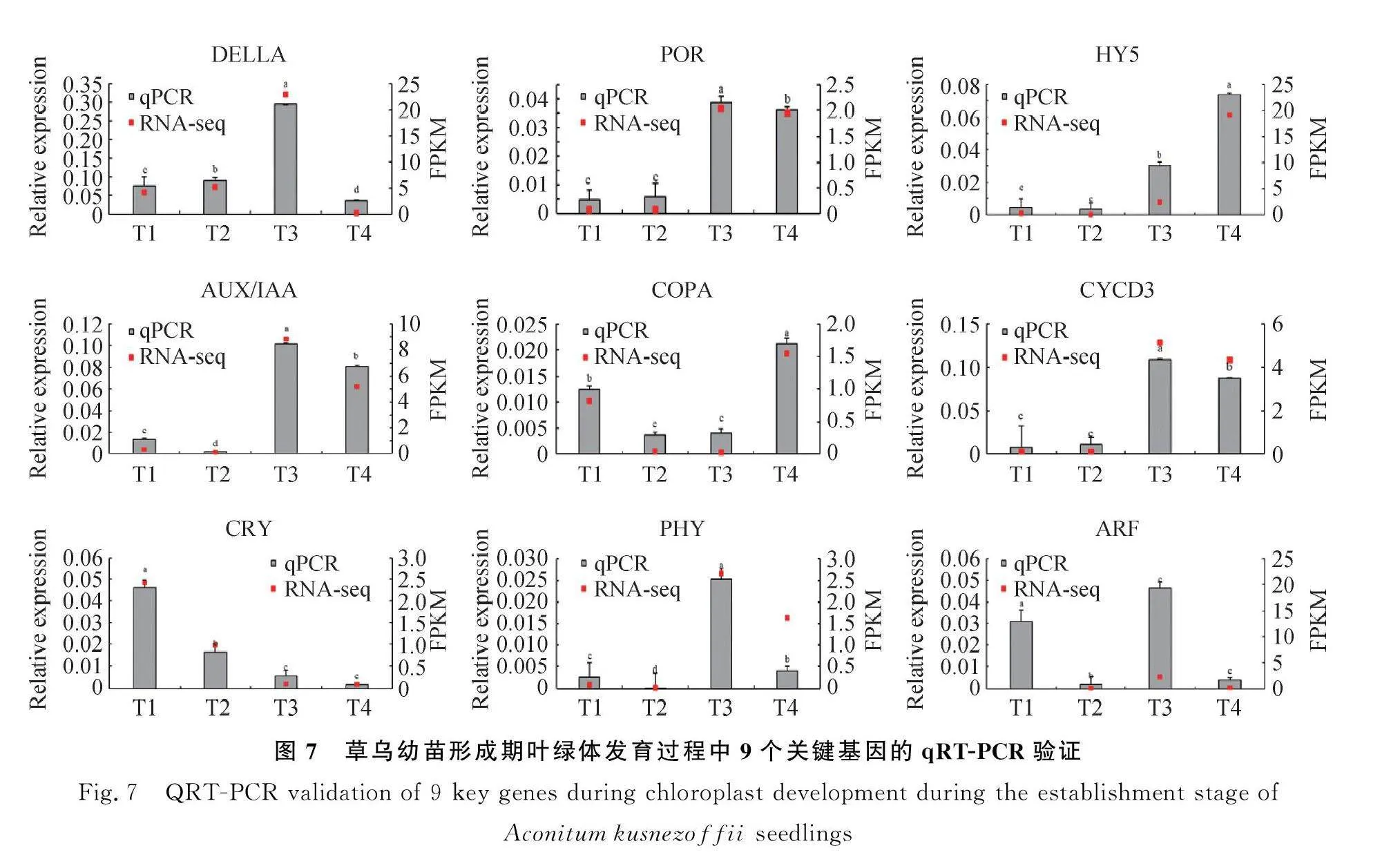
在本研究所有差异表达基因中随机选取9个与草乌叶绿体发育相关基因进行验证,使用Primer3plus网站设计PCR引物(表1),以草乌中actin为内参基因,采用Trizol法提取样品总RNA,使用PrimeScript TM 1 st Strand cDNA Synthesis Kit(TaKaRa)反转录试剂盒进行cDNA合成,以cDNA为模板进行qRT-PCR分析。qRT-PCR反应体系见表2,试验技术设置3次重复,基因表达量采用2-ΔΔCT法计算[26]。
2 结果与分析
2.1 草乌转录组数据组装与功能注释
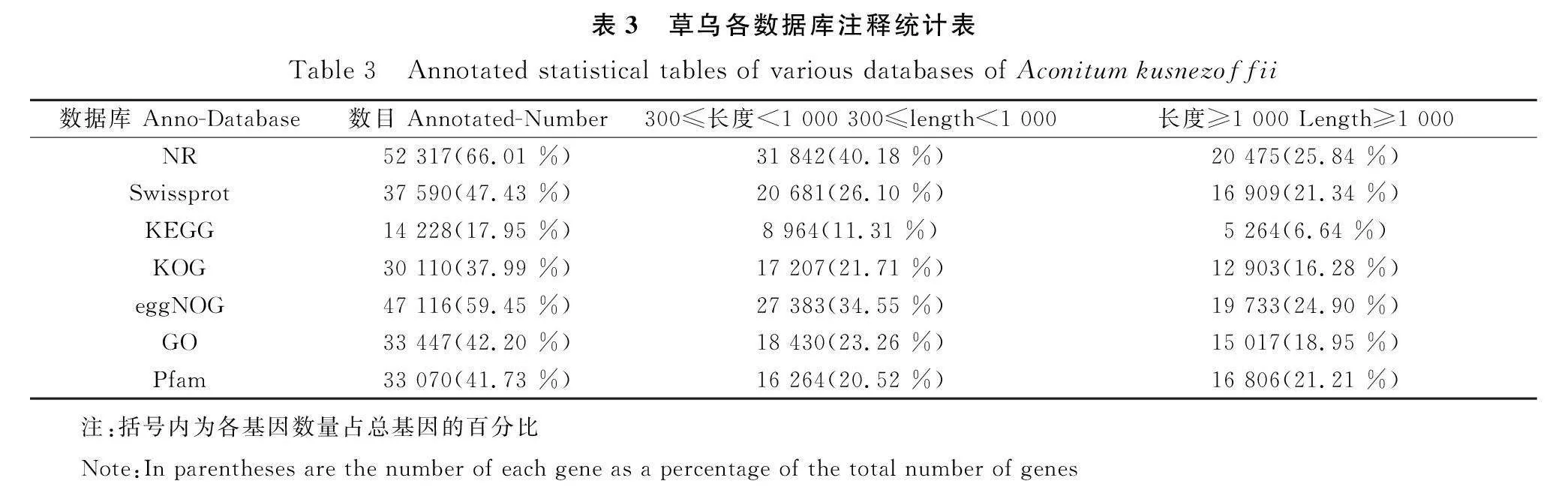
通过用Trinity软件对所有reads进行组装,我们在草乌中发现了79 251个unigene,平均长度为881.74 bp,组装的unigene的N50长度为1 221 bp,平均GC含量为46.72%。为了获得本研究中草乌叶绿体的基因功能信息,我们采用diamon软件将Unigene与6大数据库进行比对,选择具有最高序列相似性的蛋白,获得功能注释信息(表3)。
2.2 叶绿体发育过程差异表达基因及其功能富集分析
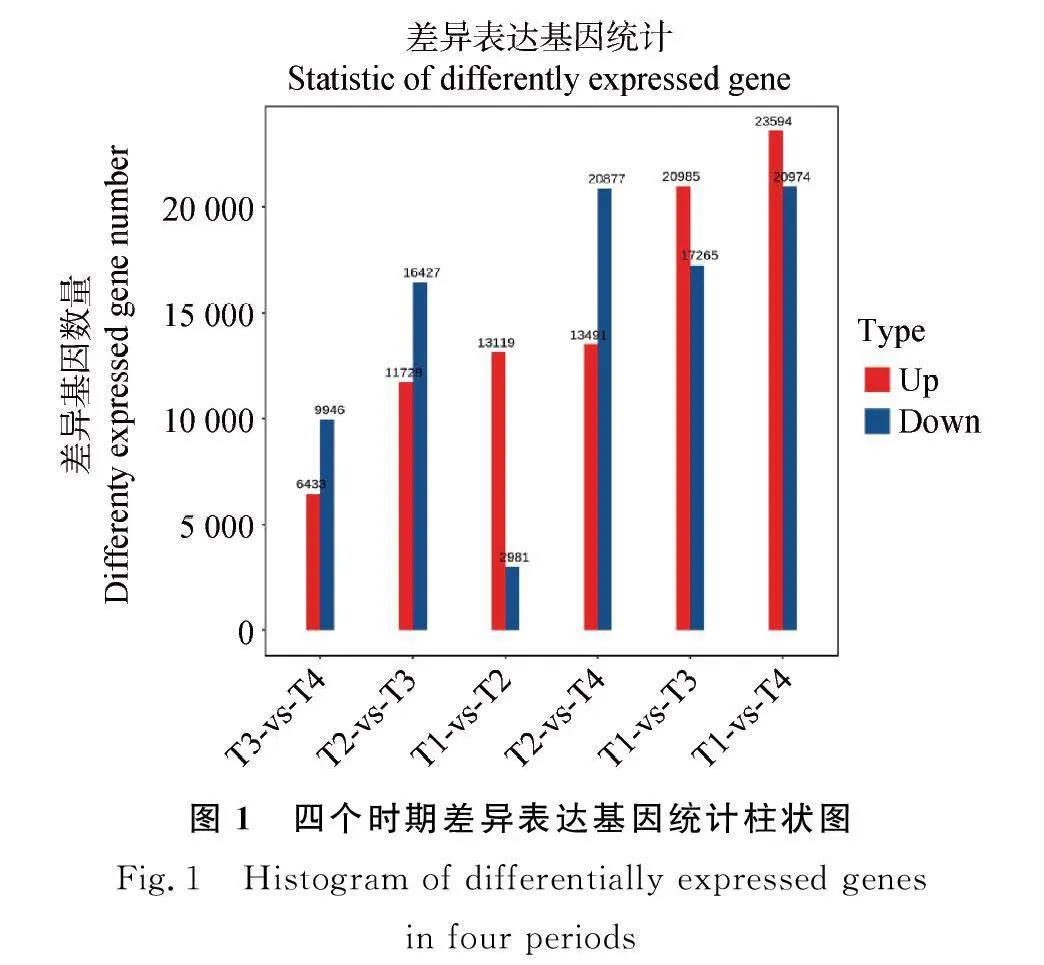
2.2.1 差异表达基因的统计分析 以qlt;0.05 且差异倍数(fold Change)gt; 2作为筛选条件,将4个不同时期草乌两两比对,即T1vsT2、T1vsT3、T1vsT4、T2vsT3、T2vsT4、T3vsT4筛选差异表达基因(DEGs),结果表明,在T1vsT2中获得16 100个差异表达基因,上调基因数13 119个,下调基因数2 981个。在T1vsT3中获得 38 250个差异表达基因,上调基因数20 985个,下调基因数17 265个。在T1vsT4中获得44 568个差异表达基因,上调基因数23 594个,下调基因数20 974个。在T2vsT3中获得28 155个差异表达基因,上调基因数11 728个,下调基因数16 427个。在T2vsT4中获得34 268个差异表达基因,上调基因数13 491个,下调基因数20 877个。在T3vsT4中获得16 379个差异表达基因,上调基因数6 433个,下调基因数9 946个(图1)。
2.2.2 差异表达基因的GO富集分析 为了研究草乌幼苗形成期叶绿体发育过程中差异表达基因的主要生物学功能,对T3vsT4差异表达基因进行GO功能分析。图2展示了T3vsT4对比组合在生物过程、细胞组分、分子功能中显著性前10的GO条目,从图中可以看出差异基因富集在生物过程和细胞组分较多。T3vsT4差异基因在生物过程中多富集在对几丁质的反应、防御反应过程等;在细胞组分中差异基因主要富集在光合系统Ⅰ、细胞壁等;在分子功能多富集在脂肪酶活性、邻苯二酚氧化酶活性等。对所有差异基因进行GO富集分析,结果显示草乌在光形态建成和叶绿体发育过程中在生物过程富集到参与光合作用(GO:0015979)、防御反应(GO:0006952)。在分子功能富集到DNA结合转录因子活性(GO:0003700)。在细胞组分富集到叶绿体类囊体膜(GO:0009535)、叶绿体(GO:0009507)、类囊体(GO:0009579)、叶绿体基质(GO:0009570)、叶绿体类囊体(GO:0009534)、植物型细胞壁(GO:0009505)、质外体(GO:004804)。以上结果表明这些差异表达基因主要参与光合作用和叶绿体发育相关代谢途径,参与调控叶绿体的发育,影响光合作用(表4)。
2.2.3 差异表达基因的KEGG富集分析 通过对T3,T4实验组间比较的差异表达基因进行KEGG代谢通路显著性分析,选择前20条(筛选对应差异基因数目大于 2的Pathway条目,按照每个条目对应的-lgPvalue由大到小排序)通路做气泡图进行分析(图3),T3vsT4时期差异表达基因显著富集的通路主要是核糖体、植物-病原体相互作用、植物激素信号转导、光合生物中的碳固定、苯丙类生物合成等。核糖体、植物-病原体相互作用、植物激素信号转导、光合生物中的碳固定等代谢通路可能在草乌幼苗形成期叶绿体发育过程中起到一定作用。
2.3 光信号调控草乌叶绿体发育过程中相关基因表达模式分析
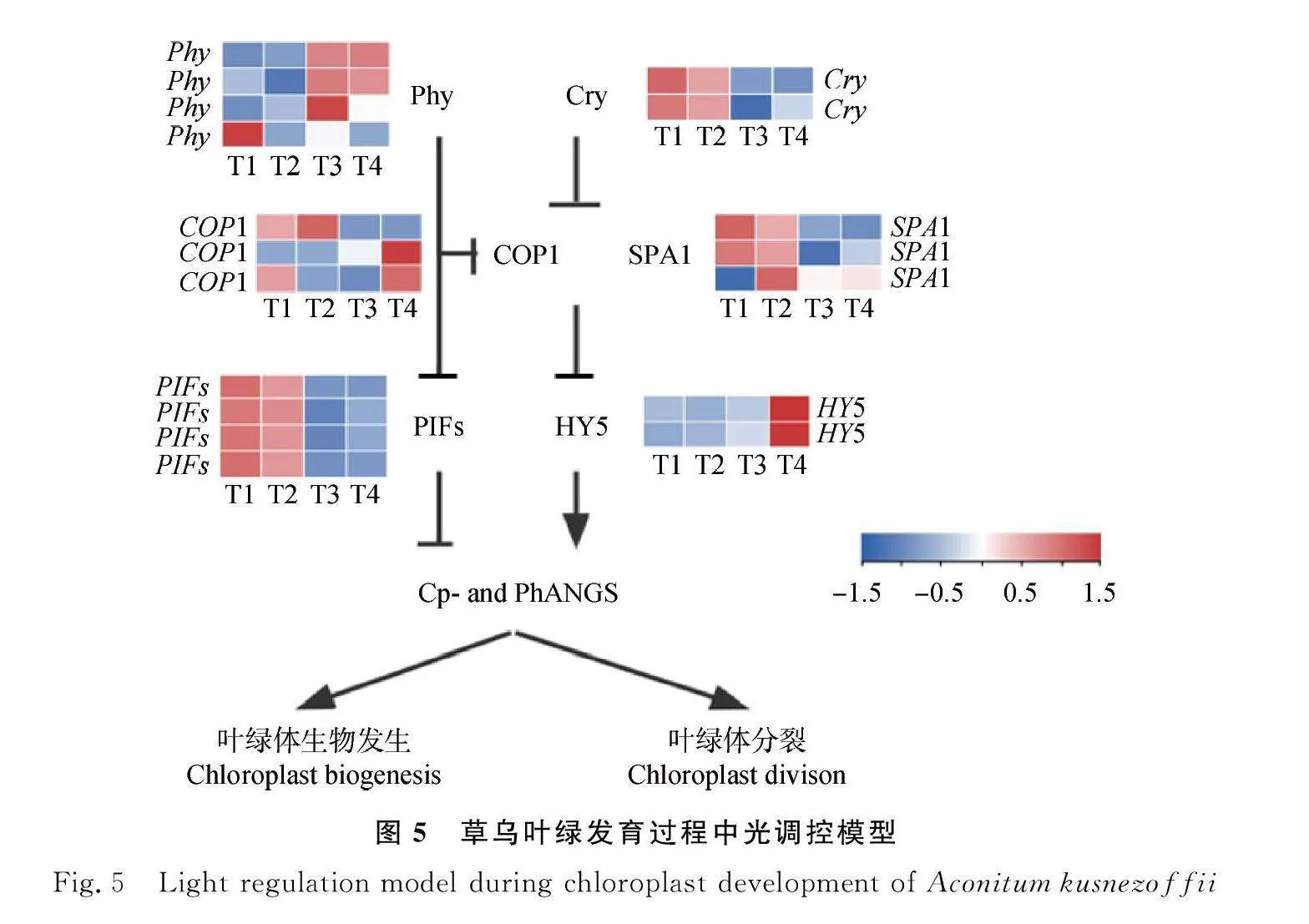
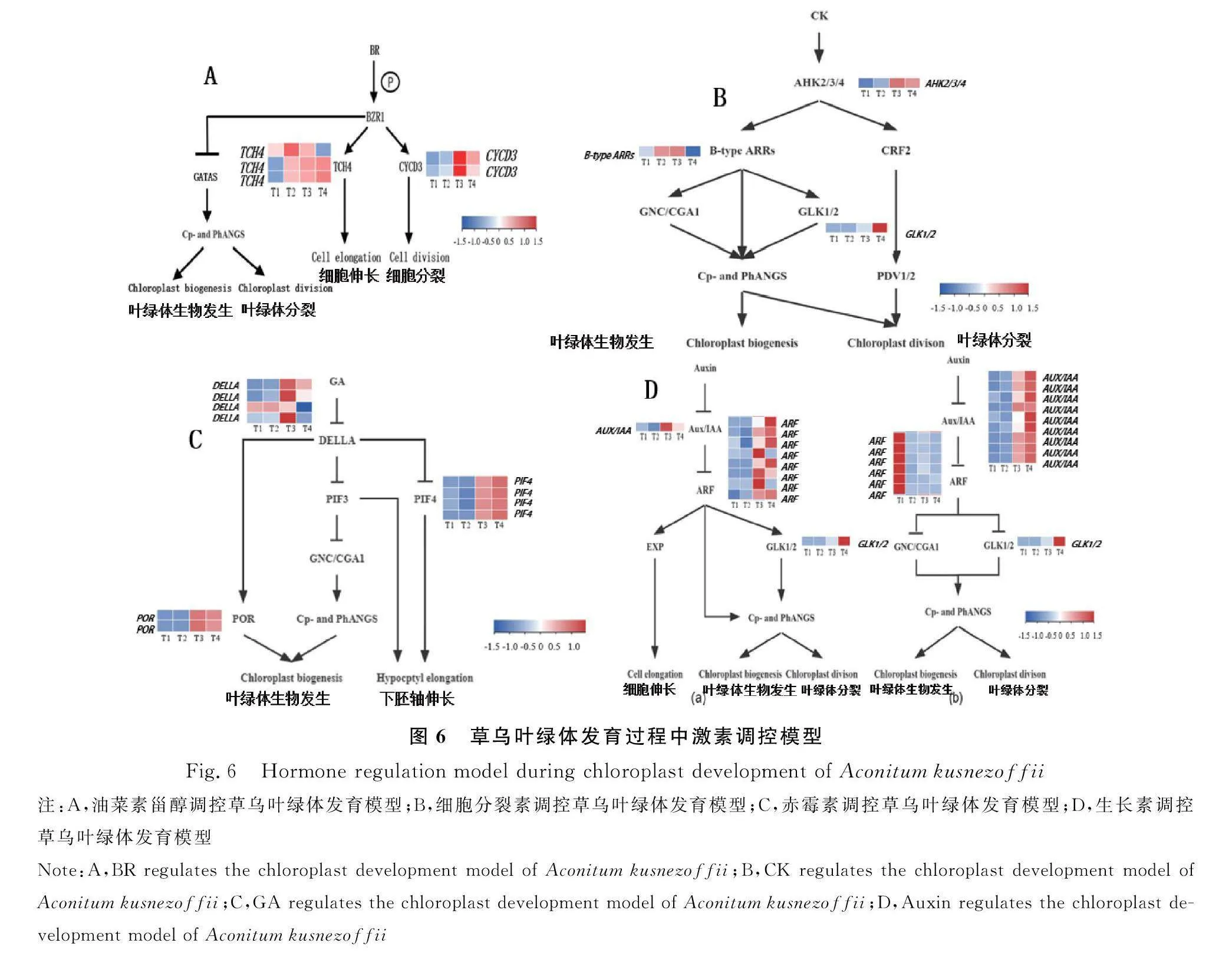
在光对叶绿体发育的影响途径中,本研究鉴定出了1个编码GOLDEN2-LIKE(GLK)蛋白的DEGs,是促进叶绿体发育和叶绿素合成的核心转录因子,常以GLK1/GLK2基因对的形式存在,该基因在植物中的功能是保守的,叶绿体发育受它正调控,GLKs调节一些-Cp和PhANGs(叶绿体和光合作用相关的核基因)的表达[20]。在草乌叶绿体发育过程中,(GLK)在幼苗形成阶段上调表达,说明其调控叶绿体生物发生和叶绿体分裂过程(图4)。
在草乌叶绿体发育过程中的光调控模型中共鉴定出了18个显著差异表达的基因;在T4时期,2个DEGs(Phy)上调表达,1个DEGs(Phy)下调表达,2个DEGs(Cry)下调表达,2个DEGs(SPA1)下调表达,2个DEGs(COP1)上调表达,1个DEGs(COP1)下调表达,4个DEGs(PIFs)下调表达,2个DEGs(HY5)上调表达;在T3时期,1个DEGs(Phy)上调表达;在T2时期,1个DEGs(SPA1)上调表达(图5)。
2.4 激素调控草乌叶绿体发育过程中相关基因表达模式分析
BR对光形态发生和叶绿体发育的调控主要由BR信号转导通路的核心转录因子(BR-activated transcription factor 1,BZR1)及其同源物BES1介导的。BZR1是BR信号转导过程中必不可少的转录因子,许多靶基因的表达都受它直接调控[27],在BR调控叶绿体发育途径中共鉴定出了5个DGEs,2个DEGs(TCH4)在T4时期上调表达,1个DEGs(TCH4)在T4时期下调表达,2个DEGs(CYCD3)在T3时期上调表达(图6)。
在细胞分裂素调控叶绿体发育过程中,1个细胞分裂素受体的His激酶(Arabidopsis His Kinase2)(AHK2)、AHK3和CRE1/AHK4在T4时期上调表达。与细胞分裂素结合后,这些受体通过组氨酸磷酸转移蛋白(AHPs)将信号传递至B型应答调节剂B-ARR,ARR(Arabidopsis Response Regulator)激活下游靶基因的转录[28],在T4时期,1个DEGs(B-ARR)下调表达,1个DEGs(GLK1/2)上调表达,以调节叶绿体的发育(图6)。
暗形态建成到光形态建成期间,DELLA蛋白介导赤霉素信号与光信号之间的互作。本研究中,在T3时期,4个DEGs(DELLA)上调表达;在T4时期,4个DEGs(PIF4)上调表达,促进了叶绿体的发育和下胚轴伸长。本研究中,2个POR酶的DEGs在T4时期上调表达(图6)。
在细胞水平上,ARF (Auxin Response Factor) 和AUX/IAA (Auxin/indole-3-Acetic Acid Inducible)蛋白因子调控生长素,如图6(D)中的a过程所示,本研究中鉴定到1个DEGs(Aux/IAA)在T3时期上调表达,7个DEGs(ARF)在T4时期上调表达,2个DEGs(ARF)在T4时期下调表达,1个DEGs (GLK1/2)在T4时期上调表达。如图6(D)中的b过程所示,本研究中,在T4时期鉴定到9个DEGs(Aux)上调表达,6个DEGs(ARF)下调表达,1个DEGs(GLK1/2)上调表达,因此,GNC和GNL的表达受生长素和赤霉素在转录水平上的交叉调控,进而影响叶绿体发育和叶绿素合成[29] (图6)。
2.5 关键基因相对表达量分析
草乌幼苗形成期叶绿体发育过程中关键基因表达情况如图7所示,结果表明,除了PHY、ARF外,DELLA、POR、HY5、AUX/IAA、COPA、CYCD3和CRY的转录组分析与qRT-PCR分析结果基本一致。PHY在转录组分析T4时期表达量下调,qRT-PCR分析结果中表达量也下调,但表达量与转录组分析数量有差异。ARF在转录组分析T3时期表达量上调,qRT-PCR分析结果中表达量也上调,但表达量与转录组分析数量间差异较大。
3 讨论
叶绿体的发育在植物萌发到成苗这一阶段至关重要,影响着植物的整个生命周期。黑暗中,光敏色素相互作用因子(PIF)抑制与光合作用相关的核编码(PhANG)转录,包括编码叶绿素生物合成酶的基因和(GLK1)转录因子等。同时,E3泛素连接酶复合物也会降解大量的转录因子和活化的光敏色素,特别是(HY5)转录因子[30]。遗传学研究发现,植物的子叶和真叶这两种叶片里叶绿体的发育是不同的,二者有自己的发育通路,但任何一个部位受到影响,都会影响植物的生长[31]。了解叶绿体发育的调控机制意义重大。前人研究发现,在黑暗条件下,GNC和GNL(GATA家族转录因子)的过表达促进了原质体向黄化质体的分化;在光照下,促进叶绿体发育[32]。本研究中光信号调控叶绿体发育过程中发现1个DEGs(GLK1/2)在T4时期显著下调,2个DEGs(CRY)在T4时期显著下调,4个DEGs(PIFs)和2个DEGs(HY5)在T4时期显著上调,激活下游转录因子促进叶绿体发育。
叶绿体的生物发生由核和叶绿体编码的基因产物共同决定。除了光以外,一些激素如生长素、细胞分裂素、赤霉素等都参与调节叶绿体发育。植物激素可以通过控制细胞分裂和扩张之间的平衡,或通过影响光合作用相关基因的表达、叶绿体的生物合成和分裂来影响细胞中叶绿体的大小,从而影响其发育。在光形态建成过程中BR信号被植物接收后,BRZ1受体会结合GATA2的启动子,因此GATA2的表达被抑制;光形态建成相关因子COP1的水解被光抑制,GATA2被激活跟光响应基因的启动子元件结合,光和BR响应基因的表达被调控,因此植物幼苗生长被影响,在光形态建成过程中,GATA2起正调节因子的作用[33]。HY5是连接光信号与激素信号的重要节点,通过整合光信号以此来影响激素含量来促进光形态建成。例如,HY5可以与BZR1相互作用拮抗BZR1来调控子叶开放相关基因的转录活性[34],本研究在BR调控叶绿体发育途径中发现2个DEGs(TCH4)在T4时期上调表达,1个DEGs(TCH4)在T4时期下调表达,2个DEGs(CYCD3)在T3时期上调表达,在草乌叶绿体发育过程中起调控作用。
番茄(Solanum lycopersicum L.)中AtBZR1-1D与SlGLK2协同上调促进叶绿素合成与叶绿体发育[35],与本研究的结果一致。CRF2作为细胞分裂素反应因子家族的成员,属于AP2/ERF类转录因子。CRF2过表达导致了PDV2蛋白水平的升高和叶绿体分裂的增加。作为参与叶绿体发育和分裂的重要调控因子CGA1和CRF2被发现在调控细胞分裂素信号上起着极其重要的作用[15]。本研究在CK调控叶绿体发育途径中发现3个DGEs影响其发育,1个DEGs(AHK2/3/4)和1个DEGs(GLK1/2)在T4时期显著上调,1个DEGs(B-ARR)在T4时期显著下调。GA能抑制CGA1和GNC这两个叶绿体发育促进因子的表达,进而抑制CGA1和GUC下游相关叶绿体发育基因的表达[20]。光可以诱导POR基因表达,POR酶可以促进叶绿素合成[30],在GA调控叶绿体发育途径中发现10个DGEs调控其发育,4个DEGs(PIF4)、2个DEGs(POR)在T4时期显著上调,其余基因既有上调也有下调。原叶绿素酸酯氧化还原酶(POR)是编码光合体中的一个关键酶,参与叶绿素a的合成过程[36],本研究也证明POR对草乌叶绿体发育起到了一定的调控作用。Auxin调控叶绿体发育途径中发现26个DGEs调控其发育,10个DEGs(AUX/IAA)和2个DEGs(GLK1/2)在T4时期显著上调,9个DEGs(ARF)在T4时期显著下调,5个DEGs(ARF)在T4时期显著上调。综上所述,光与其他刺激如激素有交叉作用,共同调节植物发育,我们应把焦点聚集在将复杂的信号转导网络系统与功能基因组的信息整合起来,以此来正确认识植株水平上的光调控发育机理,有助于明晰环境因素如何调控植物的生长发育[37]。
4 结论
对草乌4个生长发育阶段的转录组数据分析,共筛选出79 251个基因,T3vsT4时期差异表达基因在GO富集分析中主要富集到参与对几丁质的反应、光合系统Ⅰ、脂肪酶活性等过程中。在KEGG富集分析中主要富集到植物-病原体相互作用、植物激素信号转导、光合生物中的碳固定。同时,草乌的4个不同时期在光和激素调节叶绿体发育的不同阶段其表达量不同,19个差异表达基因注释光信号调控叶绿体发育通路上。44个差异表达基因注释植物激素信号转导通路上。本研究挖掘到一部分草乌幼苗形成期叶绿体发育相关基因,为进一步研究草乌生长发育相关分子机制提供理论基础。
参考文献
[1] 张跃华. 草乌头种子休眠及繁殖特性研究[D]. 呼和浩特:内蒙古农业大学,2016:1
[2] 彭劭.草乌中生物碱类化学成分的研究[D]. 长春:吉林大学,2014:1
[3] 山丹. 不同种源草乌生物学特性及入药部位生物碱含量的研究[D]. 呼和浩特:内蒙古农业大学,2020:1
[4] 王小菁. 植物生理学[M]. 第8版.北京:高等教育出版社,2019:236285
[5] 郑素玲. 谈植物的光形态建成[J]. 唐山师专学报,1999(5):75-76
[6] MOON J,ZHU L,SHEN H,et al. PIF1 directly and indirectly regulates chlorophyll biosynthesis to optimize the greening process in Arabidopsis[J]. Proceedings of the National Academy of Sciences,2008,105(27):9433-9438
[7] LU X D,ZHOU C M,XU P B,et al. Red-light-dependent interaction of phyB with SPA1 promotes COP1-SPA1 dissociation and photomorphogenic development in Arabidopsis[J]. Molecular Plant,2015,8(3):467-78
[8] SHEERIN D J,MENON C,ZUR OVEN-KROCKHAUS S,et al. Light-activated phytochrome A and B interact with members of the SPA family to promote photomorphogenesis in Arabidopsis by reorganizing the COP1/SPA complex[J]. Plant Cell,2015,27(1):189-201
[9] BAUER D,VICZIN A,KIRCHER S,et al. Constitutive photomorphogenesis 1 and multiple photoreceptors control degradation of phytochrome interacting factor 3,a transcription factor required for light signaling in Arabidopsis[J]. Plant Cell,2004,16:1433-1445
[10]ZHONG S,ZHAO M,SHI T,et al. EIN3/EIL1 cooperate with PIF1 to prevent photo-oxidation and to promote greening of Arabidopsis seedlings[J]. Proceedings of the National Academy of Sciences,USA,2009,106(50):21431-21436
[11]LEIVAR P,MONTE E,OKA Y,et al. Multiple phytochrome-interacting bHLH transcription factors repress premature seedling photomorphogenesis in darkness[J]. Current Biology, 2008,18(23):1815-1823
[12]SHI H,SHEN X,LIU R,et al. The Red Light Receptor Phytochrome B Directly Enhances Substrate-E3 Ligase Interactions to Attenuate Ethylene Responses[J]. Developmental Cell, 2016,39(5):597-610
[13]LIU X,LIU R,LI Y,et al. EIN3 and PIF3 Form an Interdependent Module That Represses Chloroplast Development in Buried Seedlings[J]. Plant Cell, 2017,29(12):3051-3067
[14]JIAO Y,LAU OS,DENG XW. Light-regulated transcriptional networks in higher plants[J]. Nature Reviews Geneticst,2007(8):217-230
[15]HUQ E,AL-SADY B,HUDSON M,et al. Phytochrome-interacting factor 1 is a critical bHLH regulator of chlorophyll biosynthesis[J]. Science,2004,305:1937-1941
[16]GOSLINGS D,MESKAUSKIENE R,KIM C,et al. Concurrent interactions of heme and FLU with Glu tRNA reductase (HEMA1),the target of metabolic feedback inhibition of tetrapyrrole biosynthesis,in dark and light-grown Arabidopsis plants[J]. Plant Journal,2004,40:957-96
[17]SHIRR J,KIM K,KANG H,et al. Phytochromes promote seedling light responses by inhibiting four negatively-acting phytochrome-interacting factors[J]. Proceedings of the National Academy of Sciences,USA,2009,106(18):7660-7665
[18]李保珠,赵孝亮,彭雷. 植物叶绿体发育及调控研究进展[J]. 植物学报,2014,49(3):337-345
[19]唐钰莹,刘阳轩,潘婷,等. 叶绿体蛋白CV调节质体逆向信号的研究[J]. 植物生理学报,2020,56(7):1553-1560
[20]陈炜. 调控水稻叶绿体发育基因YGL3的图位克隆及功能研究[D]. 南昌:江西农业大学,2022:5-6
[21]YOUMING Y,CHUNIAN X,BAOMIN W,et al. Effects of plant growth regulators on secondary wall thickening of cotton fibres[J]. Plant Growth Regulation,2004,35(3):233-237
[22]ROBERTS E H. Seed dormancy and oxidation processes[J]. Symposia of the Society for Experimental Biology,1969,23:161-192
[23]GRABHERR M G,HAAS B J,YASSOUR M,et al. Trinity:reconstructing a full-length transcriptome without a genome from RNA-Seq data[J]. Nature Biotechnology,2011,29(7):644
[24]洪森荣,刘佳凝,袁昕,等. 苏丹草和高丹草转录组测序及其差异基因表达分析[J]. 草地学报,2024,32(3):714-725
[25]BENIAMIN B, XIE C, HUSON D H. Fast and sensitive protein alignment using DIAMOND[J]. Nature Methods,2015,12:59-60
[26]金忠民,李春月,刘本松,等. 菌株JB12影响铅镉胁迫下菊苣黄酮合成的转录组分析[J]. 草地学报,2023,31(6):1648-1655
[27]王晋,王新宇,沈渊博,等. 番茄果实叶绿体发育调控及其应用的研究进展[J]. 园艺学报,2022,49(12):2669-2682
[28]卫云丰. 拟南芥PGA37转录因子调控叶绿体发育的分子机制[D]. 晋中:山西农业大学,2020:4
[29]SAKAMOTO W,MIYAGISHIMA S Y,JARVIS P. Chloroplast biogenesis:control of plastid development,protein import,division and inheritance [J]. Arabidopsis Book,2008,6:e0110
[30]吴钒漳. miR319-TCP4调控叶绿体发育的分子机制研究[D]. 昆明:昆明理工大学,2022:4
[31]SAKAI A,TAKANO H,KUROIWA T. Organelle nuclei in higher plants:structure,composition,function,and evolution [J]. International Review of Cytology,2004,238:59-118
[32]王娟,兰海燕. GATA转录因子对植物发育和胁迫响应调控的研究进展[J]. 植物生理学报,2016,52(12):1785-1794
[33]CHIANG Y H,ZUBO Y O,TAPKEN W,et al. Functional characterization of the GATA transcription factors GNC and CGA1 reveals their key role in chloroplast development,growth,and division in Arabidopsis[J]. Plant Physiol,2012,160(1):332-348
[34]詹为民. 利用转录组和代谢组解析玉米光信号与杂种优势的互作机制[D]. 郑州:河南农业大学,2023:5
[35]LIU L,JIA C,ZHANG M,et al. Ectopic expression of a BZR1-1D transcription factor in brassinosteroid signalling enhances carotenoid accumulation and fruit quality attributes in tomato[J]. Plant Biotechnology Journal,2014,12(1):105-115
[36]LIANG M,GU D,LIE Z,et al. Regulation of chlorophyll biosynthesis by light-dependent acetylation of NADPH:protochlorophyll oxidoreductase A in Arabidopsis[J]. Plant Science,2023,330:111641
[37]王小菁. 我国光形态建成研究回顾[J]. 植物学通报,2003(4):407-415
(责任编辑 彭露茜)

