青稞BBX基因家族鉴定及其对UV-B的响应








摘要:B-box(BBX)蛋白是植物中一类重要的转录因子,在控制植物生长发育、响应环境胁迫中起着重要作用。本研究从青稞(Hordeum vulgare L. var. nudum Hook.f.)全基因组中鉴定出18个青稞BBX基因家族成员,分析了它们的理化性质、基因结构、进化关系及UV-B照射幼苗后的表达特性等。结果表明:青稞BBX基因的编码序列(CDS)长度为636~2 223 bp;分子质量为22.07~54.29 kDa。系统发育分析将18个HvnBBX分为4个亚类。共线性分析表明青稞种内共产生4对片段复制形成的基因对,种间与玉米进化关系更近;HvnBBX启动子区域包含与逆境胁迫、激素、生长发育等相关顺式作用元件。转录组测序结果显示UV-B照射后青稞叶片中有5个BBX基因(HvnBBX2/4/5/6/17)的表达量显著下调,qRT-PCR验证结果与转录组测序一致。上述结果为深入研究HvnBBX基因的抗紫外功能提供参考。
关键词:青稞;BBX基因家族;UV-B照射;基因表达
中图分类号:Q344+.13""" 文献标识码:A """"文章编号:1007-0435(2024)06-1760-10
Genome-Wide Identification of BBX Family Genes and It’s
Response to UV-B in Hulless Barley
CHEN Sheng-rong1, SHI Guo-min2, WANG Le1, HE Tao1*
(1.State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University, Xining, Qinghai Province 810016, China;
2.College of Agriculture and Animal Husbandry, Qinghai University, Xining, Qinghai Province 810016 China)
Abstract:B-boxes (BBX) are a class of transcription factors in plants that play a crucial role in controlling plant growth,and responding to environmental stresses. In this study,18 members of the Hulless barley BBX gene family were identified from the whole barley genome. The physical and chemical properties,gene structure,evolution,and expression after UV-B irradiation of the 18 HvnBBX genes were analyzed. The results showed that the coding sequence (CDS) length of the BBX gene ranges from 636 to 2 223 bp,with a molecular mass of 22.07 to 54.29 kDa. The 18 HvnBBX genes were classified into 4 subcategories through phylogenetic analysis. Homology analysis revealed 4 gene pairs formed by segment duplication within the barley species,and interspecies analysis showed a closer relationship to maize in evolution. The HvnBBX promoter region contains cis-acting elements related to stress,hormones,and growth. RNA-Seq analysis revealed a significant decrease in the expression levels of 5 BBX genes (HvnBBX2/4/5/6/17) in barley leaves after UV-B irradiation. This variation in expression level was further confirmed by qRT-PCR. These findings provide a reference for further study of the anti-UV function of the BBX gene.
Key words:Hulless barley;BBX gene family;UV-B radiation;Gene expression
青稞(Hordeum vulgare L. var. nudum Hook.f.)是一种大麦品种,在基因上与大麦(Hordeum_vulgare)高度相似[1-2],主要生长在海拔3 000 m以上具有强紫外线(夏季UV-B辐射高约65 kJ·m-2)照射的高寒地带[3-5]。青稞是青藏高原重要的粮食作物,广泛应用于酿酒、饲料和食品加工[6]。逆境是影响作物生长的主要制约因素之一[7],尤其是在青藏高原,青稞更容易受到UV-B照射胁迫。植物已经发展出多种策略来改善UV-B照射造成的有害影响[8],如产生抗坏血酸盐和类黄酮等额外的抗氧化保护剂[9-10]。然而,目前对青稞在高原逆境UV-B胁迫下的耐受机制尚不清楚。
BBX (B-box结构域蛋白)是一组锌指蛋白转录因子,结构域包含一个或两个长度为40~47个氨基酸残基组成的B-box基序[11]。根据序列和7~Zn结合残基的间距,B-box基序可分为B-box1和B-box2两种类型。植物B-box结构域可以单独存在,也可以与CCT结构域一起存在。根据包含BBX结构域的数量及是否含有CCT结构域,将BBX基因家族分为5个亚族[12-13]。部分B-box结构域不仅直接介导转录调控,还与其他转录因子相互作用,调节蛋白质活性,包括结合能力、转录活性、E3泛素连接酶活性等,形成精细的调控网络,精确调控植物生长发育过程的许多方面。如BBX在植物的光形态建成、光周期控制开花[14]、避荫、非生物胁迫、植物激素介导的生长发育、昼夜节律、衰老和花青素生物合成中发挥关键作用[15]。
目前,人们已在拟南芥(Arabidopsis thaliana (Linn.) Heynh.)[10]、苹果(Malus pumila Mill.)[16]、玉米(Zea mays L.)[17]、小麦(Triticum aestivum L.)[18]、葡萄(Vitis vinifera Linn.)[19]、马铃薯(Solanum tuberosum L.)[20]、甘薯(Dioscorea esculenta (Lour.) Burkill)[21]、矮牵牛(Petunia hybrida (J. D. Hooker) Vilmorin)[22]、大豆(Glycine max (L.) Merr.)[23]等多种植物中对 BBX基因家族进行了系统性鉴定与分析。BBX基因家族在不同物种中的数量存在显著差异,且发挥多种生物学功能,如响应UV-B照射[24]、低温[16]、高温[25]、干旱[26]和盐[27]等逆境胁迫,参与类黄酮生物合成等[28]。青稞是青藏高原重要的农作物。目前尚无对青稞BBX基因家族进行鉴定的研究报道。为此,本研究鉴定了青稞BBX基因家族成员,分析了各成员的蛋白质特性,染色体分布、保守基序及进化关系。采用转录组测序方法探究了UV-B照射处理后青稞叶片中18个HvnBBXs基因的表达特性,并进一步利用QRT-PCR验证了其中5个有表达差异的HvnBBXs基因的表达量。以明确青稞BBX基因的表达特性及其在UV-B照射下的响应模式,为深入研究HvnBBX基因家族的抗紫外功能提供参考。
1 材料与方法
1.1 试验材料及UV-B照射方法
本试验采用的青稞品种为‘藏青2000’。选择颗粒饱满的青稞种子,置于装有滤纸的培养皿中发芽48 h,然后移栽到基质土中。放到培养箱培养,设置条件白天温度为25 ℃,湿度为60%,光照时间为12 h,夜间温度为20 ℃,湿度为60%。在基质土中培养14天,对大小长势一致的青稞三叶期幼苗采用40 W主谱线为253.7 nm的UV-B灯管(UV-B313EL,上海)按照师生波[29]的方法模拟UV-B照射处理,取UV-B照射了4 h的青稞叶片用于转录组测序和qRT-PCR测试,未照射的叶片为对照组。
1.2 试验方法
1.2.1 HvnBBX基因家族成员鉴定与理化性质分析 从拟南芥基因组数据库TAIR(https://www.arabidopsis.org/)获取拟南芥基因组数据及AtBBX基因家族蛋白序列。从ensembl数据库中下载大麦基因组和gff注释文件(https://plants.ensembl.org/Hordeum_vulgare/Info/Index?db=core)。利用TBtools-II (v2.031)软件[30]通过两种方法鉴定青稞BBX基因家族成员。Blast功能鉴定:以拟南芥的BBX蛋白序列为基础,对青稞全基因组蛋白序列进行搜索,删除E-value大于0.000 05的基因,得到候选HvnBBX基因。HMM Search功能鉴定:在Pfam(https://www.ebi.ac.uk/interpro/search/text/Pf006 43/page=1#table)数据库获取BBX基因家族HMM模型(Pfam00643)文件,根据结构域进行筛选,得到候选的HvnBBX基因。最后利用TBtools提取两种方法鉴定出的HvnBBX基因的交集,提取HvnBBX序列,筛选删除蛋白序列重复的基因,最终得到HvnBBX基因成员。将得到的HvnBBX基因成员序列分别提交至ExPASY(http://web.expasy.org/protparam/)在线分析网站,预测其分子量、氨基酸数目和等电点。利用WoLFPSORT (https://wolfpsort.hgc.jp/)在线网站进行亚细胞定位分析。
1.2.2 青稞BBX基因结构和保守结构域分析 基于Domain分析HvnBBX基因成员结构的保守性。利用Batch CD-Search进行预测,在NCBI网站(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)下载hitdate文件,使用TBtools软件中的Visualize NCBI CDD Domain Pattern将蛋白保守序列的结果做成可视化图。基于Motif分析成员序列保守特征,将HvnBBX蛋白序列提交到MEME(https://meme-suite.org/meme/tools/meme)网站鉴定HvnBBX蛋白的保守基序,参数设置为基序数量10个,其他为默认参数,下载MAST XML文件。使用TBtools软件将蛋白保守序列的结果做成可视化图。利用MEGA软件构建系统发育树。
1.2.3 多物种BBX蛋白系统发育树的构建 下载玉米BBX基因家族的蛋白的氨基酸序列,以玉米、拟南芥和青稞为研究对象,利用MEGA11和TBtools软件对3种物种的49个BBX氨基酸序列进行比对构建系统发育树。
1.2.4 青稞BBX基因的染色体位置 利用TBtools的Gen Location Visualize from GTF/GFF功能对HvnBBX基因进行染色体定位。
1.2.5 青稞BBX基因家族的共线性分析 分别下载青稞、拟南芥、玉米、豇豆(Vigna unguiculata)、马铃薯基因组及其基因组注释文件,利用TBtools软件一步法完成共线性分析。设置E-value值为1e-10,分析得到共线性文件colinearity和分析后的新注释文件gff,并对结果进行可视化,画出circos图。利用TBtools提取染色体长度和数量以及colinearity文件中的基因对。将分析的基因对与其在染色体上的位置进行匹配,生成基因对共线性可视化文件。
1.2.6 青稞BBX基因启动子序列分析 首先利用TBtools提取青稞所有基因的启动子区域,获得青稞所有基因5′端上游2 000 bp的序列作为候选启动子序列。其次输入目标基因ID,提取目标基因的启动子序列,提交到Plantcare (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站进行顺式作用元件预测,整理和简化PlantCare分析结果。最后利用TBtools对顺式作用元件进行可视化。
1.2.7 UV-B照射下青稞BBX基因表达分析 收集UV-B照射后的青稞叶片液氮冻存,由广州基迪奥公司利用Illumina HiseqTM 4000平台进行转录组测序,每个处理分别设置3个生物学重复。测序结果经过筛选,数据库比对注释基因,然后利用FDR值与差异倍数log2FC筛选差异基因,设置值为FDRlt;0.05,|log2FC|≥1。根据鉴定得到的HvnBBX基因序列在转录组测序结果中查找每一个HvnBBX基因成员,得到青稞叶片中BBX基因的转录表达谱(TPM值)。利用TBtools绘制HvnBBX基因的表达热图。根据转录组测序分析结果,通过qRT-PCR对5个BBXs(BBX4,BBX9,BBX13,BBX14,BBX15)成员的表达特性进行验证。使用天根多糖多酚植物总RNA提取试剂盒(中国,DP441)提取RNA。使用宝生物快速反转录试剂(中国,RR092)试剂盒进行cDNA合成。使用TB GreenTM Premix Ex TaqTM II定量PCR试剂盒(中国,RR820X)进行qRT-PCR。利用Primer Premier6软件和在线设计网址(www.oligoarchitect.com)设计qRT-PCR引物,引物序列如表1所示。以青稞Actin作为内参基因。相对定量计算使用2-ΔΔct法,设置3个生物学重复。
2 结果与分析
2.1 青稞BBX基因家族成员鉴定
利用B-box结构域HMM profile (PF00643)文件搜索和以拟南芥BBX蛋白序列进行Blast两种方法在青稞基因组中共鉴定得到18个HvnBBX基因。根据它们在青稞染色体上的分布,依次命名为HvnBBX1~HvnBBX18,如表2所示。HvnBBX基因的编码序列(CDS)长度为636~2 223 bp;蛋白的分子质量为22.07~54.29 kDa;除了HvnBBX14之外其他成员的等电点都小于7,说明HvnBBX蛋白富含酸性氨基酸,属酸性蛋白。亚细胞定位预测结果显示,HvnBBX有3个(HvnBBX2,HvnBBX5,HvnBBX14)定位在叶绿体中,其他成员都定位在细胞核中。
2.2 青稞BBX基因家族结构和保守基序分析
青稞BBX蛋白的进化树和保守基序分布如图1(a),(b)所示。经过MEME软件检索后共得到10个保守基序(Motif)。进化树中距离较近的蛋白具有相似的保守基序结构,同一类成员之间所含Motif种类类似,例如,HvnBBX3与HvnBBX12、HvnBBX4与HvnBBX15、HvnBBX14与HvnBBX16等进化树距离较近,含有相同的保守基序。同时,青稞的18个BBX蛋白都含有Motif1,13个HvnBBX蛋白都含有Motif9,占全部蛋白数量的72%。根据拟南芥BBX基因的结构[16]和多序列比对判断Motif1可能为B-Box结构域,Motif2为CCT结构域。同时,分析了青稞BBX基因保守结构域如图1(c),9个HvnBBX包含2个B-box结构域,8个包含1个B-box结构域和1个CCT结构域,只有HvnBBX13只包含1个B-box结构域。如图1(d)所示,HvnBBX基因所包含的外显子数量在2~5之间,其中含有3个外显子的基因占大多数。除HvnBBX1,HvnBBX8基因外,其他基因都至少含有一个UTR区,且UTR区域长度大小不一。
2.3 青稞BBX基因家族的系统发育分析
利用构建的系统发育树,分析青稞、拟南芥和玉米之间BBX蛋白的进化关系。根据系统发育树的拓扑结构和之前拟南芥中BBX基因家族的报道[16],3个物种的BBX蛋白家族成员可分为五个亚家族(分别为A,B,C,D,E),如图2所示。其中五个亚组中四个都包含有来自拟南芥、玉米和青稞BBX蛋白。结果表明,第一个亚家族(A)中包含7个 AtBBX、11个 ZmBBX和4个HvnBBX。第二个亚家族(B)只有一个HvnBBX17,有9个AtBBX和3个ZmBBX。第三个亚家族(C)中包含9个HvnBBX、8个AtBBX和13个ZmBBX,包含的青稞BBX蛋白数量最多。第四个亚家族(D)中包含有4个HvnBBX、6个AtBBX和5个ZmBBX,而第五个亚家族(E)中只包含2个AtBBX和1个ZmBBX,不包含青稞HvnBBX。
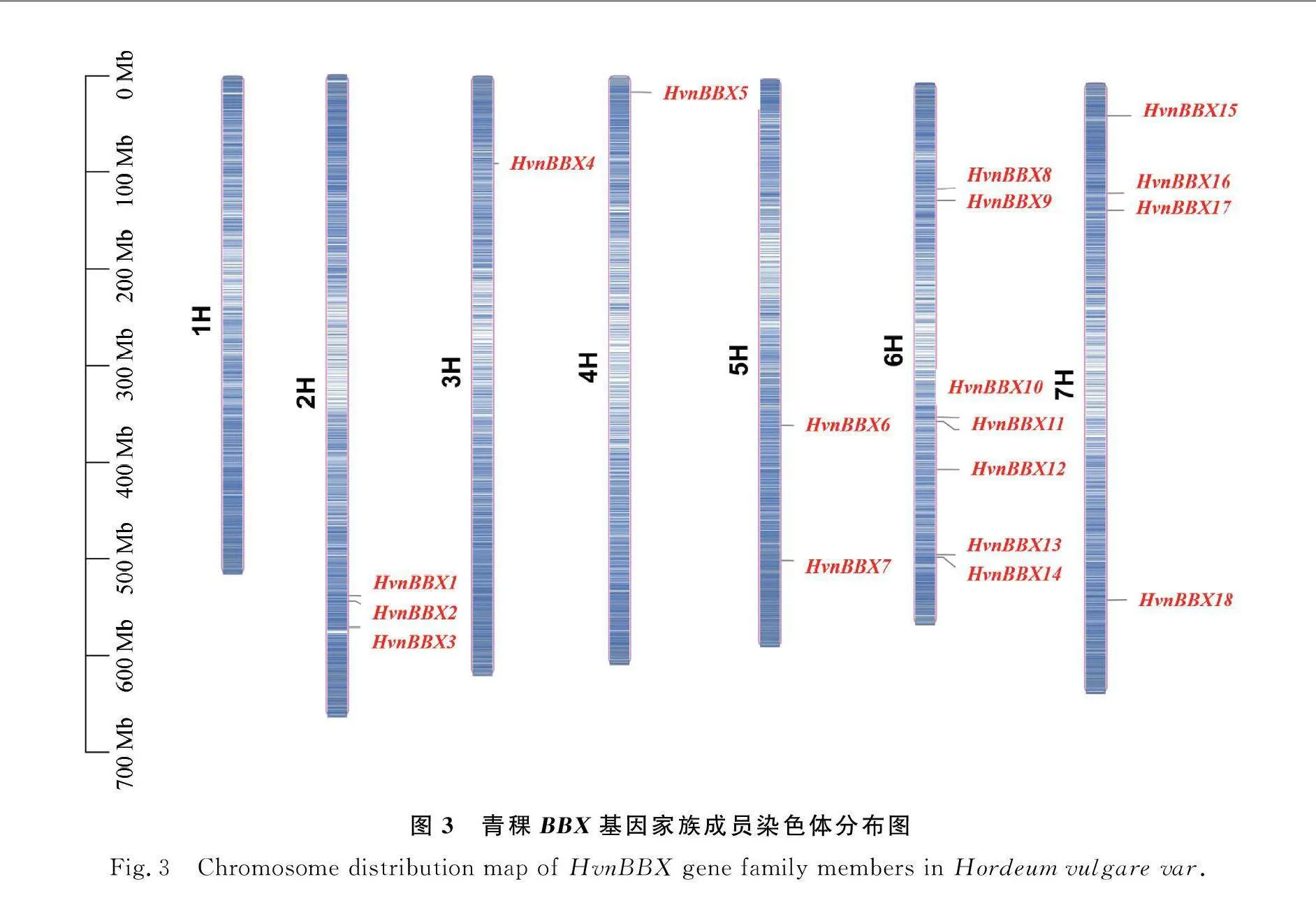
2.4 青稞中BBX基因染色体定位分析
HvnBBX基因在染色体上的分布如图3所示,HvnBBX基因在染色体上的分布不均,除1H染色体外,其余6条染色体上均有HvnBBX分布,其中3H和4H只分布一个基因,分布最多的是6H,有7个成员。
2.5 青稞BBX基因家族的同源分析
对青稞种间和种内BBX基因家族成员进行了共线性分析,结果如图4所示。18个HvnBBX基因种内共产生4对片段复制形成的基因对,分别是HvnBBX14/HvnBBX17,HvnBBX3/HvnBBX12,HvnBBX2/HvnBBX11和HvnBBX9/HvnBBX18。同时,分析了拟南芥、马铃薯、豇豆和玉米的共线性关系。结果显示HvnBBX基因与拟南芥有1对直系同源基因对,与马铃薯有1对,与豇豆有2对,与玉米有32对(图5)。说明青稞与玉米的BBX基因家族具有更近的同源性进化关系。
2.6 青稞BBX基因启动子区顺式作用元件分析
为了进一步了解HvnBBX基因在胁迫反应中转录水平上的调控作用,利用PlantCARE数据库分析了青稞18个HvnBBX基因上游2 000 bp序列中的顺式作用元件(图6)。结果显示,HvnBBX基因启动子区顺式作用元件种类丰富,包含脱落酸响应元件(Abscisic acid responsiveness,ABRE)、生长素响应元件(Auxin responsive element,TGA-element)、赤霉素响应元件(GARE-motif和P-box)、茉莉酸甲酯(MeJA)响应元件(TGACG-motif和CGTCA-motif)和水杨酸响应元件(TCA元件),防御和应激响应元件(TC-rich repeats)、创伤响应元件、干旱(DRE)和低温响应元件(LTR),参与细胞周期、玉米醇溶蛋白代谢、昼夜节律、厌氧诱导、分生组织表达、种子特异性调控、胚乳发育、干旱和低温等。另外还包含参与类黄酮生物合成响应元件。通过上述结果推测HvnBBX基因可能在青稞响应逆境胁迫、生物合成等方面具有多种生物学功能。
2.7 青稞BBX基因UV-B照射下的表达模式
利用鉴定得到的HvnBBX基因序列,在基迪奥公司的在线平台OmicShare上Blast检索HvnBBX基因。得到18个HvnBBX基因的表达量TPM值,绘制热图,如图7(a)所示。其中有5个基因HvnBBX2,HvnBBX4,HvnBBX5,HvnBBX6和HvnBBX17在UV-B照射后表达量下调,说明UV-B照射在一定程度上抑制了这5个HvnBBX基因的表达,推测这些成员可能介导青稞叶片对UV-B照射的响应。为了进一步鉴定响应UV-B照射的HvnBBX基因,利用qRT-PCR验证了青稞中HvnBBX2,HvnBBX4,HvnBBX5,HvnBBX6和HvnBBX17基因的表达特性。qRT-PCR验证的结果与转录组测序结果一致,它们的表达量显著下调(P<0.05),如图7(b)所示。因此,HvnBBX2,HvnBBX4,HvnBBX5,HvnBBX6和HvnBBX17可能是响应UV-B照射的潜在基因,其具体功能有待进一步研究。
3 讨论与结论
青稞作为高海拔地区重要的粮食作物,探究其抵御UV-B照射的分子机制具有重要意义。而BBX是植物中一类重要的转录因子,在植物生长发育中发挥重要的调控作用。本研究从青稞基因组中共鉴定到18个HvnBBX基因。在不同植物中BBX基因家族成员数目各不相同,如拟南芥有35个[12]、玉米有34个[17]、马铃薯有30个[20]、葡萄有25个[19]、白桦(Betula platyphylla Suk.)有19个[31];青稞BBX基因的编码序列(CDS)长度为636~2 223 bp;蛋白的分子质量为22.07~54.29 kDa;大部分成员等电点小于7,属于酸性蛋白。HvnBBX蛋白的编码序列长度和分子量变化范围较大,这些分子特性与以上列举的物种不一致,说明该基因家族成员在物种间存在多样性[32]。基序分析表明,所有BBX蛋白均具有1~2个B-box结构域,部分成员具有CCT保守结构域。不同组间的HvnBBX基序具有明显的差异,而在同组成员之间具有相似的保守基序,这表明了BBX基因家族成员之间进化的保守性。类似的结果也普遍存在于其它植物中,如甘薯[21]、草莓(Strawberry)[33]、矮牵牛[34]等。青稞BBX基因中的外显子数量为2~4个,大多数为3个,表明BBX基因结构在青稞中高度保守。通过系统发育分析,青稞BBX蛋白的分类与它们的结构域比对并不完全一致,BBX基因家族成员属于一个结构群,可能在进化过程中失去了一个B-box结构域[32]。
通过RNA-seq分析和qRT-PCR验证,有5个HvnBBX成员(HvnBBX2,HvnBBX4,HvnBBX5,HvnBBX6和HvnBBX17)在UV-B照射后表达量显著下调,qRT-PCR结果显示HvnBBX5对UV-B照射的响应变化最明显。说明UV-B照射对这些基因的表达量产生了负向调节作用,推测它们可能在UV-B信号调控的生理过程中发挥重要作用。这些基因可能充当响应UV-B胁迫的调节因子,参与调控相关的生物学过程。研究表明拟南芥中AtBBX32与AtBBX21相互作用抑制HY5基因表达,从而抑制UV-B光应答基因表达,影响花青素合成[35]。同时,AtBBX24通过与HY5形成非活性的异源二聚体来抑制HY5表达,响应UV-B照射[36]。在番茄中也证实SlBBX20/21与SlHY5形成转录因子模块在UV-B信号传导中激活和负反馈调控相关基因的表达[24]。另外,通过COP1调控基因的转录组分析结果发现在UV-B条件下,COP1促进BBX5和BBX18的表达,抑制BBX7和BBX8的表达[37]。因此不同的BBXs在介导UV-B信号过程中可能存在交叉、冗余或差异,其具体的分子功能还需要后续生物学验证。同时,本研究在青稞叶片转录组测序数据中没有找到显著上调的HvnBBX基因,可能与选择的UV-B照射时间和强度等有关,例如玉米中的一些基因只有在一定的UV-B照射剂量阈值以上才会被诱导,这表明在不同的照射剂量下,不同的信号通路会起作用[38-40],该内容需要进一步做深入研究。
综上所述,通过对青稞基因组中的BBX进行系统鉴定和分析,本研究揭示了青稞的BBX在结构上表现出高度保守性。在UV-B照射条件下的表达水平发生了变化,其中HvnBBX5呈现最显著的下调趋势。这表明这些基因可能在植物对UV-B光的响应中发挥着重要作用,类似于其他植物中BBX基因家族成员参与UV-B信号传导途径的调节作用。此外,研究还发现了青稞BBX基因家族与拟南芥和玉米等物种的同源进化关系,为进一步探索其在逆境应答和生物合成等方面的生物学功能提供了基础。通过转录组测序分析和qRT-PCR验证,本研究深入了解了UV-B胁迫下HvnBBX基因的表达模式,为未来农作物育种和逆境应对机制的研究提供了有益的参考。
参考文献
[1] YAO X,WANG Y,YAO Y,et al. Identification microRNAs and target genes in Tibetan Hulless barley to BLS infection[J]. Agronomy Journal,2021,113(3):2273-2292
[2] YAO X,YAO Y,AN L,et al. Accumulation and regulation of anthocyanins in white and purple Tibetan Hulless Barley(Hordeum vulgare L. var. nudum Hook. f.)revealed by combined de novo transcriptomics and metabolomics[J]. BMC Plant Biology,2022,22(1):391
[3] ZENG X,GUO Y,XU Q,et al. Origin and evolution of qingke barley in Tibet[J]. Nature Communications,2018,9(1):5433
[4] 魏婵,姚晓华,姚有华,等. 青稞HvnRPS2基因克隆及其在条纹病胁迫下的表达分析[J]. 西北植物学报,2021,41(12):2021-2029
[5] 祁存英,李媛,杨成兰,等. 青稞HD-Zip基因家族鉴定及其在非生物胁迫下的表达特性[J]. 西北植物学报,2023,43(1):66-78
[6] ZENG X,YUAN H,DONG X,et al. Genome-wide Dissection of Co-selected UV-B Responsive Pathways in the UV-B Adaptation of Qingke[J].Molecular Plant,2020,13(1):112-127
[7] 杨成兰,祁存英,马银花,等. 青稞GPAT基因家族全基因鉴定及表达分析[J]. 植物生理学报,2022,58(10):2006-2016
[8] TAKSHAK S,AGRAWAL S B. Defense potential of secondary metabolites in medicinal plants under UV-B stress[J]. Journal of Photochemistry and Photobiology B:Biology,2019,193:51-88
[9] YIN R,ULM R. How plants cope with UV-B:from perception to response[J]. Current Opinion in Plant Biology,2017,37:42-48
[10]LYU G,LI D,LI S. Bioinformatics analysis of BBX family genes and its response to UV-B in Arabidopsis thaliana[J]. Plant Signal Behav,2020,15(9):1782647
[11]曲毅鹏,李国瑞,张春玲,等. 植物BBX转录因子的研究进展[J]. 分子植物育种,2020,36(4):666-677
[12]TALAR U,KIEBOWICZ-MATUK A. Beyond Arabidopsis:BBX Regulators in Crop Plants[J]. International Journal of Molecular Sciences,2021,22(6):2906
[13]杨宁,从青,程龙军. 植物BBX转录因子基因家族的研究进展[J]. 生物工程学报,2020,36(4):666-677
[14]OUYANG Y,PAN X,WEI Y,et al. Genome-wide identification and characterization of the BBX gene family in pineapple reveals that candidate genes are involved in floral induction and flowering[J]. Genomics,2022,114(4):110397
[15]CAO J,YUAN J,ZHANG Y,et al. Multi-layered roles of BBX proteins in plant growth and development[J]. Stress Biology,2023,3(1):1
[16]房鸿成. B-box转录因子介导UV-B和温度调控苹果果实着色的机理[D].泰安:山东农业大学,2019:40
[17]赵长江,徐尚缘,都梦翔,等. 玉米BBX基因家族鉴定及表达分析[J]. 西北农业学报,2022,31(6):677-689
[18]王艳朋. 小麦B-box和Hsp70基因家族的全基因组分析[D].哈尔滨:哈尔滨师范大学,2021:12-24
[19]葛孟清,刘众杰,朱旭东,等. 葡萄BBX基因家族的鉴定与表达分析[J]. 核农学报,2021,35(1):18-30
[20]马文婧,刘震,李志涛,等. 马铃薯BBX基因家族的全基因组鉴定及表达分析[J]. 作物学报,2022,48(11):2797-2812
[21]毕楚韵,黄小芳,黄伟群,等. 甘薯基因组BBX转录因子基因鉴定与逆境胁迫表达分析[J]. 四川农业大学学报,2021,39(2):157-165
[22]符真珠,蒋卉,王锐,等. 矮牵牛BBX基因家族成员鉴定及对不同光质的表达响应[J]. 植物生理学报,2021,57(1):50-58
[23]殷丽丽,邢宝龙,陈晓亮,等. 大豆BBX基因家族的鉴定及表达[J]. 西北农林科技大学学报(自然科学版),2022,50(6):35-45
[24]YANG G,ZHANG C,DONG H,et al. Activation and negative feedback regulation of SlHY5 transcription by the SlBBX20/21-SlHY5 transcription factor module in UV-B signaling[J]. The Plant Cell,2022,34(5):2038-2055
[25]韩笑盈. 菊花高温下花色褪色差异表达基因分析及CmHY5的功能研究[D]. 南京:南京农业大学,2020:43
[26]叶洋. PtBBX8和PtBBX38在开花调控和干旱胁迫响应中的功能研究[D]. 咸阳:西北农林科技大学,2022:37-40
[27]齐小坤,孟祥熹,赵志明,等. 毛果杨BBX基因家族鉴定与生物信息学分析[J]. 河北农业大学学报,2023,46(5):41-49
[28]LI C,PEI J,YAN X,et al. A poplar B-box protein PtrBBX23 modulates the accumulation of anthocyanins and proanthocyanidins in response to high light[J]. Plant,Cell and Environment,2021,44(9):3015-303
[29]师生波,韩发. 紫外光源及太阳UV-B辐射的模拟实验[J]. 生物技术通报,2006(z1):161-166
[30]CHEN C,WU Y,LI J,et al. TBtools-II:A “one for all,all for one” bioinformatics platform for biological big-data mining[J]. Molecular Plant,2023,16(11):1733-1742
[31]贾珊珊,文雪静,王玉成,等. 白桦BBX转录因子家族鉴定、表达分析及BpBBX24抗逆功能初探[J]. 植物生理学报,2023,59(1):138-152
[32]YU L,LYU Z,LIU H,et al. Insights into the evolutionary origin and expansion of the BBX gene family[J]. Plant Biotechnology Reports,2022,16(2):205-214
[33]叶云天. 草莓BBX家族鉴定及FaBBX28cl调控草莓开花时间的分子机制研究[D]. 成都:四川农业大学,2022:41-45
[34]WEN S,ZHANG Y,DENG Y,et al. Genomic identification and expression analysis of the BBX transcription factor gene family in Petunia hybrida[J]. Molecular Biology Reports,2020,47(8):6027-6041
[35]HOLTAN H E,BANDONG S,MARION C M,et al. BBX32,an Arabidopsis B-Box Protein,Functions in Light Signaling by Suppressing HY5-Regulated Gene Expression and Interacting with STH2/BBX21[J]. Plant Physiology,2011,156(4):2109-2123
[36]JIANG L,WANG Y,LI Q F,et al. Arabidopsis STO/BBX24 negatively regulates UV-B signaling by interacting with COP1 and repressing HY5 transcriptional activity[J]. Cell Research,2012,22(6):1046-1057
[37]ORAVECZ A,BAUMANN A,MATE Z,et al. CONSTITUTIVELY PHOTOMORPHOGENIC1 Is Required for the UV-B Response inArabidopsis[J]. The Plant Cell,2006,18(8):1975-1990
[38]CASATI P,WALBOT V. Rapid transcriptome responses of maize (Zea mays) to UV-B in irradiated and shielded tissues[J]. Genome Biology,2004,5(3):R16
[39]唐芳,梅亭,高佳荷,等. 紫花苜蓿GPAT基因家族鉴定及在盐碱胁迫下的表达模式分析[J]. 草地学报,2023,31(9):2608-2620
[40]李根,牛奎举. 小黑麦SWEET家族基因鉴定及其在不同逆境下表达模式分析[J]. 草地学报,2023,31(11):3310-3321
(责任编辑 刘婷婷)

