高羊茅赤霉素受体家族成员鉴定及其在不同逆境下的表达模式分析






摘要:赤霉素受体(Gibberellin insensitive dwarf1)可感知赤霉素信号,参与调控植物的生长发育及逆境胁迫。高羊茅(Festuca arundinacea)是低养护成本的冷季型草坪草,面临多种逆境胁迫,但其赤霉素受体在逆境和发育中的作用尚未明确。本研究从高羊茅的转录组中鉴定到12个赤霉素受体基因序列,它们含有高度保守的结构域,可划分为两个进化枝,Ⅰ类为GID1L2,Ⅱ类为GID1。采用实时荧光定量PCR技术分析短期低温胁迫(0℃)、高温胁迫(38℃)、盐胁迫(120 mmol·L-1 NaCl)及干旱(15%聚乙二醇6000)逆境下高羊茅分蘖节和叶片中赤霉素受体基因的表达模式。结果表明,高羊茅赤霉素受体基因对各类逆境胁迫均有响应,GID1L2s在分蘖节和叶片中表达模式不同,GID1s则相似。除冷胁迫下叶片中FaGID1d表达模式独特,其余GID1s在不同逆境胁迫下表达模式一致。研究结果为进一步开展赤霉素受体基因参与逆境胁迫的功能解析提供了理论依据。
关键词:赤霉素受体;生物信息学;逆境胁迫;表达模式
中图分类号:S602.4""" 文献标识码:A"""" 文章编号:1007-0435(2024)06-1719-10
Characterization and Analysis of Gibberellin Insensitive Dwarf1 Gene
Family and Response to Abiotic Stresses in Tall Fescue
QIAN Wan-qing, AN Cong, ZHUANG Li-li*
(1. College of agro-grassland and science, Nanjing Agricultural University, Nanjing, Jiangsu province 210095, China)
Abstract:Gibberellin receptor (Gibberellin insensitive dwarf1) can sense the signal of gibberellin and participate in the regulation of plant growth and development,as well as in plant abiotic stress resistance. Tall fescue (Festuca arundinacea) is a low-maintenance cool-season turfgrass and is exposed to various stresses,but the role of its gibberellin receptor family in stress and development has not been reported yet. In this study,12 gibberellin receptor gene sequences were identified in the transcriptome of tall fescue,which contained highly conserved domains and could be divided into two clades,GID1L2 (gibberellin receptor 1 like 2) for class Ⅰ and GID1 for class Ⅱ. The expression patterns of these genes in crown and leaf of tall fescue under low temperature stress (0℃),high temperature stress (38℃),salt stress (120 mmol·L-1 NaCl) and short-term drought (15% PEG 6000) were determined by quantitative real-time polymerase chain reaction. The results showed that these genes were responsive to various abiotic stresses. The expression patterns of FaGID1L2 genes were different in crown and leaf,but FaGID1s’ were similar. Except the expression pattern of FaGID1d in leaf under cold stress was unique,the expression pattern of the rest FaGID1s under cold stresses was consistent. These results provided a theoretical basis for further functional analysis of gibberellin receptor genes involved in stresses.
Key words:GID1;Bioinformatic analysis;Abiotic stress;Expression pattern
植物具有固着生长的特性,在整个生长过程中无法避免遭受干旱、高温、冷害等非生物胁迫,这些胁迫直接或间接影响了植物的生产潜力及营养品质[1-2]。随着高温干旱等极端天气在全球范围内出现的频率增高,农业生产力将会受到更为深远的负面影响[3-4]。因此,了解植物如何适应并且抵抗逆境的机制至关重要。
赤霉素(Gibberellins,GAs)是一类普遍存在于植物体内的重要激素,在促进种子萌发、下胚轴的伸长、根的形态建成、花和果实的发育等方面都发挥不可或缺的作用[5-8]。近年来,随着基因组、蛋白组学等实验技术的发展,人们已经鉴定了多个参与GA信号的调控因子,如GA受体GID1蛋白、DELLA蛋白、F-box蛋白[9-11]。其中,GID1蛋白的发现是GA信号转导途径领域取得的突破性进展。在该转导途径中,GID1作为受体与活性赤霉素结合,与DELLA蛋白形成GA-GID1-DELLA蛋白复合体后被SCFSLY1泛素连接酶识别并泛素化,随后被26S蛋白酶降解,从而产生GA效应[12-15]。
GID1最早在水稻(Oryza sativa)GA信号传导中被鉴定出来,且在水稻中过表达OsGID1出现植株变高,分蘖减少的表型[10],随后拟南芥中(Arabidopsis thaliana)也找到了三个GID1:AtGID1a,AtGID1b,AtGID1c,其单突变体生长发育正常,但三突变体植株极度矮化,开花延迟,且花器官发育严重缺陷[16-17]。这些转基因植株的表型都表明了GID1家族对于植物生长发育的重要性。此外,GID1家族也参与了植物对于逆境的响应。例如低温处理拟南芥的gid1突变体,处理后gid1b突变体的根长远低于野生型[18];此外,对大白菜(Brassica rapa L)、茶树(Camellia sinensis)中的GID1s启动子片段进行顺式作用元件分析,发现含有响应干旱、冷和厌氧胁迫的相关元件[19-20]。相对于GID1,关于GID1L2的研究则较少,有研究报道GID1与GID1L2均从激素敏感脂肪酶(Hormone Sensitive Lipase,HSL)进化而来[21]。在水稻的sped1-D突变体中过表达GID1L2家族基因LOC_Os06g11130,能够不同程度地恢复水稻的正常穗型,证明了该家族成员参与了水稻的次生分枝的伸长[22];但关于GID1L2家族在逆境响应方面的研究,目前仍然研究较少。
高羊茅(Festuca arundinacea)是应用广泛的冷季型禾本科草,因其绿期长、根系发达、抗逆性强和耐粗放管理的特点[23],可作为优良的草坪草和生态修复用草,相较于其他冷季型草坪草而言,高羊茅更耐高温及干旱[24-25]。目前,高羊茅中赤霉素受体家族成员的研究尚未见报道。本研究基于高羊茅转录组序列,通过生物信息学方法对高羊茅中赤霉素受体家族成员的基因序列进行鉴定,并在基因序列、蛋白结构、系统进化等方面对其进行分析。通过实时荧光定量PCR技术检测其在冷害、高温、盐害及干旱四种不同逆境条件下的表达模式,为深入研究高羊茅赤霉素受体家族成员的生物学功能提供理论依据。
1 材料与方法
1.1 植物材料与生长条件
本研究采用高羊茅品种‘凌志’为试验材料。将‘凌志’种子放置在铺有三层润湿滤纸的培养皿中,加入适量水,置于4℃冰箱中春化3 d,随后将其置于光照培养箱中萌发培养。将萌发16 d的小苗转移到人工气候室进行水培培养。培养条件为白天、夜晚各12 h,白天温度25℃,夜晚温度20℃,空气湿度70%,光照强度为500 μmol·m-2·s-1。用剪好的海绵包裹小苗的分蘖节部位,置于水培板的小孔上,每板6孔,共18板。根系浸入霍格兰营养液,每周更换一次营养液。
1.2 植物处理
对霍格兰营养液中水培培养43 d的‘凌志’植株进行短期低温处理(0℃),高温处理(38℃),盐处理(120 mmol·L-1 NaCl)和干旱处理(15%聚乙二醇6000)。处理持续24 h,在0,6,12和24 h时进行取样,将分蘖节和叶片在液氮中速冻,随后保存在-80℃冰箱中。每种处理分别处理3个水培板,取样时均有三个生物学重复。
1.3 高羊茅赤霉素受体家族成员鉴定
利用课题组前期筛选到的FaGID1L2a蛋白[26],通过在线网站Phyzotome13(https://phytozome-next.jgi.doe.gov/blast-search)的‘blast’程序,以水稻作为搜索物种,E-90为期望值,得到相应的水稻序列;再以这些水稻序列作为请求序列,在配置好的高羊茅转录组数据库的BioEdit软件中采用‘tblastn’,以E-90为期望值,进行搜索,得到相应的12个高羊茅序列(相关信息已整理至表2)。AtGID1蛋白序列从TAIR网站(www.arabidopsis.org)获得。
1.4 系统进化树的构建及序列分析
采用MEGA 7.0软件,用邻接法构建系统进化树。采用Compute pI / Mw在线工具预测12个高羊茅蛋白的等电点和分子量,采用Plant-mPLoc在线工具预测亚细胞定位,采用MEME Suite 5.4.1预测保守结构域。
1.5 荧光定量PCR
采用植物RNA提取试剂盒提取样品总RNA。取1 μg RNA进行第一链cDNA的合成,所用试剂盒是MonScriptTM RTⅢ Super Mix with dsDNase(Two-step),反转录之前去除基因组DNA。所用定量PCR试剂为MonAmpTM ChemoHS qPCR Mix。定量PCR的条件设置为95℃预变性10 min,随后进行40个循环的PCR扩增(95℃变性15 s,60℃退火15 s,72℃延伸20 s)。每个循环都设定在65℃采集数据。内参基因为FaTubblin [27],每个生物学样品都进行两次技术重复,采用2-ΔΔCT法计算基因的相对表达水平。使用primer premier 5软件对12个高羊茅序列设计定量引物。定量引物见表1。
1.6 数据分析
采用SPSS19.0软件进行方差分析并用TBtools绘图,平均值采用最小显著差异法(LSD)进行多重比较,显著水平为Pgt;0.05。
2 结果与分析
2.1 高羊茅赤霉素受体家族成员基因序列的获得
由分析结果可知,12个高羊茅赤霉素受体蛋白序列长度在317(FaGID1L2h)~397(FaGID1L2a)个氨基酸之间,等电点最小为4.92(FaGID1L2h),最大为9.84(FaGID1L2b),分子质量从34 264.82 Da(FaGID1L2f)到42 632.46 Da(FaGID1L2a)(表2)。亚细胞定位预测结果表明,这12个赤霉素受体家族成员大部分只定位在细胞核中,部分蛋白定位在细胞核与叶绿体(FaGID1L2a,FaGID1L2b,FaGID1L2g,FaGID1L2c)。
为分析高羊茅、水稻及拟南芥中赤霉素受体家族成员蛋白的系统进化关系,对所得高羊茅的赤霉素受体家族蛋白序列与水稻及拟南芥中的同源蛋白共同构建系统进化树,具体序列可根据登录号在NCBI上查看。采用邻接法构建系统进化树(图1),植物赤霉素受体家族蛋白可以分为两个亚家族,Ⅰ类亚家族包括8个FaGID1L2蛋白(FaGID1L2a,FaGID1L2b,FaGID1L2c,FaGID1 L2d,FaGID1L2e,FaGID1L2f,FaGID1L2g,FaGID1L2h)和8个OsGID1L2蛋白(Os09g28 690,Os08g37040,Os09g28740,Os08g37010,Os08 g37030,Os06g11130,Os09g28750,Os09g28720);Ⅱ类亚家族包括4个FaGID1蛋白(FaGID1a,FaGID1b,FaGID1c,FaGID1d)、1个OsGID1蛋白(OsGID1)和3个AtGID1蛋白(AtGID1a,AtGID1b,AtGID1c)。
2.2 保守结构域分析及氨基酸比对
采用MEME软件预测高羊茅、水稻和拟南芥24个赤霉素受体蛋白的保守结构域,一共鉴定到6个保守的结构域(结构域宽度设置为6~100个氨基酸残基,E值小于1.8×10-45),详细信息见图2。结果表明,结构域1,2,3,6为高羊茅赤霉素受体蛋白家族12个成员所共有的保守结构域,且1,2,3排布顺序一致;结构域6分布在Ⅰ类成员的N端,而在II类成员的C端。结构域4和5在第Ⅱ亚类的4个成员(FaGID1a,FaGID1b,FaGID1c,FaGID1d)及OsGID1和AtGID1s中出现,为第Ⅱ亚类成员区别于第Ⅰ亚类成员的结构域。
已有研究表明GID1与GID1L2都由HSL进化而来,在一级结构上相似,HSL家族含有HGGG和GXSXG保守基序[28],氨基酸比对结果表明(图3),Ⅰ类和Ⅱ类的成员均含有GXSXG保守序列,但仅有部分蛋白如FaGID1L2d,FaGID1L2e,FaGID1L2g,FaGID1L2h及四个水稻蛋白(Os08g37010,Os08g37030,Os09g28750,Os09 g28720)保留了HGGG基序,剩余的Ⅰ类蛋白中则是HGGA,Ⅱ类蛋白中则变为HGGS。Ⅰ类蛋白保留了HSL家族的S-D-H催化三联体结构,在Ⅱ类蛋白中,结构中的最后一个H被V或者I取代。
2.4 不同胁迫下高羊茅赤霉素受体基因的表达
2.4.1
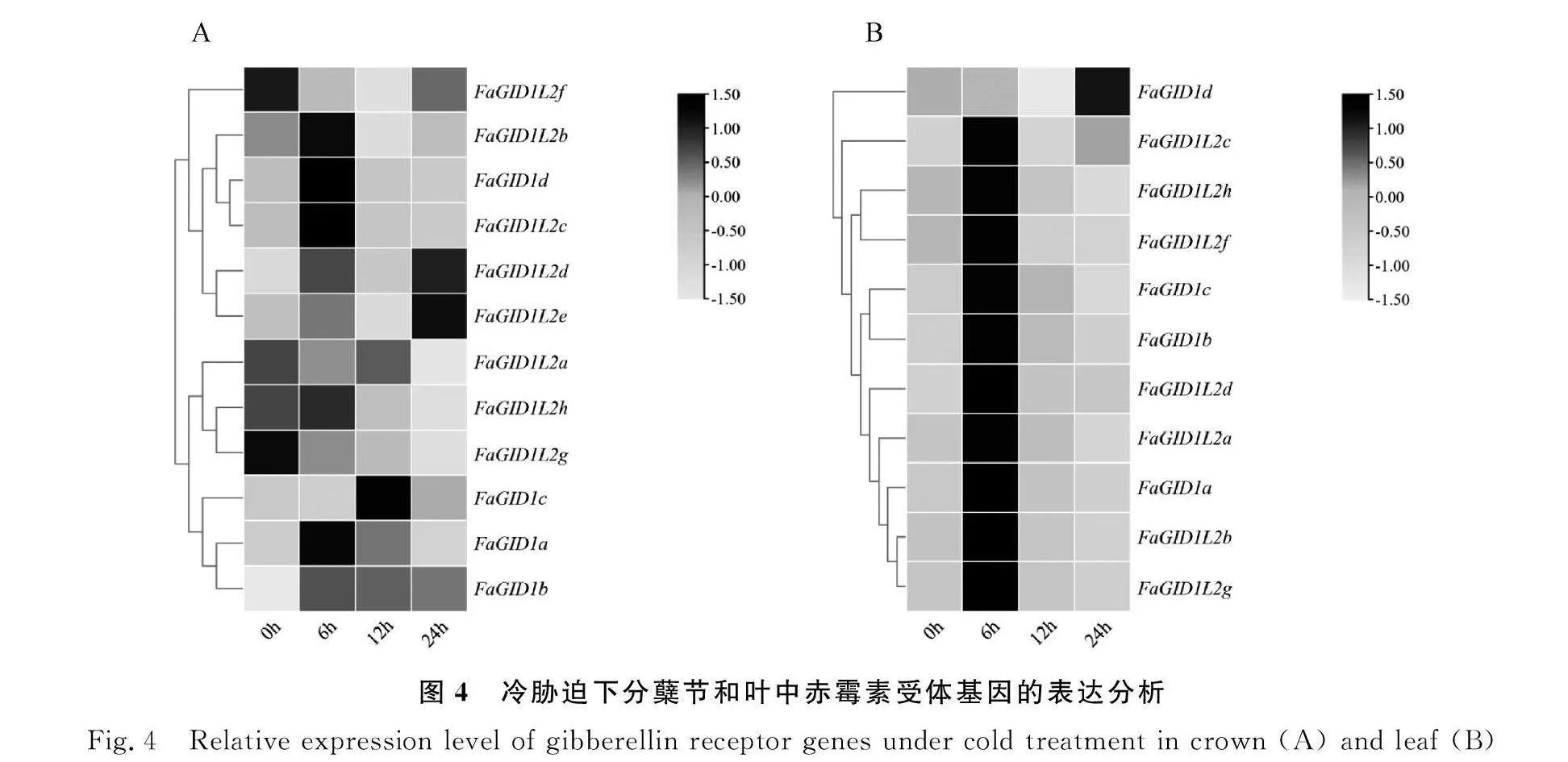
0℃冷胁迫下高羊茅赤霉素受体基因的表达分析 冷胁迫24 h内,12个高羊茅赤霉素受体基因在分蘖节中呈现多样的表达模式(图4A),在叶片中的表达模式则比较单一(图4B)。冷胁迫6 h时,FaGID1L2b,FaGID1d和FaGID1L2c的表达水平在分蘖节中显著增加且达到最高,随后逐渐降低;冷胁迫处理下,FaGID1L2a,FaGID1L2h和FaGID1L2g在分蘖节中的表达量整体呈下降趋势,在24 h时达到最低水平(图4A)。在叶片中,FaGID1d的表达量呈先下降后上升的趋势,在24 h时达到最高,其余基因则在胁迫6 h时的表达水平达到最高,随后逐渐下降(图4B)。
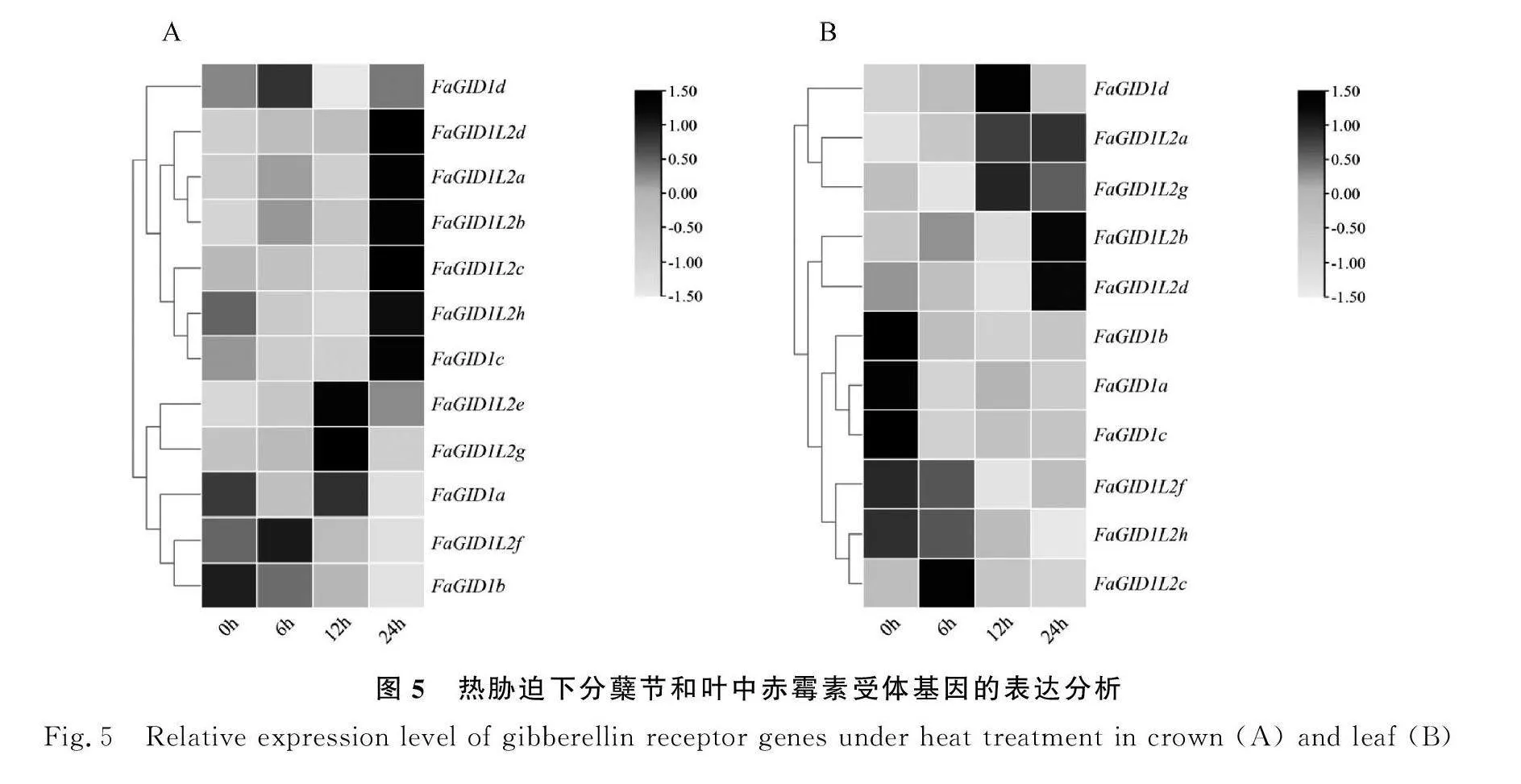
2.4.2 38℃热胁迫下高羊茅赤霉素受体基因的表达分析 在热胁迫下,12个高羊茅赤霉素受体基因在分蘖节中的表达模式总体分为三类,包括FaGID1L2a,FaGID1L2b,FaGID1L2c,FaGID1L2d,FaGID1L2h和FaGID1c在内的6个基因的表达量在热处理24 h后达到最高,且高于处理前的水平;FaGID1L2e和FaGID1L2g则呈现先上升后下降的趋势,FaGID1a,FaGID1L2f和FaGID1b的表达水平在24 h时达到最低,这5个基因的表达模式为第二类;另外,FaGID1d在12 h时达到最低,随后恢复到处理前水平(图5A)。在叶片中,FaGID1L2b、FaGID1L2d、FaGID1L2g的表达模式与FaGID1L2a类似,在24 h时处于最高或较高水平;FaGID1d则在热处理12 h时在叶片中表达量最高;其他相关基因在热胁迫后表达量呈下降趋势(图5B)。
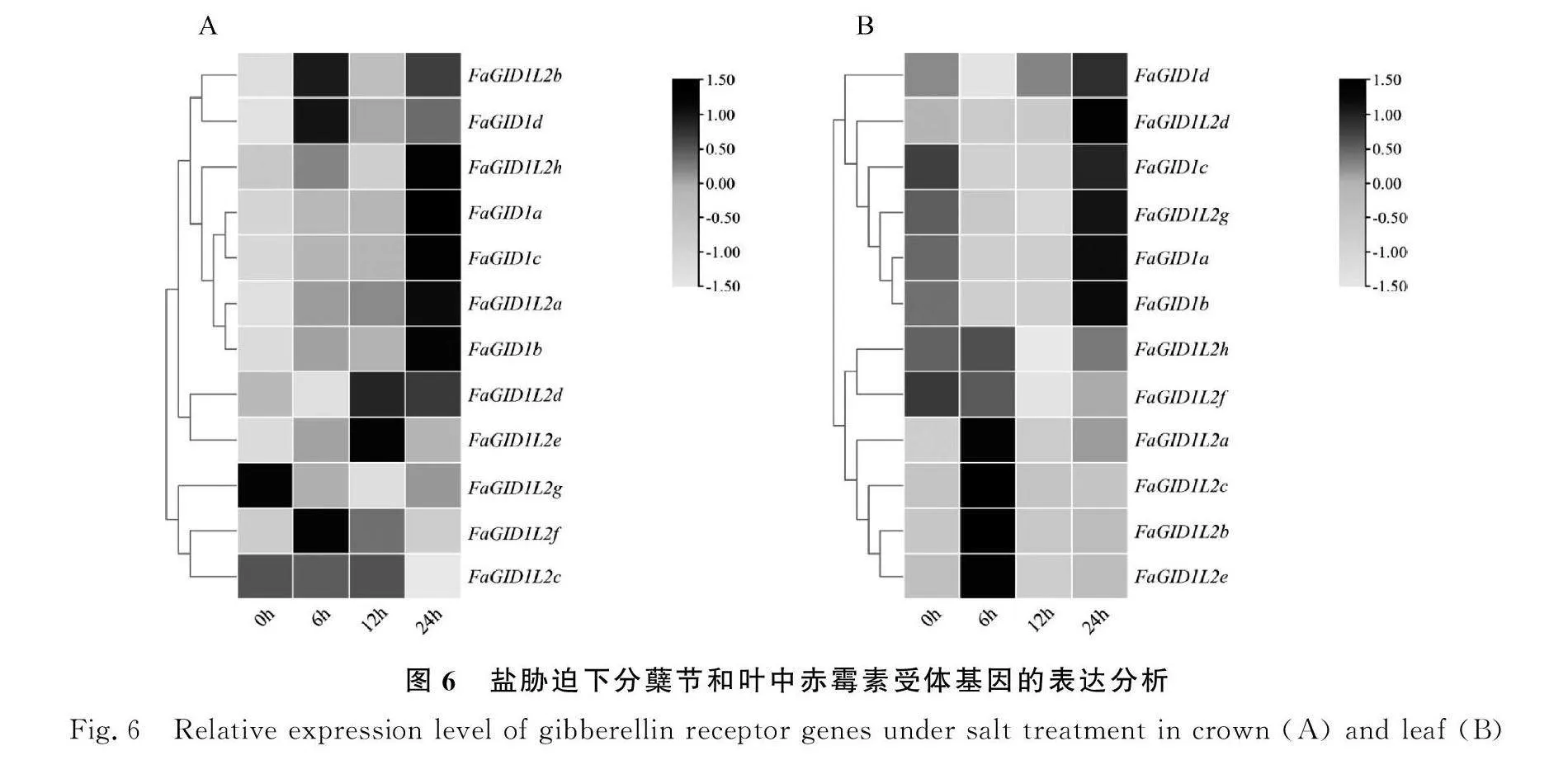
2.4.3 120 mM盐胁迫下高羊茅赤霉素受体基因表达分析 在盐胁迫24 h后,FaGID1L2h,FaGID1a,FaGID1c,FaGID1L2a和FaGID1b在分蘖节中的表达量呈现上升趋势,且在24 h时的表达量最高(图6A);FaGID1L2b和FaGID1d呈现相似的表达模式;其余基因在分蘖节中随着盐胁迫处理时间表现出多样的响应。叶片中FaGID1L2a的表达量则在6 h时达到最高,而后下降,与此类似有FaGID1L2b,FaGID1L2c和FaGID1L2e;叶片中FaGID1L2h及FaGID1L2f基因在盐胁迫12 h时降至最低水平,随后基本恢复至胁迫前水平;FaGID1d在6 h时降至最低表达量水平,随后恢复并升高;其他5个基因(FaGID1L2d,FaGID1c,FaGID1L2g,FaGID1a和FaGID1b)则在盐胁迫24 h后达到其最高表达量(图6B)。
2.4.4 15% PEG6000胁迫下高羊茅赤霉素受体基因的表达分析 短期干旱胁迫后,分蘖节中,FaGID1a,FaGID1b,FaGID1c和FaGID1L2f(图7A)的表达量呈现先下降后上升的趋势,在24 h达到最高;FaGID1d也表现出先降低后升高的表达模式,但24 h时的表达量低于起始水平;FaGID1L2a和FaGID1L2h在分蘖节中的表达水平在干旱胁迫6 h时达到了最低;FaGID1L2d,FaGID1L2g和FaGID1L2b在干旱处理12 h达到最高表达水平。在叶片中,FaGID1L2a,FaGID1L2b,FaGID1L2f和FaGID1L2h表现出下降的趋势(图7B),FaGID1L2c表现出先升高后降低的表达模式;而其他的6个基因(FaGID1L2d,FaGID1d,FaGID1a,FaGID1c,FaGID1L2g和FaGID1b)的表达水平则表现出先下降后上升的趋势。
3 讨论
3.1 高羊茅赤霉素受体家族成员生物信息学分析
本研究基于高羊茅转录组数据库信息,结合序列搜索、比对分析等步骤,快速地获得12个高羊茅赤霉素受体家族成员基因编码区全长序列,并对其进行了分析研究。GID1s为GA受体蛋白,其基因家族成员已在多种植物中被克隆研究,在水稻、葡萄、柑橘等作物中,GID1均定位于细胞核[10,29-30]。本研究中FaGID1s的分子量、等电点与编码区长度均与拟南芥及水稻中的GID1s蛋白相似,且FaGID1蛋白也被预测定位于细胞核。此外,除FaGID1L2a,FaGID1L2b,FaGID1L2c和FaGID1L2 g还被预测定位于细胞核和叶绿体,其他FaGID1L2蛋白均被预测定位于细胞核。
基于系统进化树分析,鉴定出的12个高羊茅赤霉素受体家族基因被分为两个亚族,Ⅰ类为FaGID1L2s,Ⅱ类为FaGID1s。GID1与GID1L由HSL进化而来[28],本研究中,氨基酸序列比对结果也支持这个观点,即FaGID1及FaGID1L2中均存在HSL家族的GXSXG保守结构域和催化三联体(Ser-Asp-His,S-D-H)。然而,在FaGID1中,原本在HSL中形成氧阴离子空穴的HGGG结构域被替换为HGGS,这与水稻和拟南芥中GID1一致[21]。但在FaGID1L2中,尽管部分蛋白仍然保留HGGG结构,另一部分蛋白(FaGID1L2a,FaGID1L2b,FaGID1L2c和FaGID1L2f)中则变为HGGA,我们猜测这也许是HSL另外的进化方向。此外,在FaGID1s蛋白中,HSL的催化三联体(Ser-Asp-His,S-D-H)中的H被V(Val)或者I(Ile)取代,这和水稻和拟南芥中的GID1一致,这种变化导致了其脂肪酶活性的丧失,而能够识别GA[21]。在先前的研究中,小立碗藓(Physcomitrella patens)中PpGI1DL蛋白也含有S-D-H催化三联体,且被证明与GA4和DELLA没有结合能力,证明GA诱导的GID1-DELLA相互作用在苔藓植物分化之后[31]。而在FaGID1L2蛋白中,S-D-H催化三联体结构被保留了下来。研究发现,同属GID1L2家族的成员LOC_Os06g11130被证明参与调控了水稻次级分枝的伸长[22],但目前并没有LOC_Os06g11130与GA结合的研究。因此,GID1L2家族成员是否拥有区别于经典的GA-GID1-DELLA复合体途径从而参与调控植物生长的机制,还需要进一步的实验研究证明。高羊茅中的GID1L2蛋白是否与小立碗藓中的GID1L蛋白一样,不具备识别结合GA的能力,这有待进一步研究。
本研究通过MEME软件分析12个高羊茅赤霉素受体蛋白的保守结构域,共发现 6个结构域(图2)。结构域1,2,3,6高度保守,为所有蛋白所共有,且在FaGID1L2s类蛋白中排列顺序一致。结构域4和5只存在于FaGID1s类蛋白(FaGID1a,FaGID1b,FaGID1c,FaGID1d)中,且结构域6在结构域3之后,与FaGID1L2s类蛋白(FaGID1L2a,FaGID1L2b,FaGID1L2c,FaGID1L2d,FaGID1L2e,FaGID1L2f,FaGID1L2g,FaGID1L2h)中结构域6的排列位置不同。结构决定功能,由此我们可以推断,FaGID1s在生长发育中及逆境胁迫等方面也许和水稻及拟南芥中的GID1s起类似的作用,这也侧面说明了GID1L2s与GID1s的功能上存在一定的差异,需进一步的研究来证明。
3.2 非生物胁迫下高羊茅赤霉素受体家族成员的表达
高温、低温、盐害、干旱是最常见的非生物胁迫,对植物的生长发育有重要影响。赤霉素受体作为赤霉素调控网络的重要元件,在感受GA信号的同时结合DELLA蛋白来激活下游GA反应以便植物应对各种非生物胁迫。干旱胁迫下,水稻gid1突变体气孔导度增加;而淹水条件下,gid1突变体中叶绿素和碳水化合物增加,并且具有较强的清除活性氧的能力,表现出更好的耐淹性[32]。另外,有研究表明低温影响拟南芥gid1b突变体根系的伸长[18]。GID1参与了逆境的调控,而关于GID1L是否参与逆境调控的研究还未见文献报道。
本研究对逆境胁迫下高羊茅12个赤霉素受体基因进行定量表达分析,发现赤霉素受体家族成员响应多种胁迫,同时,在4种逆境胁迫下,大部分FaGID1L2s在分蘖节与叶片中呈现不同的表达模式。例如PEG胁迫下分蘖节中FaGID1L2a,FaGID1L2b,FaGID1L2d和FaGID1L2h呈现先下降后上升的表达趋势,然而在叶中,FaGID1L2a,FaGID1L2b和FaGID1L2h都呈现下降的趋势,FaGID1L2d呈现上升的趋势。反观FaGID1s,无论在分蘖节还是叶片中,PEG胁迫下都呈先下降后上升的表达趋势,且最终表达量高于处理前,前人对水稻进行PEG处理后也发现GID1转录水平显著增加[32],这与我们的定量结果一致(图7)。不仅如此,其他胁迫下也能发现一些在分蘖节中和叶中表达模式不同甚至相反的基因,例如在高温胁迫下,FaGID1L2c和FaGID1L2h在分蘖节中呈现先下降后上升的趋势,而在叶片中呈现先上升后下降的趋势(图5),且这些基因大多是FaGID1L2s(图4~图7),意味着FaGID1L2s可能在不同的组织部位中发挥不同的作用。由图4可知,冷胁迫下叶中仅有FaGID1d与其他所有的基因表达模式不一致,其他基因均在胁迫后6 h达到最高的表达量,而FaGID1d在24 h时表达量最高,先前有研究报道水稻gid1突变体对冷胁迫有更高的耐受性[33],以及冷胁迫下柑橘叶片中涉及GA代谢的基因减少[34],也许能一定程度解释FaGID1d与其他基因表达模式不同的原因,但具体的分子机制还需进一步实验研究。拟南芥三个GID1基因之间存在功能冗余[35],而本研究中FaGID1s与水稻和拟南芥GID1的亲缘关系较近,且FaGID1s在不同胁迫及不同部位中的表达模式几乎一致,我们猜测FaGID1s功能相似甚至可能出现功能冗余。高羊茅赤霉素受体家族很有可能参与调控逆境,且不同亚族的基因调控可能有组织特异性。本研究揭示了高羊茅GID1及GID1L2家族在不同逆境胁迫下的动态性及复杂性,然而对于其响应逆境的机制,还需要进一步的研究证明。
4 结论
本文利用生物信息学方法鉴定了12个赤霉素受体家族成员,对其序列和功能进行了分析和预测。亚细胞定位预测结果显示其定位于细胞核和叶绿体,系统进化树分析表明其存在两个进化枝,MEME结构域分析揭示了高羊茅不同亚族间在保守结构域的数目及排布方式基本一致,与系统进化树结果相吻合。氨基酸比对结果中GID1L2与GID1之间存在的差异,是否决定了GID1L2与GID1之间的功能进化方向,这需要进一步对两者功能进行研究确定,同时也为后续实验开展提供理论基础。在生信分析的基础上,本研究还分析了高羊茅赤霉素受体基因在4种短期逆境下的转录表达,结果表明12个基因对不同的逆境胁迫均有响应,GID1L2s的调控方式可能具有组织特异性,GID1s之间则功能更相似。本研究为深入研究高羊茅赤霉素受体家族基因功能提供了理论依据,进一步推动了赤霉素受体基因的研究与发展。
参考文献
[1] WANG W X,VINOCUR B,ALTMAN A. Plant responses to drought,salinity and extreme temperatures:towards genetic engineering for stress tolerance[J]. Planta,2003,218(1):1-14
[2] 黄小芳,石培礼,余成群,等. 非生物胁迫下牧草抗逆性研究进展[J]. 草地学报,2023,31(5):1293-1301
[3] RAY D K,MUELLER N D,WEST P C,et al. Yield trends are insufficient to double global crop production by 2050[J]. Plos One,2013,8(6):e66428
[4] BAILEY-SERRES J,PARKER J E,AINSWORTH E A,et al. Genetic strategies for improving crop yields[J]. Nature,2019,575(7781):109-118
[5] DAVIES P J. Plant hormones:Physiology,biochemistry and molecular biology[M]. 2nd ed. New York:Springer Dordrecht,1995:833p
[6] 袁高峰,汪俏梅. 赤霉素信号转导研究进展[J]. 细胞生物学杂志,2003(2):90-94
[7] UBEDA-TOMS S,FEDERICI F,CASIMIRO I,et al. Gibberellin signaling in the endodermis controls Arabidopsis root meristem size[J]. Current Biology,2009,19(14):1194-1199
[8] ERIKSSON S,BHLENIUS H,MORITZ T,et al. GA4 is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation[J]. The Plant Cell,2006,18(9):2172-2181
[9] SUN T P,GUBLER F. Molecular mechanism of gibberellin signaling in plants[J]. Annual Review of Plant Biology,2004,55:197-223
[10]UEGUCHI-TANAKA M,ASHIKARI M,NAKAJIMA M,et al. GIBBERELLIN INSENSITIVE DWARF1 encodes a soluble receptor for gibberellin[J]. Nature,2005,437(7059):693-698
[11]XU H,LIU Q,YAO T,et al. Shedding light on integrative GA signaling[J]. Current Opinion in Plant Biology,2014,21:89-95
[12]MURASE K,HIRANO Y,SUN T P,et al. Gibberellin-induced DELLA recognition by the gibberellin receptor GID1[J]. Nature,2008,456(7221):459-464
[13]HIRANO K,UEGUCHI-TANAKA M,MATSUOKA M. GID1-mediated gibberellin signaling in plants[J]. Trends in Plant Science,2008,13(4):192-199
[14]SUN T P. Gibberellin metabolism,perception and signaling pathways in Arabidopsis[J]. The Arabidopsis Book. 2008,6:e103
[15]SUN T P. Gibberellin-GID1-DELLA:A pivotal regulatory module for plant growth and development[J]. Plant Physiology,2010,154(2):567-570
[16]NAKAJIMA M,SHIMADA A,TAKASHI Y,et al. Identification and characterization of Arabidopsis gibberellin receptors[J]. The Plant Journal,2006,46(5):880-889
[17]GRIFFITHS J,MURASE K,RIEU I,et al. Genetic characterization and functional analysis of the GID1 gibberellin receptors in Arabidopsis[J]. The Plant Cell,2006,18(12):3399-3414
[18]YOSHIDA H,TANIMOTO E,HIRAI T,et al. Evolution and diversification of the plant gibberellin receptor GID1[J]. Proceedings of the National Academy of Sciences of the United States of America,2018,115(33):E7844-E7853
[19]宋晴晴,张慧敏,张烨,等. 大白菜GID1家族基因鉴定及表达模式分析[J]. 山东农业科学,2020,52(3):1-7
[20]袁连玉,韩雨欣,代洪苇,等. 茶树CsGID1 s基因家族的克隆及功能分析[J]. 西南大学学报(自然科学版),2023,45(7):75-86
[21]HIRANO K,AYA K,MATSUOKA M,et al. Molecular determinants that convert hormone sensitive lipase into gibberellin receptor[J]. Protein and Peptide Letters,2012,19(2):180-185
[22]JIANG G H,XIANG Y H,ZHAO J Y,et al. Regulation of inflorescence branch development in rice through a novel pathway involving the pentatricopeptide repeat protein sped1-D[J]. Genetics,2014,197(4):1395-1407
[23]张秀娟,范玟,杨乐,等. 镉胁迫对3种草坪草生理特性及叶片超微结构的影响[J]. 草地学报,2023,31(9):2663-2670
[24]宋娅丽,王克勤,王莎,等. 3种冷季型草坪草对持续干旱、高温及其互作的生理生态响应[J]. 草地学报,2018,3(26):705-717
[25]马智宏,李征,王北洪,等. 冷季型草坪草耐旱及耐寒性比较[J]. 草地学报,2002,10(4):318-321
[26]王剑.干旱胁迫抑制高羊茅分蘖发育的分子机理[D].南京:南京农业大学,2019:68-71
[27]ZHUANG L L,WANG J,HUANG B R. Drought inhibition of tillering in Festuca arundinacea associated with axillary bud development and strigolactone signaling[J]. Environmental and Experimental Botany,2017,142:15-23
[28]HEMIL H,KOIVULA T T,PALVA I. Hormone-sensitive lipase is closely related to several bacterial proteins,and distantly related to acetylcholinesterase and lipoprotein lipase:Identification of a superfamily of esterases and lipases[J]. Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism,1994,1210(2):249-253
[29]王西成,吴伟民,房经贵,等. 葡萄赤霉素受体基因VvGID1A的分离、亚细胞定位及表达分析[J]. 园艺学报,2013,40(5):839-848
[30]申世辉.纽荷尔脐橙中赤霉素受体基因CsGID1的功能分析[D]. 武汉:华中农业大学,2012:29
[31]HIRANO K,NAKAJIMA M,ASANO K,et al. The GID1-mediated gibberellin perception mechanism is conserved in the Lycophyte Selaginella moellendorffii but not in the Bryophyte Physcomitrella patens[J]. The Plant Cell,2007,19(10):3058-3079
[32]DU H,CHANG Y,HUANG F,et al. GID1 modulates stomatal response and submergence tolerance involving abscisic acid and gibberellic acid signaling in rice[J]. Journal of Integrative Plant Biology,2015,57(11):954-968
[33]TANAKA N,MATSUOKA M,KITANO H,et al. gid1,a gibberellin-insensitive dwarf mutant,shows altered regulation of probenazole-inducible protein (PBZ1) in response to cold stress and pathogen attack[J]. Plant Cell amp; Environment,2006,29(4):619-631
[34]PENG T,YOU X S,GUO L,et al. Transcriptome analysis of Chongyi wild mandarin,a wild species more cold-tolerant than Poncirus trifoliata,reveals key pathways in response to cold[J]. Environmental and Experimental Botany,2021,184:104371
[35]GAZARA R K,MOHARANA K C,BELLIENY-RABELO D,et al. Expansion and diversification of the gibberellin receptor GIBBERELLIN INSENSITIVE DWARF1 (GID1) family in land plants[J]. Plant Molecular Biology,2018,97(4-5):435-449
(责任编辑 彭露茜)

