有机化学探究性实验题例析





摘" 要:有机化学探究性实验题,以考查有机物结构与性质、反应类型及本质为素材,重在考查学生的证据推理与模型认知、科学探究与创新意识等核心素养.
关键词:探究性实验;例题分析;高中化学
中图分类号:G632""" 文献标识码:A""" 文章编号:1008-0333(2024)16-0131-04
收稿日期:2024-03-05
作者简介:边永平(1971.12—),男,河北省承德人,本科,中学一级教师,从事高中化学教学研究.
有机化学实验题,试题取材多以探究有机物的结构与性质、有机反应的原理为主,重在考查学生的证据推理与模型认知、科学探究与创新意识等核心素养,现举几例并作简析.
1" 探究有机物的结构
例1" 为探究乙醇的结构,进行了如下实验设计(图1):
(1)根据碳元素的价态原理,写出C2H6O可能的结构简式.
(2)图中盛装乙醇的仪器名称是;实验中要将钠粉碎成很细小的颗粒,其理由是.
(3)本实验进行了2次,平均消耗乙醇2.30 g,量气管收集到H2体积平均为0.56 L(已换算成标准状况).由上述实验数据推测乙醇的结构式为.
解析" (1)根据C、H、O 3种元素的价态原理,分子式为C2H6O其可能的结构有2种,分别为:CH3—CH2—OH,CH3—O—CH3 .(2)图1中盛装乙醇的仪器是分液漏斗;实验中要将金属钠粉碎成细小的颗粒,目的是增大接触面积,加快反应.(3)本实验中每次平均消耗乙醇的物质的量为0.05 mol,产生H2为0.025 mol,即相当于每1个乙醇分子中只有1个H转化为H2,对比乙醇和二甲醚的结构简式可知:二甲醚分子中的6个H位置均相同,而乙醇分子中羟基上的H与众不同,因此可知,乙醇的结构简式为:CH3—CH2—OH.
答案见解析.
2" 探究有机反应原理
例2" 乙醇在有浓硫酸存在时加热会产生乙烯,该反应属于消去反应.某化学小组在实验室进行乙醇的消去反应实验,装置如下图(图2).
部分实验操作和实验现象见表1.
表1" 实验操作和现象
实验操作实验现象
给烧瓶加热,使烧瓶中液体快速升高到170 ℃
Ⅰ:烧瓶中的液体渐渐变为黑色
Ⅱ:溴水中有气泡产生,溴水褪色
……
实验结束,清洗烧瓶Ⅲ:A中烧瓶内壁上附着少量黑色小颗粒,同时闻到有刺激性气味
(1)由乙醇制乙烯的化学方程式为,烧瓶内产生刺激性气味气体的无机反应化学方程式为.
(2)烧瓶内的溶液“渐渐变黑”,表明浓硫酸具有性.
(3)甲同学通过B中溴水褪色的现象,认为制乙烯的反应属于消去反应,甲同学认为B中溴水褪色的化学方程式为.
(4)乙同学认为此实验设计存在不足之处,即使B中溴水褪色,也不能证明烧瓶中发生了消去反应.乙同学提出了下面2种改进措施:
①在A、B间增加一个装有(填试剂的化学式)溶液的洗气瓶.
②在A、B间增加一个盛有浓硫酸的洗气瓶,并将B中的Br2的水溶液改为Br2的CCl4溶液,即可排除干扰,据实验现象可证明烧瓶中发生了的是消去反应.
则乙同学认为对B中溴水褪色产生干扰的原因是(用化学方程式表示), 由方案②可知不能使Br2的四氯化碳溶液褪色.
解析" (1)乙醇和浓硫酸共热至170 ℃时,乙醇发生分子内脱水,即消去反应,化学方程式为:
CH3CH2OH浓硫酸170℃
CH2CH2↑+H2O
浓硫酸有脱水性,将部分乙醇炭化,生成的碳单质在加热时被浓硫酸氧化,反应产生二氧化碳、二氧化硫,所以会闻到有刺激性气味,反应的化学方程式为:
C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O
(2)依据上述分析可知,烧瓶内液体变黑表明浓硫酸具有脱水性.
(3)甲同学认为溴水褪色,是因为乙烯和溴发生了加成反应,化学方程式为:
CH2CH2+Br2CH2BrCH2Br
(4)乙同学认为,制得的乙烯中混有二氧化硫杂质,也能使溴水褪色,可以通过氢氧化钠溶液除去乙烯中的二氧化硫,以排除对检验乙烯的干扰;二氧化硫使溴水褪色的化学方程式为:
SO2+Br2+2H2OH2SO4+2HBr
由方案②可知,在没有水存在时,二氧化硫不能使溴水褪色,即干燥的SO2不能使Br2的四氯化碳溶液褪色[1].
答案见解析过程.
例3" 某校化学兴趣小组的同学将乙醛和溴水混合,发现溴水褪色,同学们根据乙醛的结构进行了如下探究性实验:
实验假设" (1)假设Ⅰ:醛基中含有不饱和键,可与Br2发生反应(填反应类型).
假设Ⅱ:乙醛分子中具有α-H,能被溴取代.无论乙醛发生几元取代反应,反应中消耗的Br2与生成的HBr物质的量之比均为.
假设Ⅲ:醛基有还原性,能被溴水氧化,此反应的化学方程式为.
实验过程 "针对以上假设,该小组同学设计了2组方案.
方案Ⅰ:通过对比反应现象(表1)判断反应类型.
表2" 实验操作和现象
序号操作现象试管11 mL溴水+1 mL乙醛,充分振荡后静置褪色试管21 mL溴的CCl4溶液+1 mL乙醛,充分振荡后静置
结论:假设Ⅰ不成立.
(2)试管2中的实验现象为.
方案Ⅱ:通过测定反应后混合液的pH(表3)判断反应类型.
表3" 实验操作和测定的pH
序号操作pH
试管3加入20 mL溴水,再加入10 mL苯酚溶液,待完全反应后(苯酚过量),测定混合液pH1.85试管4加入20 mL相同浓度的溴水,再加入10 mL 20%的乙醛溶液(乙醛过量),3 min后完全褪色,测定混合液pH
注:苯酚和乙酸的电离及温度变化对混合液pH的影响可忽略不计.
(3)写出苯酚与溴水反应的化学方程式:.
(4)若试管4中反应后混合液的pH=1.85,则证明乙醛与溴水的反应为反应(填反应类型);若试管4中反应后混合液的pH1.85(填“大于”或“小于”),则证明乙醛与溴水的反应为氧化反应.
解析" (1)假设Ⅰ认为:乙醛中的醛基含有碳氧双键,能与溴发生加成反应;假设Ⅱ认为乙醛中的α-H能被溴取代. 根据取代反应的机理,反应过程中消耗的Br2与产生的HBr等量,即二者物质的量之比总是1∶1. 假设Ⅲ认为醛基有还原性,能被溴水氧化,对应的化学方程式为:
CH3CHO+Br2+H2OCH3COOH+2HBr
(2)由于假设Ⅰ不成立,对比试管1和试管2,均含有溴单质,但乙醛不能与溴发生加成反应,则试管2中的实验现象为:溴的四氯化碳溶液不褪色.
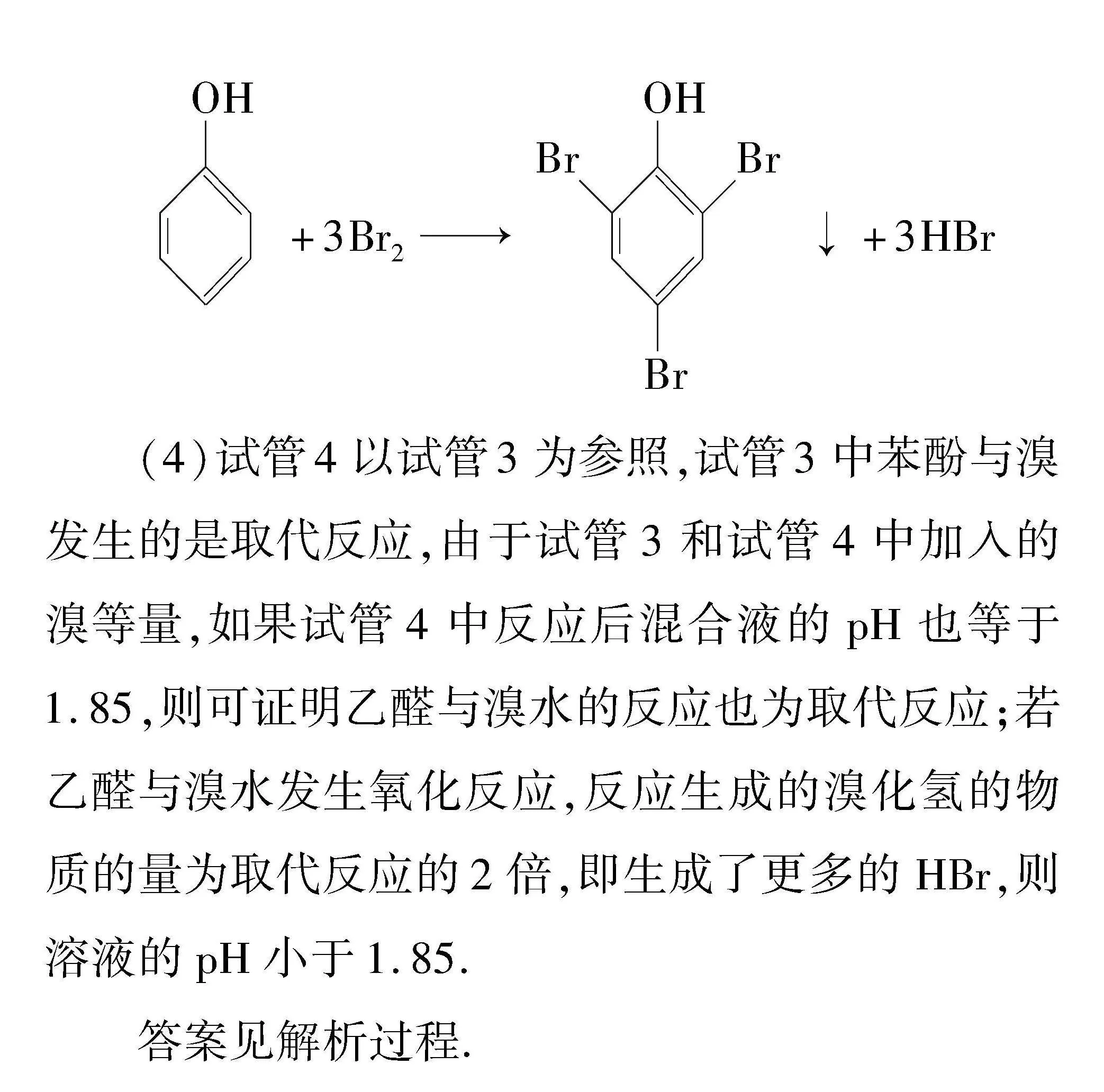
(3)苯酚与溴水能发生取代反应,生成三溴苯酚沉淀和溴化氢,化学方程式为:
OH+3Br2BrBrOHBr↓+3HBr
(4)试管4以试管3为参照,试管3中苯酚与溴发生的是取代反应,由于试管3和试管4中加入的溴等量,如果试管4中反应后混合液的pH也等于1.85,则可证明乙醛与溴水的反应也为取代反应;若乙醛与溴水发生氧化反应,反应生成的溴化氢的物质的量为取代反应的2倍,即生成了更多的HBr,则溶液的pH小于1.85.
答案见解析过程.
3" 比较几种有机物的酸性强弱
例4" 为了比较乙酸、碳酸和苯酚的酸性,某校学生小组进行了以下探究实验,实验装置如图3所示.
(1)CH3COOH和CaCO3反应的化学方程式为.
(2)CO2通入苯酚钠溶液中,实验现象为,该反应的离子方程式为.
(3)该小组中有人提出本实验设计存在不妥之处,(2)中的实验现象不能说明碳酸的酸性比苯酚强,理由是,改进该装置的方法.
解析" (1)乙酸和大理石反应的化学方程式为:
2CH3COOH+CaCO3
(CH3COO)2Ca+H2O+CO2↑
(2)CO2通入苯酚钠溶液中,产生苯酚,溶液变浑浊,反应的离子方程式为:O-+CO2+H2O
OH+HCO-3
(3)由于乙酸具有挥发性,这样A装置中产生的二氧化碳气体中混有乙酸气体,因乙酸酸性强于碳酸,乙酸也可以与苯酚钠溶液反应生成苯酚,即乙酸会干扰二氧化碳与苯酚钠的反应,因此需要除去,可用饱和碳酸氢钠溶液洗气,改进方法为:在装置A和B之间增加一个洗气瓶,盛有饱和NaHCO3溶液.
答案见解析过程.
4" 探究影响淀粉水解的因素
例5" 某同学为研究影响淀粉水解的因素,进行如下实验设计(图4):
试管甲和丙均在60~80 ℃的水浴中加热5~6 min,试管乙保持在室温下.待试管甲中的溶液冷却后再进行后续实验.
实验1:取少量试管甲中的溶液,加入新制氢氧化铜悬浊液,加热,结果没有出现砖红色沉淀.
实验2:取少量试管乙中的溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色.
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化.
(1)淀粉水解的化学方程式为.
(2)设计甲和乙是为了探究对淀粉水解的影响,设计甲和丙是为了探究对淀粉水解的影响.
(3)实验1没有砖红色沉淀产生的原因是.
(4)实验3中溶液的颜色无明显变化的原因是.
解析" (1)淀粉水解的化学方程式为:
(C6H10O5)n+nH2O稀硫酸△nC6H12O6
淀粉葡萄糖
(2)试管甲和乙所加试剂及用量均相同,只是温度不同,即设计甲和乙是为了探究温度对淀粉水解的影响;甲和丙的不同点是甲中加了稀硫酸作催化剂,而丙中没有加,即设计甲和丙是为了探究催化剂对淀粉水解的影响.
(3)由于淀粉在稀硫酸存在时发生水解,故水解液中存在硫酸,由于在加入新制的氢氧化铜悬浊液之前没有用氢氧化钠溶液中和硫酸,故没有砖红色沉淀出现.
(4)丙中的淀粉没有水解,但丙中加入氢氧化钠溶液后,再加入碘水,I2已与NaOH反应,则溶液不会变蓝.
5" 结束语
基于化学学科特点,化学实验承载着训练双基、培养学生实验操作技能、提高思维能力的重要教育功能.设计有机化学内容的探究性实验,则主要通过探究有机物的结构特点、有机反应原理以及影响实验的因素分析等问题,重点考查学生对有机物的空间结构、原子的成键特点、有机反应的机理、有机反应的实验原理的掌握情况,同时考查学生信息获取与加工、逻辑推理与论证和批判性思维能力.考查的终极目标则是对宏观辨识与微观探析、证据推理与模型认知、科学探究与创新意识等核心素养的考查.在教学中,要积极创设条件,为学生提供便利的实验条件,培养其创新思维,提高其实践能力.
参考文献:[1]
北京天利考试信息网.五年高考真题汇编详解·综合[M].拉萨:西藏人民出版社,2021.
[责任编辑:季春阳]

