范德瓦尔斯气体的状态方程与多方过程



摘 要 范德瓦尔斯气体模型是对理想气体模型的一种修正,很多普通物理教材和文献对范德瓦尔斯气体的状态方程进行了讨论,但对过程方程很少讨论,尤其是结合物理图像的讨论。本文结合数学表达式和相关物理图像首先讨论了范德瓦尔斯气体的状态方程,并代入实际气体进行分析,再探究特殊的热力学过程,进而讨论一般的热力学过程,并与理想气体进行比较。讨论在热力学过程中功、内能、热量、热容量以及多方指数的变化,并结合相关实际应用,可以加深对范德瓦尔斯气体相关物理图像的理解。
关键词 范德瓦尔斯气体;状态方程;多方过程;多方指数;热容量
范德瓦尔斯气体是基于理想气体,考虑气体分子的体积以及分子之间相互作用力的一种模型。目前,很多普通物理教材和文献对理想气体的多方过程进行了探讨[1-3],但是关于范德瓦尔斯气体多方过程的研究仅涵盖几种特殊热力学过程[4-6],并且很少有结合过程方程与物理图像的讨论。本文通过与压强、体积和摩尔热容量等相关的物理图像,讨论范德瓦尔斯气体的状态方程以及与多方过程相关的一般热力学过程,并且将其与理想气体进行对比,以加深对相关物理图像的理解。
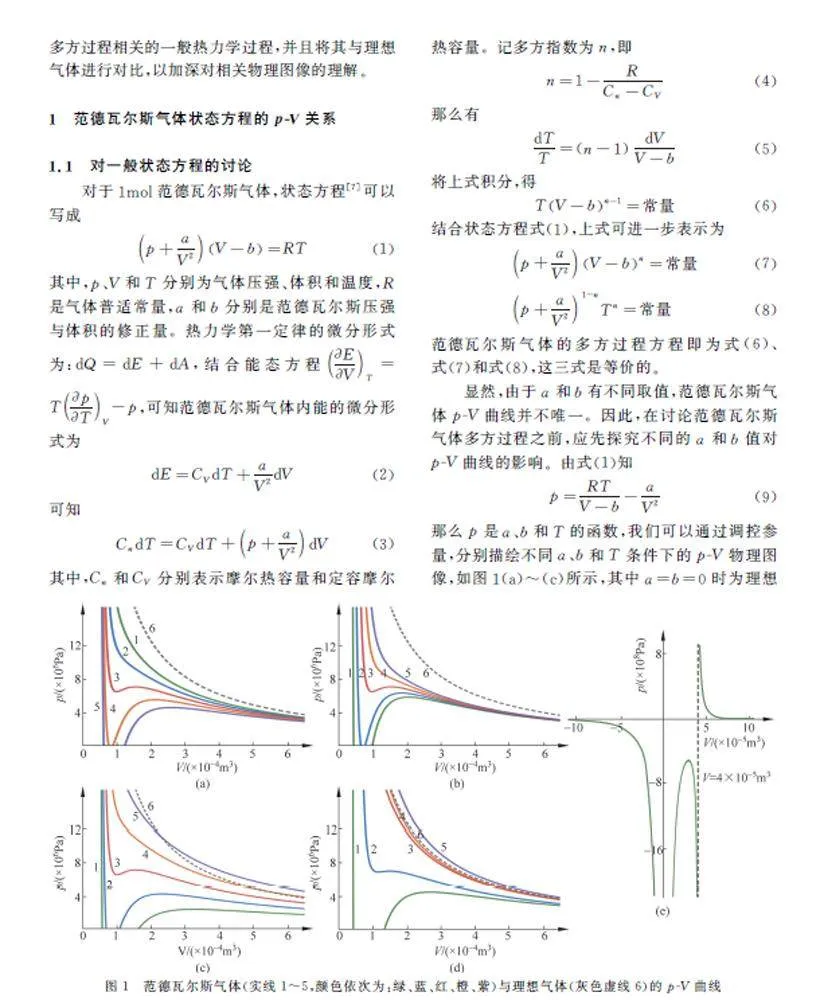
那么p 是a、b 和T 的函数,我们可以通过调控参量,分别描绘不同a、b 和T 条件下的p-V 物理图像,如图1(a)~(c)所示,其中a=b=0时为理想气体的p-V 曲线。
由图1(a)~(c)可知:当a 取较大值时,如图1(a)中a=0.45J·m3·mol-2(曲线5);或者当b取较小值时,如图1(b)中b=3×10-5m3·mol-1(曲线1);又或者当T 取较小值时,如图1(c)中T=200K和T=250K(曲线1和曲线2),曲线均有明显的间断区域。间断区域分别随着a 的减小,b的增大以及T 的增大而消失,继而出现的尖峰也逐渐变得平坦,最终,范德瓦尔斯气体p-V 曲线与理想气体的p-V 曲线相似,这表明在压强不太高(体积不太小)和温度不太低的情况下,理想气体近似的描述与范德瓦尔斯近似相近。在间断区域,有RT/V-b 0,这 与 真 实 气 体 满 足∂p/∂V Tlt;0的条件矛盾,所以上升区段是不存在的[8,9]。此外,以图1(a)的绿色实线1为例,作其p 为负值时的p-V 曲线,由于p 的跨度过大,省略了其中一部分图像,如图1(e)所示。当V lt;0时,plt;0,该区域没有实际物理意义,不做讨论。b的数值为4×10-5m3 · mol-1,当0b。从式(9)中同样可以发现在数值上,V 无法达到b处,但是对实际气体而言,V 的取值显然是连续的,在V 取一个特定的正值时,p 的数值不应当为无穷值。这揭示了范德瓦尔斯气体状态方程的不足之处,也表明了数学表达式不能完全反映物理规律,需要结合实际物理现象进行修正。
范德瓦尔斯气体p-V 曲线的斜率kFp =- RT/(V-b)2+2a/V3,而理想气体kp=-RT/V2 。因为a、b 的数值一般分别在10-1、10-5 量级,所以当温度T 较高或体积V 较大时,斜率表达式中b 和2a/V3的影响可以忽略,即: RT/(V-b)2 ≈RT/V2 ≫2a/V3,那么kFp ≈kp 。这说明在高温或大体积(低压强)的条件下,理想气体与范德瓦尔斯气体的状态方程是一致的,并且理想气体状态方程在形式上更加简洁;但在低温和小体积(高压强)的条件下,两者有明显差异,由于气体分子的体积以及分子之间的相互作用力不容忽视,范德瓦尔斯气体比理想气体更加符合实际气体。
1.2 实际气体范德瓦尔斯状态方程的p-V 关系
以T =300K时的氨气、二氧化碳、氧气、氮气和氦气等五种实际气体为例,利用范德瓦尔斯气体状态方程(7)分别代入相应的a、b 值(表1),得到它们的p-V 曲线,并与理想气体p-V 曲线比较,如图1(d)所示。可以看到,氨气和二氧化碳的p-V 曲线(实线1和实线2)与理想气体的p-V 曲线(灰色虚线6)有明显区别,氨气的p-V 曲线有明显的间断区域,而氧气、氮气和氦气的p-V 曲线(实线3~实线5)与理想气体p-V 曲线的差异较小。其原因在于这五种气体的b 值差距不大,而氨气和二氧化碳的a 值相对较大,另外三种气体的a 值相对较小。图1(d)气体之间的差异与图1(a)的情况相似。另外,用理想气体来描述这些实际气体,得到的p-V 曲线是相同的。
2 范德瓦尔斯气体多方过程
2.1 特殊的热力学过程
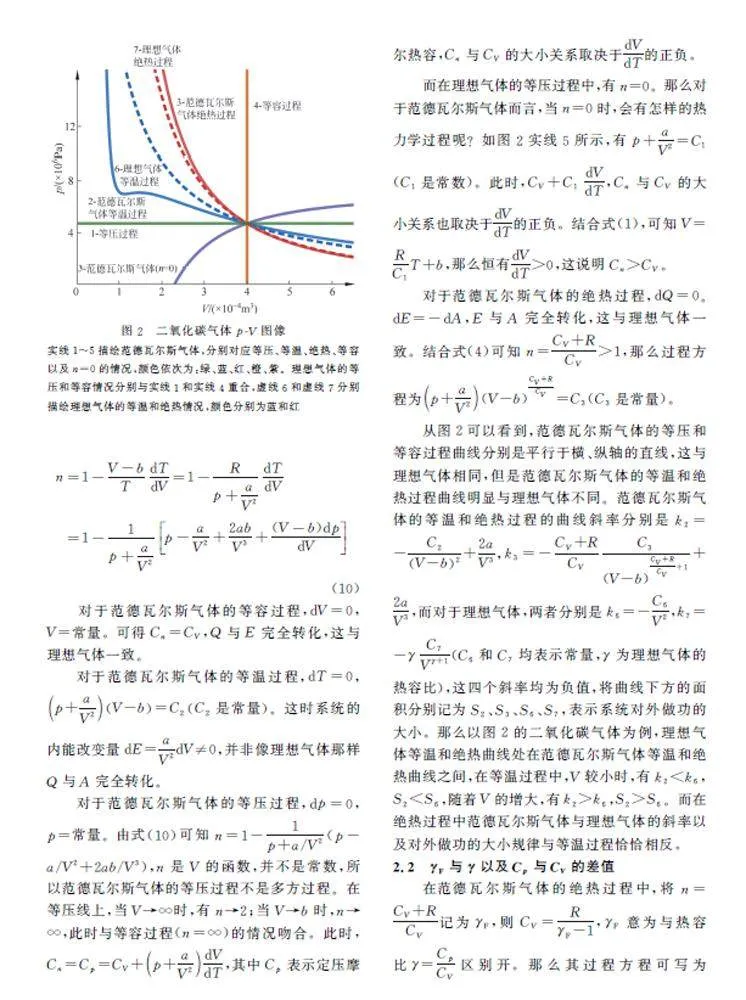
以二氧化碳气体为例,通过代入其a 和b 值(表1),探究几种特殊的热力学过程,进而讨论范德瓦尔斯气体多方过程。根据式(7),可以作在不同的n 值条件下的二氧化碳气体p-V 曲线,如图2所示。对于理想气体特殊多方过程的分析已经有很多[1-3],这里不再重复讨论。
将式(3)、式(4)、式(7)与式(1)的微分形式联立,可以得到
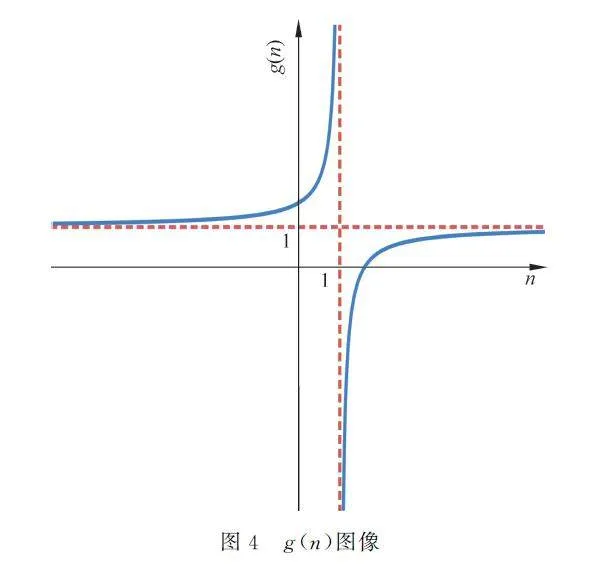
可以记函数g(n)=1+1-γF/n-1,其图像如图4所示。当n 有不同的取值时,Cn 与CV 的大小关系如表2所示。
由图4可知,当nlt;1时,g(n)gt;1;当ngt;1时,g(n)lt;1;当n→±∞时,g(n)→1。
根据图2的特殊热力学过程,可以进一步分析。系统对外做功的大小即为图2中曲线下方的面积,那么当n 在下面的某一特定范围内时,dA的值也正是介于对应的两种特殊热力学过程的dA 之间。
当-∞lt;nlt;0时,过程曲线介于n=0和n=∞(等容过程)两条曲线之间,系统的内能改变量和对外做的功都不为0。dV ≠0,若dV gt;0,则比等容过程多吸收热量,反之则少吸收热量。
当0lt;nlt;1时,过程曲线介于n=0和n=1(等温过程)两条曲线之间,系统对外做功dA=pdV。
当1lt;nlt;γF 时,过程曲线介于n=1(等温过程)和n=γF(绝热过程)两条曲线之间,系统从外界吸收的热量不为0,分别用于对外做功和改变内能。系统内能改变量的大小介于等温和绝热过程的内能改变量之间。制冷机膨胀致冷的工作原理正是由此而来,随着压强降低,范德瓦尔斯气体的温度降低,虽然系统不可避免地从外界吸收热量,但是通过其快速膨胀,使范德瓦尔斯气体的体积迅速增大,来减少吸热。
当γFlt;nlt;+∞时,过程曲线介于n=γF(绝热过程)和n=∞(等容过程)两条曲线之间,系统从外界吸收的热量和对外做的功都不为0。dT ≠0,若dT gt;0,则内能改变量比等温过程的大,反之则小。实际中,热机一般工作在绝热过程和等容过程之间,当热机压缩升温时,范德瓦尔斯气体温度低于外界温度,从外界吸收热量。当范德瓦尔斯气体的温度高于外界温度时,降温膨胀,并对外做功和向外界释放热量。
此外,天空中的气团在白天吸收热量,温度升高,体积膨胀变大,夜晚时气团向外界放出热量,温度降低,体积收缩减小,这样的气团变化是介于等温过程和等压过程之间的多方过程[10]。
3 结语
本文利用数学表达式和相关物理图像比较了范德瓦尔斯气体与理想气体的状态方程以及与多方过程相关的一般热力学过程。通过讨论范德瓦尔斯气体状态方程数学表达式和压强与体积关系曲线,得到了不同的范德瓦尔斯气体修正量和温度对压强与体积关系的影响,并且分析了范德瓦尔斯气体模型的不足之处。在高温和大体积(低压强)的条件下,范德瓦尔斯气体与理想气体的描述趋于一致,而在低温和小体积(高压强)的条件下,范德瓦尔斯气体比理想气体更加符合实际。通过范德瓦尔斯气体和理想气体状态方程描述实际气体,进而讨论两者在压强与体积关系曲线上的异同之处。随后,探究了几种特殊的热力学过程,进而讨论范德瓦尔斯气体的多方过程,最后,在范德瓦尔斯气体与理想气体的热力学过程中,比较功、内能和热量以及热容量和多方指数的变化,并列举相关实际应用。这些结果有助于加深对范德瓦尔斯气体相关物理图像的理解。
参 考 文 献
[1] 岑敏锐. 理想气体吸热和放热的讨论[J]. 物理与工程,2006, 16(5): 28-30.
CEN M R. Discussion on heat absorption and release of ideal gas[J]. Physics and Engineering, 2006, 16(5): 28-30. (inChinese)
[2] 高崇伊,朱琴. 多方过程的定义及其和准静态过程的关系[J]. 大学物理,2006, 25(2): 13-15.
GAO C Y, ZHU Q. The definition of polytropic process andthe relation between it and the quasi-static process[J]. CollegePhysics, 2006, 25(2): 13-15. (in Chinese)
[3] 郑明阳,王天为,张国锋. 理想气体热力学过程吸放热情况的图像判断法[J].物理与工程,2014, 24(3): 24-28.
ZHENG M Y, WANG T W, ZHANG G F. A simple methodto determine gaining or loosing heat in a thermodynamicprocess for an ideal gas system[J]. Physics and Engineering,2014, 24(3): 24-28. (in Chinese)
[4] 蓝风华. 范德瓦尔斯气体的气压公式[J].物理与工程,2014, 24(1): 46-54.
LAN F H. Barometric formula of van der Waals gas[J].Physics and Engineering, 2014, 24(1): 46-54. (in Chinese)
[5] 张万林. 范德瓦尔斯气体的热力学性质研究[J].科技资讯,2008, 14: 209.
ZHANG W L. Studies of the thermodynamic properties ofvan der Waals gas[J]. Science and Technology Information,2008, 14: 209. (in Chinese)
[6] 舒纯军,余先伦,姜友娥,等. 范德瓦尔斯气体多方过程的研究[J]. 重庆三峡学院学报,2013, 29(145): 35-36.
SHU C J, YU X L, JIANG Y C, et al. Studies on the polytropicprocess of van der Waals gas[J]. Journal of ChongqingThree Gorges University, 2013, 29(145): 35-36. (in Chinese)
[7] 杨晓雪. 大学物理[M]. 武汉: 华中科技大学出版社,2014.[8] 付清荣,赵建东,张国梁. 范德瓦尔斯气体热力学过程的研究[J].伊犁师范学院学报(自然科学版),2012, 3: 39-42.
FU Q R, ZHAO J D, ZHANG G L. A Study on ThermodynamicsProcess of van der Waals Gas[J]. Journal of YiliNormal University (Natural Science Edition), 2012, 3: 39-42. (in Chinese)
[9] 尹钊,陈雪亮. 范德瓦尔斯气体方程描述真实气体的成功与缺陷[J]. 聊城大学学报(自然科学版),2003, 16(4): 98-100.
YIN Z, CHEN X L. The successes and defects of real gasesof the van der Waals gas equation description[J]. Journal ofLiaocheng University (Natural Science Edition), 2003, 16(4):98-100. (in Chinese)
[10] 朱元举. 多方过程的实用解析[J]. 中国科技纵横,2013,23: 248, 250.
ZHU Y J. Analyzing for the polytropic process[J]. ChinaScience amp; Technology Overview[J], 2013, 23: 248, 250.(in Chinese)

