外源褪黑素对盐胁迫下棉花生长发育、抗氧化酶活性及渗透调节物质含量的影响

摘要:【目的】探究外源褪黑素(melatonin, MT)对盐胁迫下棉花生长发育的调控效应。【方法】以国欣棉9号为材料,采用室内盆栽方法,土壤含盐量为0.3%(质量分数),筛选出适宜的MT浓度后,设置4个处理:浇灌清水+喷施清水(CK)、浇灌盐水+喷施清水(S)、浇灌清水+喷施MT(MT)和浇灌盐水+喷施MT(MS),研究了不同处理下棉花的株高、茎粗、叶面积、叶绿素相对含量(用soil and plant analyzer development,SPAD值代表)、单株生物量、根冠比、抗氧化酶活性、活性氧含量以及渗透调节物质含量的变化,并对上述指标进行了相关分析。【结果】与CK处理相比,S处理显著降低棉花的株高、茎粗、叶面积、SPAD值、单株地上部鲜物质质量、地下部鲜物质质量、地上部干物质质量、地下部干物质质量,显著提高根冠比;在盐胁迫处理后期,S处理显著降低叶片超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)活性,显著提高过氧化氢、超氧阴离子和丙二醛的含量,显著降低可溶性糖、可溶性蛋白和脯氨酸的含量。与S处理相比,盐胁迫下叶片喷施200 μmol·L-1 MT(MS处理)可显著提高棉花的株高、茎粗、叶面积、SPAD值、单株地上部与地下部的鲜物质质量及地上部干物质质量,显著降低根冠比,显著提高SOD、POD和CAT活性,显著降低过氧化氢、超氧阴离子和丙二醛的含量,显著提高可溶性糖、可溶性蛋白和脯氨酸的含量。棉株地上部干物质质量与株高、茎粗、叶面积、SPAD值、地上部鲜物质质量、地下部鲜/干物质质量、SOD活性、POD活性、CAT活性、可溶性糖含量、可溶性蛋白含量、脯氨酸含量均呈显著正相关关系,而与超氧阴离子含量、丙二醛含量显著负相关。【结论】叶面喷施200 μmol·L-1 MT能够有效缓解高盐环境(土壤含盐量为0.3%)对棉花产生的氧化胁迫与渗透胁迫,促进棉花生长,提高耐盐能力。
关键词:棉花;褪黑素;盐胁迫;抗氧化酶;渗透调节物质;生物量
Effects of exogenous melatonin on the growth and development, antioxidant enzyme activity, and osmotic adjustment substance content of cotton under salt stress
Song Chen1, 2, Liu Shasha1, 2, Wang Jian1, 2, Ma Xinying1, 2, Liu Liantao2, Zhang Ke2, Zhang Yongjiang2, Sun Hongchun2, Bai Zhiying1, 2*, Li Cundong2*
(1. College of Life Science, Hebei Agricultural University, Baoding, Hebei 071000, China; 2. College of Agronomy, Hebei Agricultural University/State Key Laboratory of North China Crop Improvement and Regulation/Key Laboratory of Crop Growth Regulation of Hebei Province, Baoding, Hebei 071000, China)
Abstract: [Objective] This study aims to investigate the regulatory effect of exogenous melatonin (MT) on cotton growth and development under salt stress. [Methods] Guoxinmian 9 was used as the material, and the indoor pot method was adopted with the soil salt content of 0.3%, and after screening out the appropriate MT concentration, four treatments were set: irrigate water + spray water (CK), irrigate salt water + spray water (S), irrigate water + spray MT (MT), and irrigate salt water + spray MT (MS). The plant height, stem diameter, leaf area, relative chlorophyll content (soil and plant analyzer development, SPAD value), biomass per plant, root-shoot ratio, antioxidant enzyme activity, reactive oxygen species content, and osmotic adjustment substance content of cotton under different treatments were studied. And correlation analysis of the above indexes was carried out. [Results] Compared with CK treatment, S treatment significantly reduced plant height, stem diameter, leaf area, SPAD value, aboveground fresh matter mass, underground fresh matter mass, aboveground dry matter mass, and underground dry matter mass, and significantly increased root-shoot ratio of cotton. In the later stage of salt stress treatment, S treatment significantly reduced the activities of superoxide dismutase (SOD), peroxidase (POD), and catalase (CAT) in cotton leaf; significantly increased the contents of hydrogen peroxide, superoxide anion, and malondialdehyde; and significantly decreased the contents of soluble sugar, soluble protein, and proline. Compared with S treatment, foliar spraying 200 μmol·L-1 MT under salt stress (MS treatment) significantly increased plant height, stem diameter, leaf area, SPAD value, aboveground and underground fresh matter mass, and aboveground dry matter mass per plant; significantly reduced root-shoot ratio; significantly increased SOD, POD, and CAT activities; significantly reduced the contents of hydrogen peroxide, superoxide anion, and malondialdehyde; and significantly increased the contents of soluble sugar, soluble protein, and proline. Aboveground dry matter mass was significantly and positively correlated with plant height, stem diameter, leaf area, SPAD value, aboveground fresh matter mass, underground fresh and dry matter mass, SOD activity, POD activity, CAT activity, soluble sugar content, soluble protein content, and proline content; while was significantly and negatively correlated with superoxide anion content and malondialdehyde content. [Conclusion] Foliar spray 200 μmol·L-1 MT can effectively alleviate the oxidative stress and osmotic stress of cotton under high salt environment (soil salt content of 0.3%), promote cotton growth, and improve salt tolerance of cotton.
Keywords: cotton; melatonin; salt stress; antioxidant enzymes; osmotic adjustment substance; biomass
土壤盐渍化是1种主要的环境风险,且随着人口增加、工业污染加重、不良灌溉习惯日益加剧,土地盐渍化面积逐年增加,严重影响了植物的生长发育[1]。盐胁迫主要通过影响作物种子萌发、生长和开花结果,造成作物产量与品质下降[2-3]。研究发现,盐渍化土壤中高浓度的Na+和Cl-打破了植物体内离子动态平衡,导致种子萌发率降低[4-5]。盐胁迫会使幼苗期植物吸水能力下降,引起渗透胁迫,导致植物体内水分亏缺和营养失衡,植株生长缓慢[6]。盐胁迫导致植物叶面积、叶绿素含量和类胡萝卜素含量显著降低,从而对光合作用产生不利影响,致使地上部和地下部的鲜物质质量及干物质质量降低[7-8]。高浓度的盐胁迫还会引起植物体内活性氧(reactive oxygen species, ROS)过度累积,加重膜脂过氧化程度,导致丙二醛(malondialdehyde, MDA)过量产生。为了减轻ROS对细胞产生的危害,植物可通过调节抗氧化系统平衡减少ROS的累积。超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)是植物体内酶促防御系统的重要保护酶,它们能有效分解活性氧自由基,从而减轻逆境对植物的危害[9-10]。研究发现,在150 mmol·L-1 NaCl处理前期,水稻体内抗氧化酶活性升高,而处理中后期抗氧化酶活性降低[11]。150 mmol·L-1 NaCl处理降低了黄瓜幼苗的抗氧化酶活性,导致ROS与MDA累积[12]。盐胁迫下,植物为了维持细胞内的渗透压平衡状态,会积累可溶性糖、可溶性蛋白和脯氨酸等物质,以缓解盐胁迫的不利影响[13]。Wang等[14]研究表明,0.3%(质量分数)NaCl胁迫处理前期水稻幼苗根系中可溶性糖、可溶性蛋白含量增加。
褪黑素(melatonin, MT)是吲哚胺类化合物,具有很强的抗氧化能力,能够有效清除植物体内的自由基,以减轻氧化胁迫产生的损伤[15-16]。研究发现,150 mmol·L-1 NaCl条件下,100 μmol·L-1 MT处理增加了玉米叶片中叶绿素含量,并提高了抗氧化酶活性,从而增强了玉米的耐盐性[8]。盐胁迫下MT可通过提高SOD、POD、CAT等抗氧化酶的活性来降低ROS含量,调节氧化还原稳态[17]。在150 mmol·L-1 NaCl条件下,10 μmol·L-1 MT处理能够增加棉花根系的可溶性糖和可溶性蛋白含量,维持细胞的完整性,缓解盐胁迫对棉花根系发育的抑制效应[18]。
棉花为锦葵科棉属植物,是我国重要的经济作物之一。棉花相对耐盐,但高浓度的盐胁迫仍会对棉花的生长发育以及产量形成造成较大影响[19-20]。目前,有关MT对盐胁迫下棉花影响的研究主要集中在种子萌发与幼苗生长等方面[18-21],关于MT对盐胁迫下棉花生长发育后期调控效应的研究报道较少。鉴于此,本研究通过室内盆栽试验,设置盐胁迫条件及MT处理,明确MT对盐胁迫下棉花生育期内植株形态、生物量和叶片生理生化指标的影响,为MT在棉花生产中的应用提供参考。
1 材料与方法
1.1 试验材料
供试棉花材料为国欣棉9号。2023年4月至2024年1月种植于河北农业大学智能气候室。MT购买于Sigma公司,用95%(体积分数)的乙醇配成200 mmol·L-1母液,储存于-20 ℃冰箱,使用时稀释成相应浓度的MT溶液。
1.2 MT浓度筛选
采用土培种植方式,土壤由深层土和黄沙按3∶1的体积比混合而成。选取健康饱满的棉花种子,消毒浸种后在培养箱中(25 ℃,湿度60%)避光保存24 h。筛选露白程度一致的棉种播种到盆钵中,每个处理10盆,每盆10粒,在河北农业大学科研大楼智能气候室进行培养,室内昼/夜温度为28 ℃/25 ℃,光照14 h/黑暗10 h,相对湿度为45%~50%,光照强度为300 μmol·m-2·S-1。待棉苗长出1片真叶后间苗,每盆仅保留1株生长良好的棉苗。在培养过程中,采用称量法精确控制灌水量,保持土壤湿润。
NaCl处理:棉苗三叶期,根据土壤质量及土壤含水量,精确称取适量NaCl,使用蒸馏水将其溶解。随后将制备完成的NaCl溶液均匀浇灌至盆栽土壤中,确保土壤中的盐分含量达到0.3%(质量分数)。对于其他非盐胁迫处理,同时浇灌等量蒸馏水。为了防止盐分随水分流失,每个花盆下放置1个托盘,用于收集可能渗出的溶液,并将托盘中收集的溶液重新浇灌回相应的花盆中,以确保土壤含盐量的稳定性[22]。
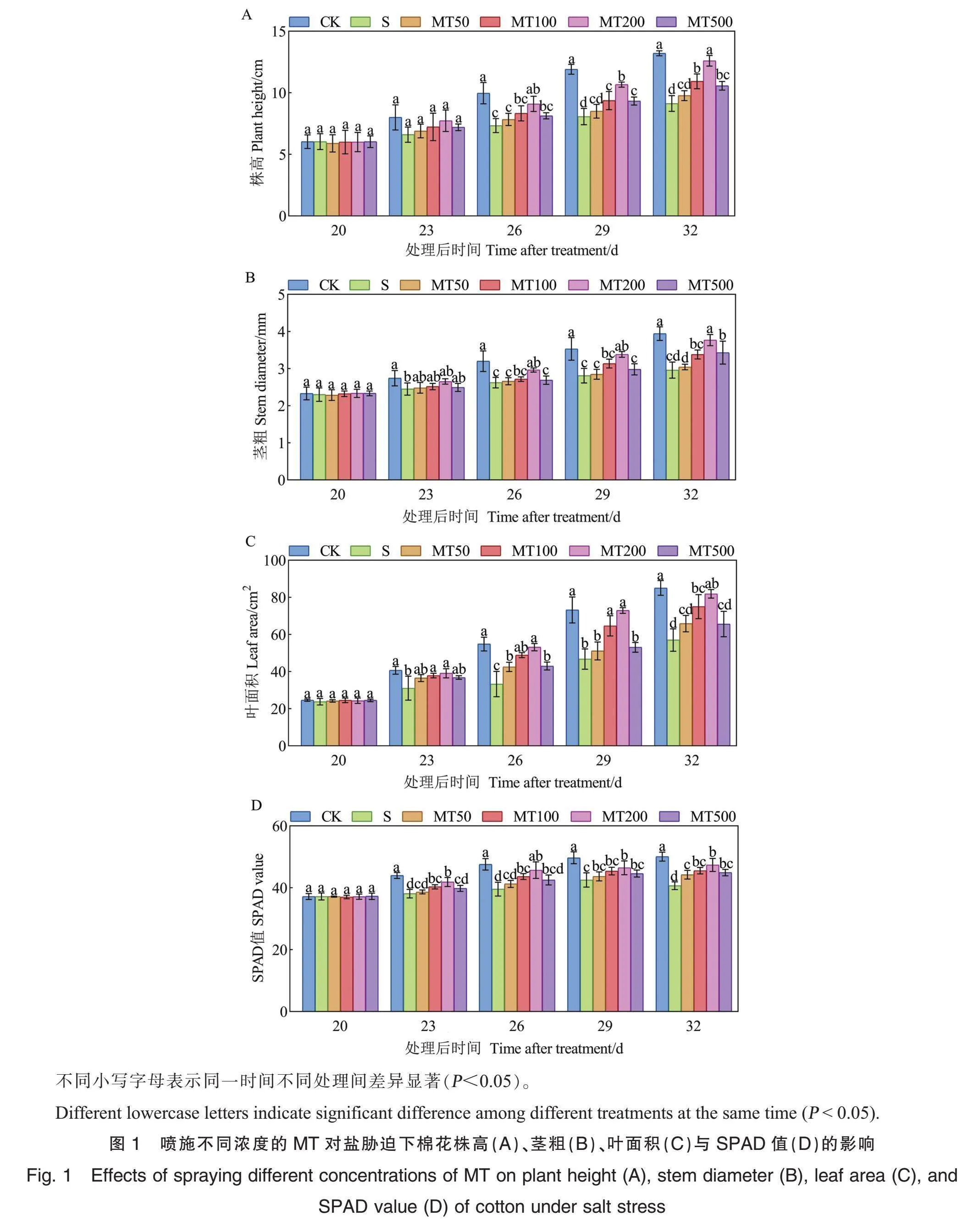
MT处理:盐胁迫或清水处理后第6天开始,每隔1 d对植株叶面喷施不同浓度(50、100、200、500 μmol·L-1)的MT溶液(分别记为MT50、MT100、MT200、MT500),避光喷施,共喷施7次,每次以叶片正反两面附着一层小液珠且不滴落为标准。以喷施等量清水作为对照。第7次喷施后1 d,测定棉花的株高、茎粗、叶面积与叶片叶绿素相对含量(soil and plant analyzer development, SPAD值),每3 d(即盐胁迫处理后20 d、23 d、26 d、29 d、32 d)测定1次,筛选出最适宜的MT处理浓度。
1.3 试验处理
设置4个处理:浇灌清水+喷施清水(CK),浇灌盐水+喷施清水(S),浇灌清水+喷施MT(MT),浇灌盐水+喷施MT(MS)。每个处理10株。棉花播种、培养条件及盐胁迫处理同1.2。
盐胁迫或清水处理后第6天喷施筛选浓度的MT溶液,喷施方法同1.2。第7次喷施后1 d,测定棉株的生长和生理指标,每15 d(即盐胁迫处理后20 d、35 d、50 d、65 d和80 d)测定1次。
1.4 形态指标测定
垂直测量子叶节至棉花顶端生长点的距离即为株高。于子叶节上方1 cm处使用游标卡尺测量茎粗。叶面积=叶片长度×叶片宽度×0.75。
1.5 鲜物质质量和干物质质量测定
地上部、地下部的鲜物质质量和干物质质量:在盐胁迫处理后80 d,从子叶节处将棉花分为地上部和地下部,并分别进行称量,获得地上部、地下部的鲜物质质量。然后将地上部和地下部放入烘箱,先在105 ℃杀青30 min,然后在80 ℃烘干72 h至质量恒定,测定地上部、地下部的干物质质量。
根冠比:地下部干物质质量与地上部干物质质量之比。
1.6 生理生化指标测定
使用SPAD-502叶绿素计(日本柯尼卡美能达公司)测定棉花主茎倒三叶的SPAD值。
每个处理选取3株棉花,取主茎倒三叶,用锡纸包裹,使用液氮速冻并保存于-80 ℃冰箱。用南京建成生物工程研究所的总超氧化物歧化酶测定试剂盒、过氧化物酶测定试剂盒、过氧化氢酶测定试剂盒分别测定样品的SOD、POD和CAT活性,用植物可溶性糖含量测试盒、总蛋白测定试剂盒和脯氨酸测定试剂盒分别测定可溶性糖、可溶性蛋白和脯氨酸的含量,用过氧化氢测定试剂盒、丙二醛测定试剂盒分别测定过氧化氢(H2O2)和MDA的含量。用索莱宝生物公司的超氧阴离子含量检测试剂盒测定超氧阴离子(superoxide anion)含量。
1.7 数据处理与分析
使用Microsoft Office Excel 2019整理相关数据,利用SPSS 27.0.1进行单因素方差分析,使用Origin 2021进行相关分析,采用GraphPad Prism 8.0绘图。
2 结果与分析
2.1 MT浓度的筛选
从图1可以看出,处理后23 d、26 d、29 d、32 d,相较于CK处理(浇灌清水+喷施清水),S处理(浇灌盐水+喷施清水)下棉花的株高、茎粗、叶面积以及SPAD值均显著下降(处理后23 d的株高除外)。盐胁迫下喷施MT增加了棉花的株高、茎粗、叶面积和SPAD值;但随着MT浓度的升高,不同时期的棉花株高、茎粗、叶面积和SPAD值均呈先升高后降低趋势,其中MT浓度为200 μmol·L-1(MT200)时,棉花的株高、茎粗、叶面积及SPAD值最高,且在处理后26 d、29 d、32 d均与S处理差异显著。说明200 μmol·L-1的MT处理能够有效促进盐胁迫下棉花植株的生长,选择200 μmol·L-1的MT开展进一步的研究。
2.2 外源MT对盐胁迫下棉花株高、茎粗和叶面积的影响
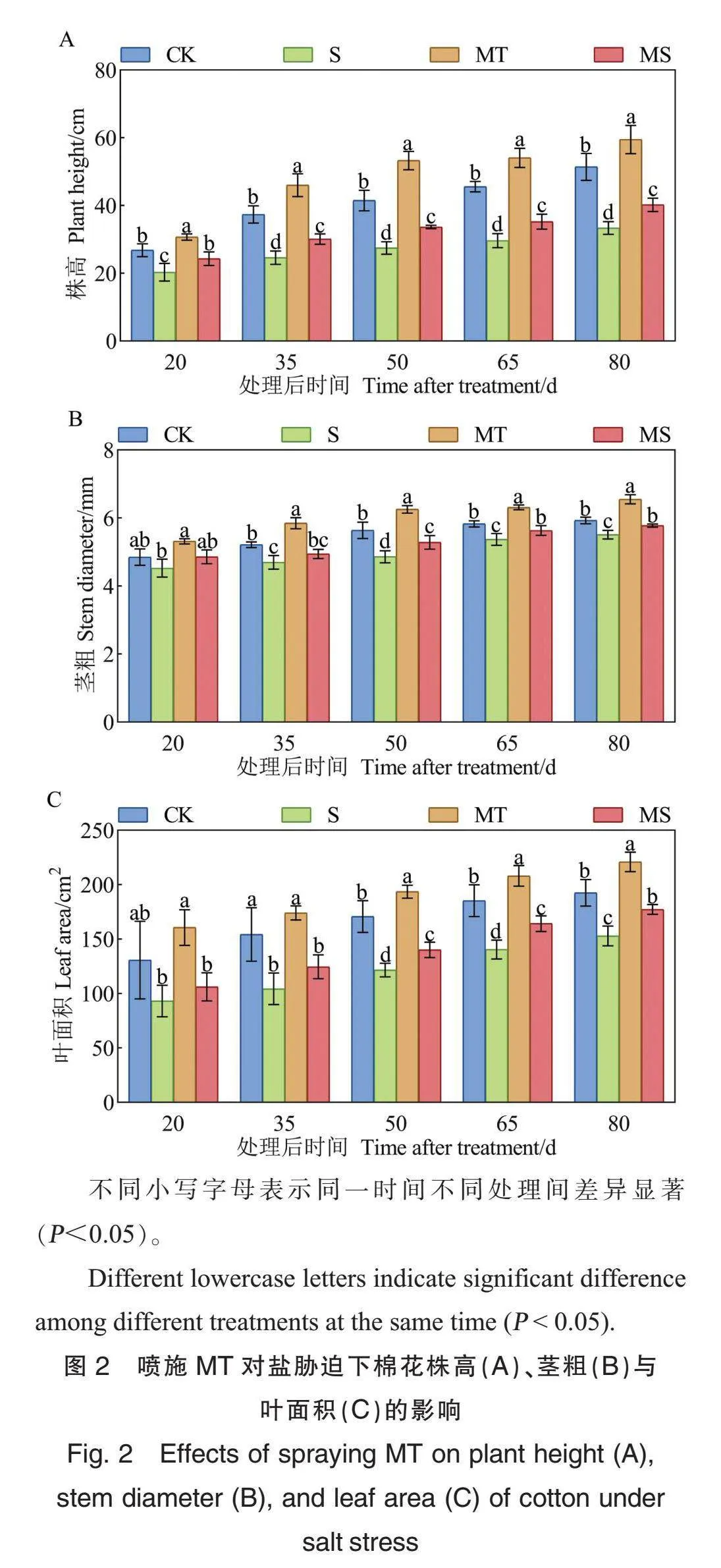
与CK处理相比,S处理下棉花的株高、茎粗和叶面积显著降低(盐胁迫处理后20 d的茎粗和叶面积除外)(图2),说明盐胁迫显著影响棉株生长。
与CK处理相比,MT处理下棉花株高显著增加14.55%~28.46%,茎粗增加8.35%~12.15%,叶面积增加12.32%~22.94%。与S处理相比,MS处理下棉花株高显著增加15.89%~18.40%,茎粗增加4.84%~8.71%,叶面积增加13.89%~19.39%,但均低于CK处理。表明在正常条件和盐胁迫下喷施MT均能促进棉株生长。
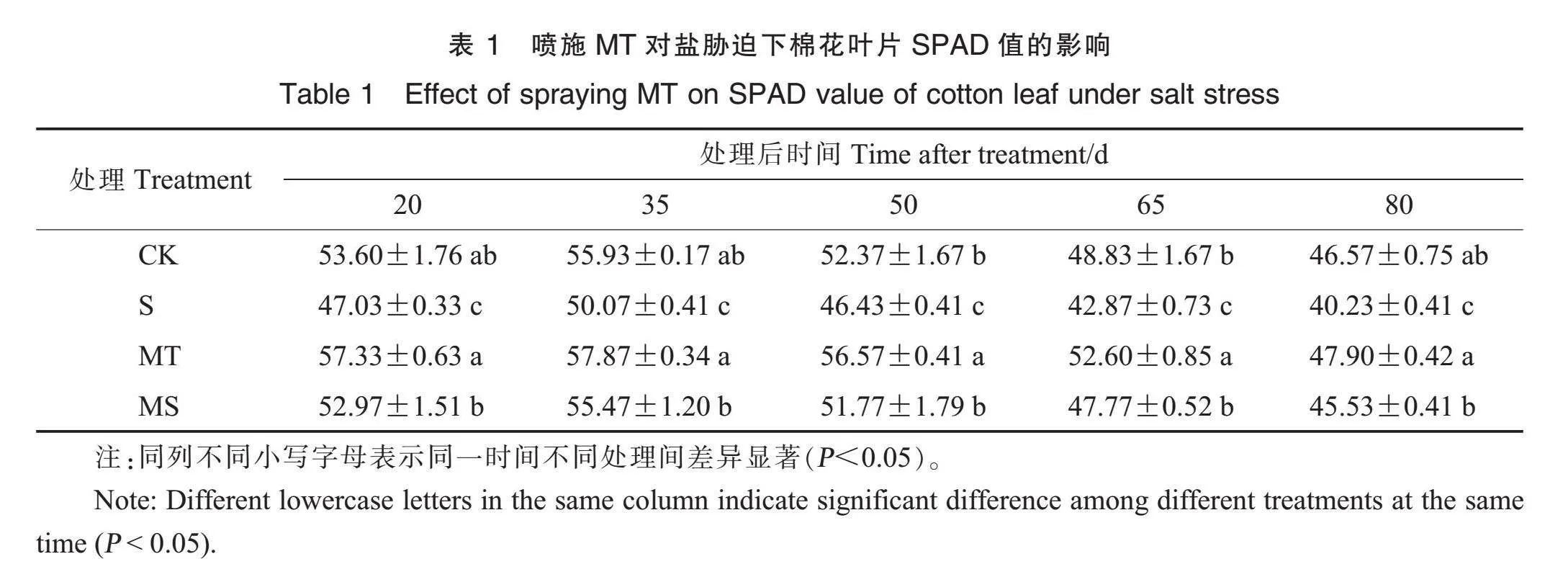
2.3 外源MT对盐胁迫下棉花叶片SPAD值的影响
随着生育进程推进,各处理的棉花叶片SPAD值呈现先升高后降低的变化趋势。与CK处理相比,MT处理的棉花叶片SPAD值升高,在盐胁迫处理后50 d、65 d分别显著升高8.02%、7.72%。与CK处理相比,S处理下棉花叶片SPAD值显著降低10.48%~13.61%。与S处理相比,MS处理显著提高了棉花叶片SPAD值,在盐胁迫处理后20 d、35 d、50 d、65 d和80 d的增幅分别为12.63%、10.78%、11.50%、11.43%和13.17%(表1)。表明盐胁迫显著降低棉花叶片的SPAD值,外源MT处理能够显著提高盐胁迫下棉花叶片的SPAD值。
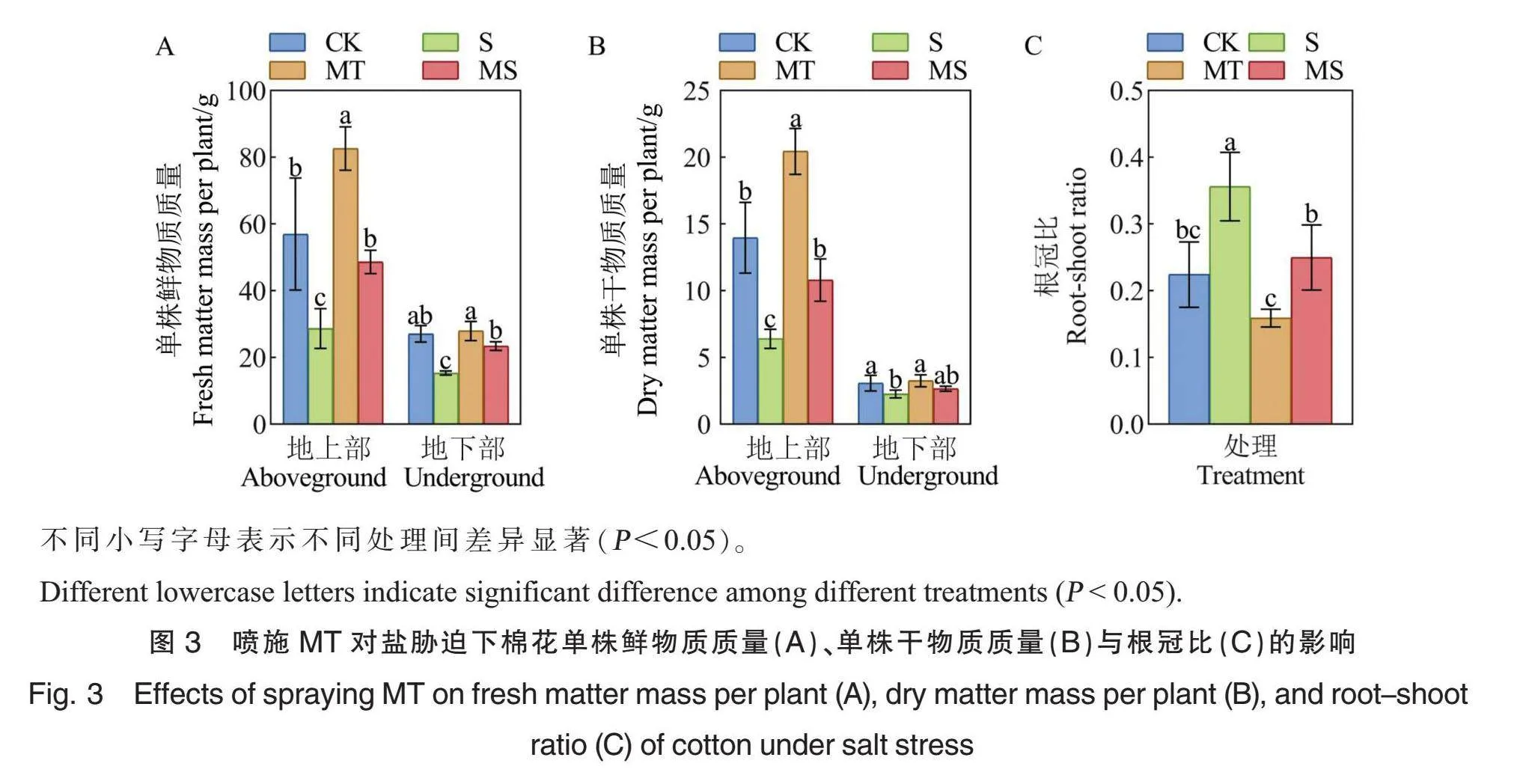
2.4 外源MT对盐胁迫下棉花生物量及根冠比的影响
盐胁迫处理后80 d,MT处理的棉花地上部鲜物质质量较CK处理显著增加45.00%,但地下部鲜物质质量无显著差异。与CK处理相比,S处理的棉花地上部、地下部鲜物质质量分别显著降低49.75%、43.39%。与S处理相比,MS处理的棉花地上部、地下部鲜物质质量分别显著增加41.06%、34.46%(图3A)。MT处理的棉花地上部干物质质量较CK处理显著增加46.38%,但地下部干物质质量无显著差异。S处理下棉株地上部、地下部干物质质量分别较CK处理显著降低54.17%和26.62%。与S处理相比,MS处理下棉株地上部干物质质量显著增加68.70%,棉株地下部干物质质量增加17.26%(图3B)。说明盐胁迫显著抑制棉花生物量的累积,喷施MT可以缓解这种抑制效应。
与CK处理相比,MT处理降低了棉花根冠比,但二者之间无显著差异;S处理下棉花的根冠比显著提高58.78%。与S处理相比,MS处理下棉花根冠比显著降低29.80%(图3C)。说明盐胁迫会导致棉花根冠比显著升高,盐胁迫下喷施MT可以降低棉花的根冠比,但在正常条件下喷施MT对根冠比的影响并不显著。
2.5 外源MT对盐胁迫下棉花抗氧化酶活性的影响
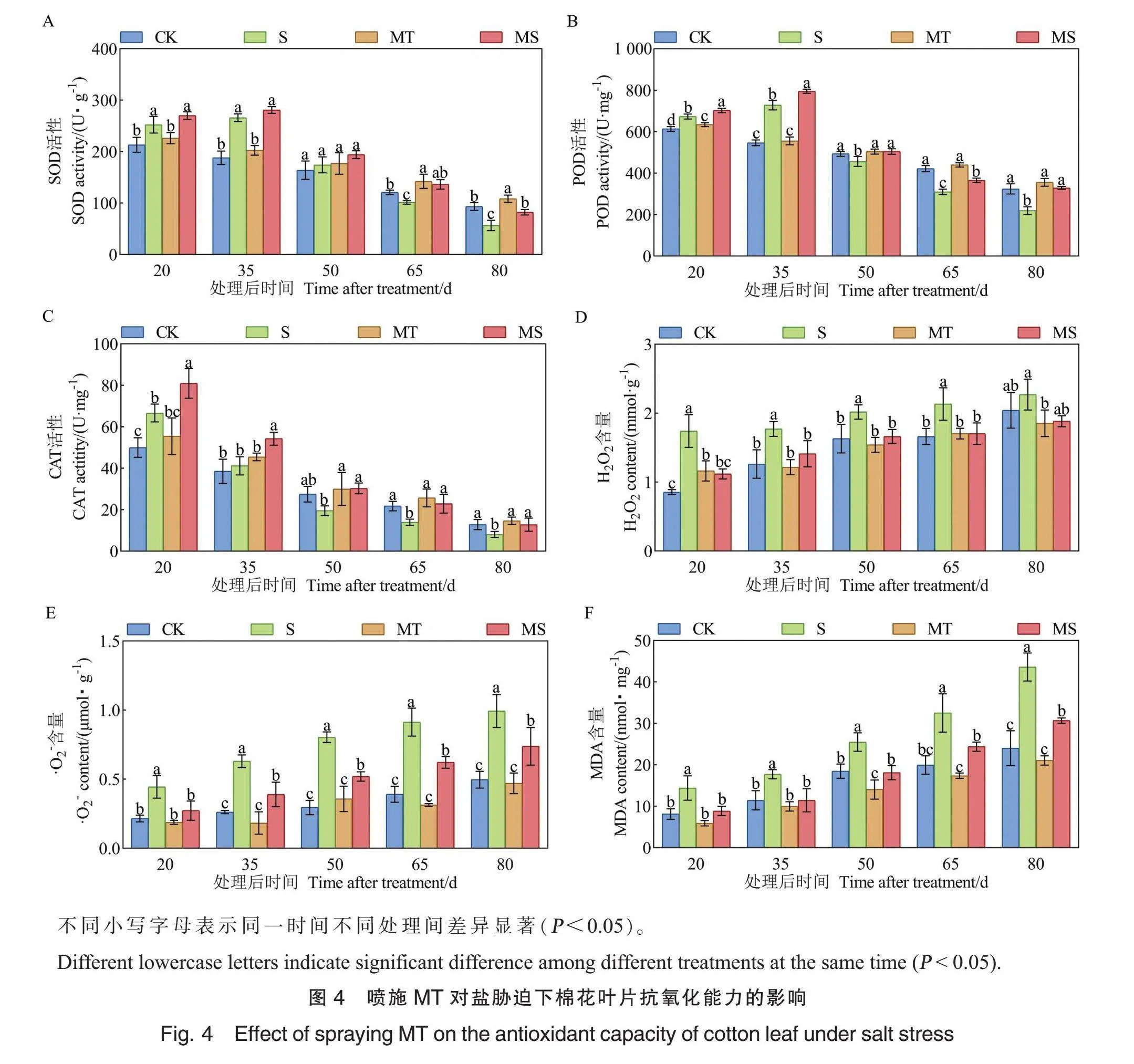
随着生育进程推进,CK、MT处理下棉花叶片的SOD、POD、CAT活性均呈下降趋势;S和MS处理下,棉花叶片的SOD、POD活性呈先升高后降低趋势,CAT活性呈下降趋势(图4A~C)。与CK处理相比,MT处理提高了棉花叶片的SOD、POD、CAT活性。
与CK处理相比,S处理的SOD活性在盐胁迫处理后20 d、35 d分别显著升高18.25%、41.39%,在盐胁迫后65 d、80 d分别显著降低16.15%、39.44%。与S处理相比,MS处理的SOD活性在盐胁迫后65 d、80 d 分别显著提高34.60%、45.35%(图4A)。
与CK处理相比,S处理的POD活性在盐胁迫处理后20 d、35 d分别显著升高9.84%、33.29%,在50 d、65 d、80 d分别显著降低7.56%、26.62%、32.20%。与S处理相比,MS处理的POD活性在盐胁迫处理后20 d、35 d、50 d、65 d和80 d分别显著提高4.30%、9.15%、10.59%、17.98%和49.77%(图4B)。
与CK处理相比,S处理的CAT活性在盐胁迫处理后20 d显著提高33.35%,在65 d、80 d分别显著降低35.96%、37.13%。与S处理相比,MS处理的CAT活性在盐胁迫处理后20 d、35 d、50 d、65 d和80 d分别显著提高21.43%、31.79%、55.01%、63.87%和58.28%(图4C)。
以上结果表明,正常情况下外源MT可提高棉花叶片抗氧化酶活性,而盐胁迫下喷施MT能有效提高棉花叶片抗氧化酶活性。
2.6 外源MT对盐胁迫下棉花ROS及MDA含量的影响
随着生育进程推进,4个处理下棉花叶片的H2O2、超氧阴离子、MDA含量均呈逐渐增加或波动增加趋势(图4D~F)。
与CK处理相比,MT处理的棉花叶片H2O2含量在盐胁迫处理后20 d显著升高,其余时间无显著差异。在盐胁迫处理后20 d、35 d、50 d和65 d,S处理的棉花叶片H2O2含量分别比CK处理显著增加103.60%、40.38%、23.69%和28.39%。与S处理相比,在盐胁迫处理后20 d、35 d、50 d和65 d,MS处理的棉花叶片H2O2含量分别显著降低35.76%、20.27%、17.63%和20.19%(图4D)。
与CK处理相比,在盐胁迫处理后20 d、35 d、50 d、65 d和80 d,MT处理的棉花叶片超氧阴离子含量无显著变化;S处理下棉花叶片的超氧阴离子含量分别显著增加106.45%、140.40%、172.35%、133.78%和100.12%。MS处理的棉花叶片超氧阴离子含量较S处理分别显著降低38.67%、38.29%、35.42%、31.94%和25.70%(图4E)。
与CK处理相比,MT处理的棉花叶片MDA含量在盐胁迫处理后50 d显著降低,其余时间无显著差异。在盐胁迫处理后20 d、35 d、50 d、65 d和80 d,S处理的棉花叶片MDA含量比CK处理分别显著升高77.27%、54.84%、38.00%、62.96%和81.54%;MS处理的棉花叶片MDA含量比S处理分别显著降低38.46%、35.42%、28.99%、25.00%和29.66%(图4F)。
以上结果表明,盐胁迫显著增加棉花叶片H2O2、超氧阴离子和MDA含量,盐胁迫下喷施MT显著降低棉花叶片的H2O2、超氧阴离子和MDA含量,但在正常情况下喷施MT的效果并不显著。
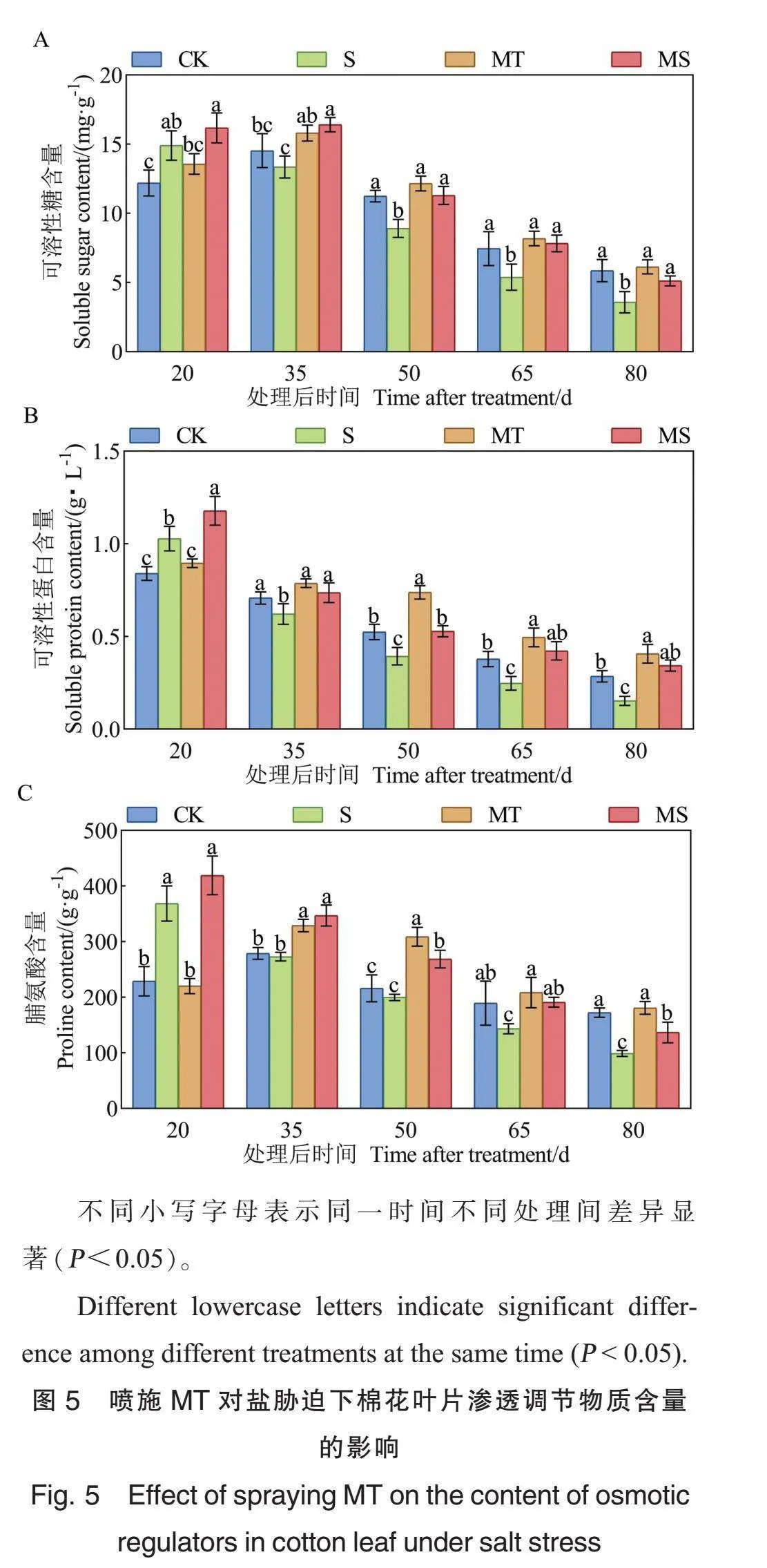
2.7 外源MT对盐胁迫下棉花渗透调节物质含量的影响
随着生育进程推进,S处理下棉花叶片可溶性糖含量呈下降趋势,其余处理下棉花叶片的可溶性糖含量均呈现先上升后降低的变化趋势。与CK处理相比,MT处理增加了棉花叶片可溶性糖含量,但差异并不显著。盐胁迫处理后20 d,S处理的棉花叶片可溶性糖含量比CK处理显著增加22.24%;盐胁迫处理后50 d、65 d和80 d,S处理的叶片可溶性糖含量分别比CK处理显著降低20.75%、27.77%和38.99%。盐胁迫处理后35 d、50 d、65 d和80 d,MS处理的叶片可溶性糖含量分别比S处理显著增加22.89%、26.79%、45.48%和43.09%(图5A)。
不同处理下的棉花叶片可溶性蛋白含量均随生育进程推进呈下降趋势。与CK处理相比,MT处理的叶片可溶性蛋白含量在盐胁迫处理后50 d、65 d和80 d分别显著增加40.93%、30.99%和42.64%; S处理的叶片可溶性蛋白含量在盐胁迫处理后20 d显著增加22.37%,在盐胁迫处理后35 d、50 d、65 d和80 d分别显著降低12.19%、24.89%、34.50%和46.51%。在盐胁迫处理后20 d、35 d、50 d、65 d和80 d,MS处理的叶片可溶性蛋白含量比S处理分别显著增加14.62%、18.51%、34.27%、70.53%和124.64%(图5B)。
随着生育进程推进,CK和MT处理的棉花叶片脯氨酸含量呈先上升后降低趋势,S和MS处理的棉花叶片脯氨酸含量呈降低趋势。与CK处理相比,MT处理增加了棉花叶片脯氨酸含量(盐胁迫处理后20 d除外);S处理下的叶片脯氨酸含量在盐胁迫处理后20 d显著增加61.01%,在盐胁迫处理后65 d、80 d分别显著降低24.25%、42.65%。与S处理相比,在盐胁迫处理后35 d、50 d、65 d和80 d,MS处理下的棉花叶片脯氨酸含量分别显著增加27.10%、34.49%、33.16%和38.39%(图5C)。
综上所述,在盐胁迫初期,棉花叶片的可溶性糖、可溶性蛋白和脯氨酸含量上升,但长期盐胁迫导致其含量明显下降,盐胁迫条件下喷施MT能显著增加棉花叶片的渗透调节物质含量。
2.8 棉花生长及生理生化指标之间的相关分析
地上部干物质质量与株高、茎粗、叶面积、SPAD值、地上部鲜物质质量、地下部鲜物质质量、地下部干物质质量、SOD活性、POD活性、CAT活性、可溶性糖含量、可溶性蛋白含量、脯氨酸含量均呈显著正相关关系。地下部干物质质量与株高、茎粗、叶面积、SPAD值、地上部鲜物质质量、地下部鲜物质质量、SOD活性、CAT活性、可溶性糖含量、脯氨酸含量均呈显著正相关关系。棉株地上部干物质质量和地下部干物质质量均与超氧阴离子含量、MDA含量呈显著负相关关系。SOD、POD和CAT的活性均与超氧阴离子含量、MDA含量显著负相关。超氧阴离子含量与MDA含量显著正相关(图6)。
3 讨论
3.1 MT对盐胁迫下棉花生长的调控效应
盐胁迫抑制植物生长发育[22]。盐胁迫下,小麦叶片中叶绿素的积累受到抑制,根长和株高显著降低[23-25]。盐胁迫下棉花幼苗的株高、叶面积、生物量显著降低,而喷施MT可显著提高株高、叶面积和生物量[7, 18]。本研究结果表明,在土壤盐含量为0.3%的胁迫条件下,棉花的株高、茎粗、叶面积、叶片SPAD值、地上部鲜物质质量、地下部鲜物质质量、地上部干物质质量和地下部干物质质量均显著降低,经过MT处理后棉花的株高、茎粗、叶面积、SPAD值、地上部鲜物质质量、地下部鲜物质质量和地上部干物质质量显著增加,但仍低于对照处理;在正常条件下喷施MT也可增加棉花的株高、茎粗、叶面积、SPAD值、地上部鲜物质质量、地下部鲜物质质量、地上部干物质质量和地下部干物质质量。表明在盐胁迫条件下,棉花生长受到明显抑制,正常条件和盐胁迫下MT处理均能促进棉花的生长,但并未使盐胁迫下的棉花生长状态恢复到正常环境的水平[7]。
根冠比能够反映植物地上部与地下部的生物量分配。盐胁迫下,花楸、平欧杂种榛的根冠比显著高于对照处理[26-27]。本研究结果表明,盐胁迫显著提高了棉花的根冠比,说明盐胁迫增加了地下部生物量的占比,可能利于增强棉株对水分和营养物质的吸收能力。而盐胁迫下喷施MT显著降低棉花根冠比,说明MT可明显促进棉花地上部发育,缓解盐胁迫对棉花生长发育的影响。
3.2 MT对盐胁迫下棉花抗氧化能力的调控效应
在正常情况下,ROS的产生和清除系统是保持稳态平衡的,高浓度的盐胁迫会打破这种稳态平衡,导致体内超氧阴离子和MDA累积,影响植物的生长发育[28]。在逆境胁迫下为了清除体内过量的ROS,植物会提高SOD、POD、CAT等抗氧化酶的活性[29]。研究表明,盐胁迫增加了黄瓜、甜菜体内超氧阴离子、H2O2和MDA含量,MT处理显著提高了SOD、POD、CAT活性,进而降低了超氧阴离子、H2O2和MDA含量[12, 30]。本研究发现,棉花叶片的SOD、POD和CAT活性在盐胁迫处理前期显著增加,后期逐渐降低;随时间延长,超氧阴离子、H2O2和MDA的含量明显增加,这可能是由于盐胁迫会激活植物体内的抗氧化系统使抗氧化酶活性提高,但长时间胁迫导致抗氧化酶活性降低,超氧阴离子、H2O2过量积累[31]。盐胁迫下,喷施MT后,棉花叶片的SOD、POD和CAT活性显著升高,超氧阴离子、H2O2和MDA含量显著降低,表明MT可通过增强抗氧化酶防御系统活性缓解氧化损伤。此外,本研究发现,正常条件下喷施MT后棉花叶片的SOD、POD、CAT活性升高,但无显著差异(胁迫后65 d和80 d的SOD活性以及胁迫后20 d的POD活性除外),表明正常情况下喷施MT对棉花叶片抗氧化酶活性无明显影响[5]。
3.3 MT对盐胁迫下棉花渗透调节物质含量的调控效应
在逆境条件下,植物会通过增加渗透调节物质的含量来提升细胞的渗透压,从而增强植物对不利环境的适应能力[32-33]。较低的盐浓度会导致植物体内可溶性糖、可溶性蛋白和脯氨酸含量升高,但长时间盐胁迫会导致渗透调节物质含量降低[18, 30]。盐胁迫处理导致玉米幼苗可溶性糖含量显著增加,MT处理可促进可溶性糖积累[8, 34]。盐胁迫下,裸燕麦中可溶性蛋白含量降低,脯氨酸含量增加;MT处理可显著增加可溶性蛋白、脯氨酸含量[35]。本研究结果表明,棉花叶片的可溶性糖、可溶性蛋白和脯氨酸含量在盐胁迫处理后20 d显著高于对照,之后逐渐降低,这可能是由于长时间盐胁迫导致大量ROS累积,影响渗透调节物质的合成途径并促进渗透调节物质降解,导致其含量降低;盐胁迫下,喷施MT能显著提高棉花叶片的可溶性糖、可溶性蛋白和脯氨酸含量。上述结果表明盐胁迫下喷施MT可促进棉花体内渗透调节物质积累,减轻渗透胁迫对棉花造成的损伤[8, 35]。
此外,相关分析表明,棉花地上部鲜物质质量、地上部干物质质量与株高、茎粗、叶面积、SPAD值、地下部鲜物质质量、地下部干物质质量、抗氧化酶(SOD、POD、CAT)活性、渗透调节物质(可溶性糖、可溶性蛋白、脯氨酸)含量均呈显著正相关关系,而与超氧阴离子含量、MDA含量呈显著负相关关系。表明外源MT通过增强抗氧化酶活性,提高渗透调节物质含量,降低超氧阴离子含量和MDA含量,促进棉花生物量积累和生长发育。这与前人的研究结果相符[36]。
4 结论
土壤含盐量为0.3%的胁迫处理显著影响棉花的生长发育,降低棉花的株高、茎粗、叶面积、SPAD值、单株生物量和叶片抗氧化酶(SOD、POD、CAT)活性,提高叶片H2O2、超氧阴离子和MDA含量,降低渗透调节物质(可溶性糖、可溶性蛋白、脯氨酸)含量。盐胁迫下喷施200 μmol·L-1 MT能够显著提高棉花的株高、茎粗、叶面积、SPAD值及单株生物量,提高叶片抗氧化酶活性,显著降低叶片H2O2、超氧阴离子和MDA含量,显著提高渗透调节物质含量,从而促进棉花生长,增强棉株的耐盐性。
参考文献:
[1] Yang Y Q, Guo Y. Unraveling salt stress signaling in plants[J/OL]. Journal of Integrative Plant Biology, 2018, 60(9): 796-
804[2024-07-06]. https://doi.org/10.1111/jipb.12689.
[2] Zhao S S, Zhang Q K, Liu M Y, et al. Regulation of plant responses to salt stress[J/OL]. International Journal of Molecular Sciences, 2021, 22(9): 4609[2024-07-06]. https://doi.org/10.3390/
ijms22094609.
[3] Zhang Q, Liu Y Q, Jiang Y L, et al. OsASR6 enhances salt stress tolerance in rice[J/OL]. International Journal of Molecular Sciences, 2022, 23(16): 9340[2024-07-06]. https://doi.org/10.3390/ijms23169340.
[4] Gong Z Z. Plant abiotic stress: new insights into the factors that activate and modulate plant responses[J/OL]. Journal of Integrative Plant Biology, 2021, 63(3): 429-430[2024-07-06]. https://
doi.org/10.1111/jipb.13079.
[5] 陈莉, 刘连涛, 马彤彤, 等. 褪黑素对盐胁迫下棉花种子抗氧化酶活性及萌发的影响[J/OL]. 棉花学报, 2019, 31(5): 438-447[2024-07-06]. https://doi.org/10.11963/1002-7807.cllcd.20190905.
Chen Li, Liu Liantao, Ma Tongtong, et al. Effects of melatonin on the antioxidant enzyme activities and seed germination of cotton (Gossypium hirsutum L.) under salt-stress conditions[J/OL]. Cotton Science, 2019, 31(5): 438-447[2024-07-06]. https://doi.org/10.11963/1002-7807.cllcd.20190905.
[6] Arif Y, Singh P, Siddiqui H, et al. Salinity induced physiological and biochemical changes in plants: an omic approach towards salt stress tolerance[J/OL]. Plant Physiology and Biochemistry, 2020, 156: 64-77[2024-07-06]. https://doi.org/10.1016/j.plaphy.2020.08.042.
[7] Jiang D, Lu B, Liu L T, et al. Exogenous melatonin improves salt stress adaptation of cotton seedlings by regulating active oxygen metabolism[J/OL]. PeerJ, 2020, 8: e10486[2024-07-06]. https://
doi.org/10.7717/peerj.10486.
[8] Chen Y E, Mao J J, Sun L Q, et al. Exogenous melatonin enhances salt stress tolerance in maize seedlings by improving antioxidant and photosynthetic capacity[J/OL]. Physiologia Plantarum, 2018, 164(3): 349-363[2024-07-06]. https://doi.org/10.1111/ppl.12737.
[9] 陈明媛, 张淑英, 王梦柯, 等. 外源硫化氢对NaCl胁迫下棉花幼苗抗逆生理特性的影响[J/OL]. 干旱地区农业研究, 2021, 39(2): 55-61[2024-07-06]. https://doi.org/10.7606/j.issn.1000-
7601.2021.02.08.
Chen Mingyuan, Zhang Shuying, Wang Mengke, et al. Effects of exogenous hydrogen sulfide on stress resistance physiological characteristics of cotton seedlings under NaCl stress[J/OL]. Agricultural Research in the Arid Areas, 2021, 39(2): 55-61[2024-07-
06]. https://doi.org/10.7606/j.issn.1000-7601.2021.02.08.
[10] Birhanie Z M, Yang D, Luan M, et al. Salt stress induces changes in physiological characteristics, bioactive constituents, and antioxidants in kenaf (Hibiscus cannabinus L.) [J/OL]. Antioxidants, 2022, 11(10): 2005[2024-07-06]. https://doi.org/10.3390/antiox11102005.
[11] Yan F Y, Wei H M, Ding Y F, et al. Melatonin regulates anti-
oxidant strategy in response to continuous salt stress in rice seedlings[J/OL]. Plant Physiology and Biochemistry, 2021, 165: 239-250[2024-07-06]. https://doi.org/10.1016/j.plaphy.2021.05.003.
[12] Zhang T G, Shi Z F, Zhang X H, et al. Alleviating effects of exogenous melatonin on salt stress in cucumber[J/OL]. Scientia Horticulturae, 2020, 262: 109070[2024-07-06]. https://doi.org/
10.1016/j.scienta.2019.109070.
[13] 齐琪, 马书荣, 徐维东. 盐胁迫对植物生长的影响及耐盐生理机制研究进展[J/OL]. 分子植物育种, 2020, 18(8): 2741-2746[2024-07-06]. https://doi.org/10.13271/j.mpb.018.002741.
Qi Qi, Ma Shurong, Xu Weidong. Advances in the effects of salt stress on plant growth and physiological mechanisms of salt tolerance[J/OL]. Molecular Plant Breeding, 2020, 18(8): 2741-
2746[2024-07-06]. https://doi.org/10.13271/j.mpb.018.002741.
[14] Wang Y X, Zhao L M, Feng N J, et al. Plant growth regulators mitigate oxidative damage to rice seedling roots by NaCl stress[J/OL]. PeerJ, 2024, 12: e17068[2024-07-06]. https://doi.org/
10.7717/peerj.17068.
[15] Jiang D, Lu B, Liu L T, et al. Exogenous melatonin improves the salt tolerance of cotton by removing active oxygen and protecting photosynthetic organs[J/OL]. BMC Plant Biology, 2021, 21(1): 331[2024-07-06]. https://doi.org/10.1186/s12870-
021-03082-7.
[16] 马鑫颖, 宋晨, 孟妍君, 等. 外源褪黑素对镉胁迫下棉花种子萌发、抗氧化酶活性及渗透调节物质含量的影响[J/OL]. 棉花学报, 2023, 35(4): 313-324[2024-07-06]. https://doi.org/10.11963/cs20230021.
Ma Xinying, Song Chen, Meng Yanjun, et al. Effects of exogenous melatonin on germination, antioxidant enzymes activity, and osmotic adjustment substance content of cotton seed under cadmium stress[J/OL]. Cotton Science, 2023, 35(4): 313-324[2024-07-06]. https://doi.org/10.11963/cs20230021.
[17] Khan A, Numan M, Khan A L, et al. Melatonin: awakening the defense mechanisms during plant oxidative stress[J/OL]. Plants, 2020, 9(4): 407[2024-07-06]. https://doi.org/10.3390/plants
9040407.
[18] Duan W J, Lu B, Liu L T, et al. Effects of exogenous melatonin on root physiology, transcriptome and metabolome of cotton seedlings under salt stress[J/OL]. International Journal of Molecular Sciences, 2022, 23(16): 9456[2024-07-06]. https://
doi.org/10.3390/ijms23169456.
[19] 孙文君. 低温和盐碱胁迫下棉花幼苗对外源褪黑素的生理响应[D]. 阿拉尔: 塔里木大学, 2021.
Sun Wenjun. Physiological responses of cotton seedlings to exogenous melatonin under low temperature and salt-alkaline stress[D]. Aral: Tarim University, 2021.
[20] Shen J, Chen D D, Zhang X P, et al. Mitigation of salt stress response in upland cotton (Gossypium hirsutum) by exogenous melatonin[J/OL]. Journal of Plant Research, 2021, 134(4): 857-
871[2024-07-06]. https://doi.org/10.1007/s10265-021-01284-6.
[21] Chen L, Lu B, Liu L T, et al. Melatonin promotes seed germination under salt stress by regulating ABA and GA3 in cotton (Gossypium hirsutum L.) [J/OL]. Plant Physiology and Biochemistry, 2021, 162: 506-516[2024-07-06]. https://doi.org/10.1016/j.plaphy.2021.03.029.
[22] 王龙, 李静, 钱晨, 等. 盐胁迫对油菜生理特征和菜籽产量品质的影响[J/OL]. 作物学报, 2024, 50(6): 1597-1607[2024-07-
06]. https://doi.org/10.3724/SP.J.1006.2024.34137.
Wang Long, Li Jing, Qian Chen, et al. Effects of salt stress on yield, quality, and physiology in rapeseed[J/OL]. Acta Agronomica Sinica, 2024, 50(6): 1597-1607[2024-07-06]. https://doi.
org/10.3724/SP.J.1006.2024.34137.
[23] Shah F A, Ni J, Tang C G, et al. Karrikinolide alleviates salt stress in wheat by regulating the redox and K+/Na+ homeostasis[J/OL]. Plant Physiology and Biochemistry, 2021, 167: 921-933[2024-07-06]. https://doi.org/10.1016/j.plaphy.2021.09.023.
[24] 李双, 王爱英, 焦浈, 等. 盐胁迫下不同抗性小麦幼苗生理生化特性及转录组分析[J/OL]. 中国农业科技导报, 2024, 26(2): 20-32[2024-07-06]. https://doi.org/10.13304/j.nykjdb.2022.
0679.
Li Shuang, Wang Aiying, Jiao Zhen, et al. Physiological and chemical characteristics and transcriptome analysis of different type of wheat seedlings under salt stress[J/OL]. Journal of Agricultural Science and Technology, 2024, 26(2): 20-32[2024-07-
06]. https://doi.org/10.13304/j.nykjdb.2022.0679.
[25] Fu Y Y, Li P H, Si Z Y, et al. Seeds priming with melatonin improves root hydraulic conductivity of wheat varieties under drought, salinity, and combined stress[J/OL]. International Journal of Molecular Sciences, 2024, 25(9): 5055[2024-07-06]. https://doi.org/10.3390/ijms25095055.
[26] 黄荣雁, 路程伟, 许嵘, 等. 盐碱胁迫对‘冬红’花楸生长、生理及光合特性的影响[J/OL]. 草地学报, 2024, 32(2): 480-488[2024-07-06]. https://doi.org/10.11733/j.issn.1007-0435.2024.
02.015.
Huang Rongyan, Lu Chengwei, Xu Rong, et al. Effects of saline-alkali stress on growth, physiology and photosynthetic characteristics of Sorbus sibirica 'DongHong'[J/OL]. Acta Agrestia Sinica, 2024, 32(2): 480-488[2024-07-06]. https://doi.org/10.11733/j.issn.1007-0435.2024.02.015.
[27] 罗达, 史彦江, 宋锋惠, 等. 盐胁迫对平欧杂种榛幼苗生长、光合荧光特性及根系构型的影响[J/OL]. 应用生态学报, 2019, 30(10): 3376-3384[2024-07-06]. https://doi.org/10.13287/j.
1001-9332.201910.001.
Luo Da, Shi Yanjiang, Song Fenghui, et al. Effects of salt stress on growth, photosynthetic and fluorescence characteristics, and root architecture of Corylus heterophylla × C. avellan seedlings[J/OL]. Chinese Journal of Applied Ecology, 2019, 30(10): 3376-3384[2024-07-06]. https://doi.org/10.13287/j.1001-9332.
201910.001.
[28] Cen H F, Wang T T, Liu H Y, et al. Melatonin application improves salt tolerance of alfalfa (Medicago sativa L.) by enhancing antioxidant capacity[J/OL]. Plants, 2020, 9(2): 220[2024-07-06]. https://doi.org/10.3390/plants9020220.
[29] Hasanuzzaman M, Parvin K, Bardhan K, et al. Biostimulants for the regulation of reactive oxygen species metabolism in plants under abiotic stress[J/OL]. Cells, 2021, 10(10): 2537[2024-07-
06]. https://doi.org/10.3390/cells10102537.
[30] Zhang P F, Liu L, Wang X, et al. Beneficial effects of exogenous melatonin on overcoming salt stress in sugar beets (Beta vulgaris L.)[J/OL]. Plants, 2021, 10(5): 886[2024-07-06]. https://
doi.org/10.3390/plants10050886.
[31] Laxa M, Liebthal M, Telman W, et al. The role of the plant antioxidant system in drought tolerance[J/OL]. Antioxidants, 2019, 8(4): 94[2024-07-06]. https://doi.org/10.3390/antiox
8040094.
[32] Yancey P H. Organic osmolytes as compatible, metabolic and counteracting cytoprotectants in high osmolarity and other stresses[J/OL]. Journal of Experimental Biology, 2005, 208(15): 2819-2830[2024-07-06]. https://doi.org/10.1242/jeb.01730.
[33] Inayat H, Mehmood H, Danish S, et al. Impact of cobalt and proline foliar application for alleviation of salinity stress in radish[J/OL]. BMC Plant Biology, 2024, 24: 287[2024-07-06]. https://doi.org/10.1186/s12870-024-04998-6.
[34] Li Z G, Xu Y, Bai L K, et al. Melatonin enhances thermotole-
rance of maize seedlings (Zea mays L.) by modulating anti-
oxidant defense, methylglyoxal detoxification, and osmoregulation systems[J/OL]. Protoplasma, 2019, 256(2): 471-490[2024-07-06]. https://doi.org/10.1007/s00709-018-1311-4.
[35] Gao W Y, Feng Z, Bai Q Q, et al. Melatonin-mediated regulation of growth and antioxidant capacity in salt-tolerant naked oat under salt stress[J/OL]. International Journal of Molecular Sciences, 2019, 20(5): 1176[2024-07-06]. https://doi.org/10.3390/ijms20051176.
[36] 段文静, 孟妍君, 江丹, 等. 外源褪黑素对盐胁迫下棉花幼苗形态及抗氧化系统的影响[J/OL]. 中国生态农业学报(中英文), 2022, 30(1): 92-104[2024-07-06]. https://doi.org/10.12357/cjea.20210411.
Duan Wenjing, Meng Yanjun, Jiang Dan, et al. Effects of exogenous melatonin on the morphology and antioxidant enzyme activities of cotton seedlings under salt stress[J/OL]. Chinese Journal of Eco-Agriculture, 2022, 30(1): 92-104[2024-
07-06]. https://doi.org/10.12357/cjea.20210411.
(责任编辑:王小璐" " 责任校对:王国鑫)

