龟纹瓢虫酪氨酸脱羧酶基因鉴定及其在卵黄沉积中功能初探


摘要:【目的】明确龟纹瓢虫(Propylea japonica)酪氨酸脱羧酶(tyrosine decarboxylase, TDC)基因的结构特征、分子特性和表达情况,探明其作为章鱼胺关键合成酶基因在瓢虫生殖发育中的调控作用。【方法】通过生物信息学软件分析鉴定了龟纹瓢虫PjTDC1~4基因及其结构特征,选择其中PjTDC1基因,采用聚合酶链式反应(polymerase chain reaction, PCR)、实时定量聚合酶链式反应(quantitative real-time PCR, qRT-PCR)和RNA干扰(RNA interference, RNAi)技术,探索了PjTDC1基因在不同组织和不同发育时期的表达模式及其在龟纹瓢虫中的功能。【结果】生物信息学分析表明,龟纹瓢虫中存在4个TDC基因,并命名为PjTDC1~4。4个龟纹瓢虫TDC蛋白均有PLN02880结构域。 PjTDC1基因开放阅读框共1 728 bp,编码 575 个氨基酸残基。龟纹瓢虫PjTDC1蛋白与甘薯小象甲(Cylas formicarius)的TDC蛋白有最高的同源性。PjTDC1基因在龟纹瓢虫不同发育阶段均有表达,在幼虫期和羽化1~7 d的雌虫中的表达量均逐渐降低,其中在1龄幼虫中表达量最高,在卵期、4龄幼虫及7日龄雌成虫中表达量较低。PjTDC1基因在不同组织中均有表达,但主要在卵巢、背部表皮和头部中有较高的表达量。RNAi试验结果显示,PjTDC1基因沉默抑制龟纹瓢虫卵母细胞中卵黄沉积,除此之外,在双链RNA注射后的第1天和第3天,处理组初级卵母细胞宽度显著小于对照组卵母细胞宽度,分别降低10.03%和18.60%。【结论】明确了龟纹瓢虫TDC基因的基本结构特征,以及PjTDC1在龟纹瓢虫不同发育阶段和不同组织的时空表达模式,明确了其在龟纹瓢虫卵母细胞的卵黄沉积过程中的正向调控作用,可为进一步解决龟纹瓢虫大规模人工扩繁难题提供理论依据。
关键词:龟纹瓢虫;酪氨酸脱酸酶;PjTDC1;章鱼胺;时空表达;生殖发育;RNA干扰
Identification and preliminary function exploration of tyrosine decarboxylase gene in vitellogenin deposits of Propylea japonica
Tang Zhijuan1, 2, Zhu Xiangzhen2, Zhang Kaixin2, Li Dongyang2, Ji Jichao2, Gao Xueke2, Luo Junyu2, Cui Jinjie2, Wang Li2*, Huangfu Ningbo2*, Chen Zhaorong1*
(1. College of Horticulture and Landscape Architecture, Tianjin Agricultural University, Tianjin 300392, China; 2. Institute of Cotton Research, Chinese Academy of Agricultural Sciences/State Key Laboratory of Cotton Bio-breeding and Integrated Utilization, Anyang, Henan 455000, China)
Abstract: [Objective] The aim of this study is to analyze the structural and molecular characteristics of Propylea japonica tyrosine decarboxylase (TDC) genes, and their expression pattern and to explore their regulatory role as a key octopamine synthetase gene in the reproductive development of ladybird beetle. [Methods] Four PjTDC genes and their basic structural characteristics were identified by bioinformatics software. PjTDC1 gene was cloned by polymerase chain reaction. The expression pattern of PjTDC1 gene in different tissues and at different developmental stages were investigated by quantitative real-time polymerase chain reaction. And the function of PjTDC1 gene in P. japonica were studied by RNA interference techniques. [Results] There were four TDC genes in the P. japonica, which were named PjTDC1-4. All the TDC proteins of P. japonica have PLN02880 domain, and PjTDC1 gene has an open reading frame of 1 728 bp, encoding 575 amino acid residues. PjTDC1 protein has the highest homology with the TDC protein of Cylas formicarius. PjTDC1 gene was expressed in P. japonica at different developmental stages, with the highest expression level in the 1st instar larvae but lower expression level in the egg stage larvae, the 4th instar larvae, and 7-day-old female adults. Generally speaking, the expression level of PjTDC1 decreased gradually at larval stages and in the adults after eclosion for 1 to 7 days. PjTDC1 gene is also expressed in different tissues, but it is mainly expressed in the ovaries, dorsal cuticula and head of the 5-day-old female adults. The results of RNA interference experiment showed that silencing of PjTDC1 gene inhibited the deposition of vitellogenin in the oocytes of P. japonica. In addition, on the 1st and 3rd day after injection of double strand RNA, the width of primary oocytes in the treatment group was significantly 10.03% and 18.60% lower than that in the control group. These results suggest that PjTDC1, as a key gene for octopamine synthesis, also plays an important regulatory role in the reproductive development of P. japonica. [Conclusion] In this study, the basic structural features of PjTDC genes and the spatial and temporal expression pattern of PjTDC1 at different developmental stages and in different tissues of P. japonica were studied, and its positive regulatory role in the process of vitellogenin deposits in the oocytes of P. japonica were clarified, which will provide theoretical basis for further solving the problem of large-scale artificial propagation of P. japonica.
Keywords: Propylea japonica; tyrosine decarboxylase; PjTDC; octopamine; spatio-temporal expression pattern; reproductive development; RNA interference
龟纹瓢虫(Propylea japonica)是我国最重要的捕食性天敌昆虫之一,属鞘翅目(Coleoptera)瓢虫科(Coccinellidae),广泛分布在我国北方和南方大多数地区的农田生态系统中[1-2]。龟纹瓢虫具有生命周期长、产卵量大、耐高温干旱、喜高湿等特点,因此在我国多数农田农业生态系统中占据绝对优势,并逐渐成为我国温室瓜果、蔬菜产业以及景观园林作物等高附加值农业生产中生物防治的重要天敌[3-5]。龟纹瓢虫幼虫和成虫均以蚜虫、叶蝉、飞虱、鳞翅目昆虫的卵和低龄幼虫为食,喜食蚜虫,是蚜虫的天然“克星”[6-8]。但目前在人工饲料饲养条件下,龟纹瓢虫存在卵巢发育慢,产卵前期延长,产卵量少,卵孵化率低等问题[9-11]。因此,了解龟纹瓢虫的生殖调控机理,明确影响其生殖发育的关键因子是解决当前其大规模扩繁困难的关键。
章鱼胺(octopamine, OA)是在无脊椎动物中广泛存在的1种神经递质,最早发现是在章鱼(Octopus vulgaris)唾液腺中,其结构和功能类似于脊椎动物的去甲状腺类激素[12-13]。在昆虫中,OA的生物合成主要以酪氨酸(tyrosine, Tyr)为底物,在酪氨酸脱羧酶(tyrosine decarboxylase, TDC)的催化下发生脱羧反应生成酪胺(tyramine, TA),接着在酪胺β-羟化酶(tyramine β-hydroxylase, Tβh)的作用下发生羟化反应而最终合成[13-14]。目前在昆虫中的研究表明,OA作为1种神经递质分子主要参与下列生命活动:调节昆虫的运动、记忆、取食、神经信号的传导;调节昆虫的脂类和碳代谢;调节昆虫生殖发育等多种生理功能。例如,给蜜蜂、蟑螂和苍蝇注射OA,能够显著增加其伸吻反射,从而增加对蔗糖水的吸入[15-18]。近年来的研究表明,OA能够参与调控昆虫交配后的卵巢发育,调节雌虫的交配行为,调控昆虫保幼激素和蜕皮激素合成与分泌,调节卵形成和卵黄的生成,进而影响昆虫的生殖发育[19-22]。
TDC作为OA合成的关键酶,除了直接参与合成OA,在昆虫产卵行为调控中同样起着重要的作用,然而具体的调控机理仍不明确[19]。因此,TDC的相关研究不仅可以为揭示TDC基因本身的重要调控作用提供依据,还可以为研究OA重要生理功能提供方向。本研究基于龟纹瓢虫基因组和转录组测序数据[23],分析龟纹瓢虫和其他昆虫TDC基因的亲缘关系远近,探索了PjTDC1基因在不同组织和不同发育时期的表达模式,初步研究PjTDC1基因在龟纹瓢虫生殖发育中的功能,为进一步研究章鱼胺合成的关键酶在瓢虫生殖发育中的调控作用奠定基础。
1 材料与方法
1.1 试验材料
供试昆虫:本实验最初的龟纹瓢虫种群采自河南安阳的棉田,并在中国农业科学院棉花研究所温室连续纯化饲养多代。龟纹瓢虫于纱网笼(30 cm×30 cm×30 cm)中饲养,笼中放置接有豌豆修尾蚜(Megoura crassicauda)的蚕豆苗,并定期更换生长状况良好的带有豌豆修尾蚜的蚕豆苗。饲养条件为光照时间14 h/黑暗时间10 h,温度(25±1)℃,相对湿度(60±5)%。
1.2 总RNA 的提取及cDNA 的合成
使用TRIzol试剂(Invitrogen,美国)并根据操作说明,提取龟纹瓢虫总RNA。采用赛默飞世尔分光光度计NanoDrop 2000和1.4%(质量分数,下同)琼脂糖凝胶电泳检测RNA的质量和完整性。使用翌圣生物科技(上海)股份有限公司的反转录试剂盒Hifair○R" V one-step RT-gDNA digestion SuperMix for qPCR以1.0 μg RNA为模板合成cDNA,并保存于-20 ℃备用。
1.3 基因克隆
在已经公开的龟纹瓢虫基因组数据库(NCBI 登录号: SRR10076377)中通过基因组注释文件关键词检索和同源搜索的方法筛选4个TDC基因(PjTDC1、PjTDC2、PjTDC3、PjTDC4),根据PjTDC1基因序列,利用Primer Premier 6.0软件设计全长引物(表1)用于克隆PjTDC1。以反转录得到的龟纹瓢虫的cDNA为模板利用宝日医生物技术(北京)有限公司的Ex Taq○R" DNA Polymerase进行聚合酶链式反应(polymerase chain reaction, PCR),反应体系:10×Ex Taq Buffer 2.5 μL,dNTP Mix 2.0 μL,Ex Taq 酶0.4 μL,上下游引物各1.0 μL,cDNA 3.0 μL,加入ddH2O补至25 μL。扩增程序为94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 3 min,30个循环;72 ℃ 10 min。使用1.4%琼脂糖凝胶电泳检测PCR扩增产物,选取单一条带进行测序。引物合成和测序均由生工生物工程(上海)公司完成。
1.4 基因及其编码产物的生物信息学分析
在美国国家生物技术信息中心(National Center for Biotechnology Information of USA, NCBI)的ORF finder 网站(https://www.ncbi.nlm.nih.gov/orffinder/)对PjTDC1进行开放阅读框(open reading frame, ORF)分析;使用Expasy在线网站ProtParam(http://web.expasy.org/protparam)分析蛋白质的理化性质;使用在线软件SignalP-4.1(https://services.healthtech.dtu.dk/services/SignalP-4.1/))和TMHMM-2.0(https://services.healthtech.dtu.dk/services/TMHMM-2.0)预测蛋白质的信号肽并分析跨膜区;使用在线网站WoLF PSORT(https://wolfpsort.hgc.jp/)对蛋白质进行亚细胞定位;使用在线软件SOPMA(https://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)分析蛋白的二级结构和预测蛋白三级结构。在NCBI的CDD网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)查找基因功能结构域;在NCBI下载29条TDC同源蛋白的氨基酸序列,利用MEGA 6 软件中的邻接法(neighbor joining)在自展值(bootstrap)1 000次下构建系统发育树,并通过在线工具 iTOL(https://itol.embl.de/itol.cgi)对进化树进行美化。
1.5 双链RNA合成和RNA干扰实验
设计具有T7启动子序列(TAATACGACTCACTATAGGN)的引物T7-dsPjTDC1和T7-
dsGFP(表1),使用T7 RiboMAXTM Express RNAi System试剂盒(Promega,美国)合成PjTDC1的双链RNA(double strand RNA, dsRNA)。RNA干扰实验选用羽化不超过24 h的雌成虫,使用微量注射器在试虫的第3、第4腹节间注射3 μg·μL-1 dsRNA,每头注射0.5 μL,对照组注射相同剂量的dsGFP。试验设3个生物学重复,每个生物学重复12头试虫。注射dsRNA后的龟纹瓢虫用豌豆修尾蚜正常饲养。在注射dsRNA后1 d、2 d和3 d,使用罗氏实时荧光定量仪qRT-PCR LightCycler 480检测干扰效率。选取注射dsRNA后 1 d、3 d、5 d、7 d的龟纹瓢虫,在磷酸缓冲盐溶液(phosphate buffer saline, PBS)里进行活体解剖,采用蔡司体式显微镜SteREO Discovery V8观察卵巢形态并拍照,同时测量卵巢小管长度和初级卵母细胞宽度。实验共设3个生物学重复,每个生物学重复共观察12头试虫卵巢,每个卵巢测量5~8个卵巢小管长度和初级卵母细胞宽度。
1.6 龟纹瓢虫PjTDC1时空表达模式分析
选取龟纹瓢虫卵,1龄、2龄、3龄、4龄幼虫,蛹,羽化第1天、第2天、第3天、第4天、第5天、第7天和第9天的雌性成虫,进行时间表达模式分析。选取羽化第5天的龟纹瓢虫雌成虫头、胸部、肠道、鞘翅、背部表皮和卵巢进行空间表达模式分析。通过Primer Premier 6.0软件设计引物q-PjTDC1(表1)用于实时定量PCR(quantitative real-time PCR, qRT-PCR),使用RPS18作为内参基因[24],并采用2-△△Ct法计算靶标基因的表达水平[25],均设3个生物学重复,4个技术重复。其中:用于时间表达的卵及1龄、2 龄、3 龄幼虫,每个生物学重复样本量均为20头,4龄幼虫、蛹、成虫的样本量为5头;用于组织表达的样品,每个重复为5头。qRT-PCR混合反应体系:模板cDNA 2.0 μL,上下游引物各0.4 μL,2× TransStart○R" Top Green qPCR SuperMix(+Dye Ⅰ)5.0 μL,用超纯水补足至 10 μL。反应条件为94 ℃预变性30 s;94 ℃ 5 s、55 ℃ 15 s、72 ℃ 10 s,40个循环。qRT-PCR试剂购于北京全式金生物技术有限公司。
1.7 数据分析
实验结果采用平均值±标准误表示。采用 t 检验法分析2组样本均值的差异显著性;采用单因素方差分析,采用邓肯氏新复极差法进行多重比较。数据分析和作图采用SPSS 26.0和Graphpad Prism 6软件。图片处理采用 Photoshop 2022和Adobe Illustrator 2020软件。
2 结果与分析
2.1 PjTDC1蛋白的理化性质以及蛋白结构预测分析
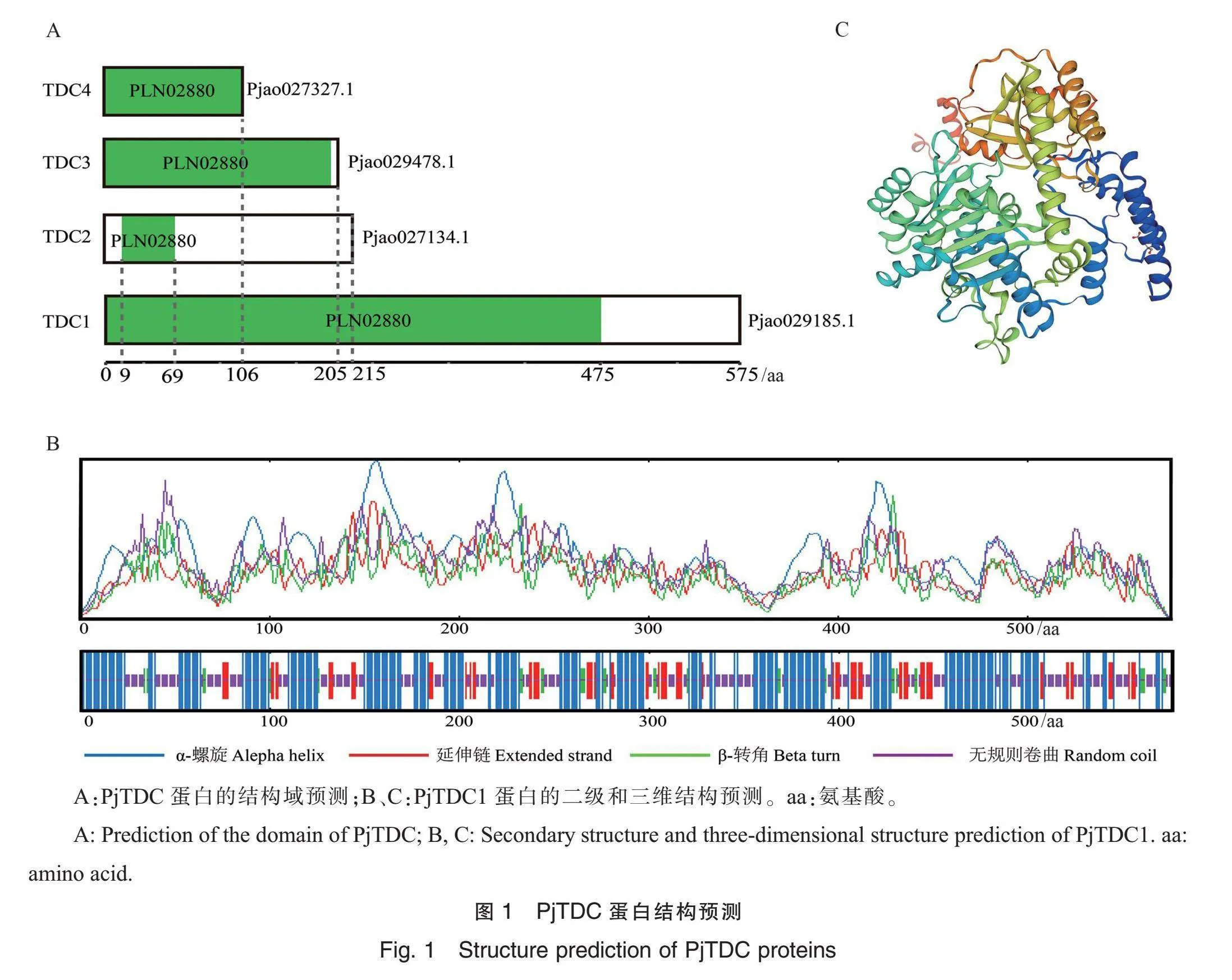
基于龟纹瓢虫的基因组和转录组测序数据,共鉴定到4个龟纹瓢虫TDC基因,并根据氨基酸序列长短依次命名为PjTDC1、PjTDC2、PjTDC3和PjTDC4。这4个PjTDC基因分别编码Pjao029185.1、Pjao027134.1、Pjao029478.1、Pjao-
027327.1,分别包含575、215、205和106个氨基酸残基,均含有与TDC相关的PLN02880结构域,PLN02880结构域分别位于PjTDC1~4蛋白第1~475、9~69、56~203和1~106个氨基酸(图1A)。PLN02880结构域属于磷酸吡哆醛(pyridoxal phosphate, PLP)依赖性酶中的天冬氨酸转氨酶(aspartate aminotransferase, AAT)超家族成员的典型结构域。
PjTDC1基因的ORF长度为1 728 bp,预测PjTDC1蛋白分子量和理论等电点(isoelectirc point, pI)分别为65 074.79 Da和6.17。PjTDC1蛋白的亲水性平均系数为-0.220,是亲水性蛋白。对PjTDC1蛋白进行分析,未发现明显的信号肽切割位点,推测为非分泌蛋白。预测显示,PjTDC1蛋白无跨膜区。亚细胞定位结果显示,PjTDC1蛋白被定位在细胞质中。通过二级结构分析,发现PjTDC1蛋白由α-螺旋、延伸链、β-转角和无规则卷曲结构组成,占比分别为46.96%、14.26%、5.39%、33.39%(图1B)。以白蜡窄吉丁(Agrilus planipennis)的TDC蛋白三级结构为模板(A0A1W4XJ75.1.A)通过同源建模构建龟纹瓢虫PjTDC1蛋白三级结构,PjTDC1蛋白构建三级结构的序列与模板蛋白序列的覆盖度为0.86,序列相似度为73.69%(图1C)。PjTDC1蛋白的三级结构主要由α-螺旋组成,与二级结构预测结果一致。
2.2 TDC基因的系统进化分析
根据龟纹瓢虫与其他物种的TDC蛋白序列构建系统发育树,结果(图 2)显示,龟纹瓢虫PjTDC1蛋白与甘薯小象甲(Cylas formicarius)的XP_060529679.1聚在同一分支,同源性最高;龟纹瓢虫PjTDC2与米象(Sitophilus oryzae)XP_030761693.1亲缘关系最近;PjTDC3与牛犀金龟(Onthophagus taurus)XP_022920893.1亲缘关系最近,有最高的同源性;PjTDC4与白蜡窄吉丁XP_018332420.1亲缘关系最近。4个PjTDC蛋白与马铃薯甲虫(Leptinotarsa decemlineata)XP_023025865.1和小蜂窝甲虫(Aethina tumida)XP _019873389.1亲缘关系较远。
2.3 PjTDC1时空表达模式分析
通过qRT-PCR对PjTDC1基因在龟纹瓢虫不同发育时期(卵、1~4龄幼虫、蛹、雌虫羽化第1、2、3、4、5、7和9天)和雌虫羽化第5天的不同组织(头、胸部、肠道、卵巢、鞘翅、背面表皮)的时空表达模式进行分析,结果显示,PjTDC1在1龄幼虫中的表达水平最高,在卵中的表达量仅为1龄幼虫中表达量的34%,PjTDC1表达水平随着幼虫的发育进程呈现降低的趋势,在4龄幼虫达到最低(图3A)。从4龄幼虫到羽化第1天的雌虫,PjTDC1的表达水平急速上升,且在羽化第1天达到成虫期的峰值。在羽化第1~7天的雌虫中,PjTDC1的表达水平呈现下降趋势,然而在成虫羽化的第9天再次升高(图3A)。从组织表达特异性来看,PjTDC1基因在羽化第5天的雌虫卵巢、背部表皮和头部中的表达量较高,在胸部的表达量相对较低(图3B)。
2.4 PjTDC1基因沉默对生殖发育的影响
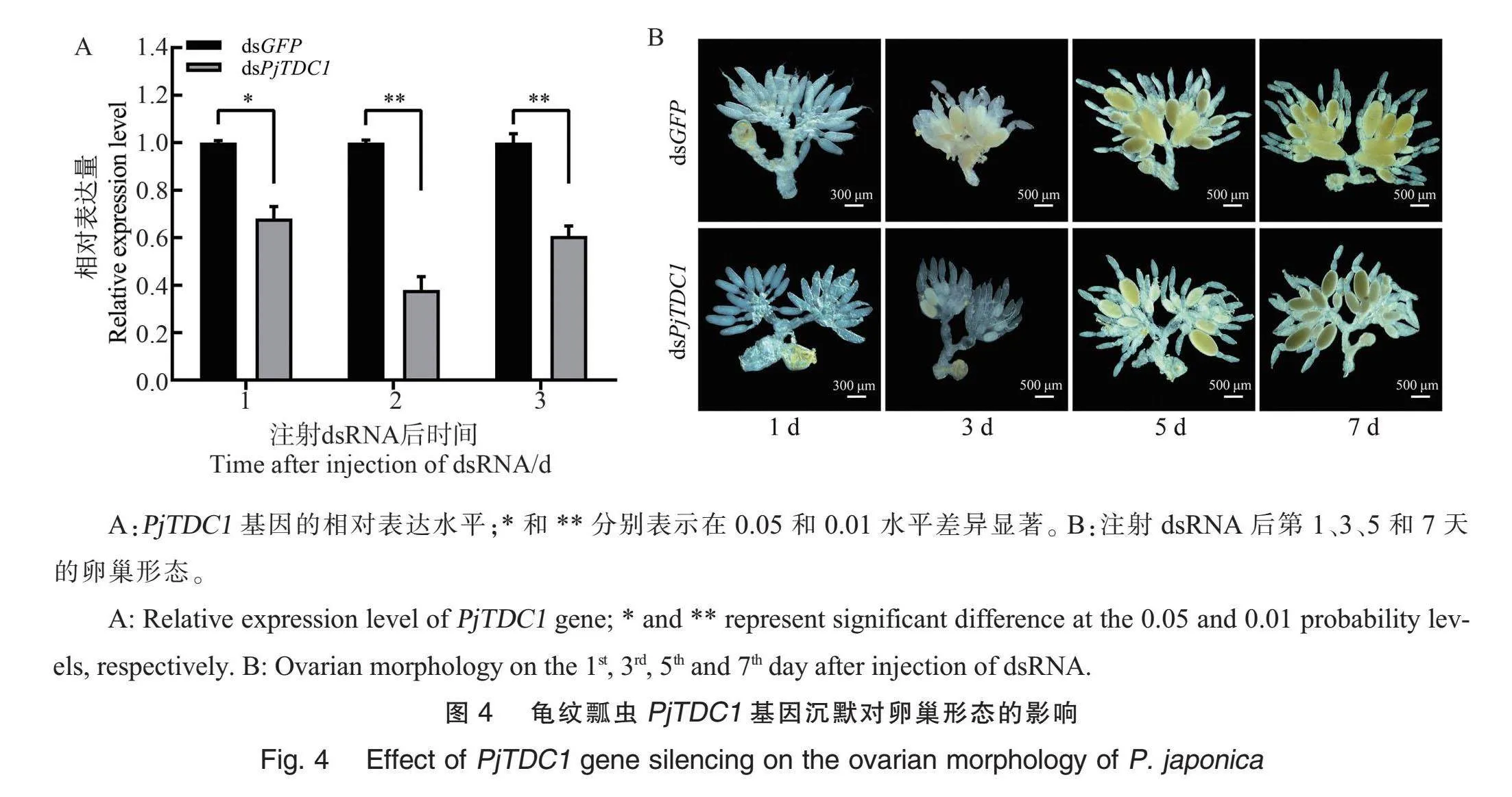
为了进一步探索PjTDC1基因的功能,通过RNAi技术对龟纹瓢虫PjTDC1基因进行敲低。qRT-PCR结果显示,PjTDC1基因的表达水平在注射dsRNA后第1 天与dsGFP对照组相比显著下降31.98%,第2 天显著下降62.04%,第3 天显著下降39.32%(图4A)。进一步评估PjTDC1基因敲低对龟纹瓢虫生殖发育的影响,注射后第3 天,dsGFP对照组初级卵母细胞逐步膨大,开始沉积卵黄,卵母细胞呈现浅黄色;然而dsPjTDC1处理组卵母细胞较小,卵黄沉积少。注射后第5天,相比dsGFP对照组,dsPjTDC1处理组的卵母细胞发育迟缓,多数卵母细胞没有完成卵黄沉积。注射后第7天,dsGFP对照组大量卵母细胞完成卵黄沉积发育成熟,而dsPjTDC1处理组仅有个别卵母细胞发育成熟(图4B)。初步推测,PjTDC1基因的敲低主要影响卵母细胞中卵黄沉积过程。
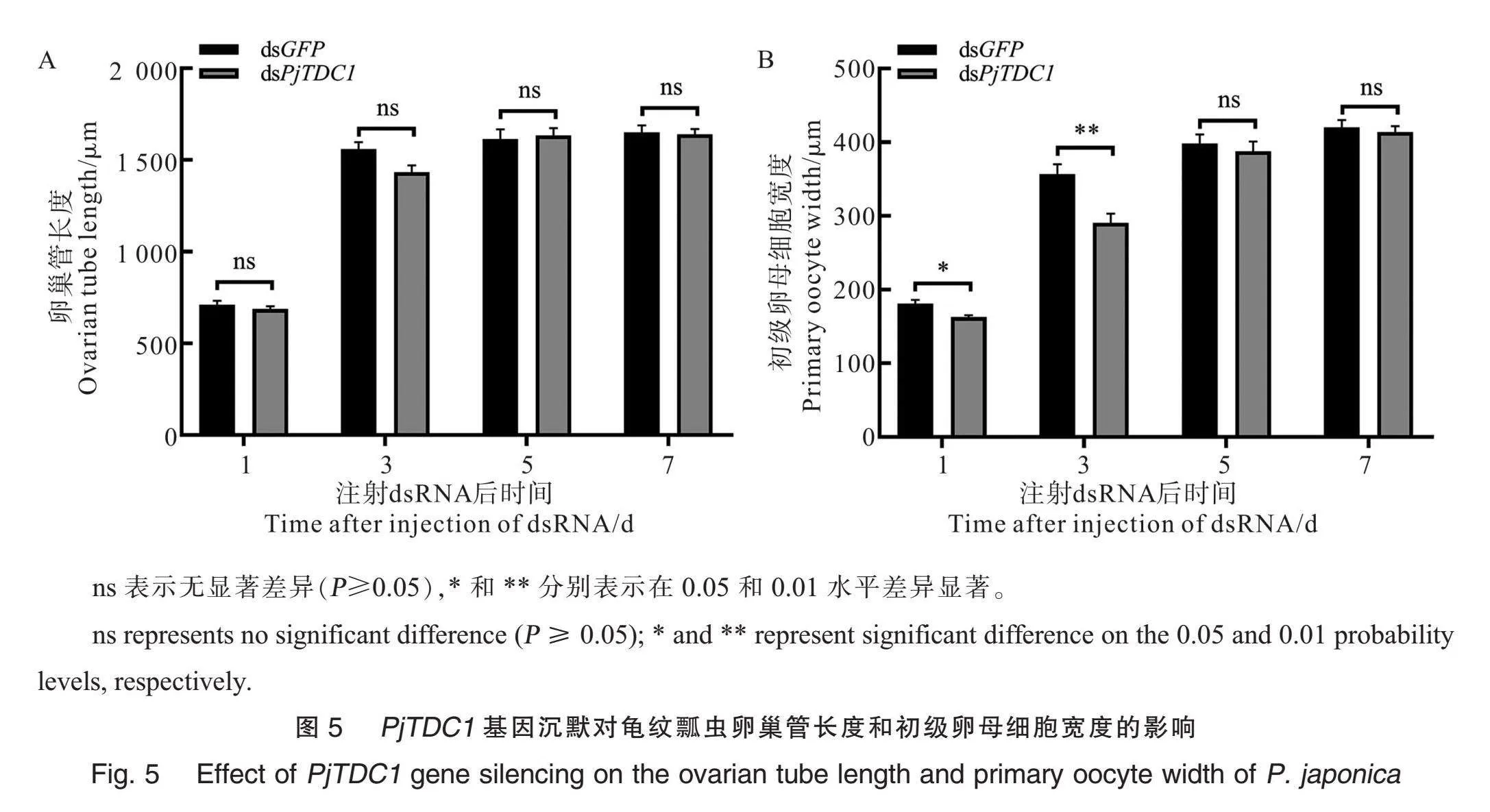
观察和检测PjTDC1基因敲低对卵巢管长度和卵母细胞宽度发育的影响(图5),dsPjTDC1处理组和dsGFP对照组的卵巢管长度无显著差异;但注射后第1天和第3天dsPjTDC1处理组的初级卵母细胞宽度比对照组显著降低10.03%和18.60%,处理组初级卵母细胞的宽度分别为162.71 μm和290.63 μm,对照组则分别为180.84 μm和357.06 μm。进一步验证PjTDC1基因的敲低影响卵母细胞卵黄沉积。
3 讨论
TDC作为OA合成的关键酶,在生殖发育中扮演重要角色。本研究克隆了龟纹瓢虫PjTDC1基因,分析了PjTDC1~4基因的基本结构和分子特征,探索了PjTDC1基因在不同组织和不同发育时期的表达模式,初步验证了PjTDC1基因在龟纹瓢虫中的功能。本研究发现龟纹瓢虫中存在4个TDC同源基因,并且4个TDC蛋白均含有与酪氨酸脱羧酶相关的结构域PLN02880。系统发育分析结果显示,PjTDC1与甘薯小象甲XP_060529679.1有最高同源性,PjTDC2与米象XP_030761693.1亲缘关系最近,PjTDC3与牛犀金龟XP_022920893.1亲缘关系最近,PjTDC4与白蜡窄吉丁XP_018332420.1有较高同源性。结果表明TDC基因具有很高的进化保守性。
在时空表达模式分析中发现,PjTDC1在龟纹瓢虫不同发育阶段和不同组织中均有表达,这表明PjTDC1在龟纹瓢虫的不同发育时期和不同组织中均发挥着重要的调控功能[26]。PjTDC1在龟纹瓢虫1龄幼虫中表达水平最高,在幼虫期整体呈现逐渐下降的表达趋势。PjTDC1在龟纹瓢虫1龄幼虫中的高表达与鞘翅目模式昆虫赤拟谷盗(T. castaneum)OA受体基因OctβR3和褐飞虱(Nilaparvata lugens)OA家族受体基因NIOA3的表达模式类似[27-28]。因此,推测PjTDC1在龟纹瓢虫幼虫发育早期的高表达可能预示PjTDC1基因与赤拟谷盗OctβR3和褐飞虱NIOA3具有相似的功能。结合这些研究结果推测,在幼虫的发育过程中,昆虫对OA合成的需求逐渐降低,OA在幼虫的早期发育中发挥更关键的功能。当龟纹瓢虫从蛹期羽化为成虫时,PjTDC1基因的表达水平显著升高;然而,随着成虫日龄的增加,PjTDC1的表达水平持续下降。这一表达趋势与家蚕(Bombyx mori)、亚洲玉米螟(Ostrinia furnacalis)中与卵巢发育、卵子成熟相关的卵巢丝氨酸蛋白酶编码基因BmOsp和OfOsp1的情况一致[29-30]。推测PjTDC1基因在蛹期羽化为成虫时的上调表达与龟纹瓢虫羽化以及羽化后成虫卵巢快速发育和卵子成熟相关。这一结果与PjTDC1在卵巢中的高表达一致,暗示PjTDC1基因参与龟纹瓢虫成虫期卵巢的发育和卵形成调控过程。
为验证上述推论,进行了RNAi实验,结果表明,PjTDC1基因的沉默影响卵母细胞的卵黄沉积过程。dsRNA注射后第3天,dsPjTDC1处理组卵母细胞较小,卵黄沉积少。在第5天和第7天,dsPjTDC1处理组仅有个别卵母细胞发育成熟,而dsGFP对照组大量卵母细胞完成卵黄沉积发育成熟。这与褐飞虱中OA合成酶基因NlTβH在卵巢发育中的功能研究结果一致[31]。褐飞虱中NlTβH的敲低抑制OA合成水平,阻碍环腺苷酸/蛋白激酶A信号通路和保幼激素合成相关信号通路关键基因的表达[31],导致卵黄原蛋白水平显著降低,卵黄沉积受到抑制。OA通过特异性结合G-蛋白偶联受体进而调控第二信使环腺苷酸,从而实现调控昆虫的产卵、排卵、精子释放和觅食等多种行为[13]。除此之外,研究表明OA还能间接作用于咽侧体和前胸腺,调节保幼激素和蜕皮激素的合成和分泌,进而通过影响卵黄生成和卵母细胞的成熟影响生殖[21, 31]。在果蝇中发现,OA合成酶基因的敲除造成雌性生殖缺陷,主要通过影响输卵管肌肉和排卵过程实现[32-33]。本研究发现PjTDC1基因正调控龟纹瓢虫卵巢卵黄沉积和初级卵母细胞宽度,推测这种调控作用很可能是通过对保幼激素和蜕皮激素的调控而实现的,但具体的分子机理还有待研究。
4 结论
本研究明确了龟纹瓢虫PjTDC1基因的基本结构特征以及在不同发育阶段和不同组织中的时空表达模式,探明了PjTDC1基因表达量随着幼虫龄期、成虫日龄的增长而逐渐降低,并在羽化第5天的雌性成虫卵巢、背部表皮和头部中有较高水平的表达。除此之外,通过RNA干扰实验证实了PjTDC1基因对龟纹瓢虫卵黄沉积和卵形成的正调控作用。
参考文献:
[1] Zhao C C, Wu L K, Luo J Y, et al. Bt, not a threat to Propylea japonica[J/OL]. Frontiers in Physiology, 2020, 11: 758[2024-04-
01]. https://doi.org/10.3389/fphys.2020.00758.
[2] 张世泽, 仵均祥, 张强, 等. 龟纹瓢虫生物生态学特性及饲养利用研究进展[J]. 干旱地区农业研究, 2004, 22(4): 206-210.
Zhang Shize, Wu Junxiang, Zhang Qiang, et al. Research advances of Propylaea japonica (Thunberg) in biology, ecology and utilization[J]. Agricultural Research in the Arid Areas, 2004, 22(4): 206-210.
[3] 胡昌雄, 刘增虎, 杨伟克, 等. 龟纹瓢虫对桑蓟马的捕食作用及两者在桑树上的分布[J/OL]. 植物保护, 2023, 49(6): 147-154[2024-04-01]. https://doi.org/10.16688/j.zwbh.2022474.
Hu Changxiong, Liu Zenghu, Yang Weike, et al. Predation of Pseudodendrothrips mori by Propylea japonica and their distribution on mulberry trees[J/OL]. Plant Protection, 2023, 49(6): 147-154[2024-04-01]. https://doi.org/10.16688/j.zwbh.2022474.
[4] 何清华, 李桂花. 枸杞蚜虫及其优势天敌捕食模型建立及性态分析[J/OL]. 石河子大学学报(自然科学版), 2023, 41(5): 655-
660[2024-04-01]. https://doi.org/10.13880/j.cnki.65-1174/n.
2023.23.016.
He Qinghua, Li Guihua. Establishment and behavior analysis of the model considering wolfberry aphids and their dominant predators[J/OL]. Journal of Shihezi University (Natural Science), 2023, 41(5): 655-660[2024-04-01]. https://doi.org/10.13880/j.cnki.65-1174/n.2023.23.016.
[5] 皇甫宁博. 保幼激素调控龟纹瓢虫卵子发生和卵黄生成的机制研究[D]. 北京: 中国农业科学院, 2021.
Huangfu Ningbo. Study on the mechanisms of juvenile hormone regulating ogenesis and vitellogenesis in Propylea japonica[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021.
[6] Zhang S, Luo J Y, Jiang W L, et al. Response of the bacterial community of Propylea japonica (Thunberg) to Cry2Ab protein[J/OL]. Environmental Pollution, 2019, 254: 113063[2024-04-
01]. https://doi.org/10.1016/j.envpol.2019.113063.
[7] 宋慧英, 吴力游, 陈国发, 等. 龟纹瓢虫生物学特性的研究[J]. 昆虫天敌, 1988, 10(1): 22-33.
Song Huiying, Wu Liyou, Chen Guofa, et al. Biological characteristics of ladybird beetle, Propylea japonica[J]. Natural Enemies of Insects, 1998, 10(1): 22-33.
[8] 张春玲, 岳凤荣. 龟纹瓢虫对3种果树害虫的捕食作用研究[J]. 山东农业大学学报, 1996, 27(4): 425-430.
Zhang Chunling, Yue Fengrong. Functional responses of Propylaea japonica (Thunbery) to three fruit tree pests[J]. Journal of Shandong Agricultural University, 1996, 27(4): 425-430.
[9] 沈志成, 胡萃, 龚和. 取食雄蜂蛹粉对龟纹瓢虫和异色瓢虫卵黄发生的影响[J]. 昆虫学报, 1992, 35(3): 273-278.
Shen Zhicheng, Hu Cui, Gong He. Effect of feeding artificial diet on vitellogenesis of Propylaea japonica and Harmonia axyridis[J]. Acta Entomologica Sinica, 1992, 35(3): 273-278.
[10] Intazar A, Zhang S, Luo J Y, et al. Artificial diet development and its effect on the reproductive performances of Propylea japonica and Harmonia axyridis[J/OL]. Journal of Asia-Pacific Entomology, 2016, 19(2): 289-293[2024-04-01]. https://doi.org/10.1016/j.aspen.2016.03.005.
[11] 张丽莉, 李恺, 张天澍, 等. 人工饲料对龟纹瓢虫生长和繁殖的影响[J]. 昆虫知识, 2007, 44(6): 871-876.
Zhang Lili, Li Kai, Zhang Tianshu, et al. The effect of the artificial diets on Propylea japonica growth and fecundity[J]. Chinese Journal of Applied Entomology, 2007, 44(6): 871-876.
[12] Erspamer V, Boretti G. Identification and characterization, by paper chromatography, of enteramine, octopamine, tyramine, histamine and allied substances in extracts of posterior salivary glands of octopoda and in other tissue extracts of vertebrates and invertebrates[J]. Archives Internationales de Pharmacodynamie et de Therapie, 1951, 88(3): 296-332.
[13] Roeder T. Tyramine and octopamine: ruling behavior and metabolism[J/OL]. Annual Review of Entomology, 2005, 50(1): 447-477[2024-04-01]. https://doi.org/10.1146/annurev.ento.50.071803.130404.
[14] Lange A B. Tyramine: from octopamine precursor to neuroactive chemical in insects[J/OL]. General and Comparative Endocrinology, 2009, 162(1): 18-26[2024-04-01]. https://doi.org/
10.1016/j.ygcen.2008.05.021.
[15] Menzel R, Wittstock S, Sugawa M, et al. Chemical codes of learning and memory in honey bees[C]// The Biology of Memory: Symposium Bernried, Stuttgart, Germany: F. K. Schattauer Verlag, 1990: 335-359.
[16] Long T F, Murdock L L. Stimulation of blowfly feeding be-
havior by octopaminergic drugs[J/OL]. Proceedings of the National Academy of Sciences of the United States of America, 1983, 80(13): 4159-4163[2024-04-01]. https://doi.org/10.1073/
pnas.80.13.4159.
[17] Angioy A M, Barbarossa I T, Crnjar R, et al. Effects of octopaminergic substances on the labellar lobe spreading response in the blowfly Protophormia terraenovae[J/OL]. Neuroscience Letters, 1989, 103(1): 103-107[2024-04-01]. https://
doi.org/10.1016/0304-3940(89)90493-x.
[18] Cohen R W, Mahoney D A, Can H D. Possible regulation of feeding behavior in Cockroach Nymphs by the neurotransmitter octopamine[J/OL]. Journal of Insect Behavior, 2002, 15(1): 37-50[2024-04-01]. https://doi.org/10.1023/A:1014428011892.
[19] Rezával C, Nojima T, Neville M C, et al. Sexually dimorphic octopaminergic neurons modulate female postmating behaviors in Drosophila[J/OL]. Current Biology, 2014, 24(7): 725-730[2024-04-01]. https://doi.org/10.1016/j.cub.2013.12.051.
[20] Heifetz Y, Lindner M, Garini Y, et al. Mating regulates neuromodulator ensembles at nerve termini innervating the Drosophila reproductive tract[J/OL]. Current Biology, 2014, 24(7): 731-
737[2024-04-01]. https://doi.org/10.1016/j.cub.2014.02.042.
[21] Gruntenko N E, Karpova E K, Alekseev A A, et al. Effects of octopamine on reproduction, juvenile hormone metabolism, dopamine, and 20-hydroxyecdysone contents in Drosophila[J/OL]. Archives of Insect Biochemistry and Physiology, 2007, 65(2): 85-94[2024-04-01]. https://doi.org/10.1002/arch.20187.
[22] Hannes K, Stefan E, Sabine K. Stimulatory effect of octopamine on juvenile hormone biosynthesis in honey bees (Apis mellifera): physiological and immunocytochemical evidence[J/OL]. Journal of Insect Physiology, 1994, 40(10): 865-872[2024-04-01]. https://doi.org/10.1016/0022-1910(94)90020-5.
[23] Zhang L J, Song L, Luo J Y, et al. Chromosome‐level genome assembly of the predator Propylea japonica to understand its tolerance to insecticides and high temperatures[J/OL]. Molecular Ecology Resources, 2019, 20(1): 292-307[2024-04-01]. https://doi.org/10.1111/1755-0998.13100.
[24] Lü J, Chen S M, Guo M J, et al. Selection of appropriate reference genes for RT-qPCR analysis in Propylea japonica (Coleoptera: Coccinellidae)[J/OL]. PLoS One, 2018, 13(11): e0208027[2024-04-01]. https://doi.org/doi:10.1371/journal.pone.0208027.
[25] Kenneth J, Thomas D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J/OL]. Methods, 2001, 25(4): 402-408[2024-04-01]. https://doi.org/10.1006/meth.2001.1262.
[26] Wu S F, Yao Y, Huang J, et al. Characterization of a β-adrenergic-
like octopamine receptor from the rice stem borer (Chilo suppressalis)[J/OL]. The Journal of Experimental Biology, 2012, 215(15): 2646-2652[2024-04-01]. https://doi.org/10.1242/jeb.
068932.
[27] 刘小强, 蒋红波, 李慧敏, 等. 赤拟谷盗章鱼胺受体3(TcOctβR3)cDNA克隆、表达及功能[J/OL]. 中国农业科学, 2018, 51(7): 1315-1324[2024-04-01]. https://doi.org/10.3864/j.issn.0578-1752.2018.07.009.
Liu Xiaoqiang, Jiang Hongbo, Li Huimin, et al. The cDNA cloning, expression profiling and functional characterization of octopamine receptor 3 (TcOctβR3) in Tribolium castaneum[J/OL]. Scientia Agricultura Sinica, 2018, 51(7): 1315-1324[2024-04-01]. https://doi.org/10.3864/j.issn.0578-1752.2018.07.
009.
[28] 居晓敏. 褐飞虱章鱼胺家族受体基因分析及药理学和生理功能研究[D]. 南京: 南京农业大学, 2019.
Ju Xiaomin. Genetic analysis, pharmacology and physiological functions of octopamine receptors family in brown planthopper, Nilaparvata lugens[D]. Nanjing: Nanjing Agricultural University, 2019.
[29] 徐霞. 家蚕丝氨酸蛋白酶Ser2和Osp参与生殖调控的研究[D]. 上海: 华东师范大学, 2020.
Xu Xia. Function study of serine protease Ser2 and Osp in the regulation of reproduction in Bombyx mori[D]. Shanghai: East China Normal University, 2020.
[30] 张珀瑞. 亚洲玉米螟(Ostrinia furnacalis)卵巢丝氨酸蛋白酶基因的鉴定及功能研究[D]. 沈阳: 沈阳农业大学, 2023.
Zhang Porui. Identification and functional characterization of Ovarian Serine Protease (Osp) in Ostrinia furnacalis[D]. Shenyang: Shenyang Agricultural University, 2023.
[31] 顾浩天. 章鱼胺在褐飞虱生殖中的调控作用及其机理研究[D]. 扬州: 扬州大学, 2020.
Gu Haotian. Function and regulatory mechanism of octopamine in fecundity of Nilaparvata lugens (St■l) (Hemiptera: Delphacidae)[D]. Yangzhou: Yangzhou University, 2020.
[32] Monastirioti M. Distinct octopamine cell population residing in the CNS abdominal ganglion controls ovulation in Drosophila melanogaster[J/OL]. Developmental Biology, 2003, 264(1): 38-
49[2024-04-01]. https://doi.org/10.1016/j.ydbio.2003.07.019.
[33] Monastirioti M, Linn C E J, White K. Characterization of Drosophila tyramine beta-hydroxylase gene and isolation of mutant flies lacking octopamine[J/OL]. The Journal of Neuroscience, 1996, 16(12): 3900-3911[2024-04-01]. https://doi.org/
10.1523/jneurosci.16-12-03900.1996.
(责任编辑:王国鑫" " 责任校对:王小璐)

