小干扰RNA降脂药物英克司兰在心血管疾病中的研究进展

基金项目:陕西省感染与免疫疾病重点实验室开放课题(2022-ZD-3);陕西省教育厅专项科研计划(21JK0606);咸阳市中西医结合防治炎性疾病研究科技创新团队(L2022CXNLTD003)
通信作者:王海芳,E-mail:wanghaifang03@126.com
【摘要】动脉粥样硬化性心血管疾病(ASCVD)是中国城乡居民死亡的第一位原因。动脉粥样硬化是一种慢性炎症性血管病变,也是ASCVD的病变基础,其主要原因是脂质代谢障碍,故降低低密度脂蛋白胆固醇成为防治ASCVD的重要手段。小干扰RNA是一类新型降血脂药。目前,针对该类药物的循证证据和实践经验较少。首个小干扰RNA降脂药物英克司兰于2023年8月在中国获批上市。现介绍英克司兰治疗动脉粥样硬化的机制、与其他降脂药物合用的情况,以及其安全性和不良反应,以期为此类药物的临床应用提供参考。
【关键词】心血管疾病;动脉粥样硬化;英克司兰;小干扰RNA;血脂管理
【DOI】10.16806/j.cnki.issn.1004-3934.2024.06.012
Small Interfering RNA Lipid-Lowering Drug Inclisiran in Cardiovascular Disease
KANG Yalong,QI Hongfei,GE Teng,PENG Tao,YU Ting,JU Jiaxin,CHENG Caocao,GUAN fang,YU Hubin,WANG Haifang
(Shaanxi University of Chinese Medicine,Shaanxi amp; Xianyang Key Laboratory of Integrated Traditional and Western Medicine for Prevention and Treatment of Cardiovascular Diseases,Xianyang 712000,Shaanxi,China)
【Abstract】Atherosclerotic cardiovascular disease (ASCVD) is the first cause of death for urban and rural residents in China.Atherosclerosis is a chronic vascular inflammation and the pathological basis of ASCVD,and its main reason is lipid metabolism disorder.Therefore,reducing low-density lipoprotein cholesterol has become an important approach for the prevention and treatment of ASCVD.Small interfering RNA lipid-lowering drugs are novel lipid-lowering drugs.At present,there is little evidence-based evidence and practical experience for this class of drugs.Inclisiran,the first small interfering RNA lipid-lowering drug,was approved for sale in China in August 2023.In this article,we will review the anti-atherosclerostic mechanisms of inclisiran,its combined application with other lipid-lowering drugs,and the safety and adverse effects,and thus to provide supportive evidence in the future clinical application of more small interfering RNA lipid-lowering drugs.
【Keywords】Cardiovascular disease;Atherosclerosis;Inclisiran;Small interfering RNA;Lipid management
动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)是全世界范围内威胁人类生命健康最主要的慢性非传染性疾病。心血管疾病也是中国城乡居民首位死亡原因,占死因构成比的40%以上[1-2]。动脉粥样硬化(atherosclerosis,AS)是ASCVD的病理基础,低密度脂蛋白是运载胆固醇进入外周组织细胞的脂蛋白颗粒,低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)被氧化修饰过量后会导致胆固醇沉积,可引起血小板积聚与血栓形成,直接促成AS,从而诱发ASCVD。LDL-C升高是ASCVD明确的独立危险因素[3],LDL-C每降低1.0 mmol/L,血管事件的发生率至少降低1/5[4]。以降低LDL-C水平为目标的降脂治疗是目前公认的ASCVD重要治疗手段。目前临床常用的降血脂药包括他汀类药物、烟酸类药物、胆固醇吸收抑制剂、前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂。
他汀类药物是降脂治疗的基石,能显著降低LDL-C水平,从而减少ASCVD患者的心血管事件,但当药物剂量倍增时降脂效果只增加6%[5],副作用如肝损伤、肌肉损伤等限制了其进一步广泛应用[6]。烟酸类药物具有降低LDL-C和升高高密度脂蛋白胆固醇的作用,但因其降低胰岛素敏感性,故存在增加代谢综合征和2型糖尿病的风险[7]。胆固醇吸收抑制剂依折麦布可有效减少肠道内胆固醇的吸收,降低血浆胆固醇水平。有研究[8]表明在使用他汀类药物基础上加用依折麦布能进一步降低LDL-C水平并改善心血管事件的结局。
肝细胞上表达的LDL受体(LDL receptor,LDLR)在脂质代谢中起着重要作用。血液中的LDL-C与LDLR结合后被转运至肝细胞,LDL-C被溶酶体分解,LDLR则回到肝细胞表面被再利用[9]。肝细胞LDLR途径可清除约90%的胆固醇。研究[10]证明PCSK9可特异性结合LDLR,抑制肝细胞对LDL-C的清除而使血清LDL-C水平升高。因此,利用PCSK9抑制剂提高LDLR表达是降低血液胆固醇水平的有效手段。
PCSK9抑制剂与他汀类药物联用可进一步降低心血管事件发生率和死亡率,因此可作为他汀类药物不耐受或最大耐受量治疗后仍发生ASCVD的新治疗手段[10],但因其需频繁皮下注射,且价格较为昂贵使得患者的用药依从性变差。随着小干扰RNA(small interfering RNA,siRNA)技术的发展与应用,降脂治疗进入了新阶段。2023年8月,新型siRNA降脂药物英克司兰(inclisiran)在中国批准上市。现就inclisiran目前在心血管疾病中的研究进展做一综述。
1" inclisiran的作用机制
inclisiran是一种由20~22个核苷酸组成的短链PCSK9 siRNA,通过干扰PCSK9的基因表达而减少其蛋白合成,从而长期和显著降低LDL-C水平。
未经修饰的siRNA因分子太大不能自由穿过细胞膜,易被肾小球迅速滤过清除或被核酸酶降解[11]。化学修饰可增强药物对核酸酶的抵抗能力而显著提高药效。inclisiran核酸化学修饰主要是指核糖和磷酸二酯键的部分基团被替代,包括核糖-2’-甲氧基修饰、核糖-2’-氟代修饰、硫代磷酸二酯键、2’-脱氧和N-乙酰半乳糖胺(N-acetylgalacto-samine,GalNAc)偶联[12-13]。这些修饰显著增加药物稳定性,可有效避免提前降解,从而延长药效持续时间[14]。
siRNA能否有效递送是限制其临床应用的另一关键问题。在现有递送技术中,脂质纳米颗粒递送系统是把siRNA包裹在脂质体内,和细胞膜的双层脂质层融合后进入细胞内以减少药物降解,但脂质体本身具有的免疫原性可能会带来安全性问题[15]。目前代谢性疾病领域使用最广泛的是GalNAc递送系统,该系统具有高效率、精准靶向作用和避免刺激免疫系统等优点[16]。GalNAc的去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGPR)配体与siRNA偶联,可将足量GalNAc-siRNA缀合物带入肝细胞内,通过降解PCSK9的mRNA而抑制其合成[17-18]。
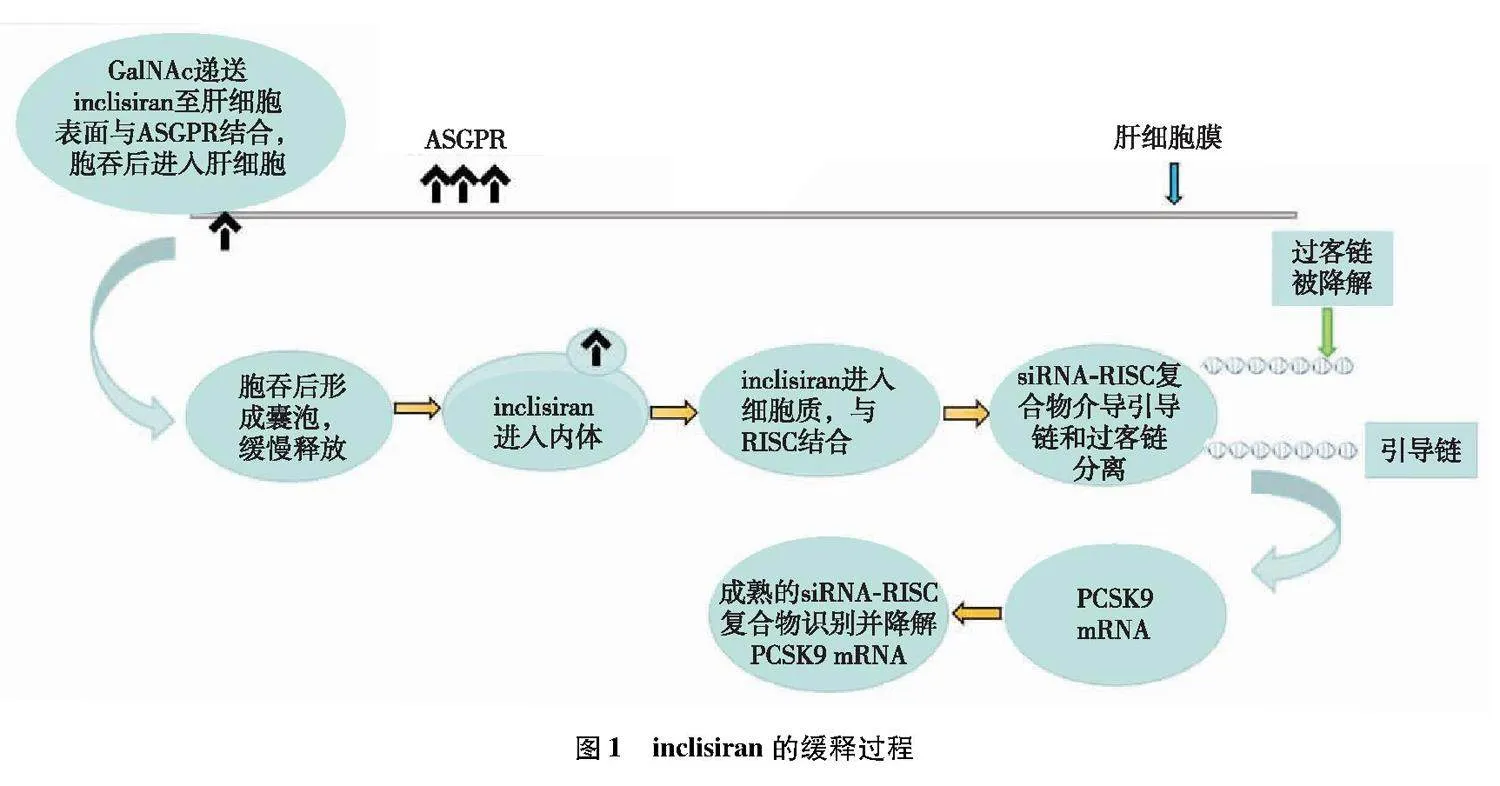
inclisiran的体内过程如下:(1)进入血液循环后,GalNAc-siRNA与ASGPR结合,通过胞吞进入肝细胞;(2)经胞吞后形成囊泡长期储存于内体中缓慢释放;(3)释放入细胞质,与细胞内RNA诱导沉默复合体(RNA-induced silencing complex,RISC)相结合,siRNA-RISC复合物可持续作用数周; (4)siRNA-RISC复合物与引导链结合后成为成熟的siRNA-RISC复合物;(5)成熟的siRNA-RISC复合物可特异性识别并降解PCSK9 mRNA,从而阻断其蛋白合成[19-20]。inclisiran缓释过程如图1示。
2" inclisiran的临床应用
inclisiran在中国获批的适应证包括:(1)作为饮食治疗的辅助疗法,用于成人原发性高胆固醇血症或混合型血脂异常患者的治疗[21];(2)使用最大耐受剂量他汀类药物后LDL-C水平仍未降至满意者,可选择该药与其他降血脂药联合使用;(3)可单独应用于他汀类不耐受或禁忌情况。2023年7月10日,美国食品药品监督管理局将inclisiran的适应证范围扩大至存在危险因素但尚未发生心血管事件的原发性高脂血症患者[22]。
inclisiran的用法用量为单次284 mg皮下注射,首次注射90 d后注射第2次,后续每隔180 d注射1次。由PCSK9单抗换用inclisiran的方法为末次使用PCSK9单抗后立即使用inclisiran(建议2周内完成换药)。
2021年12月在中国开展了inclisiran的真实世界研究[23]。2023年4月欧洲心脏病学会预防心脏病学大会上首次公布了该研究的中期分析结果:首针后第90天,患者平均LDL-C水平降低40.2%;维持原有降脂治疗并加用inclisiran者平均LDL-C水平降低53.3%。在安全性方面,目前为止尚未报告因停药导致的不良反应或其他与治疗相关的严重不良事件。
2.1" ASCVD
ORION-10试验(ASCVD患者)和ORION-11试验(ASCVD或ASCVD高危患者)[24-25]将接受最大耐受剂量他汀类药物治疗后,LDL-C水平仍高的患者以1:1的比例随机分配到inclisiran组或安慰剂组,在第1天、第90 天给药,此后每180 d给药1次,持续540 d。结果显示在ORION-10试验中,inclisiran组LDL-C水平降低52.3%,在ORION-11试验中,inclisiran组LDL-C水平降低49.9%,不良心血管事件风险降低25%[26]。Cordero等[27]对inclisiran近期的研究进行荟萃分析,共纳入57 431例患者(1 592例接受inclisiran治疗,28 259例接受PSCK9抑制剂治疗),结论为inclisiran与PCSK9抑制剂在降低LDL-C方面效果相近。
另一项临床试验ORION-4[26]将于2024年12月完成。此试验中约15 000例年龄>55岁且既往存在ASCVD的受试者被随机分为inclisiran组和安慰剂组,随访时间约为5年,试验主要终点为首次发生冠心病死亡、心肌梗死、缺血性卒中或紧急冠状动脉血运重建术等不良心血管事件,旨在为该药减少ASCVD患者主要不良心血管事件和改善预后的效果进行评估[28]。
此外,一项包含3 660例患者的临床随机试验[29]数据显示,与安慰剂组相比,inclisiran组LDL-C水平降低51%,不良心血管事件发生率降低24%。同时,inclisiran对于ASCVD的新型残余风险
脂蛋白a也具有降低作用[25,30]。
2.2" 杂合子家族性高胆固醇血症和纯合子家族性高胆固醇血症
ORION-9试验的Ⅲ期临床研究评估inclisiran对杂合子家族性高胆固醇血症(heterozygous familial hypercholesterolemia,HeFH)的疗效。482例接受最大耐受剂量降脂治疗,但LDL-C水平仍>5.6 mmol/L的HeFH成人患者在第1、90、270和450天皮下注射300 mg inclisiran或安慰剂,第510天时,inclisiran组较安慰剂组LDL-C水平降低47.9%,90~540 d平均降低44.3%。inclisiran组LDL-C水平明显低于安慰剂组,且给药频率低,安全性好[25,31]。
ORION-5试验受试对象包括56例纯合子家族性高胆固醇血症(homozygous familial hypercholesterolemia,HoFH)患者,均为接受最大耐受剂量的降LDL-C治疗(联合或不联合脂蛋白单采术)但LDL-C水平仍高者。
第1部分为6个月的双盲安慰剂对照试验,患者以2:1的比例随机接受inclisiran或安慰剂;第2部分为18个月的开放标签、单组临床试验,第1部分中的inclisiran组维持不变,安慰剂患者在第2部分改用inclisiran,
该研究主要终点是第150 天时LDL-C水平变化,结果显示HoFH患者PCSK9水平降低60.6%,LDL-C水平降低1.68%,降低不明显[32]。全程患者对inclisiran耐受性良好。
3" 与其他降脂药物联合应用
3.1" inclisiran与他汀类药物
他汀类药物可增加血浆PCSK9蛋白水平,对LDL-C降低产生负向影响。inclisiran从上游抑制PCSK9蛋白合成,与他汀类药物合用可抵消其不良影响,进一步改善血脂水平,安全性和有效性均优于他汀类药物单药治疗。siRNA降脂药物共识[20]推荐:他汀类药物治疗不达标或因不良反应使用受限的患者,可选择inclisiran联合用药,且联合用药的安全性和有效性均优于他汀类药物单药治疗剂量。
3.2" inclisiran与PCSK9单克隆抗体
PCSK9单克隆抗体(monoclonal antibodies,mAb)通过与PCSK9蛋白结合而发挥降脂作用[33-34]。研究[35]证实依洛尤单抗和阿利西尤单抗可显著降低平均LDL-C水平(50%~70%),同时还降低甘油三酯及Lp(a)水平,升高高密度脂蛋白胆固醇水平。研究证明PCSK9 mAb可降低心血管疾病风险,inclisiran具有相似的降低LDL-C作用,但其是否可以改善ASCVD患者的心血管结局还缺乏充足的证据。一项真实世界临床研究[36]将65例降脂治疗后LDL-C仍不达标的ASCVD高风险患者分为A组、B组。其中A组都给予inclisiran进行治疗,受试者
包括首次接受inclisiran治疗者和停用PCSK9 mAb>3个月者;B组包括最后一次使用PCSK9 mAb后转换为inclisiran者。3个月时,A组患者LDL-C降低38%,联合使用他汀类药物者LDL-C降低45%,然而B组患者LDL-C升高38%。B组患者LDL-C水平升高,表明与PCSK9 mAb相比,inclisiran降低LDL-C的能力较弱。
两种药物干预PCSK9作用的位置不同。PCSK9 mAb无法通过细胞膜进入细胞浆,故无法抑制细胞内的PCSK9[37],而inclisiran可有效干预细胞内外PCSK9功能。在抗药性方面,目前尚未发现inclisiran产生抗药抗体。
4" inclisiran的不良反应
在ORION-9、ORION-10和ORION-11的Ⅲ期临床试验中,inclisiran治疗组和安慰剂组患者注射部位不良反应发生率分别为8.2%和1.4%。不良反应包括注射部位的皮疹、红斑和疼痛,均为一过性,消退后无后遗症。肝功能、肾功能、肌酸激酶和血小板计数与安慰剂组无明显差别[25]。
5" inclisiran在特殊人群中的应用
针对肝功能不全受试者的ORION-6研究[38]表明:轻度和中度肝损伤患者应用inclisiran的安全性和耐受性良好,尚未对重度肝功能不全患者进行研究。
针对肾功能不全受试者的ORION-7研究[39]表明:inclisiran用于轻度、中度和重度肾功能不全患者无需调整剂量。目前尚缺乏inclisiran对血液透析的药物代谢动力学影响的证据,但考虑到inclisiran通过肾脏清除,建议给药后至少72 h内不进行血液透析。
老年患者和年轻患者应用inclisiran未观察到总体安全性差异,认为老年患者无需调整剂量。由于研究数据不足,不推荐妊娠期、哺乳期的妇女使用inclisiran。inclisiran的临床研究见表1。
6" 其他siRNA降脂药物
除针对LDL-C作为降脂靶点的inclisiran以外,目前尚有针对其他降脂靶点的多个siRNA药物正在进行临床研究。例如,Lp(a)也参与了ASCVD的病理生理过程[42],olpasiran和SLN360是作用于Lp(a)的siRNA药物,通过靶向干扰肝细胞内Lp(a) 的基因表达从而减少肝脏中Lp(a)的合成[43-44]。ARO-ANG3和ARO-APOC3分别通过靶向干扰血管生成素样蛋白3和载脂蛋白C-Ⅲ,以降低甘油三酯水平[45-46]。siRNA降脂药物的研发有望使更多患者获益。
7" 总结与展望
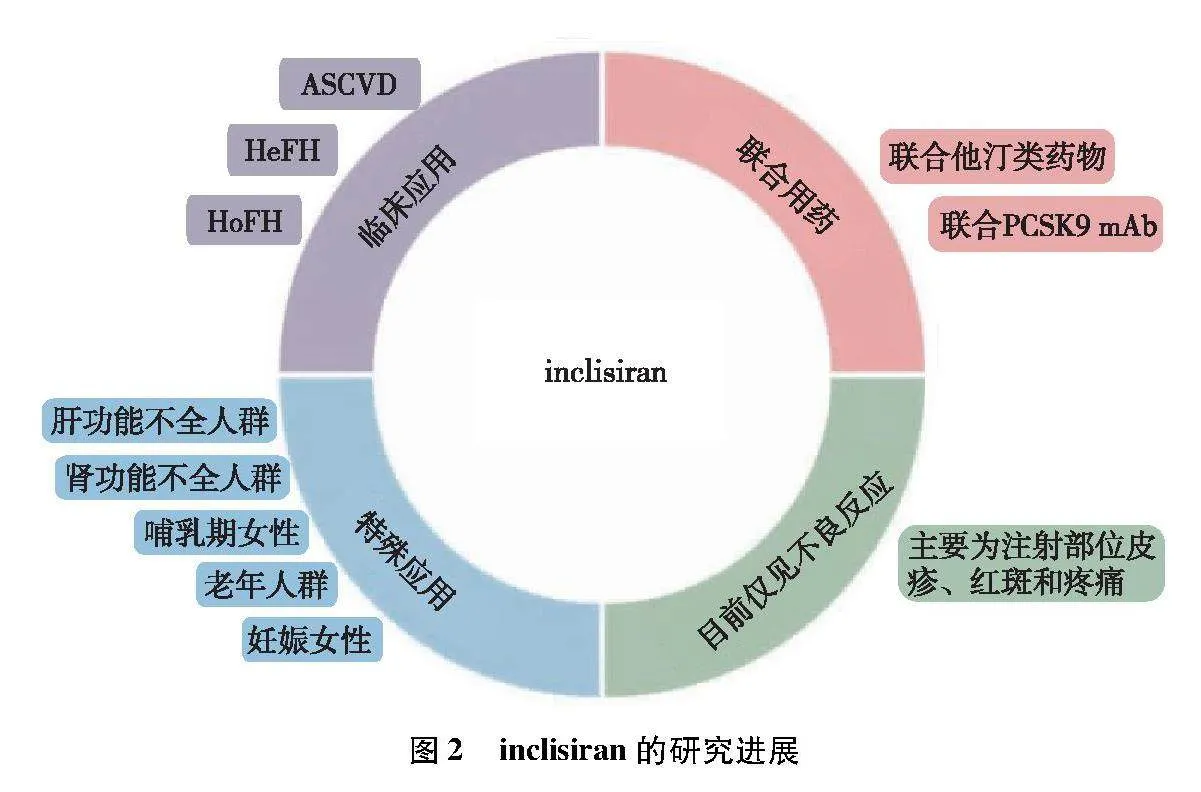
降脂治疗可降低ASCVD风险。他汀类药物可显著降低LDL-C水平和ASCVD风险,当LDL-C不达标时,联用PCSK9 mAb是进一步降低LDL-C的有效手段。inclisiran在肝细胞中靶向降解PCSK9 mRNA,更接近降脂源头,在降脂治疗中具有里程碑式的意义。多个临床试验已证明了inclisiran在持续降低PCSK9和LDL-C方面的有效性和安全性,而inclisiran是否能降低ASCVD风险,则有待大样本临床研究提供更全面、更客观的证据(见图2)。相比每日口服他汀类药物及每2~4周注射1次单抗药物,inclisiran具有给药频率低,患者依从性好的优势。价格高昂是限制其推广应用的重要因素,若能降低成本,或可作为高脂血症患者联合降脂治疗的新选择。
参考文献
[1]王增武,刘静,李建军,等.中国血脂管理指南(2023年)[J].中国循环杂志,2023,38(3):237-271.
[2]中国心血管健康与疾病报告编写组,胡盛寿.中国心血管健康与疾病报告2022概要[J].中国循环杂志,2023,38(6):583-612.
[3]Ference BA,Ginsberg HN,Graham I,et al.Low-density lipoproteins cause atherosclerotic cardiovascular disease.1.Evidence from genetic,epidemiologic,and clinical studies.A consensus statement from the European Atherosclerosis Society Consensus Panel[J].Eur Heart J,2017,38(32):2459-2472.
[4]Baigent C,Blackwell L,Emberson J,et al.Efficacy and safety of more intensive lowering of LDL cholesterol:a meta-analysis of data from 170,000 participants in 26 randomised trials[J].Lancet,2010,376(9753):1670-1681.
[5]Bonovas S,Nikolopoulos G,Sitaras NM.Efficacy and safety of more intensive lowering of LDL cholesterol[J].Lancet,2011,377(9767):715-716.
[6]李永林,司春婴,顾问,等.PCSK9抑制剂和Inclisiran在动脉粥样硬化中的研究进展[J].医学研究生学报,2021,34(4):439-443.
[7]谢坤,李勇.高甘油三酯血症临床管理多学科专家共识[J].中国循环杂志,2023,38(6):621-633.
[8]Cannon CP,Blazing MA,Giugliano RP,et al.Ezetimibe added to statin therapy after acute coronary syndromes[J].N Engl J Med,2015,372(25):2387-2397.
[9]侯立强,孙燕,任雷,等.新型siRNA药物:inclisiran在降脂治疗中的研究进展[J].中国医药导刊,2023,25(2):140-145.
[10]Gallego-Colon E,Daum A,Yosefy C.Statins and PCSK9 inhibitors:a new lipid-lowering therapy[J].Eur J Pharmacol,2020,878:173114.
[11]Shadid M,Badawi M,Abulrob A.Antisense oligonucleotides:absorption,distribution,metabolism,and excretion[J].Expert Opin Drug Metab Toxicol,2021,17(11):1281-1292.
[12]Shen X,Corey DR.Chemistry,mechanism and clinical status of antisense oligonucleotides and duplex RNAs[J].Nucleic Acids Res,2018,46(4):1584-1600.
[13]Khvorova A.Oligonucleotide therapeutics—A new class of cholesterol-lowering drugs[J].N Engl J Med,2017,376(1):4-7.
[14]Brown CR,Gupta S,Qin J,et al.Investigating the pharmacodynamic durability of GalNAc-siRNA conjugates[J].Nucleic Acids Res,2020,48(21):11827-11844.
[15]Bogaert B,Sauvage F,Guagliardo R,et al.A lipid nanoparticle platform for mRNA delivery through repurposing of cationic amphiphilic drugs[J].J Control Release,2022,350:256-270.
[16]Crooke ST,Witztum JL,Bennett CF,et al.RNA-targeted therapeutics[J].Cell Metab,2018,27(4):714-739.
[17]Lu Y,Huang W,Li M,et al.Exosome-based carrier for RNA delivery:progress and challenges[J].Pharmaceutics,2023,15(2):598.
[18]Henney NC,Banach M,Penson PE.RNA silencing in the management of dyslipidemias[J].Curr Atheroscler Rep,2021,23(11):69.
[19]Weng Y,Xiao H,Zhang J,et al.RNAi therapeutic and its innovative biotechnological evolution[J].Biotechnol Adv,2019,37(5):801-825.
[20]赵紫楠,史琛,胡欣,等.小干扰RNA降脂药物药学专家共识[J].中国医院药学杂志,2024,44(1):9-17.
[21]张磊,智昱,刘丽,等.新型小干扰RNA降脂药物Inclisiran研究进展[J].中国心血管杂志,2022,27(2):176-178.
[22]FDA.Inclisiran instruction.(2023-07-07).http://www.accessdata.fta.gov/drugsatfda-docs/label/2023/214012s009lbl.pdf.
[23]Huo Y,Fang PH,Lou HD,et al.Real-world early effectiveness and safety of inclisiran in China pilot zone:an interim analysis of 3-month data from a prospective non-interventional cohort study.Amsterdam:ESC Preventive Cardiology Congress,2023.
[24]Ray KK,Wright RS,Kallend D,et al.Two phase 3 trials of inclisiran in patients with elevated LDL cholesterol[J].N Engl J Med,2020,382(16):1507-1519.
[25]Wright RS,Ray KK,Raal FJ,et al.Pooled patient-level analysis of inclisiran trials in patients with familial hypercholesterolemia or atherosclerosis[J].J Am Coll Cardiol,2021,77(9):1182-1193.
[26]Ray KK,Raal FJ,Kallend DG,et al.Inclisiran and cardiovascular events:a patient-level analysis of phase Ⅲ trials[J].Eur Heart J,2023,44(2):129-138.
[27]Cordero A,Santos-Gallego CG,Facila L,et al.Estimation of the major cardiovascular event prevention with Inclisiran[J].Atherosclerosis,2020,313:76-80.
[28]Kosmas CE,Munoz EA,Skavdis A,et al.Inclisiran for the treatment of cardiovascular disease:a short review on the emerging data and therapeutic potential[J].Ther Clin Risk Manag,2020,16:1031-1037.
[29]Khan SA,Naz A,Qamar Masood M,et al.Meta-analysis of inclisiran for the treatment of hypercholesterolemia[J].Am J Cardiol,2020,134:69-73.
[30]Ray KK,Stoekenbroek RM,Kallend D,et al.Effect of 1 or 2 doses of inclisiran on low-density lipoprotein cholesterol levels:one-year follow-up of the ORION-1 randomized clinical trial[J].JAMA Cardiol,2019,4(11):1067-1075.
[31]Raal FJ,Kallend D,Ray KK,et al.Inclisiran for the treatment of heterozygous familial hypercholesterolemia[J].N Engl J Med,2020,382(16):1520-1530.
[32]Raal F,Durst R,Bi R,et al.Efficacy,safety,and tolerability of inclisiran in patients with homozygous familial hypercholesterolemia:results from the ORION-5 randomized clinical trial[J].Circulation,2024,149(5):354-362.
[33]Norata GD,Tibolla G,Catapano AL.Targeting PCSK9 for hypercholesterolemia[J].Annu Rev Pharmacol Toxicol,2014,54:273-293.
[34]Lagace TA,Curtis DE,Garuti R,et al.Secreted PCSK9 decreases the number of LDL receptors in hepatocytes and in livers of parabiotic mice[J].J Clin Invest,2006,116(11):2995-3005.
[35]Huynh K.Dyslipidaemia.Assessing the efficacy and safety of evolocumab and alirocumab[J].Nat Rev Cardiol,2015,12(5):261.
[36]Mulder J,Galema-Boers A,Roeters VLJ.First clinical experiences with inclisiran in a real-world setting[J].J Clin Lipidol,2023,17(6):818-827.
[37]Cunningham D,Danley DE,Geoghegan KF,et al.Structural and biophysical studies of PCSK9 and its mutants linked to familial hypercholesterolemia[J].Nat Struct Mol Biol,2007,14(5):413-419.
[38]Kallend D,Stoekenbroek R,He Y,et al.Pharmacokinetics and pharmacodynamics of inclisiran,a small interfering RNA therapy,in patients with hepatic impairment[J].J Clin Lipidol,2022,16(2):208-219.
[39]Wright RS,Collins MG,Stoekenbroek RM,et al.Effects of renal impairment on the pharmacokinetics,efficacy,and safety of inclisiran:an analysis of the ORION-7 and ORION-1 studies[J].Mayo Clin Proc,2020,95(1):77-89.
[40]Ray KK,Landmesser U,Leiter LA,et al.Inclisiran in patients at high Cardiovascular risk with elevated LDL cholesterol.N Engl J Med,2017,376(15):1430-1440.
[41]Lamb YN.Correction to:inclisiran:first approval[J].Drugs,2021,81(9):1129.
[42]Boren J,Chapman MJ,Krauss RM,et al.Low-density lipoproteins cause atherosclerotic cardiovascular disease:pathophysiological,genetic,and therapeutic insights:a consensus statement from the European Atherosclerosis Society Consensus Panel[J].Eur Heart J,2020,41(24):2313-2330.
[43]O’Donoghue ML,Rosenson RS,Gencer B,et al.Small interfering RNA to reduce lipoprotein(a) in cardiovascular disease[J].N Engl J Med,2022,387(20):1855-1864.
[44]O’Donoghue ML,Rosenson RS,Gencer B,等.Olpasiran治疗动脉粥样硬化性心血管疾病患者的临床研究[J].中国临床药理学杂志,2023,39(4):482.
[45]Ginsberg HN,Goldberg IJ.Broadening the scope of dyslipidemia therapy by targeting APOC3 (apolipoprotein C3) and ANGPTL3(angiopoietin-like protein 3)[J].Arterioscler Thromb Vasc Biol,2023,43(3):388-398.
[46]Mercep I,Strikic D,Sliskovic AM,et al.New therapeutic approaches in treatment of dyslipidaemia—A narrative review[J].Pharmaceuticals(Basel),2022,15(7):839.
收稿日期:2023-12-12