加州鲈肠道芽孢杆菌的筛选及其功能研究
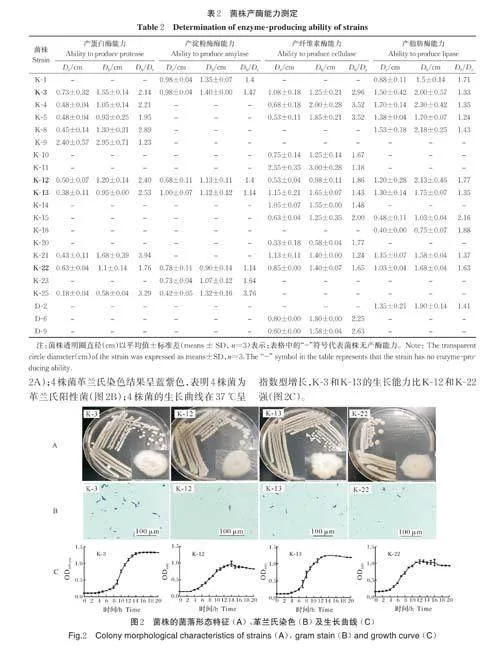
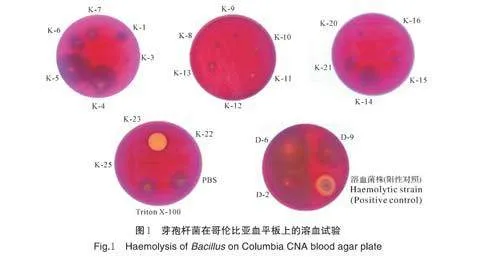
关键词 加州鲈; 芽孢杆菌; 溶血特性; 产酶性能; 诺卡氏菌
加州鲈,又名大口黑鲈(Micropterus salmoides),原产于北美,20 世纪80 年代初引进我国,因其肉质鲜嫩,深受消费者喜爱,需求量不断增加。根据2023 年《中国渔业统计年鉴》,我国2022 年加州鲈年产量达80.2 万t。由于养殖规模和养殖密度的增加,以及养殖环境的恶化,养殖加州鲈病害频发,不仅造成了巨大的经济损失,也严重制约了加州鲈产业的可持续发展[1]。应用抗生素是水产养殖中治疗细菌感染的常见做法,但抗生素的不规范使用会加剧耐药菌的出现[2]、污染养殖环境和危害养殖生物。因此,寻找安全、有效的新型水产养殖抗生素替代品至关重要。
益生菌随食物或水进入胃肠道,通过调节胃肠道内部微生物平衡来促进机体健康[3]。益生菌能够维持健康的水产养殖环境并提高养殖动物产量[4-5]。芽孢杆菌是水产养殖中常用的益生菌,作为饲料添加剂在我国水产养殖中已得到广泛应用。芽孢杆菌可以抑制多种细菌和真菌的活性,发挥拮抗作用,提高动物抗病力[6]。芽孢杆菌可形成芽孢,耐高温、耐酸碱,具有良好的稳定性和抗逆性[7-8]。芽孢杆菌能够分泌多种酶类如蛋白酶、纤维素酶、脂肪酶、淀粉酶等,增强动物的肠道消化能力,促进鱼类生长[9-10]。在饲料中添加优良益生菌对于提高养殖动物产量和减少疾病非常重要。鉴于从非水产养殖环境中分离的芽孢杆菌在鱼肠道的定植表现出不确定性[10],为了提高芽孢杆菌在鱼类肠道中的定植概率并对宿主发挥最大益处,研究的重点应从鱼类的微生物群中分离益生菌。本研究探索以芽孢杆菌作为一种有效、环保的抗生素替代品来控制诺卡氏菌病,同时提高加州鲈的生长性能,以期为促进加州鲈养殖业的健康可持续发展提供基础资料。
1 材料与方法
1.1 材料
用于筛选芽孢杆菌的加州鲈购自武汉市的农贸市场、养殖场等。用于菌株投喂试验的加州鲈购自武汉市黄陂区某水产养殖场,初始体质量(28.8±6.0) g。胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)、普通营养琼脂、产蛋白酶培养基、产淀粉酶培养基和羧甲基纤维素钠培养基购自青岛海博生物技术公司。药敏片购自杭州微生物试剂有限公司。胃蛋白酶、胰蛋白酶购自上海麦克林生化科技有限公司。胃蛋白酶测定试剂盒、α-淀粉酶检测试剂盒和脂肪酶检测试剂盒购自南京建成生物工程有限公司。定量PCR 试剂2×TSINGKE Mas⁃ter qPCR Mix 购自武汉擎科创新生物科技有限公司。
1.2 菌株分离鉴定
1)菌株分离。加州鲈用MS-222 麻醉、75% 乙醇消毒鱼体表后取出肠道,放入一次性培养皿中。用PBS 缓冲液清洗肠壁的血液、脂肪及内容物并剪碎,加到离心管中,加入PBS 缓冲液进行匀浆。将匀浆液置于水浴锅中80 ℃水浴20 min,涂布于TSA 培养平板,置28 ℃培养箱中培养2 d。待菌落长出,根据菌落形态、大小和颜色,挑选单菌落并纯化。
2)分子生物学鉴定。挑取划线纯化2 代后的单菌落到TSB 液体培养基中,28 ℃摇菌8~16 h 至浑浊。菌液PCR 扩增16S rDNA,16S rDNA 基因通用引物序列:27F(AGAGTTTGATCCTGGCTCA)和1492R(GGTTACCTTGTTACGACTT)。在NC⁃BI 数据库中对序列进行同源性比较,确定待测菌的种属分类。
1.3 潜在益生菌的筛选
1)溶血性检测。根据《饲料添加剂品种目录》,将允许添加到饲料的芽孢杆菌进行溶血试验,用接种针挑取单菌落点种于哥伦比亚血平板上,并增加PBS 阴性对照、Triton X-100 和溶血菌株阳性对照,培养24 h 后观察菌落周围是否出现溶血环[11]。
2)产蛋白酶、纤维素酶、淀粉酶和脂肪酶能力测定。采用点种法筛选产酶菌株,用消毒牙签挑取单菌落,分别点接在酪蛋白琼脂培养基、淀粉水解培养基、羧甲基纤维素培养基、三丁酸甘油酯培养基上,28 ℃培养2 d,观察平板有无水解圈的产生并测量水解圈大小。以水解圈直径(Dh,cm)与菌落直径(Dc,cm)之比(Dh/Dc)判断各菌株产酶能力[12],比值越大,产酶能力越强。
1.4 菌株形态及生理生化鉴定
1)菌株形态。将筛选的芽孢杆菌接种到TSA 固体平板上,37 ℃培养箱中倒置培养过夜,观察菌落形态特征。用革兰氏染液处理菌株,在光学显微镜下观察革兰氏染色后的菌株形态特征。
2)生理生化鉴定。使用青岛海博生物技术公司的枯草芽孢杆菌生理生化鉴定试剂,根据生化反应特征,通过《常见细菌系统鉴定手册》鉴定菌株。
1.5 药物敏感性评价
采用纸片琼脂扩散法进行药敏试验,检测菌株对29 种常见抗菌药物的敏感特性。用无菌PBS 调节菌液浓度至108 CFU/mL,然后均匀涂布于MH 培养皿,用无菌镊子夹取药敏纸片贴在培养基表面,平板倒置于37 ℃恒温培养24 h,测量抑菌圈直径,药敏性判定参考美国国家临床实验室标准化委员会(NC⁃CLS)的标准。
1.6 生物被膜形成能力测定
将菌液接种在96 孔板中,37 °C 孵育36 h。吸出培养液,用无菌 PBS 缓冲液冲洗3 次。添加100 μL甲醇进行固定,持续15 min,然后吸出甲醇,使其自然风干。接着每孔加入100 μL 1% 的结晶紫溶液,室温下染色5 min,吸出结晶紫染液并用无菌PBS 缓冲液冲洗干净。将培养板倒扣在滤纸上去除残余的水分,并放入37 ℃烘箱中烘干。每孔加入100 μL 33%的冰乙酸溶液,在37 °C 培养箱中反应30 min,以溶解结晶紫。通过酶标仪测定培养孔中溶液在595 nm 处的OD 值(D595 nm)。每种菌株做3 个孔的重复试验,试验数值取3 次的平均数值(D 值)。以未接种菌的培养液作为阴性对照,阴性值的2 倍设定为界限值[13]。
1.7 体外拮抗诺卡氏菌试验
将诺卡氏菌接种于脑心浸液肉汤培养基中,28 ℃摇床培养4~7 d,用灭菌生理盐水调节至一定浓度,取0.1 mL 菌悬液涂布于脑心浸液琼脂培养基上,然后用接种针挑取供试菌点种在培养基上。28 ℃条件下培养,观察48 h 点种区菌落周围是否出现明显的抑菌环,并测量抑菌环直径与菌落直径,观察供试菌对诺卡氏菌的抑菌情况。
1.8 人工胃肠液耐受试验
根据《中国药典》中的配制方法配制人工胃液、人工肠液,将芽孢杆菌按一定比例接种于人工胃液或人工肠液中,培养2 h 后,将菌液稀释并将各稀释度涂布平板,计数菌落数,计算存活率[14]。
1.9 对加州鲈体质量增量及免疫基因表达水平的测定试验
将体质量为(28.8±6.0) g 的加州鲈平均分为5组,分别为对照组、K-3 组、K-12 组、K-13 组、K-22组,进行芽孢杆菌拌料饲喂试验。投喂饲料为商品化饲料,在饲料中分别添加芽孢杆菌的芽孢,使添加后饲料中芽孢杆菌芽孢的浓度为1×108 CFU/g。养殖缸每缸30 尾鱼,养殖系统为华中农业大学水产新基地的循环水养殖系统,养殖水24 h 曝气,水体pH7.2±0.2,水温(20±2) ℃。试验期间每天投喂1 次,投喂量为鱼体质量的3%,饲喂周期为42 d,试验正式开始前将所有加州鲈暂养2 周以适应实验室条件。喂养结束前后测加州鲈的体质量,在喂养后每组选取3 尾鱼采集脾脏、头肾、后肠并用TRIZOL 提取RNA,反转录成cDNA 用于后续定量检测免疫因子表达水平,免疫因子及 β-actin 引物序列见表1。
1.10 统计学分析
数据处理采用Graphpad Prism 6.0 软件作图,利用t 检验进行统计学显著性差异比较,Plt;0.05 为差异显著,Plt;0.01 为差异极显著。
2 结果与分析
2.1 芽孢杆菌的分离鉴定结果
根据分离菌的16S rDNA 序列结果,从加州鲈肠道分离出94 株芽孢杆菌,包括枯草芽孢杆菌22 株、短小芽孢杆菌13 株、高地芽孢杆菌15 株、蜡样芽孢杆菌24 株和芽孢杆菌属其他种20 株。
2.2 非溶血菌株的筛选
将分离的35 株芽孢杆菌(包括22 株枯草芽孢杆菌和13 株短小芽孢杆菌)点种在哥伦比亚血平板上,筛选出23 株不产生溶血环的芽孢杆菌,包括枯草芽孢杆菌20 株,分别为K-1、K-3、K-4、K-5、K-6、K-7、K-8、K-9、K-10、K-11、K-12、K-13、K-14、K-15、K-16、K-20、K-21、K-22、K-23、K-25。短小芽孢杆菌3株,分别为D-2、D-6、D-9(图1)。
2.3 产酶菌株的筛选
产酶能力试验结果显示菌株K-3、K-12、K-13、K-22 同时具备产蛋白酶、淀粉酶、纤维素酶、脂肪酶的能力。由表2 可知,4 个菌株的产蛋白酶水解圈直径/菌落直径指标大小排序为K-13gt;K-12gt;K-3gt;K-22;产淀粉酶水解圈直径/菌落直径指标大小排序为K-3gt;K-12gt;K-13=K-22;产纤维素酶能力水解圈直径/菌落直径指标大小排序为K-12gt;K-22gt;K-13gt;K-3;产脂肪酶按能力大小排序为K-12gt;K-22gt;K-13gt;K-3。
2.4 芽孢杆菌的鉴定
1)形态学鉴定。菌株K-3、K-12、K-13、K-22 在TSA 固体培养基上37 ℃培养12 h,呈现为圆形或者椭圆形,略微隆起、不透明、有黏液的白色菌落(图2A);4 株菌革兰氏染色结果呈蓝紫色,表明4 株菌为革兰氏阳性菌(图2B);4 株菌的生长曲线在37 ℃呈指数型增长,K-3 和K-13 的生长能力比K-12 和K-22强(图2C)。
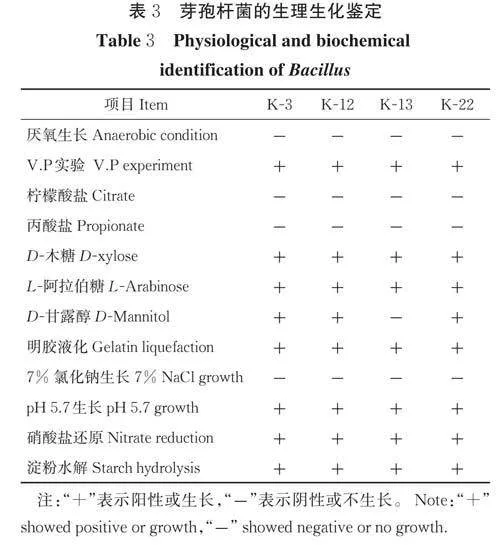
2)生理生化特征鉴定。用枯草芽孢杆菌生理生化鉴定条对菌株K-3、K-12、K-13、K-22 进行鉴定,结果如表3 所示,V.P、D-木糖、L-阿拉伯糖和明胶液化等呈阳性,利用丙酸盐、柠檬酸盐和7%氯化钠生长等呈阴性。通过《常见细菌系统鉴定手册》检索和形态学鉴定确定这4 株菌株为枯草芽孢杆菌。
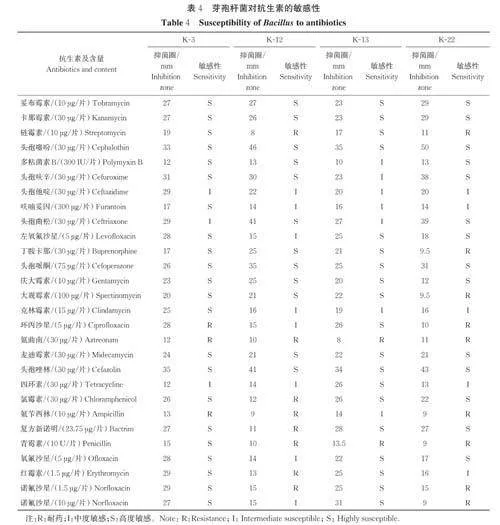
2.5 药物敏感试验结果
药敏试验是检测菌株安全性的重要指标。菌株K-3、K-12、K-13、K-22 对常见的29 种抗生素敏感性试验结果如表4 所示。K-3 菌株对22 种抗生素敏感、3 种抗生素中度敏感,对3 种抗生素不敏感;K-12 菌株对12 种抗生素敏感、8 种抗生素中度敏感,对8 种抗生素不敏感;K-13 菌株对19 种抗生素敏感、7 种抗生素中度敏感,对2 种抗生素不敏感;K-22 菌株对14种抗生素敏感、5 种抗生素中度敏感,对9 种抗生素不敏感。以上结果表明这4 株菌对大部分抗生素敏感。
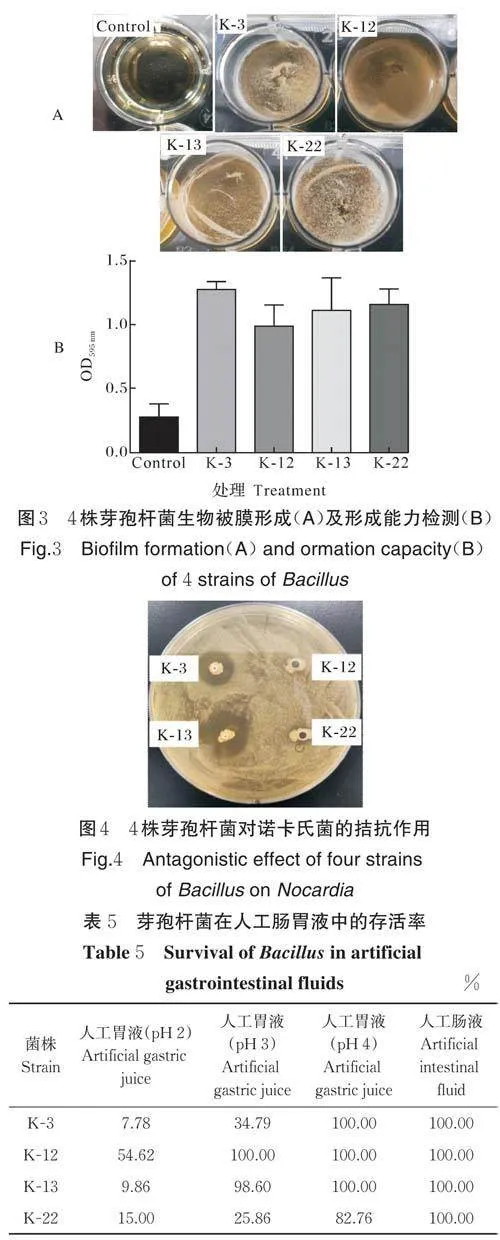
2.6 生物被膜的形成能力
菌株形成生物被膜可以保持菌株稳定以及耐受极端环境,利于菌株的生存。本研究中4 株芽孢杆菌可形成肉眼可见的生物被膜(图3A)。测定结晶紫染色的生物膜在595 nm 波长处的吸光值,以未接种菌的培养液作为阴性对照,以阴性值的2 倍作为界限值。经计算,它们的OD595 nm 值均大于界限值(图3B),表明它们均是强生物被膜形成菌株。
2.7 体外拮抗诺卡氏菌试验
诺卡氏菌是加州鲈的重要病原菌,对病原菌的拮抗作用是评价益生菌株的一个重要方面。从图4可以看出菌株K-3、K-13 对诺卡氏菌有明显的拮抗作用,能够形成抑菌圈;菌株K-12、K-22 对诺卡氏菌没有形成抑菌圈,没有拮抗作用。表明菌株K-3、K-13 能够在体外拮抗诺卡氏菌。
2.8 对人工胃肠液的耐受能力
为明确菌株在胃肠道的耐受能力,对4 株菌在人工胃液(pH 2~4)和人工肠液处理下的生存情况进行检测。结果如表5 所示,菌株K-3、K-12、K-13、K-22 能够在人工胃液和人工肠液中存活,4 株菌在pH 2的人工胃液中2 h 的存活率较低,在pH 3~4 的人工胃液中2 h,K-12 和K-13 的存活率接近100%,高于K-3 和K-22 的存活率;4 株菌在人工肠液中2 h 的存活率达到100%。表明4 株菌能一定程度耐受低pH的胃液和肠液。
2.9 对加州鲈体质量、肠道消化酶及炎症因子的影响
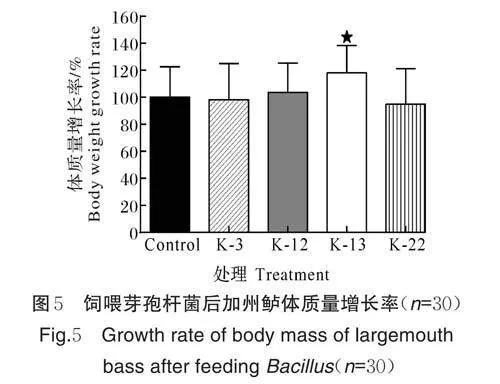
1)芽孢杆菌对加州鲈体质量的影响。由图5 可见,将菌株K-3、K-12、K-13、K-22 的芽孢拌料饲喂加州鲈42 d 后,K-13 试验组体质量增长率显著高于对照组(Plt;0.05),K-3、K-12、K-22 试验组体质量增长率相比于对照组没有显著变化(Pgt;0.05)。这表明在饲料中添加K-13 菌株能够显著提高加州鲈体质量。
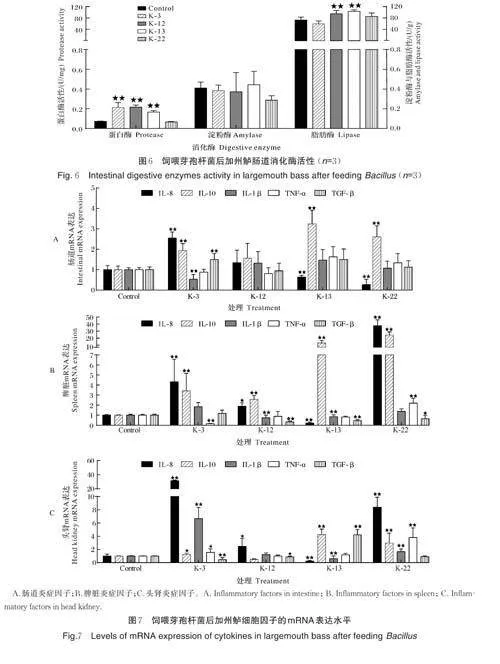
2)芽孢杆菌对加州鲈肠道消化酶的影响。将菌株K-3、K-12、K-13、K-22 的芽孢拌料饲喂加州鲈42 d,检测加州鲈肠道的酶活性。如图6 所示,K-3、K-12、K-13 组的鱼肠道蛋白酶活性显著高于对照组(Plt;0.01),K-12、K-13 组加州鲈肠道脂肪酶活性显著高于对照组(Plt;0.01)。试验组与对照组的加州鲈肠道淀粉酶活性没有显著性差异。表明饲料中添加K-12、K-13 菌株能够增强加州鲈肠道消化酶的活性。
3)芽孢杆菌对加州鲈炎症因子的影响。将菌株K-3、K-12、K-13、K-22 的芽孢拌料饲喂加州鲈42 d,检测加州鲈主要免疫器官的炎症因子表达水平。与对照组相比,K-3 组的后肠、脾脏和头肾的抑炎因子IL-10、促炎因子IL-8 表达水平显著上调,促炎因子TNF-α 表达水平显著下调(Plt;0.05);K-12 组后肠、脾脏和头肾的促炎因子IL-8、抑炎因子IL-10 表达水平显著上调(Plt;0.05);K-13 组的后肠、脾脏和头肾的促炎因子IL-8、IL-1β 表达水平显著下调(Plt;0.05)。抑炎因子IL-10 表达水平显著上调(Plt;0.05);K-22 组脾脏和头肾促炎因子IL-8、TNF-α,抑炎因子IL-10 表达水平显著上调(Plt;0.05)(图7)。总体而言,K-13 试验组的加州鲈主要免疫器官中促炎因子表达量相对于对照组下调,抑炎因子表达量相对于对照组上调。这提示K-13 菌株添加在饲料中,能够抑制加州鲈炎症反应。
3 讨论
益生菌作为饲料添加剂,可以调节动物肠道菌群,增强机体免疫力,提高动物对饲料的消化吸收能力及动物对疾病的抵抗力[4,15-16],同宿主来源益生菌在宿主肠道中更容易定植和发挥作用。因此,本研究从加州鲈肠道分离出芽孢杆菌,通过溶血性、产酶性能、拮抗诺卡氏菌、人工胃肠液耐受能力和药物敏感性等方面筛选出性状优良的菌株,并将芽孢杆菌添加在饲料中饲喂加州鲈,评价芽孢杆菌对加州鲈的益生效果,筛选对加州鲈生长性能促进效果最显著益生芽孢杆菌。
本研究从加州鲈肠道中分离到96 株芽孢杆菌,根据农业农村部发布的《饲料添加剂品种目录》,我们将枯草芽孢杆菌和短小芽孢杆菌作为试验菌株添加到饲料中。溶血性测定被认为是益生菌筛选过程中的一个重要环节。溶血素是一种非常常见的毒力因子,经常引起宿主贫血和水肿,因此非溶血菌株更适合作为益生菌使用[15]。基于此,我们筛选出了23株无溶血性的芽孢杆菌。微生物在宿主肠道中产生的酶对消化系统有积极作用[17]。微生物进入肠道后可利用肠道环境中的碳水化合物生长并产生大量的消化酶,包括淀粉酶、蛋白酶、纤维素酶和脂肪酶等,它们可以提高食物的消化率,并促进生长[3]。据报道,已有许多可以产生消化酶的益生芽孢杆菌应用在水产养殖中,如鳜鱼源的贝莱斯芽胞杆菌能够产生淀粉酶、蛋白酶和纤维素酶[18];从淡水虾中分离的3 株益生芽孢杆菌能够产生淀粉酶、蛋白酶和脂肪酶,并能够增加肠道消化酶的活性[19];从虹鳟中分离的枯草芽孢杆菌具有产蛋白酶和纤维素酶的能力[20]。在本研究中,分离菌株K-3、K-12、K-13 和K-22 均能产生淀粉酶、蛋白酶、纤维素酶和脂肪酶,具有益生菌的潜力。
判定益生菌安全性的一个重要方面是是否具有耐药性。耐药细菌可以将耐药基因转移到其他细菌上,对人类和自然环境造成潜在的危害,因此,益生菌在投入生产使用前,必须确保菌株的安全性。在本研究中,4 株芽孢杆菌对29 种抗生素中的多种抗生素表现出敏感性。这表明菌株在作为添加剂时可以安全使用。若以菌株为载体表达病毒蛋白或者制备口服疫苗时,尽量避开敏感抗生素,有助于建立以该菌株为主的菌群环境。有研究表明芽孢杆菌能形成生物被膜,且生物被膜稳定、耐受能力强,有助于保护菌株在肠道极端环境中生存[21]。本研究的4 株菌均能形成强生物被膜,这对菌株在肠道内环境的生存起促进作用。具有抑制病原菌活性也被认为是筛选益生菌的重要标准之一[22]。诺卡氏菌是引起加州鲈发病的一种常见致病菌,鱼体感染后死亡率极高[23]。有报道从加州鲈养殖基地的土样中筛选到1株拮抗诺卡氏菌的芽孢杆菌[24]。从黄颡鱼肠道中分离出1 株芽孢杆菌能够拮抗温和气单胞菌(Aeromonassobria)、嗜水气单胞菌等水产病原菌[25]。本研究结果显示,菌株K-3、K-13 能够明显拮抗诺卡氏菌,但是还需要在鱼体水平进一步研究菌株K-3、K-13 拮抗诺卡氏菌的能力。在肠道中存活的能力是另一个重要的益生菌标准。本研究中,菌株在pH 4 的人工胃液和人工肠液中2 h 的存活率均超过80%,表明菌株能够耐受低pH 的人工胃液。
肠道消化酶活性是衡量饲料利用率和宿主消化率的一种被广泛接受的指标[26],我们发现K-13 试验组中的鱼肠道蛋白酶、脂肪酶活性显著高于对照组。而K-13 试验组的增重率显著高于对照组,表明试验组的生长改善可能是鱼肠道酶活性增强的结果,这些酶有助于分解食物分子,有助于更好地吸收营养[27]。Adorian 等[28]和Reda 等[29]在饲料中添加109CFU/g 地衣芽孢杆菌和枯草芽孢杆菌或1010CFU/kg 蜡样芽孢杆菌(Bacillus cereus),饲喂亚洲鲈和非洲鲶60 d 后,亚洲鲈和非洲鲶的蛋白酶、脂肪酶和淀粉酶活性均增加,这与本研究的观察结果一致。IL-10 作为一种抗炎因子,在抑制炎症因子的释放、缓解炎症方面起重要作用,TGF-β 的主要功能是调节免疫系统和细胞增殖[30-31]。IL-8、IL-1β 和TNF-α可以诱导炎症和抵抗细菌和病毒的入侵[30,32]。本研究中,在K-13 试验组加州鲈的主要免疫器官头肾、肠和脾中促炎因子mRNA 表达量相对于对照组下调,抑炎因子mRNA 表达量相对于对照组上调。促炎因子和抑炎因子mRNA 的表达在一定程度上反映了加州鲈的免疫能力。这与在饲粮中添加以沙棘为底物的枯草芽孢杆菌、植物乳杆菌和啤酒酵母固体发酵产物投喂加州鲈[4]和用枯草芽孢杆菌PB6 治疗老鼠肠炎疾病 的结果[33]一致。因此,我们推测K-13 菌株在加州鲈体内能够调节肠道的炎症反应,使养殖动物肠道保持健康状态。

