猪伪狂犬病病毒变异株传代致弱JS18-150株的获得与鉴定

关键词 猪伪狂犬病病毒; 变异株; 传代致弱; 基因缺失; 伪狂犬病疫苗
猪伪狂犬病(pseudorabies, PR)是一种急性传染病,以体温升高、精神萎靡、食欲不振等为主要特征[1]。猪是该病毒的主要天然宿主、贮存者以及传播者[2-4]。不同年龄段的猪均可感染,主要临床症状为妊娠母猪流产、死胎、木乃伊胎,哺乳仔猪死亡率高[5]。PR 是伪狂犬病病毒(pseudorabies virus,PRV)引起,PRV 为线状双联DNA,基因组大小约为145 kb[6]。在PRV 中共发现16 种膜蛋白,包括gB、gC、gD、gE、gG、gH、gI、gK、gM、gL 和gN 等。其中gE 基因是伪狂犬病病毒的主要毒力基因之一,能够诱导细胞融合,加快病毒在细胞之间的传递过程。还能够促进病毒在宿主中枢神经中传播,与gI 蛋白形成gE/gI 复合体,从而作为一个功能单位发挥作用[7]。gE/gI 蛋白复合体能与gC 蛋白共同介导病毒在细胞中的释放[8]。
为了彻底净化伪狂犬病,世界各国都开始进行伪狂犬病疫苗的研发。目前已研制出基因缺失疫苗、弱毒疫苗、重组伪狂犬病毒载体疫苗、亚单位疫苗[9]。基因缺失疫苗因具有稳定、毒力不易返强、免疫原性强、保护时间长、区别免疫动物与自然感染动物等特点[10],在临床上应用最多。其中最具有代表性的疫苗毒株有Bartha 株、Bucharest 株和TK200株[11-12]。虽然疫苗株研制方法不同,但其主要毒力基因gE 均有缺失,以此可更好地区分疫苗免疫猪和野毒感染猪。gE 基因缺失疫苗的广泛应用使该病得到有效控制和消灭成为可能。
20 世纪70 年代,伪狂犬病活疫苗Bartha-K61 株从匈牙利引入我国,用于猪伪狂犬病的防控,并得到很好的控制。但自2011 年以来,使用Bartha-K61 株疫苗免疫过的猪场再次暴发猪伪狂犬病,表现为母猪流产、死胎,仔猪高死亡率,通过分离毒株确认其与经典毒株不同,说明伪狂犬病病毒在我国已发生变异[13]。随后全国各地均报道分离到伪狂犬病病毒的新型野毒株,表明传统疫苗株已不能产生足够的保护力,需要研制出针对变异株的新型疫苗[14-18]。本研究以变异毒株JS18 株为基础,经鸡胚成纤维细胞连续传代获得安全性良好、免疫原性高的JS18-150 株,研究JS18-150 株作为伪狂犬病病毒疫苗候选株的安全性和免疫效果,旨在为预防变异伪狂犬病的流行提供参考。
1 材料与方法
1.1 菌株与试剂
猪伪狂犬病病毒JS 株由武汉科前生物股份有限公司在江西某猪场病料分离、鉴定、保管和供应;鸡胚成纤维细胞(chicken embryo fibroblasts, CEF),由SPF 鸡胚制备而成,SPF 鸡胚购自济南赛斯;猪睾丸细胞(ST细胞)购自美国标准菌种收藏中心;DMEM、2×DMEM 培养基购自Gibco;低熔点琼脂糖购自bioshap;胎牛血清(fetal bovine serum, FBS)购自金源康;猪伪狂犬病病毒gB(PRV gB)抗体ELISA 检测试剂盒购自BioCheck;猪伪狂犬病病毒gE 抗体检测试剂盒购自IDEXX;21 日龄伪狂犬病阴性仔猪购自湖北三湖畜牧有限公司。
1.2 试验组设计
选取15 头猪伪狂犬病阴性的21 日龄仔猪(gBELISA抗体和gE-ELISA 抗体均为阴性),随机分为3组,隔离饲养。JS18株感染组试验猪每头颈部肌肉接种10 头份JS18 株(106.0 TCID50/头份);PRV JS18-150 株免疫组试验猪每头颈部肌肉接种10 头份JS18-150 株(106.0 TCID50/头份);另取伪狂犬病阴性猪5 头不做任何处理作为空白对照组。
1.3 鸡胚成纤维细胞的培养
选取9~10 日龄发育良好的SPF 鸡胚,先用碘酒消毒蛋壳气室部位,再用酒精棉球脱碘,同时在平皿中加入适量Hank’s 液,用镊子在气室中间破壳,去气室蛋壳、气室膜,从胎儿眼睛位置下镊子,轻夹颈部挑出胎儿,快速放入平皿中。将鸡胚去头、四肢和内脏,把胚体转入烧杯中,以挑剪方式把胚体剪至小米粒大小后,转移至适宜大小的锥形瓶中,Hank’s 液清洗3次。加入0.25% 胰酶后快速加盖转入37 ℃水浴锅中消化,将胰酶轻轻倒出,清洗组织3 次,加入含10% 血清乳汉液,吹打组织、静置、过滤,反复吹打7轮直至仅剩骨头渣。悬液过滤后加入细胞瓶,贴壁过夜,得到鸡胚成纤维细胞。
1.4 猪伪狂犬病病毒JS18株的传代培养
取猪伪狂犬病病毒JS18 株0.1 mL 接种CEF 细胞中,置37 ℃含5% CO2的细胞培养箱中继续培养,当细胞病变达到90% 以上时,收获上清液和细胞混合物得到JS18-2 株。按上述方法将猪伪狂犬病病毒JS18 株在CEF 细胞上连续传代至100 代。从第100代连续5 代挑取单个蚀斑,继续传代至第150 代得JS18-150 株。注意观察细胞病变出现的时间、病变率以及细胞病变的形态变化。
1.5 不同代次毒株的全基因组扩增与测序
以GenBank 中PRV 全基因组序列(KP257591.1)作为参考,设计并合成gD/US2 基因鉴定引物(表1)。分别提取猪伪狂犬病病毒JS18 株第1 代、第50 代、第100 代、第130 代和第150 代病毒基因组,利用特异性引物扩增目的基因,鉴定不同代次毒种序列的稳定性。对特异性条带进行胶回收,连接至pEASY-T1载体,构建成功后送至上海生工测序。
1.6 体外生长曲线的绘制
取猪伪狂犬病病毒JS18 株和JS18-150 株分别以0.01 MOI 接种于单层CEF 细胞,分别在接种后12、24、36、48、60、72 h 取样,测定各时间点的TCID50。
1.7 猪伪狂犬病病毒JS18-150 株对仔猪的安全性试验
将JS18 株和JS18-150 株分别经颈部肌肉接种伪狂犬病阴性猪各5 头,1.0 mL/头,病毒含量为1.0×107.0 TCID50/mL,另取伪狂犬病阴性猪5 头作为空白对照组。连续观察14 d,观察疫苗接种猪精神、食欲以及临床表现;与接种前相比,体温是否有升高现象。接种后21 d 采血,分别使用gB-ELISA 和gE-ELISA 检测伪狂犬病病毒gB 和gE 抗体。
1.8 猪伪狂犬病病毒JS18-150 株对仔猪免疫效力试验
选取20 头伪狂犬病阴性的21 日龄仔猪(gBELISA抗体和gE-ELISA 抗体均为阴性),随机分4组,隔离饲养。A、C 组肌注1 头份JS18-150 株(106.0 TCID50/头份),B、D 组肌注1 mL DMEM。免疫后每7 d 进行1 次前腔静脉采血(至攻毒后14 d),检测gB-ELISA 抗体水平。免疫后28 d,连同对照组仔猪采血分离血清,检测血清中的中和抗体。同时A、B 组使用PRV 野毒JS18 毒株滴鼻攻毒,攻毒剂量为107.0 TCID50/头份;C、D 组使用PRV HBZL05 毒株滴鼻攻毒,攻毒剂量为107.0 TCID50/头份。攻毒后观察21 d,测量体温,记录症状,统计发病率和死亡率。对试验猪进行解剖,观察脑、扁桃体病变,并取样进行组织病理学观察。
1.9 数据统计分析
所有数据分析均采用GraphPad Prism8.0 软件进行:使用t 检验进行两组间差异评估,Pgt;0.05(ns)表示差异不显著、Plt;0.05(*)表示差异显著、Plt;0.01(**)表示差异极显著。
2 结果与分析
2.1 CEF细胞中猪伪狂犬病病毒的分离培养结果
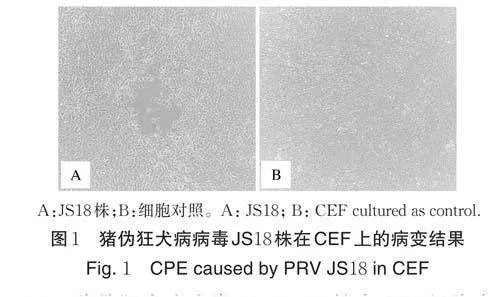
将猪伪狂犬病病毒JS 株接种到CEF 细胞,置37 ℃含5%CO2 的细胞培养箱中培养3~5 d。每日观察细胞病变,待细胞病变达80% 收取细胞上清。将所得病毒株命名为猪伪狂犬病病毒JS18株(图1)。
2.2 猪伪狂犬病病毒JS18-150 株在CEF 细胞中的增殖特性
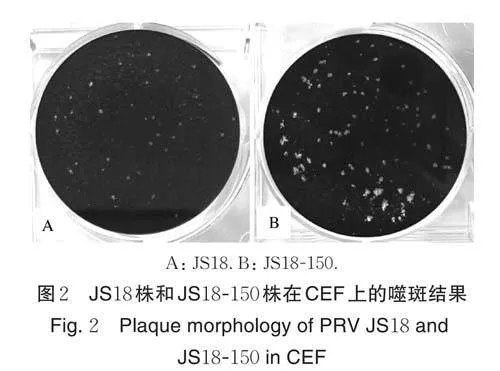
分离得到的野毒株JS18 株在CEF 细胞上传代至150 代,获得高代次毒株JS18-150 株。JS18-150株在体外传代适应性明显提升,表现为相同接种剂量下,JS18-150 株感染细胞后形成病变时间缩短,细胞病变面积增大,且单位面积内噬斑数明显多于JS18 株(图2)。
2.3 PCR鉴定与序列测定结果
分别以猪伪狂犬病病毒JS18 株第1 代、第50 代、第100 代、第130 代和第150 代病毒基因组为模板,以gD/US2 引物进行扩增。PCR 结果第1 代和第50 代毒株扩增产物大小为5 837 bp,第100 代后扩增产物大小为2 629 bp。测序结果显示第50 代与第1 代同源性为100%,ORF 大小均为5 837 bp。第100 代、第130 代和第150 代该毒株均缺失3 208 bp 碱基(从gI基因第269 位核苷酸至US9 基因,包括gI 部分基因、gE 全部基因和US9 全部基因);同时gD 基因第906位碱基发生点突变。结果表明,gI/US2 基因缺失部位稳定,未发生恢复。
2.4 不同代次毒株的滴度测定结果
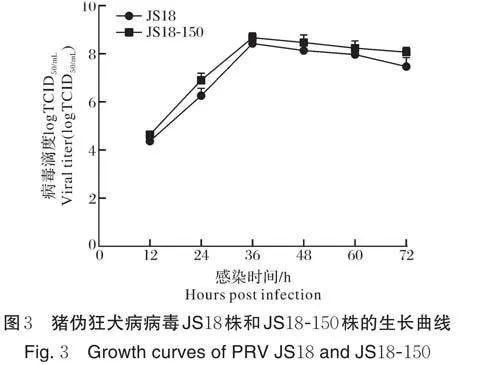
将猪伪狂犬病病毒JS18 株和JS18-150 株分别以0.01 MOI 接种单层CEF 细胞,接毒后不同时间点收集,反复冻融3 次后,对各时间点收集的样品进行毒价测定。结果显示:在CEF 细胞上PRV JS18 株和JS18-150 株的生长趋势基本相同,感染36 h 后,病毒滴度均达到顶峰,随后缓慢下降(图3)。在整个增殖过程中,相同接种时间JS18 株病毒滴度略低于JS18-150 株。
2.5 猪伪狂犬病病毒JS18-150 株对仔猪的安全性
将JS18 株和JS18-150 株接种仔猪后,JS18 株感染组5/5 仔猪出现精神不振、呼吸困难和食欲减退等临床症状,同时仔猪全部死亡(图4)。JS18-150 株和空白对照组所有仔猪均未观察到任何临床症状,且体温正常,均未超过40.5 ℃。观察期间PRV JS18 株感染组试验猪gB 和gE 抗体均为阳性;PRV JS18-150 株免疫组试验猪gB 抗体均为阳性,而gE 抗体均为阴性。
空白对照组gB 和gE 抗体均为阴性(表2~表3)。结果表明,JS18-150 株毒力显著下降,对仔猪具有良好的安全性。
2.6 猪伪狂犬病病毒JS18-150 株对仔猪的免疫保护效果
A、C 组免疫接种后试验猪精神、食欲正常,接种部位无异常;免疫后28 d 免疫组仔猪产生较高的gB抗体水平,PRV 中和抗体效价分别为(63.8±5.08)和(54.6±6.65)(图5a、5b)。B、D 组攻毒后对照组出现体温升高、精神沉郁、食欲废绝等典型症状,并在观察期间全部死亡;A、C 组使用2 种野生型PRV 毒株攻毒均未死亡,获得100% 保护(表4)。
解剖结果发现,B、D 组仔猪攻毒后,猪只脑出血,扁桃体化脓、出血,而A、C 组猪只则无典型病变出现(图6~图7)。取各组的脑和扁桃体组织制备病理切片,可观察到B、D 组脑组织脑膜、脉络膜、脑实质等血管周围淋巴细胞浸润,形成血管“袖套”;扁桃体淋巴细胞坏死,均质红染,吞噬细胞吞噬坏死细胞碎片,而A、C 组猪只则未观察到典型病理变化(图6~图7)。以上结果说明JS18-150 株作为疫苗接种仔猪能够产生良好的交叉保护。
3 讨论
猪伪狂犬病是由猪疱疹病毒引起的以发热、奇痒和脑脊髓炎为主要特征的急性传染病,该病严重制约养猪业的高质量发展。目前针对该病的防控,国内外均以疫苗免疫预防为主,结合配套的gE-ELI⁃SA 抗体检测方法淘汰、净化野毒感染猪,从而实现伪狂犬病的净化。目前,临床应用的猪伪狂犬病疫苗可分为3 类:一是经灭活加入佐剂制备的灭活疫苗;二是利用基因工程技术,使PRV 的相关毒力基因无法表达,毒力致弱同时又保持较高免疫原性而制备的基因缺失疫苗;三是将分离得到的野毒株经异源细胞不断传代得到的自然传代弱毒疫苗[19]。
目前已报道的伪狂犬病自然传代弱毒疫苗有Bartha 株、布加勒斯特株和BUK 株等。其中匈牙利的Bartha 株是将PRV 强毒株在猪肾细胞、鸡胚上反复传代后获得的疫苗株[20]。布加勒斯特株是用伪狂犬病病毒强毒株在鸡胚尿囊液培养后,再用鸡胚培养得到的疫苗株[21]。BUK 株是通过鸡胚和鸡胚成纤维细胞传代获得的疫苗株[21]。该类疫苗由于自然基因缺失、免疫原性优良、生产工艺简便易行等特点,在控制和净化猪伪狂犬病的流行中起到重要作用。
本研究将野毒株JS18 株经鸡胚成纤维细胞连续传代获得JS18-150 株。病毒噬斑结果显示,相比JS18 株,JS18-150 株在细胞形成的空斑明显更大,表明JS18-150 株在鸡胚成纤维细胞上适应性提高。测序结果显示,该毒株传代至第100 代时缺失gI 基因第269 位至US9 全部核苷酸,且挑取的单克隆继续传代至150 代时,缺失部分稳定,均未发生改变。一步生长曲线结果显示JS18 株和JS18-150 株生长动力学相似,即JS18-150 株在传代过程中虽发生缺失,但并不影响其增殖能力。安全性试验结果显示JS18 株免疫组5/5 仔猪出现精神不振、呼吸困难和食欲减退等临床症状,同时4/5 仔猪死亡。而JS18-150 株免疫组所有仔猪均未观察到任何临床症状,且体温正常,均未超过40.5 ℃。说明JS18-150 株毒力显著下降,对仔猪有良好的安全性。中和抗体检测结果显示,免疫后28 d 免疫组PRV 中和抗体效价分别为(63.8±5.08)和(54.6±6.65),PRV-150 株免疫猪体后刺激机体产生显著得抗体水平。攻毒保护试验结果显示,免疫组能100% 抵御JS18 株和HBZL05 株的攻击,未出现任何临床症状,而攻毒对照组出现典型临床症状,且均5/5 死亡。说明JS18-150 株作为疫苗接种仔猪能够产生良好的交叉保护。
研究表明,猪伪狂犬病病毒编码的gE/gI 蛋白可抑制Ⅰ型干扰素的产生,有利于自身复制,其中gE 蛋白通过降解CBP 从而阻碍其与IRF3 结合来抑制IFN-β 的产生,gI 蛋白通过抑制IRF3 的二聚化来抑制IFN-β 的产生[22]。2017 年Lamote 等[23]发现伪狂犬病病毒减毒活疫苗Bartha K61 株感染细胞后能显著增强Ⅰ型干扰素应答,并通过一系列试验最终证明源于gE/gI 复合物的缺失,除此之外gE 的缺失也会增强pDC 中ERK1/2 磷酸化,来诱导更多Ⅰ型干扰素的产生,从而诱导抗病毒反应的发生。以上研究为进一步研究猪伪狂犬病病毒JS18-150 株致弱原因提供了重要参考。

