‘东试早柚’果实无核成因探究

关键词 ‘东试早柚’; 雄性不育; 自交不亲和; 单性结实
柑橘在我国鲜果市场中占据十分重要的地位,2022 年全国柑橘总产量 6 000 余万t,占全球柑橘产量的近40%(FAOSTAT 数据库)。我国柑橘品种培育以易剥皮、有香气、风味足及无核等为主要目标[1]。在柑橘市场竞争日益激烈的大环境中,广大消费者更加青睐无核或少籽的柑橘优良品种。无核品种因食用方便,加工简单且成本低等优点,往往被市场保留下来。
柑橘无核成因主要包括雄性不育、胚囊败育、胚乳败育、自交不亲和及环境因素等。雄性不育在柑橘中是非常普遍的现象,也是导致柑橘无核的主要原因,表现为花粉败育[2],如‘马叙葡萄柚’、温州蜜柑、‘华柚2 号’‘华农本地早橘’等。王蓉[3]利用细胞学、多组学及sRNA-seq(小RNA 测序)发现Cs⁃miR399a.1 是调控柑橘雄性不育及生殖器官发育的重要因子。此外,雌性不育也是导致柑橘无核的重要原因,其主要包括胚囊败育和胚乳败育[4]。肖金平等[5]通过切片观察到‘丽椪2 号’胚囊母细胞在后期完全退化,表明其无核是由胚囊败育导致的;‘桂林良丰’无核的原因同样也是胚囊败育引起的[6]。而胚乳败育导致的柑橘无核,一般是由2x × 4x 与4x ×2x 倍性杂交引起的,打破了正常种子胚和胚乳的倍性比,使胚乳败育,进而导致种子败育[7]。
在柑橘中,自交不亲和及单性结实也是导致其果实无核的重要原因。自交不亲和性(self-incompat⁃ibility, SI)是指植物拒绝或抑制自身的花粉进入花柱而防止自交,促使异交的现象,是植物调节自身来适应环境变化的一种进化策略[8-9]。这个机制保证了植物后代具有丰富的遗传背景,最大限度地使植物更好地适应恶劣的生存环境,避免被自然淘汰[10]。自交不亲和性一般由S 位点的复等位基因控制,S 位点中的S-RNase 蛋白称为花柱决定因子。Liang等[11]利用全基因组重测序及RNA-seq 数据,确定参与柑橘自交不亲和的9 个S-RNase 复等位基因,并且明确不同柑橘品系一般具有不同的S-基因型。单性结实是指一些品种在没有授粉的情况下果实发育的现象;单性结实可分为刺激性单性结实和天然单性结实[12]。当自交不亲和及单性结实能力同时存在时,就可产生无核果实。
‘东试早柚’是云南西双版纳东风农场试验站实生选育的特早熟无核优良品种,故称为‘东试早柚’,是云南热带亚热带地区主要的柚栽培品种之一,在全省种植面积达0.8 万hm2以上,且种植面积仍呈上升趋势[13]。但随着‘东试早柚’产业的不断发展,许多产区的果实多籽,其无核性状表现不稳定,也成为制约其进一步发展的重要原因。因此,本研究利用醋酸洋红和苯胺蓝染色法、杂交授粉及分子标记等手段探究‘东试早柚’无核成因,以期为其果实品质提质增效、杂交育种、品种培育及该产业的进一步发展提供重要理论依据。
1 材料与方法
1.1 试验材料
供试柑橘材料包括:西双版纳州景洪市热带作物科学研究所柚试验基地的以‘酸柚’为砧木的23 年生‘ 东试早柚’(Citrus grandis [L.] Osbeck cv.‘Dongshi Zaoyou’)和湖北武汉市洪山区华中农业大学国家柑橘种质资源圃的以‘酸柚’为砧木的8 年生‘沙田柚’(Citrus grandis[ L.] Osbeck cv.‘ Shatiany⁃ou’)及‘沙田柚’ב东试早柚’的F1代杂交群体。
1.2 醋酸洋红染色法及花粉活力检测方法
醋酸洋红染色液的配置参照文献[14]的方法并作适当修改。称取1 g 洋红于100 mL 45% 醋酸中煮沸,冷却过滤后加入4% 铁明矾,避光保存于棕色瓶中备用。
花粉活力测定:载玻片涂上醋酸洋红染色液,用镊子取出花药,捣碎释放花粉粒,染色5 min,使用光学显微镜观察花粉活力。用于检测花粉活力的花粉2 264 粒。
1.3 花粉萌发力检测方法
花粉培养基的制备参照谭美莲[15]的方法并作适当修改。具体成分包括:0.02% MgSO4、0.01%KNO3、0.03% Ca(NO3)2、0.01% H3BO3、15% PEG-4000 以及20% 蔗糖,pH 6.0。花粉萌发力测定:用毛笔蘸取少量花粉,拨弹于培养基中,在恒温(28±2) ℃培养箱中,避光培养12 h 后,用剪去枪尖的枪头吸取萌发的花粉于载玻片上压片,通过光学显微镜观察花粉萌发情况,当花粉萌发长度大于花粉粒直径时视为萌发。用于检测花粉萌发力的花粉数量共505 粒。
1.4 自交和杂交授粉后亲和性鉴定方法
自交授粉亲和性鉴定试验于2022 年2 月11―12 日在西双版纳进行,花粉的采集、保存及授粉参照朱晨桥[16]的方法。苯胺蓝染色法采集已授粉后7 d 的花朵,用镊子取出雌蕊部分置于现配的固定液(无水乙醇∶冰醋酸=3∶1)中,固定时间24 h,用95% 乙醇洗涤2 遍后,置于70% 乙醇,4 ℃冰箱保存备用。亲和性鉴定时弃70% 乙醇,蒸馏水洗涤2~3遍,花柱于4 mol/L NaOH 65 ℃恒温蒸煮1.5 h,中间颠倒2~3 次,待花柱由黄色转变为橙红色,弃NaOH 溶液,用蒸馏水每间隔30 min 洗1 遍,直至花柱由橙红色转变为黄白色,0.1% 苯胺蓝染料染色。加2~3 滴70% 甘油于载破片上,盖上盖玻片,按压至铺平,倒置荧光显微镜观察花粉管的生长情况[17]。杂交授粉亲和性鉴定试验于2022 年4 月11日在武汉进行。
1.5 去雄和非去雄套袋处理
去雄套袋处理为刺激性单性结实,选择‘东试早柚’即将开放的顶端花蕾,去除已开放花朵、小花蕾及畸形花,用镊子小心剥开花瓣,去除花药,保留花丝,尽量不损伤雌蕊,立即套袋,用回旋针固定,作好标记。非去雄套袋处理则为天然单性结实,选择‘东试早柚’即将开放的顶端花蕾,直接套袋。套袋85 d后统计其座果数。
1.6 利用S-RNase 鉴定杂交子代
‘东试早柚’及杂交子代叶片DNA 提取参照程运江[18]的方法。利用已知的2 个S⁃RNase 基因序列[19]设计特异性引物(表1),在‘东试早柚’和‘沙田柚’及杂交子代中进行PCR 扩增。PCR 反应体系20μL,各组分为10.0 μL 2×Taq Mix,0.5 μL F(正向引物10 mmol/L),0.5 μL R(反向引物10 mmol/L),1.0 μL DNA(模板300 ng/L),8.0 μL ddH2O。PCR反应程序为94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,35 个循环,72 ℃终延伸10min,4 ℃保存。1.0% 琼脂糖凝胶(0.5×TBE 缓冲液)电泳检测,Goldview(广州健阳生物技术有限公司)显色后在凝胶成像系统下观察结果。
1.7 数据处理
试验结果的数据采用Microsoft Excel 2010 软件对原始数据进行统计和整理,使用Adobe PhotoshopCC 2019 软件对原始图片进行处理。
2 结果与分析
2.1 ‘东试早柚’生长习性观察
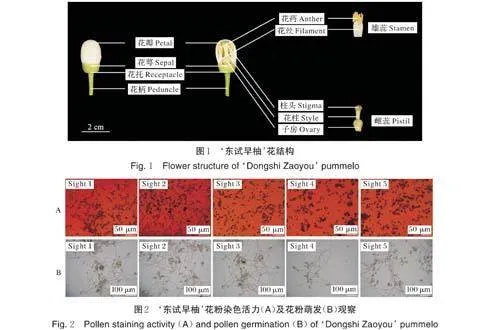
‘东试早柚’树形一般为自然开心形,树势强、花量大、花器官较大,花期以2 月上旬至3 月上旬为主,在热带地区具有周年开花的特性。座果一般以当年12 月及翌年2 月开花为主,果实特早熟,可于7 月下旬至8 月上旬上市。果型呈倒卵形,果皮和果肉浅黄色,果皮易剥,果肉多汁且化渣性好,有香味[13]。在云南热带地区,‘东试早柚’的容器苗栽植3~5 a 后可进入盛产期。从形态学的角度对‘东试早柚’无核成因进行分析,解剖其花结构,观察发现花柄、花托、花萼、花瓣、花药和花丝(雌蕊)、花柱和柱头及子房(雄蕊)等花结构均发育正常且完整,大部分为正常花(图1),几乎无畸形花。同时,观察到‘东试早柚’未散粉前的花药充盈饱满,散粉后呈橙黄色,与正常的大多数柑橘品种的雄蕊花药花粉表型特征一致。
2.2 ‘东试早柚’花粉活力及花粉萌发力检测
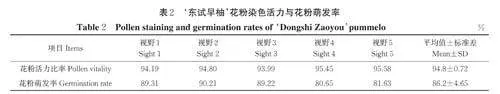
‘东试早柚’花粉染色活力结果如图2 A、表2 所示,5 个视野内具有染色活力的花粉比率分别为94.19%、94.80%、93.99%、95.45%、95.58%,花粉活力比率均值为94.80%。‘东试早柚’花粉萌发试验结果表明,5 个视野内花粉萌发率分别为89.31%、90.21%、89.22%、80.65%、81.63%,萌发率均值为86.20%(图2B、表2)。结果表明,‘东试早柚’的花粉均具有较高的花粉活力及花粉萌发力。
2.3 ‘东试早柚’自交和杂交亲和性及F1 代杂种鉴定
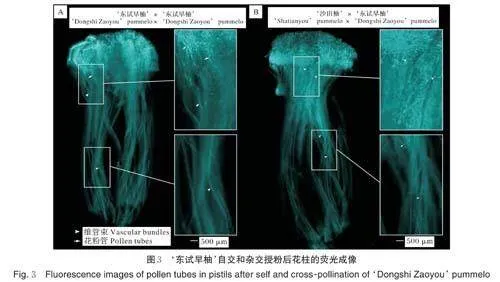
观察‘东试早柚’自交授粉后花粉管的生长萌发状态,发现大量的花粉粒在花柱顶端萌发,但花粉管向子房伸长却受到抑制而停止生长(图3A),表现为不亲和状态。同时,以‘沙田柚’为母本、‘东试早柚’为父本进行杂交授粉,观察发现大量的花粉管向下延伸穿过花柱能够到达雌蕊基部(图3B),表现为亲和状态。
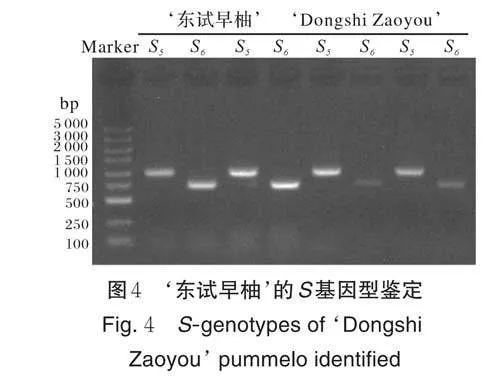
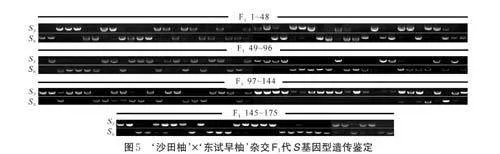
待果实成熟后采摘‘沙田柚’ב东试早柚’杂交果实,取其种子进行催芽播种,共获得F1代杂交群体175 株。通过S 基因型鉴定发现,‘东试早柚’的S 基因型为S5、S6(图4),并进一步利用‘东试早柚’SRNase对F1 代杂交群体进行遗传鉴定,扩增结果表明:在F1代中有85 株杂交后代含有与其父本相同的S5-RNase 特异性条带,79 株杂交后代含有与其父本相同的S6-RNase 特异性条带,11 株杂交后代未检测到与其父本相同的S-RNase 特异性条带(图5)。因此共获得以‘ 东试早柚’为父本的真杂种后代164 株。
2.4 ‘东试早柚’单性结实能力鉴定
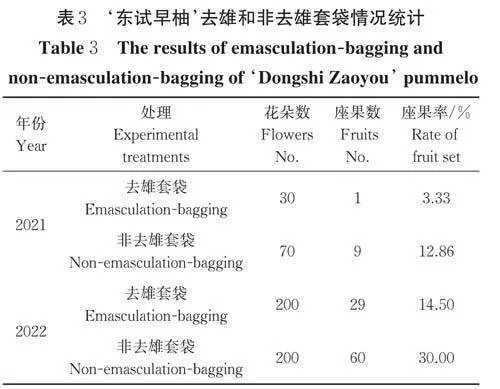
单性结实一般是指在子房未经授粉或授粉但未受精而产生无核果实的性状。2021―2022 年对‘东试早柚’进行去雄套袋和非去雄套袋的田间重复性试验,第1 年去雄套袋30 朵,挂果数为1,座果率为3.33%,非去雄套袋70 朵,座果数为9,座果率为12.86%;第2 年去雄套袋200 朵,挂果数为29,座果率为14.50%,非去雄套袋200 朵,挂果数为60,座果率为30.00%(表3)。连续2 a 的去雄套袋和非去雄套袋平均座果率分别为13.04%、25.56%。结果表明,‘东试早柚’具有较强的单性结实能力,其非去雄套袋的座果率显著高于去雄套袋的座果率。
3 讨论
植物界显花植物的花一般由花托、花萼、花瓣、雄蕊和雌蕊构成,而雄蕊由花丝和花药构成,花丝主要负责花药所需各种营养物质的运输,花药则是产生花粉粒的器官,因此花药能否正常发育很大程度上决定了植物的育性[20]。根据花药败育的形式,雄性不育可分为花药原基、绒毡层细胞、花粉壁、减数分裂和胼胝质代谢异常等类型[21]。叶丽霞[14]通过形态学观察‘华农无核椪柑’花药发育过程发现,‘华农无核椪柑’花药散粉较少,花粉粒多数无活性,在体内外都无法正常萌发且减数分裂异常。李蒙蒙[22]基于石蜡切片及扫描电镜等方法发现,‘抛橘’花粉的染色活力和花粉萌发力处在一个正常的水平且花粉粒超微结构形态大部分为正常形态,排除了‘抛橘’雄性不育的可能性。本研究从形态学角度对‘东试早柚’的花进行解剖发现,其雄蕊、雌蕊等花结构发育完整,且肉眼观察到花药及花粉与正常的柑橘品种表现相近,因此排除畸形花是其无核的可能。此外,本研究检测了‘东试早柚’花粉活力比率、花粉萌发率,二者均处于较高水平,因此可初步排除雄性不育是导致其无核的可能。
柑橘自交不亲和是指花结构完整且生殖系统均能正常发育,如‘琯溪蜜柚’‘缅甸柚’等[19],但发育成熟的花粉在花柱顶端受到阻止或干扰而不能向下生长,这也是导致柑橘无核的普遍原因之一[23]。梁梅[19]基于甜橙及克里曼丁橘测序数据和60 份柚资源的转录组数据,定位到控制柑橘自交不亲和性的S⁃RNase 基因。韦壮敏等[24]利用同样的方法,挖掘到柑橘S 遗传位点12 个新的S⁃RNase 基因并鉴定了63份柚材料的S 基因型。因此,S 基因型可作为分子标记用于种质鉴定,冯意斯[25]利用多对S-RNase 多态性引物鉴定了93 份三倍体‘沃柑’子代的遗传背景,明确其中2 份子代为‘砂糖橘’和‘沃柑’的杂交后代,而其余91 份三倍体后代可能为‘沃柑’自交授粉后染色体同源重组产生的。本研究观察发现‘东试早柚’自交授粉表现为不亲和,同时以‘东试早柚’为父本、‘沙田柚’为母本进行杂交授粉,鉴定表现为亲和,表明自交不亲和性是导致其无核的重要成因,而杂交亲和则是导致部分产区无核性状不稳定的重要原因。此外,‘沙田柚’ב东试早柚’杂交果实成熟后,利用‘东试早柚’S-RNase 从杂交子代中共鉴定到164 株为真杂种后代,且子代中含有S5-RNase 与S6-RNase 比值约为1。综合以上结果,‘东试早柚’果实无核并非由雄性不育引起。
单性结实是许多作物产生无核果实的重要原因。目前柑橘品种温州蜜柑、‘黔阳无核’椪柑、克里曼丁橘和大多数脐橙等均具有一定的单性结实能力和座果率[26-28]。赵科科[29]通过转录组测序及关键基因的挖掘及功能分析,初步解析了‘琯溪蜜柚’和‘沙田柚’单性结实的生理和细胞学基础,并明确了‘琯溪蜜柚’单性结实能力显著高于‘沙田柚’。本研究对‘东试早柚’进行去雄套袋和非去雄套袋处理来探究其单性结实能力,连续2 a 的田间重复性试验结果显示,去雄套袋后平均座果率(13.04%)显著低于非去雄套袋平均座果率(25.56%),表明‘东试早柚’具有较强的单性结实能力,且天然单性结实能力高于刺激性单性结实,推测原因可能是由于去雄处理过程损伤了花柱、花瓣和花丝等花结构,导致其刺激性单性结实能力下降。
在柑橘无核机制研究中,雄性不育、自交不亲和等因素是导致果实无核的重要原因。本研究利用形态学、分子标记等方法虽初步厘清了自交不亲和性和单性结实是‘东试早柚’无核的重要成因,但未解析其相关的基因调控网络。未来可进一步利用基因组、转录组、代谢组等多组学手段,探究‘东试早柚’自交不亲和、单性结实及自交不亲和与单性结实之间的相互作用来解析其无核成因的分子机制。

