脐带间充质干细胞对卵巢早衰家兔线粒体的影响
张娟, 李阳, 闫夏贝, 刘杰, 庹平
(1.中部战区总医院 生殖医学科, 湖北 武汉 430070; 2.武汉科技大学 医学院, 湖北 武汉 430081)
卵巢早衰(premature ovarian failure,POF) 是指40岁以下女性出现卵泡发育不良和卵巢过早老化,引起持续性闭经和性器官萎缩并伴有雌激素缺乏及促性腺激素水平升高的一种综合征[1]。其发病机制尚不清楚,与许多复杂因素有关,主要有遗传缺陷疾病[2]、自身免疫疾病和化疗损伤等医源性因素[3-4]。常用的激素替代疗法只能缓解低雌激素导致的围绝经期综合征,并不能有效恢复卵巢功能,而且超量使用激素会出现相应的副作用。因此,需要积极寻求治疗POF的新方法[5-6]。间充质干细胞(mesenchymal stem cells, MSCs)因其固有的再生特性在医学中备受重视[7-8]。MSCs是一种多能干细胞,免疫原性差,且获取途径多样。其中人脐带来源的间充质干细胞获取较为容易,也无创伤,且引发的伦理问题较少,是极好的来源途径[8-10]。脐带间充质干细胞能够分泌许多细胞因子和生长因子、信号脂质、信使RNA和调节性miRNA等[11],这些因素与细胞间通讯、细胞信号传导及细胞或组织代谢的变化有关。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)能同时激活多种机制(营养、旁分泌、免疫调节和分化)来影响受损组织再生的所有阶段,从而改善卵巢功能[12]。本课题组前期已成功构建了家兔卵巢早衰模型[13],并发现环磷酰胺诱导的家兔POF模型在注射UCMSCs治疗后,早衰卵巢的结构和功能得到改善,细胞凋亡情况减少,雌二醇(estradiol,E2)上升,促卵泡生成素(follicle-stimulating hormone,FSH)下降,UCMSCs可能通过上调富半胱氨酸蛋白61和结缔组织生长因子的表达,从而激活休眠卵泡生成、恢复卵巢功能,对POF起到治疗作用[14]。为进一步探究UCMSCs治疗POF的作用机制,本研究以家兔为对象,观察UCMSCs治疗后颗粒细胞凋亡比例、线粒体超微结构变化以及线粒体DNA(mitochondrial deoxyribonucleic acid,mtDNA)的拷贝数变化,研究UCMSCs对卵巢早衰家兔线粒体的影响。
1 材料与方法
1.1 实验动物
雌性未交配日本大耳白兔15只,2.5~2.8 kg,月龄5月左右,购自武汉万千佳兴生物科技有限公司[SCXK(鄂)2018-0022],饲养于中部战区总医院医学实验中心[SYXK (鄂)2019-0082]。本研究经中部战区总医院伦理委员会批准(审批号:2022211)。
1.2 主要试剂与仪器
EnTurboTMSYBR Green PCR SuperMix(EQ001)、FSH/ E2 ELISA Kit (ELK9279/1208)均购自武汉ELK公司;tunel试剂盒(11684817910)购自北京Roche公司;MesenCultTMOsteogenic/Adipogenic/Chondro Differentiation Kit(05465/05412/05455)均购自加拿大stemcell technologies公司;Anti-CD90/34/105/45均购自美国BD Biosciences公司;荧光定量PCR仪(QuantStudio 6 Flex System)购自武汉Life technologies公司;倒置荧光拍照显微镜(IX51)购自日本OLYMPUS公司;酶标仪(DR-200Bs)购自Diatek公司;透射电子显微镜(HT7800)购自HITACHI公司;注射用环磷酰胺(cyclophosphamide,CTX)购自德国Baxter Oncology GmbH公司。
1.3 实验方法
1.3.1 分组与模型制备
随机分组,正常对照组3只,POF模型组和UCMSCs治疗组各6只。根据前期研究,采用连续2 d腹腔注射50 mg/kg环磷酰胺构建POF模型,注射环磷酰胺后,各组家兔都有脱毛情况,采食量变少、活动量减少、E2和FSH水平变化及卵巢指数变化等。
1.3.2 UCMSCs治疗
(1)UCMSCs的培养及鉴定 脐带标本取自本院妊娠37周以上产妇胎儿,已获中部战区总医院伦理委员会批准(审批号:2016020)。将洗净的脐带剪成2~3 cm的小段,剔除脐动静脉,剥离华通胶,用无菌眼科剪将华通胶剪成1 mm2的小组织块,转移至细胞培养瓶中,加入10%胎牛血清、青霉素/链霉素及完全培养液,于5% CO2、37 ℃的培养箱中静置培养,待细胞长至80%~90%融合时用胰蛋白酶消化液消化冻存或传代。每3 d按1∶3体积比传代。取第3代UCMSCs,制成悬液于EP管,分别加入抗体CD90、CD34、CD105、CD45,流式细胞仪检测结果显示:贴壁细胞表达CD90和CD105,不表达CD34和CD45,为人体脐带间充质干细胞(图1)。取第3代UCMSCs,将细胞以(1.5×105)/孔接种于培养皿中,分别标记为正常组、成骨组、成脂组和成软骨组。待细胞长到70%~80%汇合度时分别将成骨组的培养基、成脂组的培养基、成软骨组的培养基换成相应的诱导液,正常组继续用完全培养基培养,每2~3 d换液一次,镜下观察,发现明显钙结节进行茜素红染色、发现明显脂滴进行油红O染色、在诱导的21 d行阿利新蓝染色,证明UCMSCs的成骨、成脂及成软骨分化潜能(图2)。
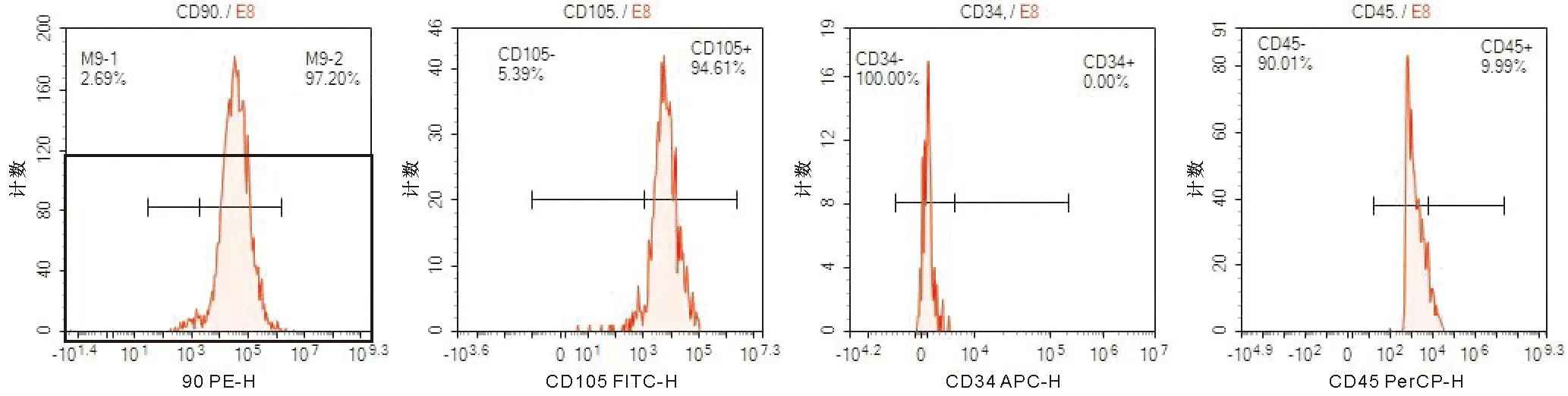
图1 UCMSCs的流式检测结果Figure 1 Flow detection results of UCMSCs
(2)治疗方法 UCMSCs治疗组的6只家兔在造模后第3天连续注射3 d的UCMSCs悬液,细胞数为(5×106)/mL,每天2 mL。卵巢早衰模型组注射同等的灭菌用水。
1.3.3 观察指标
在造模前、治疗后1、7和14 d,通过耳缘静脉采取3组家兔静脉血,离心(3 000 r/min,10 min)取上清,血清于-80 ℃冰箱保存。在治疗后14 d处死后取材,取3组家兔双侧卵巢,清洗并称质量,切取适量卵巢组织放在4%多聚甲醛中固定,固定后石蜡包埋,5 μm切片备用;切取米粒大小组织放入电镜固定液中,另取所需量新鲜组织冻存在-80 ℃冰箱中。
(1)卵巢指数 生理盐水清洗血迹,剥离多余脂肪组织后,用电子天平称取卵巢湿重并记录;卵巢指数=卵巢湿重(g)/家兔体质量(kg)。
(2)血清E2和FSH水平 取出-80 ℃冰箱保存的血清,Elisa法检测血清中E2和FSH水平。
(3)卵巢颗粒细胞凋亡检测 每个卵巢组织石蜡切片随机选取3张切片,经脱蜡,蛋白酶K消化,37 ℃水浴锅孵育30 min;加入破膜液,取tunel试剂盒中的试剂1和试剂2按体积比1∶10混合,配制适量孵育液,4 ℃过夜;滴加DAPI染核,室温避光孵育20~30 min;用抗荧光淬灭封片剂封片,显微镜下观察拍照,IPP软件计数。
(4)电镜观察线粒体形态 取出电镜固定液中的卵巢组织,1%锇酸避光室温固定;组织依次加入不同体积分数的乙醇和100%丙酮上行脱水;丙酮:812包埋剂渗透包埋;包埋板放于60 ℃烤箱聚合48 h;超薄切片后用150目方华膜铜网捞片;铜网先在2%醋酸铀饱和酒精溶液中染色;然后再2.6%枸橼酸铅溶液中避二氧化碳染色;透射电镜观察卵巢组织中线粒体的超微结构形态。
(5)RT-PCR法检测卵巢组织中mtDNA拷贝数 取20 mg卵巢组织于1 mL预冷的TRIpure中充分研磨,加入三氯乙烷混匀-离心-取上清液-加入异丙醇混匀-离心-弃上清-加入75%乙醇清洗RNA沉淀-离心-弃上清,加入RNase-Free Water充分溶解RNA,采用EntiLink 1stStrand cDNA Synthesis Kit试剂盒合成cDNA,最后使用EnTurboTMSYBR Green PCR SuperMix进行PCR扩增。引物:Rb-ACTIN:上游:5’-CCCAGATCATGTTCGAGACGT-3’,下游:5’-TAGC-CCTCGTAGATGGGCAC-3’;Rb-mtDNA:上游:5’-CGAAAAATCTTAGGGTACATACAAC-3’,下游:5’-TTAGGTTGACTAGTGGGTAAGGTAT-3’,采用2-ΔΔCT法进行mtDNA拷贝数结果的计算。
1.4 统计学分析

2 结果
2.1 卵巢指数比较
正常对照组卵巢指数为(0.0567±0.0475),POF模型组卵巢指数为(0.0379±0.0239)。与对照组相比,模型组卵巢指数降低,差异有统计学意义(P<0.05);UCMSCs治疗组卵巢指数为(0.0436±0.0125),与模型组相比,治疗组卵巢指数升高,差异无统计学意义(P>0.05);3组的卵巢指数比较差异有统计学意义(F=27.764,P<0.05)。
2.2 各组E2和FSH值比较
各组在造模前血清E2和FSH水平差异无统计学意义(FE2=0.032,PE2>0.05;FFSH=0.289,PFSH>0.05)。造模后模型组家兔E2值一直较低、FSH值一直较高,未随时间出现规律性变化,与正常对照组相比,差异有统计学意义(t治疗后1d E2=3.016,t7d E2=4.247,t14d E2=14.931,P<0.05;t治疗后1d FSH=-4.562,t7d FSH=-8.015,t14d FSH=-9.038,P<0.05)。干细胞干预后治疗组家兔血清E2水平上升,FSH水平下降,并且随着时间出现周期性波动,与模型组相比差异具有统计学意义(t治疗后1d E2=-6.896,t7d E2=-3.573,t14d E2=-45.964,P<0.05;t治疗后1d FSH=3.136,t7d FSH=4.424,t14d FSH=8.872,P<0.05),见图3、4。
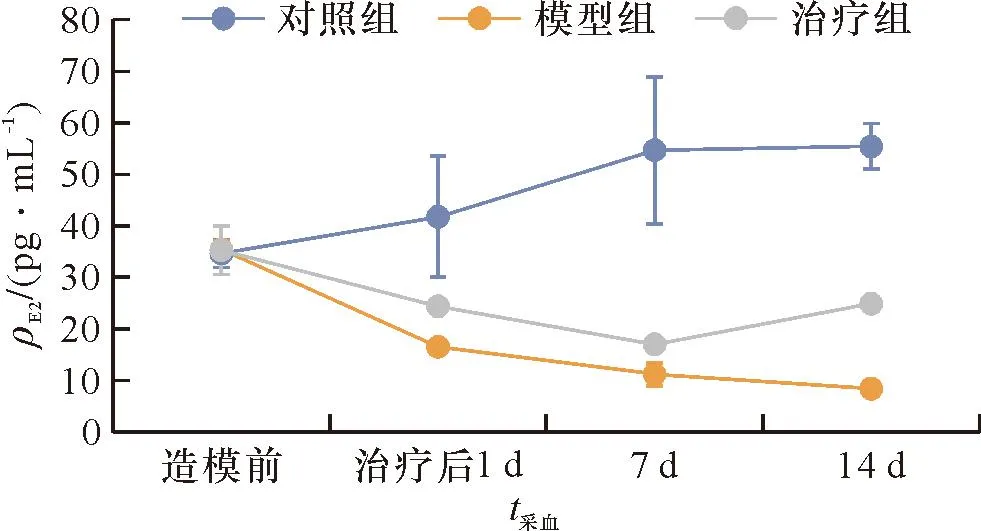
图3 3组不同采血时间点的E2水平Figure 3 E2 levels in the three groups at different blood collection time points
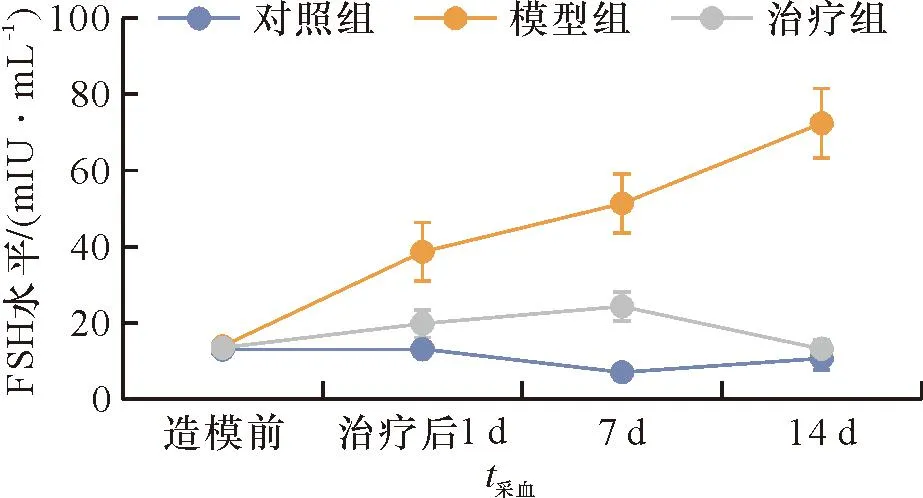
图4 3组不同采血时间点的FSH水平Figure 4 FSH levels in three groups at different blood collection time points
2.3 卵巢颗粒细胞凋亡检测
正常对照组卵巢颗粒细胞凋亡数较少,散在分布,平均表达数为(1.51±0.24);POF模型组卵巢颗粒细胞凋亡数明显增多,均匀分布,平均表达数为(50.66±7.32),与正常对照组相比有差异(t=-11.442,P<0.05);UCMSCs治疗组卵巢颗粒细胞凋亡数较模型组减少,平均表达数为(27.89±4.97),与模型组比较,差异有统计学意义(t=4.400,P<0.05)。3组凋亡率比较,差异有统计学意义(F=69.57,P<0.05),见图5、6。

A:正常对照组; B:模型组; C:治疗组A: Normal control group; B: Model group; C: Treatment group图5 卵巢颗粒细胞凋亡图Figure 5 Apoptosis of ovarian granulosa cells
2.4 电镜下卵巢组织线粒体形态变化
正常对照组中卵泡颗粒细胞的细胞核较大,圆形色淡,核仁偏位,并常见有分裂迹象。细胞质内有丰富的线粒体、发达的粗面内质网等细胞器;线粒体,呈圆形或长椭圆形,散在分布。POF模型组卵泡颗粒细胞核皱缩明显,线粒体结构排列紊乱、肿胀及空泡变,线粒体体积变大、基质变浅等,粗面内质网扩张或囊泡化,或互相离散。UCMSCs治疗组卵泡颗粒细胞核皱缩不明显,散在分布正常及异常线粒体结构,线粒体嵴部分尚存,伴空泡,见图7、8。

A:正常对照组; B:模型组; C:治疗组A: Normal control group; B: Model group; C: Treatment group图7 透射电镜下的线粒体形态改变(×2 500)Figure 7 Morphological changes of mitochondria under transmission electron microscopy(×2 500)
2.5 卵巢组织中mtDNA拷贝数变化
正常对照组卵巢组织中mtDNA拷贝数均值为(1.04±0.12),POF模型组卵巢组织中mtDNA拷贝数较少,均值为(0.26±0.10),与正常对照组相比差异有统计学意义(t=8.789,P<0.05);而UCMSCs治疗组卵巢组织中mtDNA拷贝数明显增加,均值为(0.66±0.14),与模型组相比,差异有统计学意义(t=-4.097,P<0.05)。3组卵巢的卵巢组织中mtDNA拷贝数比较差异有统计学意义(F=32.89,P<0.05),见图9。
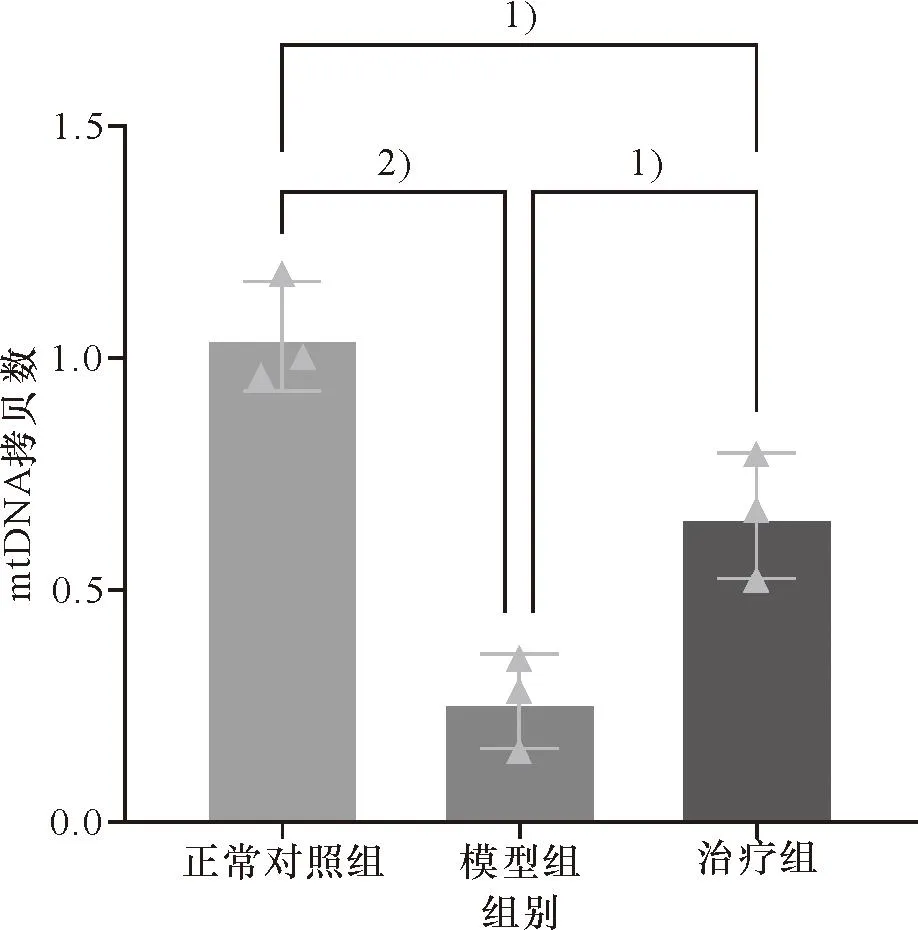
1)P<0.05; 2)P<0.01图9 卵巢组织中mtDNA拷贝数Figure 9 Copy number of mtDNA in ovarian tissue
3 讨论
近年来,众多研究表明间充质干细胞治疗是较好的细胞疗法之一[15-16]。间充质干细胞来源广泛,而较为常用的是UCMSCs[17]。UCMSCs能分化为成骨细胞、脂肪细胞、软骨细胞、上皮样细胞、平滑肌细胞及神经元样细胞等多种类型的细胞,且取材简单、免疫原性低和伦理争议少,在医学中具有广阔的应用前景。目前研究表明,UCMSCs已在许多疾病的治疗中发挥重要作用,如卵巢早衰、糖尿病、肝损伤、骨损伤等[18-20]。
线粒体是存在于颗粒细胞和卵母细胞内、具有核外遗传物质、可独立进行转录和翻译的半自主细胞器,参与许多基本的细胞功能调节。线粒体内膜向内褶皱形成“嵴”,线粒体嵴上有许多线粒体基粒,这些基粒可利用呼吸链合成ATP,线粒体分布不规则及空泡化结构改变是卵母细胞损伤的标志[21]。线粒体结构的紊乱变化会影响卵母细胞的发育,可能导致卵巢储备功能下降甚至衰退[22]。mtDNA是线粒体独立拥有的一组遗传物质,编码着线粒体呼吸链上的13种蛋白[23]。mtDNA拷贝数的减少会影响呼吸链上13种蛋白亚基的转录和翻译,从而导致线粒体功能异常[23]。研究发现[24-25],线粒体功能异常可造成卵母细胞及其周围卵丘颗粒细胞的功能障碍和凋亡,导致卵泡闭锁甚至衰竭。上述研究提示线粒体异常与卵巢衰老密切相关。
本研究显示:与正常对照组相比,造模后卵巢指数明显降低,POF模型组家兔一直处于低E2和高FSH状态,颗粒细胞凋亡比例明显升高,影响卵母细胞的生长与发育,均显示了环磷酰胺对卵巢的损伤,模型在生理上能基本代表人POF。同时观察发现,POF模型组家兔卵巢组织线粒体结构紊乱、完全空泡化,大量线粒体嵴消失,mtDNA拷贝数明显减少,表明卵巢早衰与线粒体损伤存在相关性,卵巢衰老伴随线粒体结构紊乱和功能异常。经UCMSCs耳缘静脉注射治疗后,POF家兔卵巢指数升高,血清FSH值降低、E2值升高,颗粒细胞凋亡明显减少,卵巢组织的线粒体结构中间虽有空泡化,但线粒体嵴部分尚存,mtDNA拷贝数也增加,提示线粒体损伤修复可能在UCMSCs治疗卵巢早衰中起作用。最近的观察表明,在许多情况下,干细胞只短暂地出现在受损组织中,但它们在短暂出现期间,会限制组织破坏或通过各种机制加强修复受损组织,这些机制包括为促进组织内源性干细胞的增殖和分化提供合适的环境;上调过度免疫反应的基因;转移含有线粒体和microRNA的囊泡成分;上调炎症反应的基因[26]。研究阐明[27-28],UCMSCs有能力将自己的线粒体转移到mtDNA耗尽的细胞中,转移的mtDNA可以恢复线粒体呼吸链和氧化磷酸化等一系列重要的细胞功能,表明UCMSCs可以作为一种潜在的治疗手段,线粒体的转移为UCMSCs治疗与线粒体功能障碍相关的疾病提供了合理的依据。
综上所述,POF伴随着mtDNA拷贝数的减少和线粒体结构的破坏,经UCMSCs治疗后,mtDNA拷贝数较前增加,线粒体结构部分恢复,提示UCMSCs对POF的治疗可能是通过修复线粒体损伤来减少细胞凋亡和组织修复来完成的,但其通路机制仍需进一步探索。
作者贡献声明
张娟:提出研究思路和框架,完善课题,修改论文;李阳:实验操作,撰写论文;闫夏贝:设计及指导实验,撰写论文;刘杰:指导实验步骤,协助实验完成;庹平:指导文献的查找和实验步骤。
利益冲突声明
本研究未受到企业、公司等的第三方资助,不存在潜在利益冲突。

