高良姜素对利血平诱导的抑郁模型小鼠的影响
冯真英, 周中流, 陈丹, 彭素绢, 李观同, 孙玉香, 黄丽平*
(1. 广东医科大学 附属第二医院 药学部, 广东 湛江 524001; 2. 岭南师范学院 化学化工学院, 广东 湛江 524048)
抑郁症是一类以精神障碍为突出表现的中枢神经系统疾病,症状表现为患者长时间和持续的情绪低落,反应迟缓。经世界卫生组织统计,有近4亿人正饱受抑郁症的困扰,约占世界人口的4.4%,特别是在如今新冠病毒大流行的特殊时期,10年后抑郁症可能成为人类劳动能力低下甚至丧失的首要原因[1]。而目前广泛使用的抗抑郁药物具有很大局限性,如SSRIs和三环类等抗抑郁药物,大多都有明确的不良反应、价格高、停药易复发等缺点[2],因此开发安全有效的预防抑郁症及缓解抑郁症状的药物是当今社会亟须解决的问题。近年研究表明,中医药防治抑郁症优势突出,不仅疗效显著,而且毒性较小,可以长期服用。
高良姜是一种药食同源的温里药,其性味基本稳定,从古至今药学书籍记载其特性基本一致,多以辛、苦、大温、无毒为主,在医用及日常应用方面都有突出的贡献。高良姜素是高良姜(alpiniaofficinarumhance)中的一种天然黄酮类化合物。近年研究提示,高良姜素具有修护皮肤、抑制炎症、抗糖尿病、抗肿瘤及其并发症、抗纤维化、抗病原微生物及神经保护等多种药理活性[3],其应用前景广阔。研究表明,高良姜素可改善APP/PS1小鼠海马神经元受损情况,其机制可能与介导Akt/MEF2D/Beclin-1转导途径有关[4]。另外,抑郁患者常常伴有胃肠功能障碍或慢性胃病,而胃肠功能紊乱又会导致抑郁症的症状加剧。高良姜黄酮类成分能显著改善胃黏膜血管血流、抗氧化和预防胃黏膜损伤[5]。另外,最新研究表明,胃肠道菌群可经脑-肠-菌轴干预消化道疾病的进展,脑肠肽是脑-肠轴的神经肽信号,脑肠肽分泌异常,抑制五-羟色胺(5-HT)的分泌,可刺激胃酸分泌,促进胃肠运动,导致焦虑和抑郁的发生[6]。然而,高良姜素可否通过改善胃肠功能而发挥抗抑郁作用仍未见报道,值得进一步探讨。基于此,本研究以氟西汀治疗作为阳性对照组,观察利血平诱导的抑郁小鼠海马和皮质中应激因子超氧化物歧化酶(SOD),丙二醛(MDA),谷胱甘肽过氧化物酶(GSH-Px)及5-HT水平变化和自噬的影响,旨在为其抗抑郁治疗提供药理学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
60只SPF级小鼠,体质量(20±2)g,6月龄,购自广东省医学实验动物中心,生产许可证:SCXK(粤)2018-0002。温度指示计维持温度在18~29℃,相对湿度55%,动物房持续换气。合格证编号:44007200101764。本研究获得广东医科大学动物伦理委员会批准(审批号:GDY2302382)。
1.1.2 主要试剂
盐酸氟西汀(广医第一附属医院药房,批号:1798A);高良姜素(纯度99.94%,成都曼思特生物科技有限公司,货号:548-83-4);SOD、MDA、GSH-Px和5-HT Elisa试剂盒购自Mlbio公司,货号分别为:ml29197-1、mlsh0939、m1058194、m1001891;P62、Beclin-1、LC3B和GAPDH一抗均购自英国艾博抗公司,货号分别为:ab240635,ab302670,ab192890,ab9484;RIPA裂解液购自索莱宝科技公司;BCA、电泳液和转膜液等均购自Beyotime Biotechnology公司;3MA(货号R022011)和利血平(货号R006853)均购自北京索莱宝生物科技公司。
1.2 实验方法
1.2.1 造模与干预
取模型小鼠60只,随机分为正常组、模型组、氟西汀组(15 mg/kg)、高良姜素高剂量组(100 mg/kg)、高良姜素低剂量组(25 mg/kg)和自噬抑制组(3MA组)(30 mg/kg),每组10只。按照0.1 mL/10 g对各组小鼠灌胃,连续7 d。第7天灌胃,模型组及各给药组即刻腹腔注射生理盐水配制的2.5 mg/kg利血平溶液0.1 mL/10 g,正常组腹腔注射等体积的生理盐水。
1.2.2 强迫游泳实验
实验在有机玻璃缸(25 cm×10 cm×15 cm),游泳时水温控制在(24±2)℃,控制水位使小鼠游泳时尾巴不能触碰到圆筒底部。强迫游泳6 min,观察记录后4 min内小鼠累计不动时间。当小鼠浮于液面、停止挣扎时开始记录累计不动时间[7],每次实验后清理并更换纯净水。
1.2.3 悬尾实验
悬尾实验的累计停滞时间能反映实验动物的抑郁绝望状态[8]。计算造模7 d时和给药后小鼠悬尾不动时间来评估小鼠的绝望情况。将小鼠的尾端距尾尖1 cm处黏贴在盒子顶部。小鼠的头部向下,距离盒子底部约20 cm。实验持续5 min。当悬吊的小鼠没有明显挣扎时,被认为是静止的。记录实验后5 min内小鼠的累计静止时间,每次只操作1只小鼠。适应1 min后,待小鼠停止挣扎,静止不动为悬尾不动时间。
1.2.4 旷场实验
采用旷场实验进行小鼠焦虑抑郁程度检测。将实验小鼠移置到透明箱子中(50 cm×50 cm×40 cm),以距离箱壁25 cm 的正方形区域为中心区域。小鼠因趋触性喜欢紧贴墙壁,这在有焦虑样行为的小鼠中表现更为明显,即焦虑程度较低的小鼠出现并停留在旷场中心区域的时间更多。每只小鼠分别被放置在箱子中心位置,给药1 h后,将小鼠放入旷场内,观察并记录小鼠在5 min内的运动活动情况,包括水平运动次数、后肢站立次数,每次只操作1只,每次测试后及时清理动物排泄物[9]。
1.2.5 糖水偏好实验
待给药结束,各组小鼠单只分笼饲养,笼子里放置2瓶1%糖水的饮水瓶,1 d后更换其中1瓶为纯水,放置1 d。适应训练结束后,禁水1 d后开始实验:鼠笼放置1%糖水和纯水各1瓶,1 d后称取并记录糖水和纯水的消耗量,计算糖水偏好比。
1.2.6 Elisa检测应激因子SOD、MDA、GSH-Px和5-HT水平
将各组小鼠皮质加入9 倍预冷生理盐水并置于匀浆器中研磨,4000 r/min离心10 min,吸取上清液待测,每孔加上清液10 μL和样品稀释液90 μL,随后分别严格按SOD、MDA、GSH-Px和5-HT的Elisa试剂盒说明书操作。
1.2.7 免疫荧光检测LC3B的表达
小鼠脑组织经过4%多聚甲醛固定,脱水包埋处理后,将切片脱蜡至水;在3%H2O2中浸泡10 min;0.01 mol/L柠檬酸钠缓冲液微波加热对抗原修复;遮光封闭滴加LC3B抗体(1∶50)置于37 ℃恒温箱1 h,加入羊抗兔二抗置于恒温箱20 min,抗淬灭封片;PBS作为阴性对照;显微观察拍照,呈蓝色荧光即为阳性表达,最后进行图像分析。
1.2.8 Western blot检测Beclin-1和P62水平
将各组小鼠的海马组织加入含蛋白酶抑制剂的裂解液,冷冻匀浆,12 000 r/min下低温离心10 min, BCA法测蛋白质浓度,定量后用于Western blot检测。在110 V,55 min条件下进行电泳,上样量为30 μg总蛋白,湿法转膜,条件为300 mA、90 min,兔抗小鼠Beclin-1、P62和 GAPDH一抗(1∶1000),山羊抗兔二抗(1∶2500),ECL试剂盒在CLD检测器中检测。结果以各目的蛋白与GAPDH灰度值比值表示,用Image-pro进行分析。
1.3 统计学分析
统计分析软件采用SPSS 19.0。计量资料以均数±标准差表示,通过软件中One-way ANOVA及t检验对行为学观测指标进行统计分析。免疫组化结果采用Image J进行灰密度分析,然后结合SPSS 19.0进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 高良姜素对利血平诱导的抑郁症小鼠的影响
与正常组相比较,悬尾实验中模型组小鼠的悬停时间显著增加(P<0.01);与模型组比,氟西汀组、3MA组、高良姜素高和低剂量组小鼠的悬停时间显著减少(P<0.01)。与正常对照组比较,强迫游泳实验中模型组小鼠的浮停时间显著增加(P<0.01);与模型组比,其余各组小鼠的浮停时间显著减少(P<0.01)。与正常对照组比较,旷场实验中模型组小鼠的水平活动次数和站立次数显著减少(P<0.01);与模型组比,高良姜素各剂量组的水平移动次数和站立次数显著增加(P<0.01)。与正常组比较,糖水偏好实验中模型组的糖水偏好度出现显著降低(P<0.01);与模型组比,氟西汀组、3MA组和高良姜素高剂量组小鼠的糖水偏好度显著提高(P<0.05),见图1。
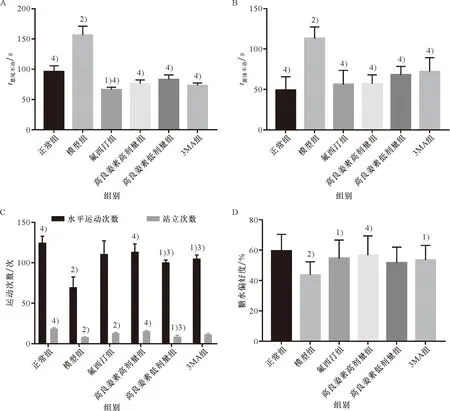
A: 悬尾实验;B: 强迫游泳实验;C: 旷场实验;D: 糖水偏好实验。与正常对照组相比, 1)P<0.05, 2)P<0.01;与模型组相比, 3)P<0.05, 4)P<0.01。A: Tail suspension test; B: Forced swimming test; C: Open field experiment; D: Sugar water preference experiment. Compared with the normal control group, 1)P<0.05, 2)P<0.01; Compared with the model group, 3)P<0.05, 4)P<0.01.图1 高良姜素对利血平诱导的抑郁小鼠模型干预作用的影响Figure 1 Effect of galangin on reserpine-induced depressive mouse model
2.2 高良姜素对利血平诱导的抑郁小鼠脑氧化应激和5-HT的影响
经利血平诱导后,与正常组比,模型组表现为SOD、GSH-Px和5-HT水平明显下降,而MDA浓度明显升高(P<0.05或P<0.01)。与模型组比,其余各组小鼠表现为SOD、GSH-Px和5-HT水平明显提高,而脂质过氧化产物MDA浓度明显减少(P<0.05或P<0.01),表明高良姜素能一定程度对抗利血平诱导的氧化应激从而发挥抗抑郁作用,见图2。

与正常对照组相比, 1)P<0.05, 2)P<0.01;与模型组相比, 3)P<0.05, 4)P<0.01。Compared with the normal control group, 1)P<0.05, 2)P<0.01; Compared with the model group, 3)P<0.05, 4)P<0.01.图2 高良姜素对利血平诱导的抑郁小鼠脑组织中氧化应激因子和5-HT水平的影响Figure 2 Effect of galangin on oxidative stress factor and 5-HT level in brain of depressed rats induced by reserpine
2.3 高良姜素对利血平诱导的抑郁小鼠脑组织中自噬蛋白的影响
免疫荧光检测LC3B表达情况,与正常对照组相比,模型组小鼠的LC3B表达显著增加(P<0.01);与模型组比,氟西汀组、高良姜素高剂量组和3MA组小鼠的LC3B表达均明显降低(P<0.01),见图3。

A:正常组;B:模型组;C:氟西汀组;D:高良姜素高剂量组;E:3MA(3-甲基腺嘌呤)组;F:LC3B蛋白相对表达量。与正常对照组相比,1)P<0.01;与模型组相比,2)P<0.01。A:Normal group; B:Nodel group; C:Fluoxetine group; D:Galangin high-dose group; E:3MA (3-methyladenine) group; F: Expression level of LC3B. Compared with the normal control group, 1)P<0.01; Compared with the model group, 2)P<0.01.图3 免疫荧光检测LC3B表达水平Figure 3 Expression level of LC3B detected by immunofluorescence
2.4 高良姜素对利血平诱导的抑郁小鼠神经元自噬的影响
与正常组相比,模型组小鼠脑组织Beclin-1表达均显著升高,而P62明显下降(P<0.05或P<0.01);与模型组相比,氟西汀组、高良姜素高剂量组和3MA组小鼠脑组织Beclin-1表达水平均明显降低,而P62则明显上升(P<0.05或P<0.01)。结果提示高良姜素可能通过抑制自噬发挥抗抑郁作用,见图4。
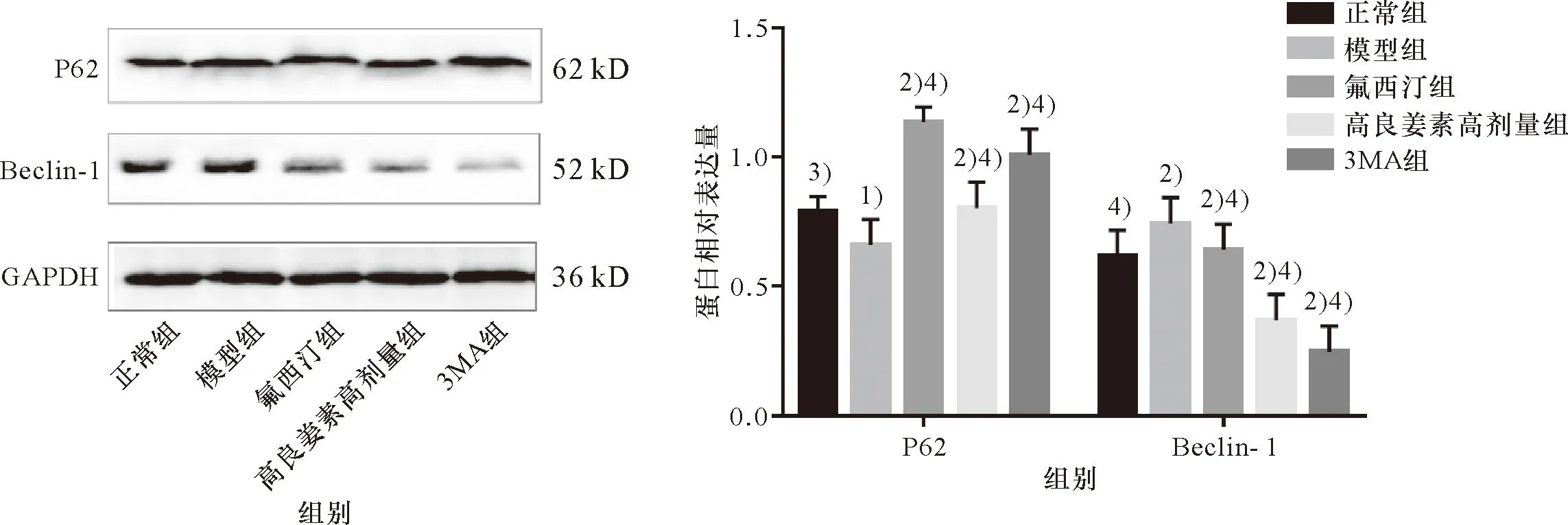
与正常对照组相比,1)P<0.05,2)P<0.01;与模型组相比,3)P<0.05,4)P<0.01。Compared with the normal control group, 1)P<0.05, 2)P<0.01;Compared with the model group, 3)P<0.05, 4)P<0.01.图4 高良姜素对P62和Beclin-1表达的影响Figure 4 Effect of galangin on P62 and Beclin-1 expression
3 讨论
利血平诱导急性抑郁症是常用的抑郁模型构建方法之一[10-12],通过消耗大脑内5-HT等神经递质,引发运动滞缓、体温降低及系列生理变化,从而造成抑郁症[13]。动物的悬尾、强迫游泳、旷场实验和糖水偏好等行为学实验广泛用于抗抑郁药物的初筛,可全面评价高良姜素抗抑郁药的作用效果[14]。本研究发现,高良姜素高、低剂量组均能显著减少小鼠强迫游泳浮停和悬尾不动时间,提高挣扎频率,增加其运动次数,表现为小鼠水平跨越格子数和后肢站立次数增多,且小鼠对药物呈现一定的剂量依赖性。此外,结果还发现高良姜素可以显著提高利血平诱导的急性抑郁模型小鼠海马脑区中5-HT的水平,提示高良姜素可能通过调节5-HT的水平来改善急性抑郁模型小鼠的抑郁行为。
氧化应激与抑郁症之间的关系已引起诸多学者的关注。临床及基础研究均发现,抑郁症患者和抑郁动物模型均出现抗氧化指标的减少及氧化有关通路的激活,从而造成蛋白质和DNA损伤,产生过氧化脂质体[15]。研究证实通过抑制氧化应激可减轻抑郁行为[16]。氧化应激的生物标志物中,MDA浓度是反映氧自由基水平的重要指标,MDA的产生过程伴随着心肌抗氧化代谢酶SOD、过氧化氢酶(CAT)和GSH-Px的消耗,促使氧自由基生成而加剧氧化。高良姜素可激活PI3K/Akt通路,发挥抗过氧化氢诱导的细胞损伤[17],提示其具有明确的抗氧化活性。本研究发现,利血平可以显著降低小鼠皮质中抗氧化代谢酶SOD和GSH-Px的水平,提高MDA浓度,提示利血平具有增强小鼠氧化应激的作用。结果显示,高良姜素各剂量组和氟西汀组小鼠脑中SOD、GSH-Px水平显著高于模型组小鼠,而MDA浓度显著降低。由此可推测得到,高良姜素能够显著提高利血平诱导抑郁模型小鼠脑组织中抗氧化酶SOD、GSH-Px的活性,减少脂质过氧化中间产物MDA的浓度。
自噬是一种高度保守的细胞质内容物消化和再循环的细胞机制,也是脑神经元死亡的主要形式之一。Beclin-1、LC3和P62均是自噬标志物,其中Beclin-1是自噬调控的标志性蛋白之一,Beclin-1表达增加与自噬活性增强呈正相关[18-19]。Beclin-1是参与刺激自噬特异性基因的正调节因子;LC3是检测自噬发生的标志蛋白,是首个自噬小体膜蛋白,在前自噬泡及自噬泡表面富集。研究证实,抑郁症模型大鼠海马组织中 Beclin-1和LC3-Ⅱ蛋白表达升高,海马神经元细胞自噬明显增多,同时,自噬过度激活,诱发神经元氧化应激损伤,从而加重海马神经损伤及大鼠的抑郁程度[20]。研究发现,高良姜素可通过调节Akt/MEF2D/Beclin-1信号通路,利用自噬和分子伴侣介导的自噬(CMA)发挥清除海马神经元内异常蛋白的作用,从而减少阿尔茨海默症特征性蛋白(p-tau和Aβ42等)的聚积[4],发挥对海马神经元的保护作用。本研究结果发现,抑郁模型组小鼠海马中Beclin-1和LC3蛋白表达显著升高,P62蛋白表达显著下降;而给予高良姜素干预治疗后,高良姜素组小鼠海马组织中Beclin-1和LC3B水平显著下降,P62水平显著升高,结果表明高良姜素能一定程度的抑制抑郁模型小鼠自噬水平。
综上所述,高良姜素可以改善利血平抑郁模型小鼠的抑郁行为,可使抗利血平诱导的5-HT水平下降,SOD和GSH-Px水平提高,MDA水平降低,以及调节自噬标志物Beclin-1、LC3B和P62的水平,因此推测高良姜素抗抑郁作用机制可能与抑制自噬和氧化应激有关,本研究为高良姜素对抑郁症的治疗作用提供了新的实验依据,后期将会针对其抗抑郁的作用机制进行深入研究。
作者贡献声明
冯真英、陈丹、彭素绢、孙玉香:实验方案设计、相关文献资料收集、分析及论文初稿写作;黄丽平、李观同:论文框架及关键部分修改;周中流:项目指导及负责人,指导论文写作。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。

