一株降解生物胺乳酸菌用于葡萄酒苹果酸乳酸发酵的特性研究
潘思弋,徐佳敏,张惠玲,杨伟明,田晓菊*
1(宁夏大学 食品科学与工程学院,宁夏食品微生物应用技术与安全控制重点实验室,宁夏 银川,750021) 2(宁夏食品检测研究院国家市场监管重点实验室(枸杞及葡萄酒质量安全),宁夏 银川,750001) 3(宁夏塞尚乳业有限公司,宁夏 银川,750021)4(宁夏志辉源石葡萄酒庄有限公司,宁夏 银川,750021)
生物胺(biogenic amines),是一类具有非挥发性的含氮低分子生物活性物质[1],前体化合物在氨基酸脱羧酶的作用下进行脱羧反应以及通过酮和醛的还原胺化而生成[2]。REDRUELLO等[3]研究发现在人体中,适量的生物胺可作为激素或神经递质起着重要的生理作用。相反,在其过量的情况下会导致心脏、神经系统等产生不同程度的毒理学损伤。研究表明,一定浓度的酒精(<10%vol)可以提高氨基酸脱羧酶的活性,但酒精又会抑制胺类氧化酶的活性从而导致生物胺过度积累,所以对葡萄酒类产品中生物胺的限量标准理应比普通食品更加严格[4]。因此,控制葡萄酒中生物胺含量是非常必要的。
葡萄酒中的生物胺主要来自葡萄果实和酿造过程。葡萄果实中生物胺的种类和含量受气候、品种及成熟度等因素的影响[5]。在葡萄酒酿造过程中,酒精发酵(alcohol fermentation,AF)和苹果酸-乳酸发酵(malolactic fermentation,MLF)均会导致腐胺、酪胺、尸胺等生物胺的形成[6]。在酒精发酵阶段酿酒酵母的代谢会生成少量的生物胺,而MLF阶段乳酸菌的代谢是葡萄酒中生物胺形成的主要原因[7]。HAN等[8]对葡萄酒全部发酵阶段中产生的生物胺含量进行了测定,发现葡萄酒从开始发酵到酒精发酵结束后尸胺、组胺、酪胺几乎检测不到,但在MLF阶段这几种生物胺的含量均明显增加。生物胺在葡萄酒中一经产生就无法将其彻底消除,甚至在高温条件下也无法将其完全破坏。因此,筛选优良的MLF启动菌株是减少葡萄酒中生物胺含量的有效方法,通过接种无氨基酸脱羧酶活性的乳酸菌,可以控制自然菌的生长或降解由自然菌产生的生物胺[9]。故选用合适的酿酒乳酸菌可以降低葡萄酒中生物胺的含量,对葡萄酒的品质保证具有重要意义。
本文将实验室前期筛选得到的一株LactobacillusplantarumNXU-Q12[10]应用于葡萄酒的MLF,测定苹果酸降解能力以及是否降解酒石酸、柠檬酸、甘油,以评价该菌株的MLF特性;测定葡萄酒MLF前后该菌株的菌落数变化评价该菌株在葡萄酒中的适应性;分别采用高效液相色谱法、顶空固相微萃取-气相色谱-质谱联用(head space-solid phase microextraction-gas chromatography-mass spectrometer,HS-SPME-GC-MS)和电子鼻测定葡萄酒中该菌株的生物胺降解率及经该菌株MLF后葡萄酒中的香气成分,评估L.plantarumNXU-Q12的应用价值,为乳酸菌在葡萄酒MLF过程中的应用提供理论依据,并为葡萄酒的质量安全控制提供解决途径。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本课题组分离鉴定的降解生物胺乳酸菌L.plantarumNXU-Q12(CGMCC No.23704)。
L.plantarumNXU-Q12的酸耐受性和乙醇耐受性已做过试验,详见徐佳敏等[10]的论文。
1.1.2 原料
赤霞珠葡萄,2021年10月于宁夏贺兰山产区志辉源石葡萄酒庄采摘,糖含量(以葡萄糖计)为(216.41±8.23) g/L,总酸含量(以酒石酸计)为(4.3±0.20) g/L,pH值为3.89±0.01,总质量约为5 kg。
马瑟兰葡萄,2021年10月于宁夏贺兰山产区志辉源石葡萄酒庄采摘,糖含量(以葡萄糖计)为(185.4±4.75) g/L,总酸含量(以酒石酸计)为(5.12±0.82) g/L,pH值为3.62±0.02,总质量约为5 kg。
1.1.3 试剂
NaOH、Na2CO3、NH3·H2O、CH3COCH3(均为分析纯),天津大茂化学试剂厂;生物胺(色胺、组胺、腐胺等)、丹磺酰氯,美国Sigma公司;商业酵母菌XR、商业乳酸菌Oenococcusoeni,法国诺盟公司;L-苹果酸试剂盒、甘油试剂盒,西班牙BioSystems公司。
1.1.4 培养基
MRS培养基(g/L):蛋白胨10,牛肉浸膏8,酵母浸粉4,葡萄糖20,磷酸氢二钾2,MgSO4·7H2O 0.2,CH3COONa 5,(NH4)2HC6H5O72,Tween 80 1,MnSO4·H2O 0.04,pH值调至5.5。
苹果酸降解培养基(g/L):苹果酸3,硫酸锰0.05,半胱氨酸盐0.5,酵母浸粉5,蛋白胨5,MgSO4·7H2O 0.2。
模拟葡萄酒环境培养基(g/L)[11]:无水乙醇100 mL,葡萄汁2,酒石酸3,柠檬酸0.5,葡萄糖2,果糖2,甘油5,乙酸钠0.28,硫酸镁0.13,硫酸锰0.03,FeSO4·7H2O 0.04,氯化钙0.1,磷酸氢钾0.6,硫酸铵1。110 ℃灭菌10 min,待该培养基温度降至室温时添加无水乙醇。
1.2 仪器与设备
W-CJ-2FD超净工作台,苏州安泰空气技术有限公司;YXQ-LS-50SII立式压力蒸汽灭菌器、BSD-150生化培养箱,上海博讯实业有限公司;Y15葡萄酒全自动分析仪,Biosystems公司;8860-5977B顶空固相微萃取-气相色谱-质谱联用仪、1260高效液相色谱,美国Agilent公司;PEN 3.0电子鼻,德国Airsense公司。
1.3 试验方法
1.3.1L.plantarumNXU-Q12生长特性及生物胺降解能力的测定
1.3.1.1L.plantarumNXU-Q12分解酒石酸、柠檬酸、甘油和苹果酸的测定
将L.plantarumNXU-Q12于37 ℃下活化培养48 h,初始菌浓度调整为1×107CFU/mL,接种于苹果酸降解培养基中25 ℃培养48 h。48 h后将培养液于4 ℃,8 000 r/min离心5 min,取上清液,参照杨江威[12]的方法测定酒石酸、柠檬酸含量,采用甘油试剂盒测定甘油含量;采用苹果酸试剂盒测定苹果酸的含量。
1.3.1.2L.plantarumNXU-Q12 SO2耐受性及其降解生物胺能力的测定
将L.plantarumNXU-Q12于含有精胺、色胺、腐胺、尸胺、酪胺、组胺(质量浓度均为1 mg/mL)的MRS液体培养基中活化,以2%接种量分别接种至SO2含量为20、40、60、80 mg/L的上述MRS液体培养基中,37 ℃静置培养48 h,在600 nm波长下测定OD值,判断SO2对L.plantarumNXU-Q12生长的影响。
采用高效液相法,参照徐佳敏等[10]的方法测定生物胺的含量并计算生物胺降解率。
1.3.1.3L.plantarumNXU-Q12温度耐受性及降解生物胺能力的测定
将L.plantarumNXU-Q12于MRS液体培养基中活化,以2%接种量接种至含精胺、色胺、腐胺、尸胺、酪胺、组胺(质量浓度均为1 mg/mL)的MRS液体培养基中,分别于18、22、26、30 ℃条件下静置培养48 h,在600 nm波长下测定OD值,判断温度对L.plantarumNXU-Q12生长的影响。5 500 r/min离心10 min,取上清液过0.22 μm微孔滤膜过滤,生物胺降解率的测定参照1.3.1.2节。
1.3.2L.plantarumNXU-Q12在葡萄酒酿造中的应用
1.3.2.1 种子液的制备
将L.plantarumNXU-Q12于MRS液体培养基中37 ℃活化24 h,测定菌浓度达到1×107CFU/mL,作为种子液。
1.3.2.2 干红葡萄酒的酿造工艺及操作要点
酿造工艺如下:
葡萄→除梗、破碎→低温浸渍→酒精发酵→MLF→发酵结束→过滤→葡萄酒→品质分析
操作要点:
a)除梗破碎:原料(赤霞珠、马瑟兰)采摘后,进行轻度破碎,均匀添加20 mg/L果胶酶、40 mg/L SO2。
b)低温浸渍:低温4 ℃浸渍24 h[13],利用固体二氧化碳来降温,控制低温浸渍条件。
c)酒精发酵:原料(赤霞珠、马瑟兰)入罐后以0.2 g/L比例接入活化好的商业酵母XR,启动酒精发酵,发酵温度控制在25~28 ℃,测定残糖量小于4 g/L时结束酒精发酵,进行皮渣分离。
d)MLF:将酒精发酵结束后的赤霞珠、马瑟兰葡萄酒样经0.45 μm微孔滤膜过滤除菌。以未接种乳酸菌的赤霞珠和马瑟兰葡萄酒样作为空白对照(分别记作C0、M0),以1×107CFU/mLL.plantarumNXU-Q12种子液按2%添加量[14]分别接种于赤霞珠和马瑟兰酒样中(分别记作C12、M12),同时商业乳酸菌O.oeni按照使用要求(0.01 g/L)进行活化,活化后分别接种于相同量的赤霞珠和马瑟兰葡萄酒样中作为对照(分别记作CS、MS)。MLF温度控制在18~20 ℃,在发酵完成后添加40 mg/L SO2,终止MLF。
1.3.2.3 葡萄酒MLF理化指标的测定
参照鲁榕榕等[15]的方法测定MLF发酵液中不同时间段的乳酸菌菌落数;参照GB 5009.225—2016测定葡萄酒酒精度;参照GB/T 15038—2006测定葡萄酒总酸、还原糖、甘油等理化指标。
1.3.2.4 葡萄酒MLF前后生物胺含量的测定
葡萄酒MLF前后生物胺含量的测定参照1.3.1.2节。
1.3.2.5 葡萄酒中挥发性化合物的测定
参考祝霞等[16]的方法,使用HS-SPME-GC-MS对不同试验处理的酒样香气成分进行检测。各成分的含量采用内标法进行半定量分析。
1.3.2.6 电子鼻的测定
参考周桂珍[17]的方法,使用电子鼻技术对不同处理的酒样进行检测。
1.4 数据分析
每组试验设置3个重复;采用Excel 2013软件、SPSS Statistic 27.0软件,对试验数据进行处理;采用Origin 2021软件、R统计软件分别进行绘图。
2 结果与分析
2.1 L.plantarum NXU-Q12对甘油、酒石酸、柠檬酸和苹果酸的分解
L.plantarumNXU-Q12对酒石酸、柠檬酸、甘油和苹果酸的分解结果如表1所示。

表1 L.plantarum NXU-Q12对酒石酸、柠檬酸、 甘油和苹果酸的分解效果Table 1 Results of tartrate, citric acid, glycerol, and malic acid decomposition by L.plantarum NXU-Q12
由表1可知,菌株L.plantarumNXU-Q12对酒石酸、柠檬酸和甘油的分解率分别为0.201%、0.649%、0.599%,对酒石酸、柠檬酸、甘油均无明显的分解效果;菌株L.plantarumNXU-Q12对苹果酸分解率为87.33%。综上所述,菌株L.plantarumNXU-Q12具有较好的苹果酸分解能力,适合葡萄酒的MLF。
2.2 L.plantarum NXU-Q12 SO2耐受性及其降解生物胺的能力
L.plantarumNXU-Q12在SO2含量分别为20、40、60、80 mg/L条件下的生长状态如图1-A所示,生物胺降解率如图1-B所示。
由图1-A可知,该菌株在SO2质量浓度为40~80 mg/L时可以生长,说明该菌株对SO2具有一定的耐受性;但随着SO2浓度的升高,菌株L.plantarumNXU-Q12的生长状态整体呈下降趋势。
由图1-B可知,随着发酵液中SO2浓度的增加,菌株降解生物胺的能力减弱,当SO2质量浓度为80 mg/L时,L.plantarumNXU-Q12对生物胺的降解率达到最低值,主要原因是乳酸菌对SO2较敏感,并且SO2作为抗氧化剂会影响微生物中蛋白质与维生素的共价结合,从而抑制乳酸菌的生长活性[18],使生物胺氧化酶含量减少,导致生物胺降解率下降。

A-生长状态;B-生物胺降解率图1 不同SO2浓度下对L.plantarum NXU-Q12生长 及生物胺降解的影响Fig.1 Effects of L.plantarum NXU-Q12 growth and bioamine degradation rates at various SO2concentrations
2.3 L.plantarum NXU-Q12温度耐受性及其降解生物胺的能力
L.plantarumNXU-Q12在温度为18、22、26、30 ℃条件下的生长状态如图2-A所示,生物胺降解率如图2-B所示。
不同温度条件对乳酸菌的生长会产生影响,随着温度的上升,菌株生长状态呈上升的趋势。由图2-A可知,该菌株在26~30 ℃生长状态良好,当温度低于22 ℃时,该菌株的生长状态明显受到抑制。
由图2-B可知,随着温度的升高,该菌株的生物胺降解能力呈上升趋势。在26 ℃时,该菌株对组胺、酪胺的降解率明显升高;在30 ℃时,该菌株除色胺外其他4种生物胺降解率均大于25%。有研究表明,当菌株处于低温环境时,菌株细胞膜会发生明显的硬化现象,并且温度越低其硬化现象越明显,此外生物胺氧化酶的活性会降低[19],从而导致菌株的存活率降低。因此,菌株对生物胺的降解能力在低温条件下减弱,但在18 ℃的葡萄酒MLF温度,该菌株仍具有一定的生物胺降解能力。

A-生长状态;B-生物胺降解率图2 不同温度对L.plantarum NXU-Q12生长 及生物胺降解的影响Fig.2 Effects of L.plantarum NXU-Q12 growth and bioamine degradation rates at different temperature
2.4 葡萄酒MLF发酵基本理化指标
赤霞珠葡萄酒和马瑟兰葡萄酒酒样MLF前后酒精度、总酸、还原糖、pH、挥发酸、甘油含量的变化如表2所示。
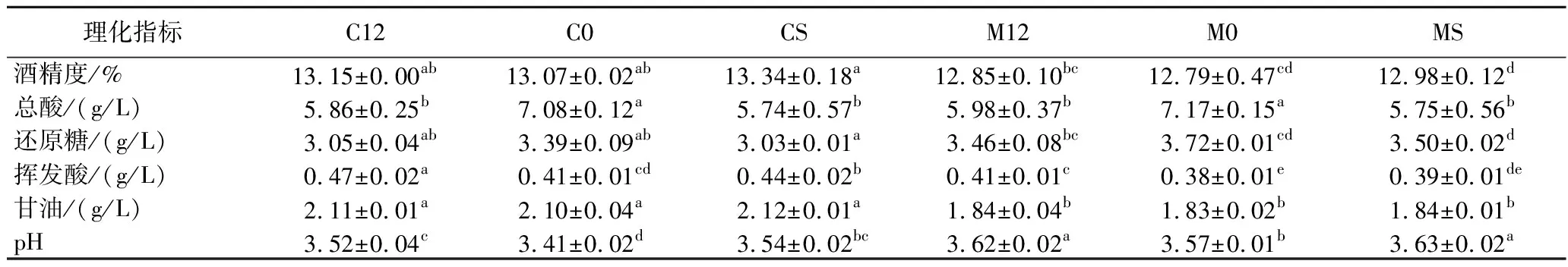
表2 葡萄酒MLF前后基本理化指标Table 2 The physicochemical indexes of wine sample before and after MLF
由表2可知,与未进行MLF的两种葡萄酒酒样相比,总酸含量均有所下降,且pH值随着总酸含量的降低而增大,其中经商业乳酸菌O.oeni发酵的两种酒样总酸含量均为最低值,而L.plantarumNXU-Q12与商业乳酸菌O.oeni相比,发酵后的酒样中总酸含量差异并不明显,说明L.plantarumNXU-Q12与商业乳酸菌O.oeni具有相当的MLF能力;MLF后的酒样与未发酵酒样中酒精度和残糖含量变化不明显,还原糖含量降低的原因之一是乳酸菌在发酵过程中为维持自身能量代谢会消耗一部分的还原糖[20];葡萄酒中挥发酸是评价其品质的指标,各个酒样在MLF后均有所上升,但含量均低于国家标准(1.20 g/L)。
2.5 葡萄酒MLF前后生物胺含量的变化
赤霞珠和马瑟兰葡萄酒两种酒样中MLF前后生物胺含量的测定结果如表3所示。

表3 葡萄酒MLF发酵前后生物胺含量变化 单位:mg/L
由表3可知,菌株L.plantarumNXU-Q12发酵后的赤霞珠、马瑟兰酒样中总生物胺含量与发酵前相比,分别降低了49.81%和65.22%;与商业乳酸菌O.oeni发酵的酒样相比,菌株L.plantarumNXU-Q12发酵的赤霞珠、马瑟兰酒样中总生物胺含量分别降低了31.07%和41.51%,说明菌株L.plantarumNXU-Q12具有一定的降解生物胺能力。
2.6 葡萄酒MLF过程中乳酸菌菌落数和L-苹果酸含量的变化
将L.plantarumNXU-Q12和商业乳酸菌O.oeni分别接入酒精发酵结束的赤霞珠和马瑟兰酒样中,对MLF过程中活菌数进行检测,结果如图3-A所示;对MLF过程中L-苹果酸含量的变化进行检测,结果如图3-B所示。
由图3-A可知,菌株L.plantarumNXU-Q12在两种酒样中生长趋势均为先下降后上升再缓慢下降;而商业乳酸菌O.oeni在两种酒样中生长趋势为先下降再上升。在MLF初期,L.plantarumNXU-Q12和商业乳酸菌O.oeni在不同葡萄酒酒样中菌落数均急速下降,其原因是菌株在发酵初期未适应葡萄酒的环境,导致其生长受到明显的抑制,当菌株逐渐适应这种环境后,菌落数逐渐上升[21],说明菌株L.plantarumNXU-Q12与商业乳酸菌一样可以适应葡萄酒的环境并进行MLF。
由图3-B可知,在MLF阶段葡萄酒中L-苹果酸的含量随着发酵时间的延长而下降,L.plantarumNXU-Q12和商业乳酸菌O.oeni均在第32天时苹果酸含量降到最低,这两株菌发酵的赤霞珠和马瑟兰葡萄酒样中苹果酸含量下降呈相似的趋势。在赤霞珠葡萄酒中,经L.plantarumNXU-Q12 MLF后L-苹果酸含量从2.02 g/L降至0.05 g/L,而经商业乳酸菌O.oeni后L-苹果酸含量从2.02 g/L降至0.10 g/L;在马瑟兰葡萄酒中,L.plantarumNXU-Q12完成MLF后L-苹果酸含量从1.96 g/L降至0.02 g/L,商业乳酸菌O.oeni完成MLF发酵后L-苹果酸含量从1.96 g/L 降至0.04 g/L,说明在赤霞珠和马瑟兰葡萄酒中L.plantarumNXU-Q12对L-苹果酸的代谢都更彻底。综上所述,菌株L.plantarumNXU-Q12具有良好的MLF性能。

A-活菌数;B-L-苹果酸含量图3 葡萄酒MLF过程中乳酸菌菌落数和苹果酸变化Fig.3 Quantity changes in lactic acid bacteria colonies and malic acid during MLF in wine
2.7 葡萄酒风味物质分析
经HS-SPME-GC-MS检测,分析不同酒样中风味物质,详见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.035007)。
赤霞珠和马瑟兰两种葡萄酒样在没有经过MLF之前,共检测出风味物质分别为40种和46种,在经过MLF后,风味物质的种类及含量均有所增加,其中酯类、醇类和酸类为葡萄酒中主要的香气物质,尤其以酯类(辛酸乙酯和癸酸乙酯)和羟基类(仲辛酮、大马士酮)物质含量增加为主要特征,这两类化合物含量的增加赋予了葡萄酒水果方面的香气[22]。MLF结束后4种发酵酒样(C12、CS、M12、MS)中分别检测到45、43、50、50种风味物质,其中包含酯类18种,醇类16种,羰基类物质4种,酸类物质5种,萜烯类4种,其他物质3种。与商业菌株对比,L.plantarumNXU-Q12在赤霞珠葡萄酒样中检测出的挥发性香气物质的种类和含量均有所增加,其中酯类物质含量显著增加。
2.8 葡萄酒挥发性成分聚类分析及组成比较
利用R软件对3种不同发酵处理(未进行MLF,分别接种商业乳酸菌O.oeni和L.plantarumNXU-Q12进行MLF)的赤霞珠和马瑟兰葡萄酒样中香气物质进行热图聚类分析,探究不同发酵处理下赤霞珠葡萄酒和马瑟兰葡萄酒中主要香气物质间差异,比较结果如图4所示。

图4 菌株L.plantarum NXU-Q12与商业乳酸菌MLF 前后葡萄酒风味物质聚类热图Fig.4 Heat map of L.plantarum NXU-Q12 clustering of wine-flavor substances before and after MLF with commercial lactic acid bacteria
由图4可知,不同颜色表示每种风味物质的含量,红色越深则表明该物质含量越高,蓝色越深表明该物质含量越低;52种香气成分聚为4类:第1类香气成分含量在M0、M12、MS发酵的酒样中含量较高,包括正己醇、2-庚醇、3-羟基丁醛等13种物质;第2类香气成分在M12、MS、C12发酵的酒样中含量较高,包括癸酸乙酯、仲辛酮、癸酸乙酯等11种物质;第3类香气成分在C12、CS、C0发酵的酒样中含量较高,包括2,4-二叔丁基苯酚、异戊醇、乙酸异戊酯等17种物质;第4类香气成分在M0、MS、CS发酵的酒样中含量较高,包括1-壬醇、α-松油醇、反式-3-己烯-1-醇等11种物质。综上所述,说明MLF对葡萄酒的风味物质有显著影响;与O.oeni相比,菌株L.plantarumNXU-Q12发酵后葡萄酒部分风味物质含量更高。因此,菌株L.plantarumNXU-Q12具有良好的MLF能力。
2.9 电子鼻雷达图分析
经电子鼻检测和分析不同酒样中挥发性成分进行雷达图分析,结果如图5所示。

图5 不同葡萄酒样的电子鼻雷达图Fig.5 Electronic nasal radar of different wine samples
由图5可知,电子鼻每个传感器对葡萄酒样均有明显的响应,且响应值均不相同,其中W1S、W1C、W1W和W5S、W2S传感器的响应值显著高于其他传感器,说明酒样中含有较多的甲基类化合物、苯类、无机硫化物、氮氧化合物、醇类,而W3C、W6S、W5C、W2W、W3S传感器基本无明显变化,说明酒样中芳香胺类、氢化物、短链烷烃、有机硫化物、长链烷烃含量较少,这与HS-SPME-GC-MS结果中不存在芳香胺化物和烷烃类化合物相符。酒样M0、C0在W1S、W5S、W1W 3个传感器响应值低于其他酒样,说明酒样M0、C0中甲基类化合物、无机硫化物、氮氧化合物含量较低。从传感器信号强度的不同可以初步判断L.plantarumNXU-Q12和商业乳酸菌O.oeni分别在赤霞珠、马瑟兰葡萄酒样品之间的气味物质差别不明显,只是响应值大小不同。因此,菌株L.plantarumNXU-Q12适合葡萄酒的MLF。
3 结论
将降解生物胺的L.plantarumNXU-Q12作为发酵剂进行MLF,获得的赤霞珠葡萄酒和马瑟兰葡萄酒两种酒样中各项理化指标均符合GB 15037—2006《葡萄酒》;经L.plantarumNXU-Q12 MLF发酵的两种酒样中L-苹果酸含量均可以降至0.1 g/L以下,说明菌株L.plantarumNXU-Q12具有良好的MLF能力。同时,经L.plantarumNXU-Q12发酵的赤霞珠、马瑟兰葡萄酒样中总生物胺含量比商业乳酸菌O.oeni发酵的酒样中生物胺含量分别降低了31.07%和41.51%,说明该菌株在葡萄酒MLF过程中对生物胺降解具有降解能力。菌株L.plantarumNXU-Q12使两种葡萄酒样中辛酸乙酯、月桂酸乙酯、芳樟醇含量增加。在赤霞珠酒样中,经菌株L.plantarumNXU-Q12发酵产生的酯类物质种类增多。因此,L.plantarumNXU-Q12不仅可以有效控制葡萄酒中生物胺含量,同时具有良好的葡萄酒MLF潜力,为L.plantarumNXU-Q12在葡萄酒MLF过程中的应用及安全控制奠定了理论基础。

