碱蓬多糖长循环脂质体的制备
刘欣鑫,姚必君,刘昱宏,邵端阳,韩冠英
(1.锦州医科大学附属第一医院;2.锦州医科大学附属第三医院,辽宁 锦州 121000)
碱蓬(Suaedasalsa,SS)为一年生草本植物。具有降血脂、清热消积、提高免疫力和抗肿瘤等功效[1]。植物多糖是近几年来研究的热点,是一类具有多种生物活性和功能的大分子物质[2-4]。碱蓬多糖(Suaedasalsapolysaccharide,SSP)是从碱蓬中提取的主要活性成分,刘欣鑫等采用水提醇沉的方法优化了碱蓬多糖的提取工艺[5],得到了成分均一的碱蓬多糖并验证了其抗肿瘤活性。然而,纯度高的多糖得率较低,多糖的结构特点和理化性质导致多糖代谢较快,难以在血浆中长时间滞留,而多糖脂质体制剂的开发不仅能提高其稳定性,还可提高其生物利用度[6]。
新型脂质体有很多种类型,而长循环脂质体(long-curculating liposome,LCL)为其中一种,这种类脂衍生物的新型脂质体的表面均通过天然或合成聚合物修饰[7],其中研究较为广泛和深入的是聚乙二醇修饰聚合物[8]。衍生化磷脂由聚乙二醇分子与磷脂分子通过共价键结合所形成,其能够有效保护脂质体,通过阻止血液中不同组分对脂质体的结合[9],使脂质体的识别和摄取显著降低,延长了体循环时间,提高了半衰期;同时更容易通过肿瘤新生血管间隙渗漏到肿瘤组织中,使肿瘤部位的药物摄取率得到提高[10]。因此,本研究将SSP制备成长循环脂质体(SSP-LCL),改善药物在体内的吸收,达到长效缓释的效果,为研发新型抗肿瘤药物提高一定的理论基础。
1 资料与方法
1.1 一般资料
碱蓬(辽宁省锦州市沿海滩涂湿地;经锦州医科大学附属第一医院韩冠英教授鉴定为碱蓬属碱蓬草);大豆磷脂(上海太伟药业有限公司);胆固醇(上海科技医药有限公司);PEG2000-DSPE(上海麦克林生化科技有限公司);其余均为分析纯。
电子天平(上海元析仪器有限公司);旋转蒸发仪(郑州长城科工贸有限公司);溶出仪(上海申安医疗器械);透析袋(Sigma公司);Agilent 1200高效液相色谱仪(安捷伦科技有限公司);高速离心机(江苏金城国胜实验仪器厂)。
1.2 方法
1.2.1 碱蓬多糖的制备
取碱蓬的干燥叶粉碎后,过20目筛。称取碱蓬粗粉以80%乙醇回流脱脂,每次2 h。提取完毕,过滤,残渣置于烘箱内烘干。残渣加10倍量水于80 ℃水浴锅中加热回流提取,每次3 h。浸提后抽滤,3000 r/min离心15 min,取上清液浓缩,按Sevag法脱蛋白后,加3倍量的90%乙醇过夜沉淀,离心,冷冻干燥,即得碱蓬粗多糖。称取0.5 g样品碱蓬粗多糖分别加载到DEAE-52纤维素阴离子交换柱(2.6 cm×30 cm)和Sephadex G-75凝胶柱上,进行梯度洗脱,每5 mL收集一管,合并单一峰位收集,冷冻干燥得均一碱蓬多糖SSP[5]。通过高效凝胶渗透色谱法测定,色谱柱为TSK-gel G3000PWxl(7.5 mm×300 mm)凝胶色谱柱,流动相为0.05 M NaCl,流速为0.5 mL/min,进样量20 μL,得到分子量为53.8 kDa的均一多糖。
1.2.2 碱蓬多糖长循环脂质体的制备工艺
称取适量的大豆磷脂、胆固醇、PEG2000-DSPE,均置入250 mL旋蒸瓶中,加20 mL三氯甲烷使其溶解,减压除有机溶剂(50 ℃,60 r/min),旋蒸至溶液在瓶壁上形成透明均匀薄膜。同时,称取2 mg SSP,加入pH=6.4磷酸盐缓冲液使其溶解,与上述旋蒸瓶中溶液混合均匀,搅拌水化,水溶超声20 min,即得SSP-LCL混悬液初品。通过0.1 μm脂质体挤出器将SSP-LCL混悬液挤出数次,得到带乳光的SSP-LCL浓溶液混悬液,调整体积,0.22 μm PVDF膜过滤除菌,充氮、灌封,即得SSP-LCL。
1.2.3 包封率的测定
称取10 mg SSP,加水溶解转移容量瓶中,定容至100 mL,震荡均匀,将浓度为100 mg/L的SSP溶液作为对照品储备液。吸取上述溶液,加流动相分别稀释成浓度为0、8、20、50、80、100 μg/mL的SSP对照品溶液,将数据进行线性回归分析,以峰面积(A)为纵坐标,浓度(C)为横坐标,苯酚-硫酸法制作多糖含量测定标准曲线得标准曲线方程为A=210.58C+82.37(r=0.9998)。
采用低温超速离心法测定包封率。精密吸取SSP-LCL 1 mL于离心管中,将其放置在高速离心机中离心90 min,转速为20 000 r/min,确保脂质体与游离药物分离,吸取上清液到容量瓶中,用甲醇定容至10 mL,作为W游离;同时量取1 mL SSP-LCL至50 mL容量瓶中进行破乳,试剂为2 mL乙醇/氯仿(2∶1)的混合溶液,甲醇定容作为W总,分别测定,计算包封率(EE%):EE%=(W总-W游离)/W总×100%。
1.2.4 单因素实验
采用1.2.1项下方法制备SSP-LCL,处方筛选条件为:固定处方条件为PEG2000-DSPE浓度0.5 mg/mL、磷脂与药物的质量比30∶1、磷脂与胆固醇的质量比10∶1、考察不同磷脂浓度(10、20、30、40、50、60 mg/mL)对SSP-LCL包封率的影响;固定处方条件为磷脂浓度20 mg/mL、磷脂与药物的质量比30∶1、磷脂与胆固醇的质量比10∶1、考察不同PEG2000-DSPE浓度(0.1、0.25、0.5、0.7、0.9、1.0 mg/mL)对SSP-LCL包封率的影响;固定处方条件为磷脂浓度20 mg/mL、PEG2000-DSPE浓度0.5 mg/mL、磷脂与胆固醇的质量比10∶1、考察不同磷脂与药物的质量比(15∶1、20∶1、25∶1、30∶1、35∶1、40∶1)对SSP-LCL包封率的影响;固定处方条件为磷脂浓度20 mg/mL、PEG2000-DSPE浓度0.5 mg/mL、磷脂与药物的质量比30∶1、考察不同磷脂与胆固醇的质量比(3∶1、5∶1、10∶1、15∶1、20∶1、25∶1)对SSP-LCL包封率的影响;进行单因素实验,考察各因素变量对SSP-LCL包封率的影响。
1.2.5 Box-Benhnken中心组合实验设计
使用单因素试验初步揭示规律,各因素再选取对SSP-LCL包封率影响最大3个的水平,使用Box-Benhnken分析方法建立一个4因素3水平的中心组合实验,响应值为SSP-LCL的包封率,使用-1、0、1对试验中各因素的3个水平进行编码,见表1。
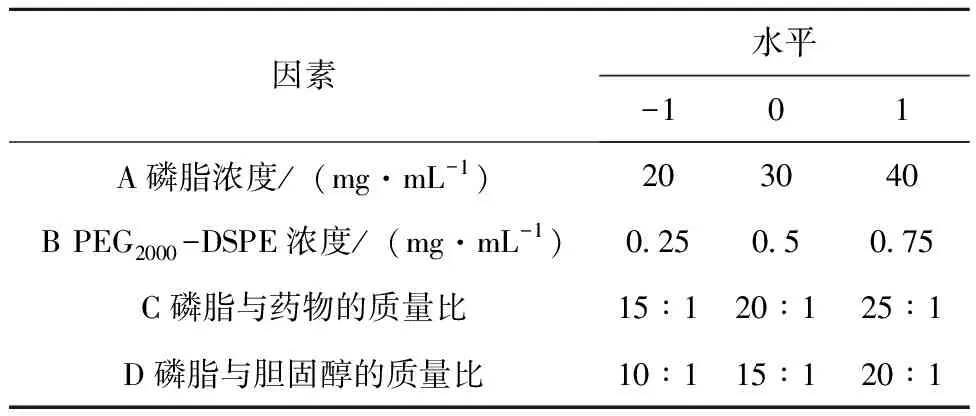
表1 响应曲面设计实验因素水平和编码
1.2.6 碱蓬多糖长循环脂质体体外释放考察
在SSP-LCL体外释放考察过程中,释放介质选取pH=6.8的PBS溶液。称取步骤1.2.2中0.5 g SSP-LCL,加2 mL水使其溶解,将样品转移到透析袋中,同时加入20 mL释放介质,在37 ℃恒温条件下进行透析,转速为100 r/min,在相应的时间点取适量的释放介质,同时添加与其体积、温度均相同的新鲜释放介质。采用HPLC测定释放介质中SSP-LCL浓度。
1.3 统计学方法
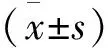
2 结 果
2.1 单因素实验
2.1.1 磷脂浓度对包封率的影响
脂质体的包封率变化与磷脂浓度相关。包封药物的能力在低磷脂浓度条件下较弱,而浓度太高会发生聚集并导致稳定性下降[11],当磷脂浓度30 mg/mL时,包封率明显减小。以上结果提示包封率受磷脂浓度影响,继续将其作为响应面法优化处方工艺的考察因素,磷脂浓度为30 mg/mL是比较合适的处方条件,见图1。
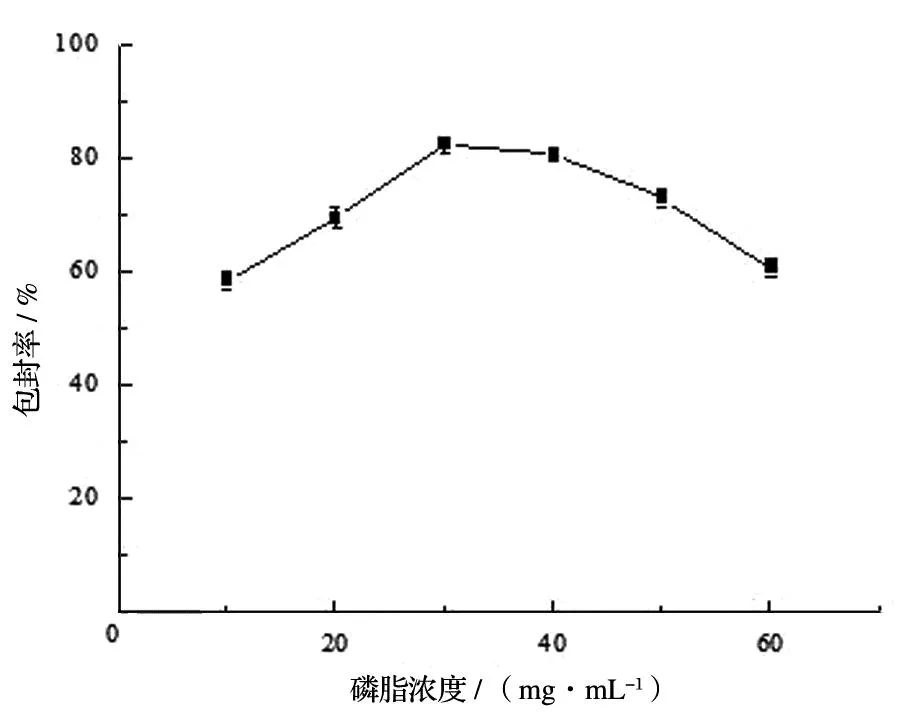
图1 磷脂浓度对包封率的影响
2.1.2 PEG2000-DSPE浓度对包封率的影响
包封率变化与PEG2000-DSPE浓度变化相关,呈现出PEG2000-DSPE浓度由低到高的过程中二者共同增加,到一定PEG2000-DSPE浓度后包封率会随之降低。该现象原因考虑为过高的PEG2000-DSPE浓度占据脂质双层膜空间,影响包封率的减小。因此,PEG2000-DSPE浓度为0.7 mg/mL为较合适的处方工艺,见图2。

图2 PEG2000-DSPE浓度对包封率的影响
2.1.3 磷脂与药物的质量比对包封率的影响
包封率与脂药比之间呈现出正相关的趋势,且脂药比为20∶1时,包封率的值呈稳定趋势。包封率的值受磷脂与药物比例的严重影响,磷脂对药物的承载能力也同样有限,所以当碱蓬多糖的投药量过大时,脂质囊材没有足够的空间对大量的药物进行包封,引起包封率明显降低,甚至可能出现药物析出的情况;若投药量过小,则包封率高,载药量小。由此可见,合适的处方条件为脂药比20∶1,见图3。

图3 磷脂/药物对包封率的影响
2.1.4 磷脂与胆固醇的质量比对包封率的影响
随着胆固醇比例的降低,包封率的值表现为先增大后减小,当膜材比为15∶1时,包封率达到最大值。究其原因,可能是胆固醇具有调节磷脂流动性的特性,起到稳定脂质双分子膜的作用,但当胆固醇所占比例太大时,其在脂质双层膜中也占据相当的空间,这时的胆固醇则出现干扰脂质囊泡形成的行为,表现为包封率降低[12]。综上所述,脂质体的载药量和脂质体的稳定性都与膜材比密切相关,见图4。
图4 磷脂/胆固醇对包封率的影响
2.2 BBD实验结果及数据分析
2.2.1 BBD实验设计方案及结果
依据单因素实验结果,Design-Expert8.0.6统计分析软件给出的实验方案及结果见表2,以SSP-LCL的包封率为响应值,以磷脂浓度(A)、PEG2000-DSPE浓度(B)、磷脂与药物的质量比(C)、磷脂与胆固醇的质量比(D)为自变量,建立4因素3水平中心组合实验设计,可得到29个实验方案用以计算实验误差。
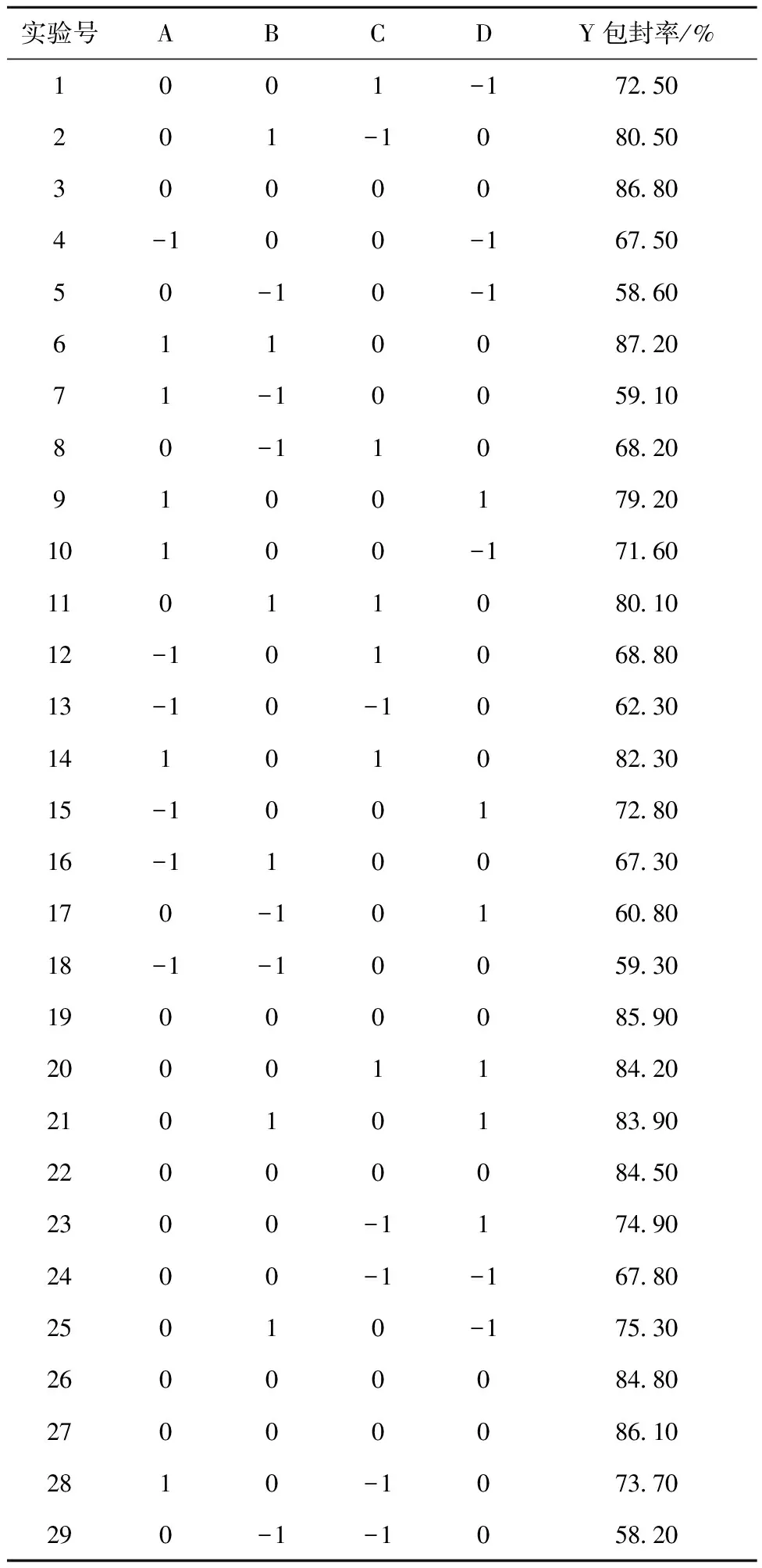
表2 响应面实验分析方案及结果
2.2.2 回归方程拟合及方差分析
通过Design Expert 8.0.6统计软件,对各因素进行回归方程拟合并对数据进行回归分析,得到回归方程:Y=+85.62+4.59A+9.17B+3.23C+3.54D+5.03AB+0.52AC+0.58AD-2.60BC+1.60BD+1.15CD-7.93A2-9.5B2-5.13C2-5.68D2;回归模型的R2=0.9787,RAdj2=0.9574,由方差分析可知回归方程模型差异有统计学意义(P<0.0001),证明该方法可行性高,模型与实际拟合良好,失拟项差异无统计学意义(P>0.05),回归方程可以代替实验真实点,并以此为依据对实验结果进行分析。结果见表3,磷脂浓度(A)、PEG2000-DSPE浓度(B)、磷脂与药物的质量比(C)、磷脂与胆固醇的质量比(D)、磷脂浓度与PEG2000-DSPE浓度交互项(AB)、PEG2000-DSPE浓度与磷脂与药物的质量比交互项(BC)、磷脂浓度二次项(A2)、PEG2000-DSPE浓度二次项(B2)、磷脂与药物的质量比二次项(C2)、磷脂与胆固醇的质量比二次项(D2)对响应值影响显著。
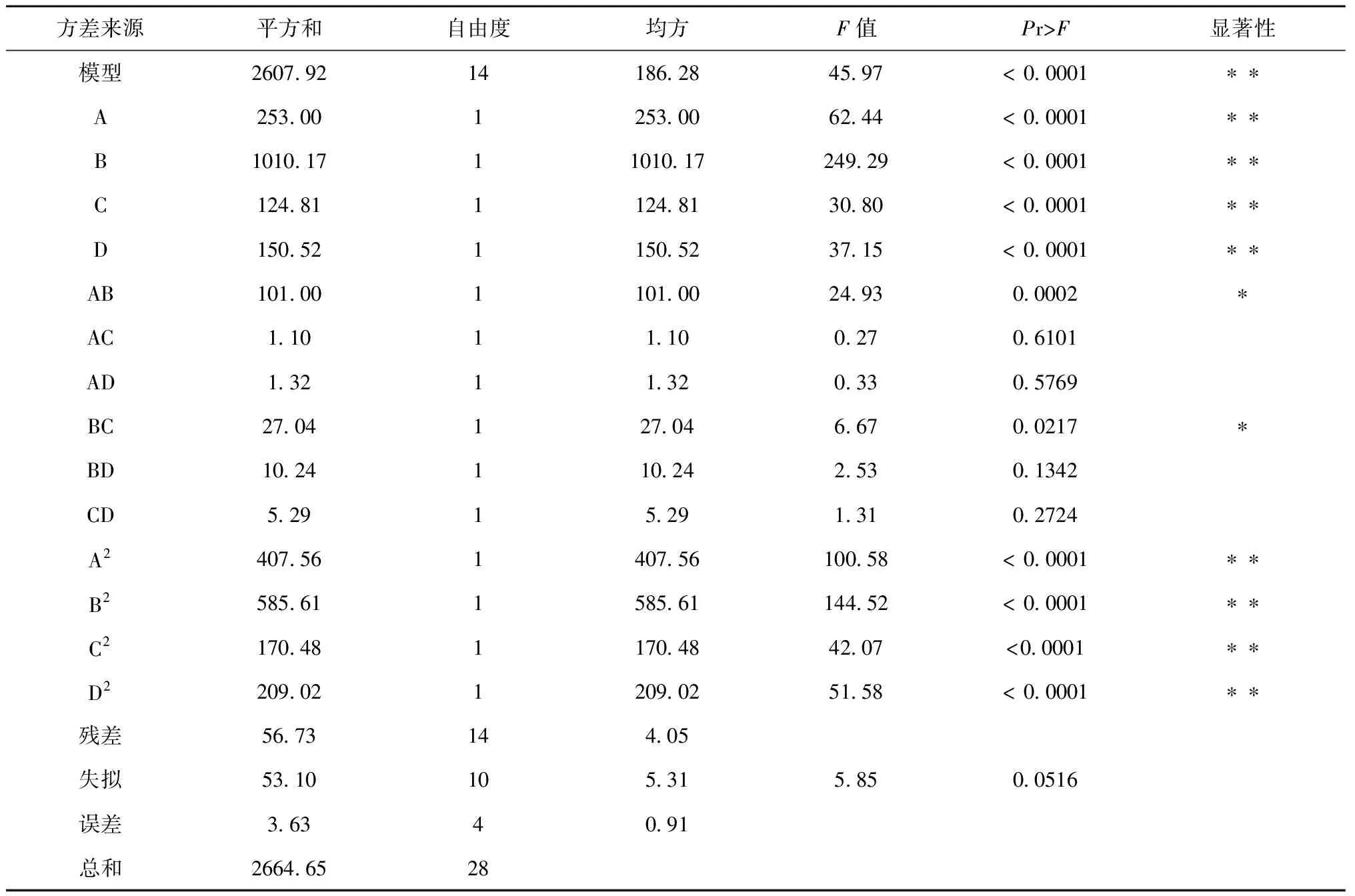
表3 回归模型及方差分析
2.2.3 响应面图分析
当存在多因素影响实验条件时,可使用响应面法优化结果,通过固定的实验次数可以对试验因素进行连续分析,并生成直观的3D曲面图用于进一步评价各因素间的交互作用[13-14]。通过软件Design-Expert得到响应值的3D曲面,可进一步分析各因素对SSP-LCL包封率的影响及各因素间的交互作用。由图5可知,磷脂浓度、PEG2000-DSPE浓度、脂药比和膜材比4个因素中,当两个因素为零水平时,另外两个因素间的交互作用对包封率均有一定程度的影响。包封率随其中两个因素的增加而提高,上升到某一程度时,曲面略呈现下降或平缓趋势,结果见图5。其中图5a和图5d曲面陡峭,说明磷脂浓度和PEG2000-DSPE浓度、PEG2000-DSPE浓度和脂药比之间交互作用较明显,与方差分析结果相符。

a
固定脂药比、膜材比为零水平,磷脂浓度和PEG2000-DSPE浓度对包封率的影响和两者之间的交互作用。随磷脂浓度增加,包封率呈现先上升后平缓下降的趋势;磷脂浓度较高时,随温度增加,包封率呈现先上升再趋于平缓的趋势;在固定PEG2000-DSPE浓度条件下,随磷脂浓度增加,包封率呈现先上升后平缓下降的趋势。分析响应面图结果可见,与磷脂浓度相比,PEG2000-DSPE浓度上升的幅度更陡峭,提示包封率受PEG2000-DSPE浓度影响大于磷脂浓度,见图5a。固定磷脂浓度和膜材比为零水平,脂药比和PEG2000-DSPE浓度对包封率的影响和两者之间的相互影响程度。随脂药比和PEG2000-DSPE浓度的增加,包封率呈先上升后平缓下降的趋势,PEG2000-DSPE浓度的上升幅度显著大于脂药比的上升幅度,提示包封率受PEG2000-DSPE浓度影响更大,见图5d。
2.2.4 验证实验
通过求解回归方程,得到最优化的处方条件为磷脂浓度为32.72 mg/mL、PEG2000-DSPE浓度为0.69 mg/mL、磷脂与药物的质量比为20.32∶1、磷脂与胆固醇的质量比为17.70∶1,最大包封率达到89.87%,为方便实际操作将实验条件定为磷脂浓度33 mg/mL、PEG2000-DSPE浓度0.7 mg/mL、磷脂与药物的质量比20∶1、磷脂与胆固醇的质量比为18∶1。在处方优化后的条件下进行重复实验3次,所得平均包封率为88.25%。结果表明,实际值与回归方程拟合出的理论值匹配程度相似,表明响应面法可以有效的优化SSP-LCL的处方工艺。
2.2.5 碱蓬多糖与碱蓬多糖长循环脂质体体外释放测定结果
SSP-LCL释放缓慢,在9 h时仅释放80.2%,可能是由于脂质双分子层中的胆固醇对磷脂膜起到了稳定作用,可减缓药物从膜内到膜外的释放,说明SSP制备成长循环脂质体后具有一定的缓释效应,见图6。

图6 SSP-LCL体外释放曲线
3 讨 论
植物多糖是一种天然高分子聚合物,具有广泛的生物活性,但由于其结构特点,应用上受到了一些限制。随着多糖纳米技术的研究与发展,我们可以进一步改善药物的稳定性,并延长药物在体内的作用时间。相比于普通脂质体而言,聚乙二醇修饰的长循环脂质体的物理、化学和生物稳定性均显著提高,不仅减少了渗漏、聚集和融合,再分散性也明显增加。近年来,聚乙二醇长循环脂质体在其领域的应用研究中取得了进展,此类脂质体可包载的药物种类繁多,并在相关研究论文及专利申请中占有很大比例[15-16]。
本实验采用Box-Behnken效应面法对SSP-LCL的处方工艺进行优化,建立了包封率的回归模型,通过优化选取合适的处方条件为:磷脂浓度33 mg/mL、PEG2000-DSPE浓度0.7 mg/mL、磷脂与药物的质量比20∶1、磷脂与胆固醇的质量比为18∶1。SSP-LCL的平均包封率为88.25%,该数据的值贴近模型预测的结果,可证明该模型具有一定的可靠性。通过体外透析实验考察SSP-LCL的体外释放度,并与SSP进行比较,说明SSP-LCL具有缓释效应。

