上位基因控制的茄子果色遗传效应解析
陈锦溶,吕紫见,范丽莎,游倩,李涛,宫超,孙光闻,李植良,孙保娟
上位基因控制的茄子果色遗传效应解析
1广东省农业科学院蔬菜研究所/广东省蔬菜新技术研究重点实验室,广州 510640;2华南农业大学园艺学院,广州 510642;3华中农业大学园艺植物生物学教育部重点实验室,武汉 430070
【目的】果实颜色是影响茄子商品价值的重要性状。通过解析两白果亲本杂交构建的F2代群体紫红果单株和白果单株特殊分离比产生的原因,为阐明茄子果实颜色形成的调控机制奠定基础。【方法】以花青素合成结构基因()突变的白花白果母本19141、未知突变基因位点的白花白果父本19142及其紫红果F1、果色分离的F2群体为试验材料,探讨上位基因控制的茄子果色遗传规律;克隆已知的茄子果色相关()和()基因,探明父本19142突变的果色基因和方式;开发基因内分子标记,对F2进行基因分型以及与其他果皮无花青素沉着茄子亲本杂交验证,解析上位基因调控茄子果色遗传的分子基础。【结果】E4450 F2紫红果和白果单株分离比符合3对上位基因控制的27﹕37的分离比率,19141的基因位点发生突变,基因型为,19142的和基因位点同时发生了突变,基因型为。克隆测序发现,19142的发生可变剪接,导致第2外显子跳跃。19142的起始密码子上游-326 bp的SNP(C→G),导致启动子缺失了1个CAAT-box顺式作用元件;在第2外显子最后一个碱基G变C,发生剪切位点突变。基于、和遗传变异,开发了基因内分子标记对E4450 F2单株进行基因分型,结果发现基因型与表型完全吻合;对应紫花紫红果表型,基因型对应紫花白果表型,、、、_、和基因型对应白花白果表型。19142与白果自交系19147(ddPPYY)和绿果自交系19144()分别杂交,结果发现F1果色分别为白色和绿色,果皮无花青素沉着,这进一步证明了19142是两个基因同时发生突变【结论】2个果皮无花青素沉着的茄子亲本杂交,如果F1代果皮有花青素沉着,且F2代有花青素沉着单株和无花青素沉着果色单株分离比符合27﹕37,则是由于其中的一个亲本在花青素合成通路的1个基因位点发生了突变,另外一个亲本在花青素合成通路的另外2个基因位点发生了突变。两个果皮无花青素沉着亲本杂交,F1果皮能够合成花青素而呈现紫红,是由于3个上位基因位点、和同时处于显性状态,花青素合成得以恢复。结构基因或突变抑制植株各个部位花青素合成;转录因子调控具有组织特异性,其突变抑制果皮花青素合成,却不抑制花中花青素合成。
茄子;果色;上位基因;花青素;遗传规律
0 引言
【研究意义】茄子属于茄科茄属,在茄科蔬菜生产中占有重要的地位。2021年,中国茄子总产量3 746万吨,占全球总产量(5 865万吨)的63.87%(FAOSTAT,http://faostat.fao.org)。茄子以果实为产品,是世界卫生组织推荐的世界十大健康蔬菜之一。茄子果皮颜色(以下统称果色)丰富多样,不同区域对果色选择具有不同的消费习惯。茄子果色是决定商品外观品质和价格的重要因素,因此,果色是茄子育种过程中的一个重要选育性状。【前人研究进展】叶绿素和花青素是决定茄子果色的两种主要色素[1]。花青素控制茄子果色呈粉红、浅紫、紫红、紫黑,甚至黑色[2]。目前,对于花青素合成途径已经研究得较为透彻,其主要通过苯丙烷途径和类黄酮生物合成途径合成[3]。控制花青素合成的关键结构基因包括苯丙氨酸解氨酶基因()、4-香豆酸-CoA连接酶基因()、查尔酮合成酶基因()、查尔酮异构酶基因(CHI)、黄烷酮3-羟化酶基因()、黄酮3′-羟化酶基因()、黄酮3′,5′-羟化酶基因()、二氢黄酮醇4-还原酶基因()和花青素合成酶基因()等[3-5]。这些结构基因还受转录调控因子(TF)调控,包括MYB、bHLH和WD40,它们常以MBW(MYB-bHLH-WD repeat)复合体的形式调控结构基因的转录[6-7]。1909年BATESON提出了上位性的概念,来定义一个基因对另一个基因的遮盖作用[8]。茄子果实花青素的合成由3个上位互作的基因共同控制,分别为、和[9]。近期,在茄子育种实践中发现2对上位基因和[10-11]、和[12]控制的茄子果色遗传现象,即两个白果或两个绿果的亲本杂交,F1为紫红或紫褐果色,F2有花青素呈色果实和没有花青素呈色果实单株分离比为9﹕7,通过遗传作图分别定位并获得了位点候选基因[10],位点候选基因[10],位点候选基因[12]。【本研究切入点】笔者前期研究中,发现了一种茄子特殊果色遗传效应,即白花白果的母本19141和白花白果的父本19142杂交,F1代为紫花紫红果,F2代分离出白果单株和紫红果单株,且白果单株多于紫红果单株,这不符合两对上位基因控制的F2紫红果和白果分离比为9﹕7的遗传规律[10]。已知母本19141的白果是由于位点突变引起的[10],F1为紫红果,说明19142突变位点发生在花青素代谢途径的其他位点,19141和19142杂交后形成互补,才使F1能够合成花青素。【拟解决的关键问题】本研究以19142、19141、两者杂交F1、F1自交后代F2为材料,通过已知茄子果色相关基因克隆,挖掘19142突变的基因和突变方式;基于目标基因遗传变异开发基因内分子标记,对F2单株进行基因分型,分析表型和基因型的对应关系;19142与已知果色基因突变的茄子亲本杂交,验证突变基因位点异同。
1 材料与方法
试验于2018—2022年在广州市白云区钟落潭镇广东省农业科学院白云试验基地和广东省蔬菜新技术研究重点实验室进行。
1.1 试验材料
本试验材料为父本19142、母本19141,及其杂交一代E4450F1,E4450F1套袋自交得到的E4450F2。父本19142为2012年引进的东南亚资源的分离后代,经6代系谱选择获得的纯合自交系。19142开白花,萼片绿色,商品果卵圆形,果皮白色,单果重8.6—9.2 g,果长3.4—3.9 cm,果粗2.2—2.3 cm。母本19141是2009年初从广州市广东省农业技术推广总站柯木塱示范基地收集的‘优美长茄’种果的分离后代,经5代系谱选育获得的纯合自交系。19141开白花,萼片绿色,商品果长条形,果皮白色,单果重175—199 g,果长29.6—34.8 cm,果粗3.8—4.2 cm。2018年春季配制杂交组合(19141×19142)获得E4450F1,2018年秋季E4450F1套袋自交获得E4450F2。
父本与母本材料花色和果色都为白色,而且在整个生育期,下胚轴、叶脉、花、萼片都观察不到花青素的沉着;F1呈现紫花紫红果;F2分离群体花色和果色出现表型分离,紫红果单株比例小于白果单株比例。父本、母本及其F1、F2于2022年7月育苗,8月种植于广州市白云区钟落潭镇广东省农业科学院白云试验基地内。
1.2 方法
1.2.1 基因组DNA提取 分别取父本19142、母本19141、E4450F1和E4450F2的单株幼嫩叶片,使用植物基因组DNA提取试剂盒(湖南艾科瑞生物工程有限公司)提取DNA,利用NANO DROP 2000C可见分光光度计和1%琼脂糖凝胶电泳检测DNA的质量和含量,检测合格后-20 ℃保存。
1.2.2 E4450F2群体的表型评价 在开花、坐果期观察花冠和果皮颜色,E4450F2单株的果色紫红色(有花青素沉着)记录为1,白色(无花青素沉着)记录为0;花冠紫色记录为1,白色记录为0。
1.2.3 花青素测定 取父本、母本及E4450F1商品果期的果实,用手术刀刮取果皮(厚度约0.05 mm)。设3次生物学重复,每个生物学重复5个单株,每个单株取1个商品果用于刮取果皮,混样、备用。提取父本、母本及E4450F1商品果期果皮花青素,用植物花青素含量检测试剂盒(Solarbio,Beijing,China)进行定量分析。采用公式:TA=[(A530-A620)-0.1(A650-A620)]/ε×(V/m)×M×100,计算花青素含量,其中TA为总花色苷含量(mg/100 g FW),ε为摩尔吸收率,V为总体积(mL),m为样品重量(g),M为分子量。
1.2.4克隆 以父本19142、母本19141的DNA为模板,扩增。基于参考基因序列,应用软件Primer Premier 5进行引物设计(表1)。PCR程序为:94℃预变性5 min;94 ℃30 s,50—60 ℃30 s,72 ℃延伸30 s或60 s,35个循环;最后72 ℃延伸5 min。50 μL PCR产物在1%的琼脂糖凝胶电泳后用SanPrep柱式DNA胶回收试剂盒(生工生物工程股份有限公司)进行切胶回收。胶回收产物使用pBM23 Toposmart克隆试剂盒将目标片段连接到T-A载体上,接着转入到大肠杆菌DH5α中,送至生工生物工程(上海)股份有限公司进行测序、拼接。

表1 目的基因克隆所用引物序列
1.2.5 基因内分子标记开发及应用 根据和在母本19141、父本19142间的序列差异,运用Primer Premier 5软件在其上、下游设计特异性引物,开发基因内分子标记(表2),用于检测E4450F2不同单株中这3个基因位点的遗传变异。InDel标记PCR扩增产物用8%聚丙烯酰胺凝胶电泳检测,和的SNP突变位点采用PARMS技术检测[13]。
1.2.6 杂交验证 19142分别与淡紫花白果突变材料19147(基因型为ddPPYY)和白花绿果突变材料19144(基因型为)杂交,观察F1后代果色表型。
2 结果
2.1 上位基因控制的茄子特殊果色遗传规律
白花白果母本19141和白花白果父本19142杂交,E4450F1为紫花紫红果(图1-A)。19141、19142、E4450F1的果皮总花青素含量测定结果为E4450F1最高(4.95 mg/100 g FW);其次是19141(0.52 mg/100 g FW),19142含量最低(0.11 mg/100 g FW)(图1-B)。E4450F2群体出现花色和果色分离,分离出紫花紫红果、紫花白果、白花白果3种表型单株(图1-C)。

表2 SmMYB1 InDel标记和SmDFR、SmANS SNP标记引物序列
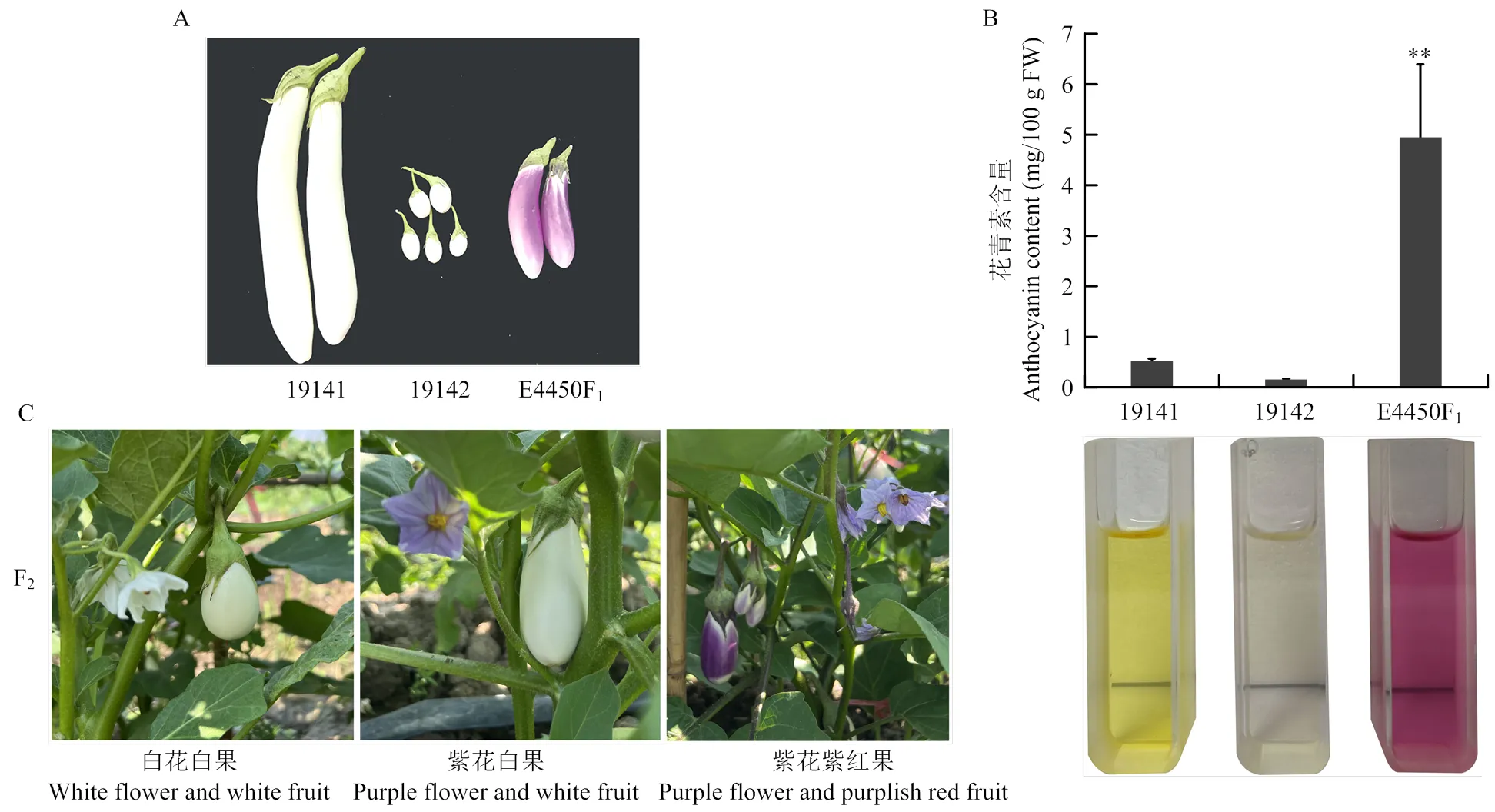
A:19141、19142、E4450F1的表型;B:19141、19142和E4450F1的果皮花青素含量(**,P<0.01);C:E4450F2的表型
由表3可知,E4450F2分离群体紫红果单株数小于白果单株数,不符合已报道的两对上位基因控制的F2紫红果和白果分离比为9﹕7的遗传规律[10-11]。
在已知19141突变位点为位点的基础上,推测19142突变了另外2个茄子果色上位基因和。19141的基因型为,19142基因型为,E4450F1的基因型则为E4450F1单株自交,雌、雄配子各有8种类型配子组合,会产生64种配子体组合的F2群体(表4)。根据茄子果色上位基因的调控特点,其中任何一个位点的纯合隐性突变都会抑制花青素合成,从表4可见,27种配子体组合产生的基因型对应果实有花青素呈色表型,37种配子体组合产生的基因型对应果实无花青素呈色表型,即2个亲本3个花青素合成相关的果色基因突变情况下,F2果实有花青素呈色单株和果实无花青素呈色单株的分离比为27﹕37。
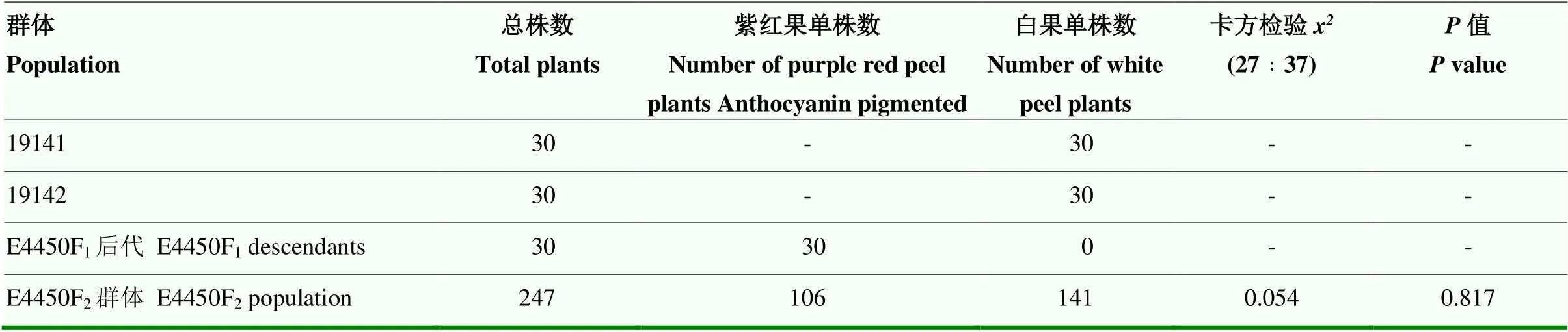
表3 不同世代果色分离比

表4 DdPpYy基因型F1自交后代的等位基因组合
加粗表示配子体组合基因型对应果皮有花青素呈色表型;无加粗表示配子体组合基因型对应果皮无花青素呈色表型,其中蓝色字体基因型对应紫花白果表型
Bold indicates the genotype of the gametophyte combination corresponds to phenotype with anthocyanins pigmentation in the peel; No bold indicates the genotype of the gametophyte combination corresponds to phenotype without anthocyanins pigmentation in the peel; Among them the blue font genotype indicates to the phenotype of purple flower and white fruit
采用卡方检验对E4450F2分离群体紫红果单株与白果单株的分离比进行检验,结果表明,紫红果与白果的分离比符合27﹕37(>0.05,表3),说明白果亲本19141突变了1个花青素合成的基因位点,白果亲本19142同时突变了2个花青素合成的基因位点,分别为和。
2.2 SmMYB1、SmDFR和SmANS克隆
2.2.1为上位基因位点的候选基因。19142的DNA长度为1 257 bp,cDNA长度为642 bp。通过与19141的全长序列对比,发现19142缺失了第1内含子3′端18个碱基和第2外显子5′端8个碱基,共26 bp(图2-A);另外,第2内含子存在2个相邻的InDel,间隔6 bp,第1个是6 bp,第2个是46 bp,使19142第2内含子比19141多52 bp。cDNA克隆发现,上述26 bp的缺失导致第2外显子跳跃,使第62位氨基酸残基处三联体密码子变为终止密码子TAA。
2.2.2克隆为上位基因位点的候选基因。克隆、测序拼接发现,19142与19141相比仅在第1外显子第101 bp处存在1个SNP位点(T﹕A)(图2-B)。已知19141在第1外显子第101号碱基发生突变,T变为A,形成终止密码子,导致蛋白质合成提前终止[10],19142的未发生突变,所以19142该位点基因型为。
2.2.3克隆为上位基因位点的候选基因。全长为1 999 bp,包含有6个外显子和5个内含子。19141与19142序列对比发现在第2外显子最后一个碱基为SNP,19141为G,19142为C。这个SNP紧邻剪切位点,为碱基错义突变和剪切突变。另外,启动子克隆发现,在起始密码子上游-326 bp位置,父本和母本之间存在一个SNP(C﹕G),导致19142缺失1个CAAT-box顺式作用元件(图2-C)。启动基本元件CAAT框是真核生物基因常有的调节区,也可能是RNA聚合酶的一个结合处,控制着转录起始的频率。综上,推测19142启动子顺式调控元件缺失以及剪切突变协同导致功能异常。
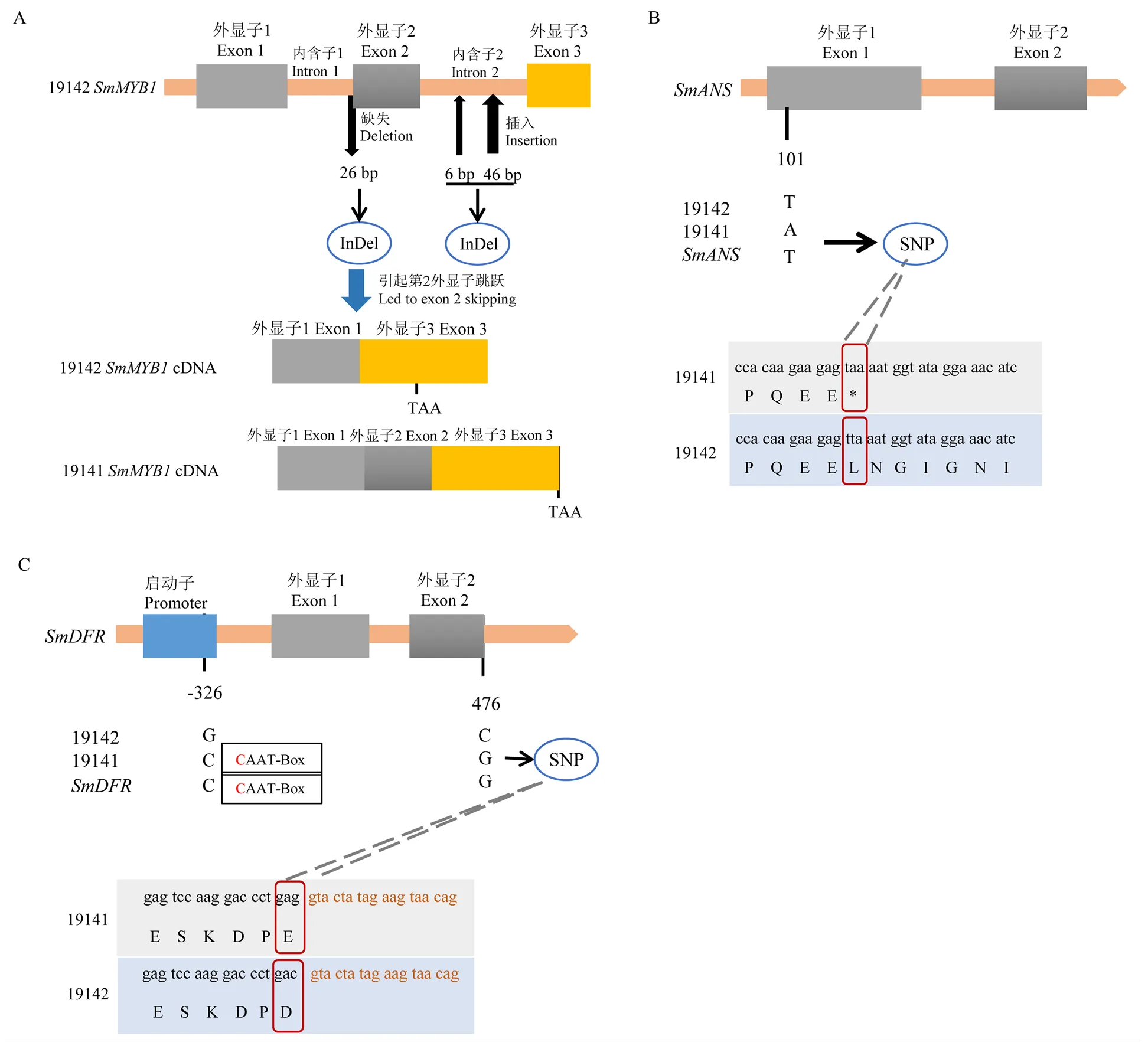
A:亲本的SmMYB1 DNA序列差异和InDel标记开发位点;B:亲本的SmANS DNA序列差异和SNP标记开发位点;C:亲本的SmDFR DNA序列、启动子序列差异和SNP标记开发位点
2.3 SmMYB1、SmANS和SmDFR基因内分子标记开发
根据亲本第1内含子和第2外显子26 bp碱基的差异,开发了一对SmMYB1-26bpInDel标记。SmMYB1-26bpInDel标记在19141扩增产物中有264 bp片段扩增;在19142中有238 bp片段扩增,E4450F1同时有264 bp和238 bp两个片段扩增(图3-A)。根据亲本第2内含子52 bp碱基的差异,开发了一对SmMYB1-52bpInDel标记。SmMYB1-52bpInDel标记在19141扩增产物中有293 bp片段扩增;在19142中有345 bp片段扩增,E4450F1同时有293 bp和345 bp两个片段扩增(图3-B)。
根据在19142与19141的SNP位点,在突变碱基上、下游设计PARMS检测引物,开发了SmANS-Chr08SNP和SBJ-DFR标记。根据SNP标记,可以将E4450F2群体基因分型,图4-A为遗传变异PARMS技术检测结果,HEX信号对应19142位点(T﹕T),为基因型;FAM信号对应19141位点(A﹕A),为基因型,FAMHEX信号对应E4450F1杂合位点(A﹕T),为基因型。图4-B为遗传变异PARMS技术检测结果,HEX信号对应19142位点(C﹕C),为基因型;FAM信号对应19141位点(G﹕G),为基因型;FAMHEX信号对应E4450F1杂合位点(G﹕C),为基因型。
2.4 基因型与表型对应性
根据开发的基因内分子标记,对E4450F2群体的104个单株进行基因分型。基因型与表型对应情况如表5所示。表型为紫花紫果色表型对应8种基因型,分别为,即基因型对应紫色花冠紫红果植株表型;白花白果表型对应13种基因型,分别为和,即结构基因和只要有一个位点为纯合隐性,就为白花白果表型。可能是由于分型的F2单株较少,和基因型单株没有检出。紫花白果表型对应4种基因型,分别为由于母本19141的白果是由于位点结构基因突变引起,19142白果为位点调控基因和位点结构基因同时突变引起,3个独立的基因位点分离重组,所以F2子代中,出现有别于两个白花白果亲本的紫花白果表型单株(对应基因型为)。位点候选基因为转录因子,其表达调控具有组织特异性,这是基因型单株在花中能合成花青素呈紫色,而在果皮中不能合成花青素呈白色的分子基础。综上,基于3个上位基因位点遗传变异进行基因分型的结果,可以100%解释E4450F2子代果色表型与基因型的对应关系。
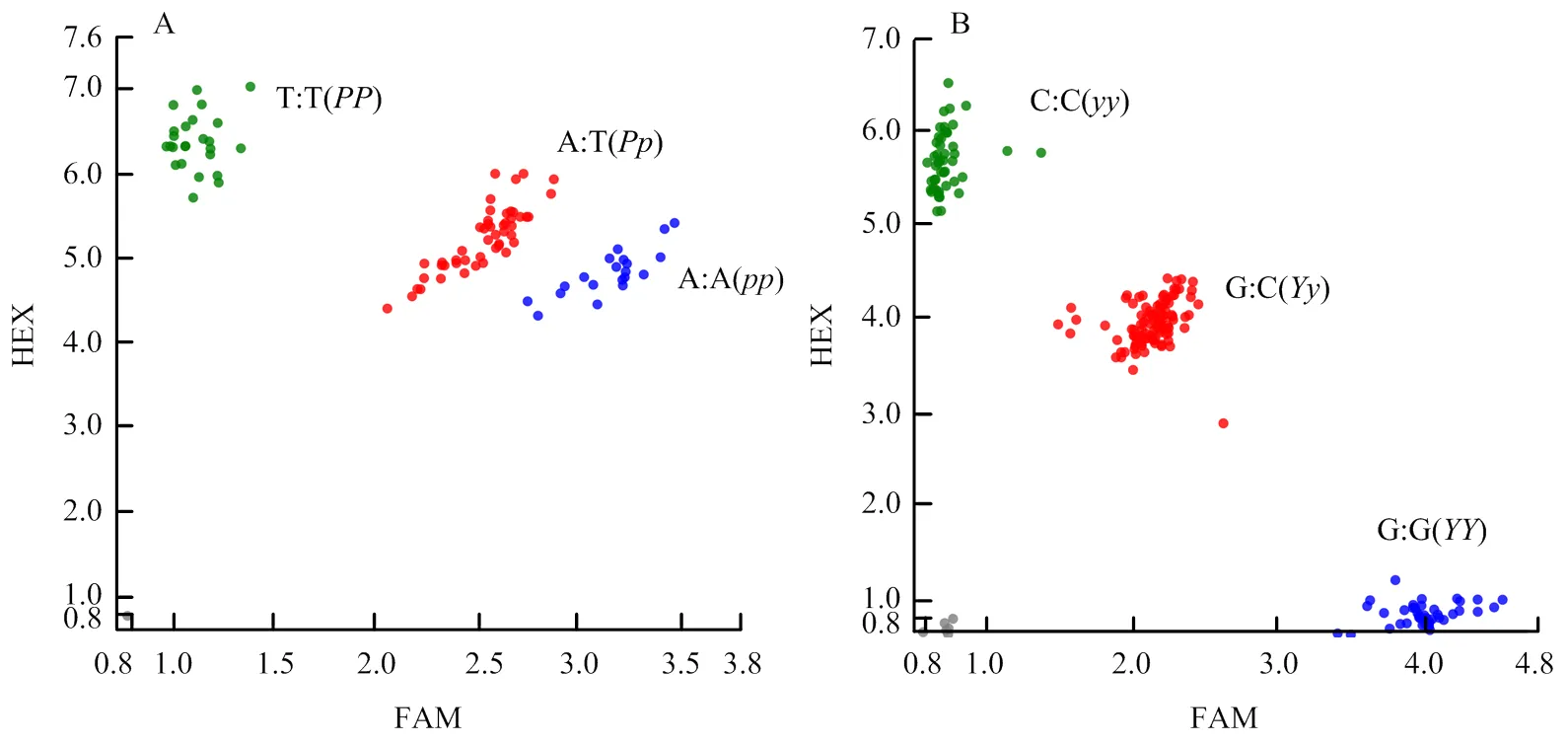
A:SmANS-Chr08SNP标记的分型图;B:SBJ-DFR标记的分型图

表5 E4450F2群体基因型和表型对应情况
2.5 杂交验证遗传规律
本试验父本19141与母本19142杂交F1代表型为紫花紫红果,为了验证19142为双突变体材料,以19142作为母本材料与白花绿果突变材料19144杂交,观察到F1后代表型为白花绿果;与淡紫花白果突变材料19147杂交,观察到F1后代表型为淡紫花白果(图5)。根据茄子果色上位基因的调控特点,其中任何一个位点的纯合隐性突变都会抑制花青素合成,亲本都为突变F1代则形成纯合隐性的基因型;亲本都为突变F1代则形成隐性的dd基因型,果皮均无法合成花青素,产生了无花青素沉着的绿果和白果。

图5 父本19144、父本19147及其与19142杂交后代F1的花和果实表型
3 讨论
3.1 上位基因互作调控花色和果色
花青素是影响茄子果皮颜色的主要色素之一,研究花青素合成通路关键基因互作对于茄子果色育种具有重要意义。控制生物复杂性状的因素包括基因主效应、基因间互作效应(上位性)以及基因与环境的互作效应[14]。上位性最早在豌豆杂交试验中被发现,当两个白花的亲本杂交时,F1的花为紫花,F2群体中紫花与白花的分离比为9﹕7,为了解释这一现象,BATESON提出了上位性的概念[8]。后来,在豌豆上发现和位点与豌豆中的花青素色素沉着有关,基因编码bHLH转录因子,在白花突变体中,一个剪切位点上的SNP(G→A),引起mRNA的错误剪接,导致终止密码子提前;基因编码WD40蛋白,该蛋白有多种突变形式,导致了白花表型[15]。马铃薯块茎颜色遗传受3个遗传位点(和的控制,位点是一种与花青素分布的组织特异性相关的特殊发育基因,果实红色产生依赖于位点,而紫色依赖于位点[16]。研究证明,马铃薯中的位点为编码R2R3-MYB转录因子[17],位点对应,位点对应[18]。3个上位基因、和共同调控茄子果皮花青素合成[9]。近期,通过遗传作图定位并获得了和的候选基因分别为[10][10]和[12]本研究中两个白果茄子亲本杂交,3个上位基因(和)互作产生紫红果F1及其F2群体紫色果色单株与白色果色单株分离比为27﹕37的特殊遗传效应,其中母本19141突变了位点,基因型为,父本19142同时突变了和位点,基因型为,杂交F1基因型为,3个基因位点杂合,花青素代谢通路打通,所以F1为紫花紫果。前期在其他园艺作物上有果色遗传受1对或2对基因控制的报道[19-21],但3个基因共同控制产生果色特殊分离比还未见报道。、和互作的3个基因位点共同决定茄子果皮花青素合成,其中任何一个基因突变都会导致果皮不能合成花青素。
3.2 茄子果色上位基因遗传变异
到目前为止,参与茄子花青素生物合成的结构基因,如、、、[22-23]和[24],以及调控基因,如[25]、[26]、[27]已被克隆和验证。()、()和()3个上位基因位点共同决定茄子果皮花青素合成。本研究中白花白果茄子亲本19141的发生突变[10],白花白果茄子亲本19142的和均发生突变。BABAK等[28]在紫花白果茄子(无花青素沉着)材料中检测到26 bp缺失和第2内含子52 bp插入,26 bp碱基的缺失导致了mRNA第2外显子缺失,使得蛋白合成受损,这与本研究中白果父本19142的突变形式相同。除了上述的突变形式,还存在多种遗传变异形式。You等[10]发现紫花白果茄子亲本19147的启动子区有1个G碱基的插入,而且在R2结合域缺失6个碱基。BABAK等[28]研究发现果实无花青素累积的白花红茄()第3外显子有9核苷酸插入和11个SNP。WANG等[29]在白果茄子材料CGN18774中发现在第2外显子最后一个碱基处存在一个SNP(G→C)位点,导致剪切突变,这与本研究19142的突变方式相同,另外efc1材料中剪切识别位点第2内含子的第1碱基由G突变为A,也会导致剪切突变;在绿果茄子(无花青素沉着)材料的启动子区域发现起始密码子上游-301 bp位置的SNP(C→G),影响了与启动子的相互作用,从而影响了的表达。本研究19142中在第2外显子的突变方式与WANG等[29]在CGN18774材料上突变的方式一致,但启动子区域SNP位点发生位置以及影响的顺式调控元件有所差异,这可能是材料的遗传背景差异造成的。本研究基于3个上位基因遗传变异开发了4个基因内分子标记,对准确、高效的选育目标果色茄子具有重要作用。
3.3 突变上位基因类型对茄子植株不同部位花青素合成的影响
和是花青素合成通路上的关键结构基因,其中任何一个基因突变都会阻断整个代谢通路;对花青素合成通路结构基因起激活作用,并且在不同组织部位花青素合成特异性调控中发挥着重要作用。通过本研究基因型与表型联合分析发现,和中任何一个基因隐性纯合都会产生白花白果表型,这与两对上位基因控制的茄子果色遗传规律一致[11]。本研究中白花白果亲本19142与突变亲本紫花白果色19147杂交,F1后代(基因型为ddPPYy)表型为紫花白果;均为白花白果的19141与19142杂交E4450F2子代中基因型对应紫花白果表型,这是由于果皮中特异性调控花青素合成的()发生了突变而低表达,无法激活结构基因表达而导致果皮颜色为白色[11];而花为紫色,则可能是由于其他MYB转录因子在茄子花的花青素特异合成中发挥着作用。已有研究表明茄子花色受一对基因控制,紫花对白花为完全显性[30],茄子花色和果皮颜色为不完全连锁遗传[31]。这与本研究的结果一致,紫花和白花材料杂交F1子代为紫花,白花和白果或绿果连锁,但紫花有可能是紫红果也可能是白果或绿果。
4 结论
2个白花白果茄子亲本杂交F1代果皮呈紫花紫红色,且F2代白果单株比例大于紫红果单株比例,这种特殊遗传规律是由于其中的一个亲本在花青素合成代谢通路的1个基因位点发生了突变,另外一个亲本在花青素合成代谢通路的另外2个基因位点发生了突变。两亲本3个突变基因上位互作产生了F2分离后代有花青素沉着果实单株和无花青素沉着果实单株27﹕37的特殊分离比率。两个白果亲本杂交F1为紫红色,是由于3个上位基因位点、和同时处于杂合状态,花青素合成得以恢复。
[1] DAUNAY M, AUBERT S, FRARY A, DOGANLAR S, LESTER R N, BARENDSE G, WEERDEN G V D, HENNART J, HAANSTRA J, DAUPHIN F, JULLIAN E. Eggplant () fruit color: Pigments, measurements and genetics//Proceedings of the 12th EUCARPIA Meeting on Genetics and Breeding of Capsicum and Eggplant, 2004: 108-116.
[2] 廖毅, 孙保娟, 孙光闻, 刘厚诚, 李植良, 黎振兴, 汪国平, 陈日远. 与茄子果皮颜色相关联的AFLP及SCAR标记. 中国农业科学, 2009, 42(11): 3996-4003. doi: 10.3864/j.issn.0578-1752.2009.11.029.
LIAO Y, SUN B J, SUN G W, LIU H C, LI Z L, LI Z X, WANG G P, CHEN R Y. AFLP and SCAR markers associated with peel color in eggplant. Scientia Agricultura Sinica, 2009, 42(11): 3996-4003. doi: 10.3864/j.issn.0578-1752.2009.11.029. (in Chinese)
[3] HOLTON T A, CORNISH E C. Genetics and biochemistry of anthocyanin biosynthesis. The Plant Cell, 1995, 7(7): 1071-1083.
[4] KOES R, VERWEIJ W, QUATTROCCHIO F. Flavonoids: A colorful model for the regulation and evolution of biochemical pathways. Trends in Plant Science, 2005, 10(5): 236-242.
[5] LIU Y, TIKUNOV Y, SCHOUTEN R E, MARCELIS L F M, VISSER R G F, BOVY A. Anthocyanin biosynthesis and degradation mechanisms in solanaceous vegetables: A review. Frontiers in Chemistry, 2018, 6: 52.
[6] 宫硖, 薛静, 张晓东. 植物花青素合成途径中的调控基因研究进展. 生物技术进展, 2011, 1(6): 381-390.
GONG X, XUE J, ZHANG X D. Regulation genes in plant anthocyanin synthesis pathway. Current Biotechnology, 2011, 1(6): 381-390. (in Chinese)
[7] ALBERT N W, DAVIES K M, LEWIS D H, ZHANG H B, MONTEFIORI M, BRENDOLISE C, BOASE M R, NGO H, JAMESON P E, SCHWINN K E. A conserved network of transcriptional activators and repressors regulates anthocyanin pigmentation in eudicots. The Plant Cell, 2014, 26(3): 962-980.
[8] MIKO I. Epistasis: Gene interaction and phenotype effects. Nature Education, 2008, 197: 2.
[9] TIGCHELAAR E C, JANICK J, ERICKSON H T. The genetics of anthocyanin coloration in eggplant (L.). Genetics, 1968, 60(3): 475-491.
[10] YOU Q, LI H M, WU J, LI T, WANG Y K, SUN G W, LI Z L, SUN B J. Mapping and validation of the epistaticandgenes controlling anthocyanin biosynthesis in the peel of eggplant (L.) fruit. Horticulture Research, 2023, 10(2): uhac268.
[11] 孙保娟, 汪瑞, 孙光闻, 王益奎, 李涛, 宫超, 衡周, 游倩, 李植良. 转录组及代谢组联合解析茄子果色上位遗传效应. 中国农业科学, 2022, 55(20): 3997-4010. doi: 10.3864/j.issn.0578- 1752.2022.20.011.
SUN B J, WANG R, SUN G W, WANG Y K, LI T, GONG C, HENG Z, YOU Q, LI Z L. Transcriptome and metabolome integrated analysis of epistatic genetics effects on eggplant peel color. Scientia Agricultura Sinica, 2022, 55(20): 3997-4010. doi: 10.3864/j.issn. 0578-1752.2022.20.011. (in Chinese)
[12] 任旋. 茄子果色上位基因定位及候选基因分析[D]. 广州: 华南农业大学, 2021.
REN X. Mapping and candidate gene analysis of epistaticgene in eggplant fruit color [D]. Guangzhou: South China Agricultural University, 2021. (in Chinese)
[13] YE S, DHILLON S, KE X Y, COLLINS A R, DAY I N M. An efficient procedure for genotyping single nucleotide polymorphisms. Nucleic Acids Research, 2001, 29(17): e88.
[14] WADE M J. Epistasis, Complex Traits, and Mapping Genes. Microevolution Rate, Pattern, Process. Dordrecht: Springer Netherlands, 2001: 59-69.
[15] HELLENS R P, MOREAU C, KUI L W, SCHWINN K E, THOMSON S J, FIERS M W E J, FREW T J, MURRAY S R, HOFER J M I, JACOBS J M E, DAVIES K M, ALLAN A C, BENDAHMANE A, COYNE C J, TIMMERMAN-VAUGHAN G M, NOEL ELLIS T H. Identification of Mendel’s white flower character. PLoS ONE, 2010, 5(10): e13230.
[16] SALAMAN R N. The inheritance of colour and other characters in the potato. Journal of Genetics, 1910, 1(1): 7-46.
[17] JUNG C S, GRIFFITHS H M, JONG D M, CHENG S P, BODIS M, KIM T S, JONG W S. The potato developer (D) locus encodes an R2R3 MYB transcription factor that regulates expression of multiple anthocyanin structural genes in tuber skin. Theoretical and Applied Genetics, 2009, 120(1): 45-57.
[18] ZHANG Y F, CHENG S P, JONG D, GRIFFITHS H, HALITSCHKE R, JONG W. The potato R locus codes for dihydroflavonol 4-reductase. Theoretical and Applied Genetics, 2009, 119(5): 931-937.
[19] 吴浪, 刘婧仪, 梁燕. 番茄绿果与红果颜色性状遗传的研究. 园艺学报, 2016, 43(4): 674-682.
WU L, LIU J Y, LIANG Y. Inheritance on fruit color character between green and red of tomato. Acta Horticulturae Sinica, 2016, 43(4): 674-682. (in Chinese)
[20] 刘军, 周晓慧, 鲍生有, 庄勇. 特殊白茄种质的果色遗传及相关性状分析. 江西农业大学学报, 2016, 38(2): 255-259.
LIU J, ZHOU X H, BAO S Y, ZHUANG Y. Fruit color heredity and related characters of white eggplant. Acta Agriculturae Universitatis Jiangxiensis, 2016, 38(2): 255-259. (in Chinese)
[21] 李全辉, 巩振辉. 线辣椒成熟果色黄色性状遗传规律. 西北农业学报, 2019, 28(5): 762-766.
LI Q H, GONG Z H. Study on the inheritance of ripe yellow fruit characters in chili pepper (var. longunt). Acta Agriculturae Boreali-Occidentalis Sinica, 2019, 28(5): 762-766. (in Chinese)
[22] CHEN M Q, XU M Y, XIAO Y, CUI D D, QIN Y Q, WU J Q, WANG W Y, WANG G P. Fine mapping identifies SmFAS encoding an anthocyanidin synthase as a putative candidate gene for flower purple color inL. International Journal of Molecular Sciences, 2018, 19(3): 789.
[23] STOMMEL J R, DUMM J M. Coordinated regulation of biosynthetic and regulatory genes coincides with anthocyanin accumulation in developing eggplant fruit. Journal of the American Society for Horticultural Science, 2015, 140(2): 129-135.
[24] JIANG M M, LIU Y, REN L, LIAN H L, CHEN H Y. Molecular cloning and characterization of anthocyanin biosynthesis genes in eggplant (L.). Acta Physiologiae Plantarum, 2016, 38(7): 163.
[25] ZHANG Y J, HU Z L, CHU G H, HUANG C, TIAN S B, ZHAO Z P, CHEN G P. Anthocyanin accumulation and molecular analysis of anthocyanin biosynthesis-associated genes in eggplant (L.). Journal of Agricultural and Food Chemistry, 2014, 62(13): 2906-2912.
[26] LI L Z, HE Y J, GE H Y, LIU Y, CHEN H Y. Functional characterization of SmMYB86, a negative regulator of anthocyanin biosynthesis in eggplant (L.). Plant Science, 2021, 302: 110696.
[27] XI H C, HE Y J, CHEN H Y. Functional characterization of
[28] BABAK O, NIKITINSKAYA T, NEKRASHEVICH N, YATSEVICH K, KILCHEVSKY A. Identification of DNA markers of anthocyanin biosynthesis disorders based on the polymorphism of anthocyanin 1 tomato ortholog genes in pepper and eggplant. Crop Breeding, Genetics and Genomics, 2020, 2(3): e200011.
[29] WANG X, CHEN X P, LUO S X, MA W, LI N, ZHANG W W, TIKUNOV Y, XUAN S X, ZHAO J J, WANG Y H, ZHENG G D, YU P, BAI Y L, BOVY A, SHEN S X. Discovery of agene that controls anthocyanin accumulation in the spiny: Roles of a natural promoter variant and alternative splicing. The Plant Journal, 2022, 111(4): 1096-1109.
[30] 林桂荣, 李宝江, 魏毓棠. 茄子白花突变的遗传及其对相关性状的影响. 遗传, 2006, 28(6): 713-716.
LIN G R, LI B J, WEI Y T. Inheritance of the white-flower and its influence to related characters in eggplant (linn). Hereditas, 2006, 28(6): 713-716. (in Chinese)
[31] 张成成, 范孟媛, 成玉富, 杨旭, 陈学好. 茄子不同花色、果色和果肉色相关性遗传研究. 植物遗传资源学报, 2021, 22(3): 700-706.
ZHANG C C, FAN M Y, CHENG Y F, YANG X, CHEN X H. Genetic study on correlation of flower color, peel color and flesh color of eggplant. Journal of Plant Genetic Resources, 2021, 22(3): 700-706. (in Chinese)
Analysis of Genetic Effect of Fruit Color Controlled by Epistatic Genes in Eggplant

1Vegetable Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Key Laboratory for New Technology Research of Vegetables, Guangzhou 510640;2College of Horticulture, South China Agricultural University, Guangzhou 510642;3Key Laboratory of Horticultural Plant Biology, Ministry of Education, Huazhong Agricultural University, Wuhan 430070
【Objective】Fruit color is an important trait that affects the commercial value of eggplant fruit. By analyzing the causes for the special segregation ratio of individual plants with purple red peel and with white peel in the F2population constructed by crossing between two white-fruit parents, this paper could lay the foundation for elucidating the mechanism of epistatic gene interaction on regulating eggplant fruit coloration.【Method】The white-flower and white-peel female parent 19141 with mutation at the structural geneinvolving in the anthocyanin biosynthesis pathway, white-flower and white-peel male parent 19142 with unknown mutation genes involving in the anthocyanin biosynthesis pathway, and their F1population with purple red peel and F2population with separate peel colors were used to explore the epistatic inheritance of eggplant fruit coloration. Genes and their mutation patterns were studied by cloning the known genes,() and() related to peel color in male parent 19142. Molecular basis of peel color-controlling epigenetic genes was analyzed by developing molecular markers based on genetic variations of peel color genes, analyzing the relationship between genotype and phenotype in E4450F2population, and crossing with other eggplant parents without anthocyanin pigmentation in peel.【Result】The segregation ratio of plants with purple red fruit and white fruit in E4450 F2progeny was consistent with the segregation ratio of 27:37 controlled by three pairs of epistatic genes, that is, mutations occurred at thegene locus in 19141, with genotype, and mutations occurred at bothandgene loci in 19142, with genotype. The results of cloning and sequencing showed that alternative splicing occurred inof 19142, which led to the second exon skipping. In 19142, SNP (C→G) in the promoter region’s -326 bp upstream of the start codon resulted in the absence of a CAAT-box cis-acting element ingene. An SNP, G to C, at the last base of the second exon, was annotated as splicing mutation, which might cause abnormal function ofgene in 19142, resulting in the eggplant peel’s inability to synthesize anthocyanin. Based on the genetic variation ofand, the functional molecular markers were developed, and the progenies of E4450F2were genotyped. The results showed that genotype and phenotype were completely consistent.corresponded to phenotypes of purple flower and purple red peel,corresponded to phenotype of purple flower and white peel,_,,,_,andgenotypes corresponded to white flower and white peel phenotypes. When 19142 was crossed with white-peel inbred line 19147 (ddPPYY), and green-peel inbred line 19144 (), it was found that the fruit color of the two F1progenies were white and green, respectively, and there was no anthocyanin pigmentation in the peel, which further proved that 19142 was a double mutantand.【Conclusion】When two eggplant parents without anthocyanin pigmentation in the peel were crossed, the peel of the F1generation had anthocyanidin pigmentation, and the segregation ratio of plants with anthocyanin pigmentation and non-anthocyanin pigmentation in F2population was 27:37, it was because one of the parents had a mutation at a gene locus in the anthocyanin biosynthesis pathway, and the other parent had mutations at two other loci in the anthocyanin biosynthesis pathway. When two parents without anthocyanin pigmentation were crossed, the peel of F1was able to synthesize anthocyanin and present purple red color, which was due to the simultaneous dominance of three epistatic gene loci,and, and anthocyanin biosynthesis was restored. Mutation of the structural gene oforinhibited anthocyanin biosynthesis in all parts of the plant. The regulation of transcription factor mutationwas tissue specific, and its mutation inhibited anthocyanin biosynthesis in the peel, but did not inhabit anthocyanin biosynthesis in the flower.
eggplant; peel color; epistatic gene; anthocyanin; genetic law

10.3864/j.issn.0578-1752.2023.23.014
2023-06-05;
2023-10-04
广西科技重大专项(桂科AA22068088)、广东省现代农业产业技术体系(2023KJ110,2023KJ106)、广东省级乡村振兴战略专项资金种业振兴项目(2022-NPY-00-026)
陈锦溶,E-mail:20213137106@stu.scau.edu.cn。通信作者孙保娟,Tel:020-38469456;E-mail:sunbaojuan@hotmail.com。通信作者李植良,E-mail:vri_li@163.com
(责任编辑 赵伶俐)

