miR-535靶向GAB2基因通过激活PI3K/AKT信号通路促进山羊颗粒细胞增殖
王鹏,刘子嶷,刘玉芳,储明星
miR-535靶向GAB2基因通过激活PI3K/AKT信号通路促进山羊颗粒细胞增殖
王鹏,刘子嶷,刘玉芳,储明星
中国农业科学院北京畜牧兽医研究所/畜禽生物育种全国重点实验室,北京 100193
【背景】MicroRNA(miRNA)是长度为18—25 nt的短RNA分子,在哺乳动物卵巢颗粒细胞调控卵泡发育过程中起着重要作用。团队前期对云上黑山羊高、低产羔数个体卵巢转录组测序结果显示,miR-535能够影响山羊产羔数,但具体调控机制尚不清楚。【目的】通过研究miR-535靶向(GRB2 associated binding protein 2)及其相关信号通路PI3K/AKT对山羊颗粒细胞增殖的影响,进一步探讨其分子生物学调控机制。【方法】在本研究中,选择具有两胎以上产羔记录的高、低产云上黑山羊各3只,同期发情处理后采集卵泡期卵巢组织,收集原代颗粒细胞。使用荧光定量PCR(reverse transcription-quantitative PCR,RT-qPCR)检测miR-535和在云上黑山羊高、低产卵巢组织中的表达量。构建GAB2的过表达/干扰载体,使用RT-qPCR、Western blot、免疫荧光、CCK8、EdU和细胞凋亡检测候选基因对山羊卵巢颗粒细胞增殖的影响。使用miRDB和miRanda软件预测miR-535和GAB2的靶向关系,构建GAB2的野生型和突变型载体,利用双荧光素酶活性检验检测miR-535和GAB2的靶向关系。构建过表达/干扰miR-535载体,探究其颗粒细胞增殖及下游基因功能的影响。【结果】RT-qPCR结果显示,在高产云上黑山羊卵巢组织中的表达量显著低于低产个体,miR-535的表达则相反(<0.05);随后,RT-qPCR和Western blot结果表明,在颗粒细胞中过表达后,CCND2、CDK4和BCL2的表达量显著升高(<0.05),BAX的表达量显著降低(<0.05),抑制其表达则与之相反;EdU和CCK8检测显示,过表达后显著促进颗粒细胞增殖(<0.05),抑制其表达后则相反;双荧光素酶报告试验表明,miR-535抑制了GAB2基因3’UTR区域的双荧光素酶活性。RT-qPCR和Western blot结果显示,在颗粒细胞中过表达miR-535后,GAB2、CCND2、CDK4和BCL2的表达量显著降低(<0.05),BAX的表达量显著升高(<0.05),抑制其表达后则与之相反;EdU和CCK8检测显示,miR-535过表达后抑制颗粒细胞增殖,抑制其表达后则相反;细胞凋亡试验表明,miR-535过表达后促进颗粒细胞增殖,抑制其表达后则相反。在颗粒细胞中抑制miR-535后,发现PI3K/AKT信号通路标志因子AKT1的表达水平显著升高(<0.05)。【结论】miR-535通过抑制的表达,抑制了山羊颗粒细胞的增殖,为进一步探究miR-535调控山羊颗粒细胞的生物学功能提供了理论依据。
山羊产羔数;卵巢颗粒细胞增殖;GAB2基因;miR-535;P13K/AKT信号通路
0 引言
【研究意义】颗粒细胞作为性索体细胞之一,与哺乳动物卵巢卵泡发育密切相关[1]。卵泡是卵巢的基本功能单位,由未成熟的卵母细胞及其周围颗粒细胞和卵泡膜细胞组成[2]。卵泡的选择、排卵和闭锁等对卵巢功能具有重要影响[3]。卵泡发育是一个有序、周期性的过程,从静止卵泡被激活到生长选择成为优势卵泡的过程中,颗粒细胞起着重要的作用[4]。在卵泡发育的周期中,卵泡具有不同的生长阶段,这些阶段与促黄体生成素(FSH)的含量有关,在生长过程中,通常是最大的卵泡持续生长,其他卵泡逐渐闭锁[5]。从原始卵泡到成熟卵泡的生长过程中,颗粒细胞通过与卵泡膜细胞直接联系,分泌生长因子和激素,在滋养卵母细胞中发挥关键作用[6]。颗粒细胞产生的雌激素及其他内分泌调节物质,引发减数分裂、类固醇生成、卵泡发育、卵丘扩张、黄体化等卵母细胞过程,最终导致成熟排卵[7]。因此,颗粒细胞的增殖、凋亡和分化成为卵泡发育的关键。排卵数又对产羔数起着决定性的作用,颗粒细胞的增殖决定了卵母细胞的生长发育,进而影响卵母细胞排卵,影响产羔数。【前人研究进展】GRB2相关结合蛋白2(GRB2 associated binding protein 2, GAB2)是GRB家族蛋白的重要成员,介导PI3K信号通路和ERK信号通路调控细胞生长发育[8]。GAB2在N端含有一个Pleckstrin同源性(PH)结构域,富含赖氨酸的基团和酪氨酸残基,以磷酸化方式与GRB2-SRC同源结构域(SH3)结合[9-10]。在GAB2中,两个富含脯氨酸GRB2-SRC同源结构域(SH3)的结合位点,通过SHC-GRB2复合物使GAB2与上游受体结合[11]。研究表明,GAB2可以参与调控细胞生长、迁移、分化和凋亡[12-14]。miRNA是长度为18—25 nt的短RNA分子,其主要功能是调节靶基因转录后沉默[15],影响相应基因的表达,并对相应的作用途径进行调控[16]。miRNA在卵巢颗粒细胞调控卵泡发育过程中起着重要作用[17-18]。已有研究指出miR-10a[19]、miR-130a-3p[20]、miR-21[21]、miR-1306[22]、miR-21-3[23]、miR-183-96-182[24]、miRNA17-9[25]、miR-21-3p[26]等均与卵巢颗粒细胞的增殖或凋亡相关。【本研究切入点】本团队前期在高、低产羔数云上黑山羊卵巢组织RNA-seq中筛选出与山羊产羔数相关候选基因和可能存在的调控元件miR-535,并且和miR-535可能对颗粒细胞产生影响,但具体作用机制还未明确。【拟解决的关键问题】本研究以山羊颗粒细胞为研究对象,利用RT-qPCR、Western blotting、CCK8、EdU、双荧光素酶试验、免疫荧光和细胞凋亡试验等验证了mi-535与的调控关系,探讨对山羊颗粒细胞的调控作用及相关机制,为山羊分子育种提供靶点。
1 材料与方法
试验时间为2022年12月至2023年3月,试验地点为中国农业科学院北京畜牧兽医研究所农业农村部动物遗传育种与繁殖重点实验室。
1.1 试验样品
云上黑山羊饲养于云南红河哈尼族彝族自治州,选择3周岁经产、健康状况良好且具有两胎以上产羔记录的云上黑山羊,根据产羔记录分为高产组(3.00± 0.38/胎)和低产组(1.32±0.19/胎),同期发情处理45 h后,所有试验羊饲养环境均相同。安乐死屠宰,收集新鲜卵巢组织,置于37℃生理盐水(含2%双抗(Penicilin-Streptomycin))中,运回实验室。使用75%医用酒精洗涤3次,37 ℃预热的生理盐水(含2%双抗)洗涤3次。使用5 mL医用注射器抽取卵泡直径2—6 mm的卵巢卵泡,收集至15 mL离心管中。2 000 r/min离心5 min去上清,加入DMEM/F12培养基(含2%双抗)重悬,1 500 r/min离心5 min,去上清,重复2次。将获得的细胞沉淀物加入10 mL DMEM/F12完全培养基(DMEM/F12﹕胎牛血清﹕双抗=45﹕5﹕1),接种于5 cm2培养皿中,置于细胞培养箱中培养(37 ℃,5% CO2,饱和湿度)。颗粒细胞密度达到85%以上,置于10 cm2培养皿中,同等条件培养,用于后续细胞试验。HEK293T细胞从北京绿源博德公司购买所得。
1.2 主要试剂
DMEM培养基、DMEM/F12培养基、Opti-MEM培养基、PBS缓冲液、胎牛血清、青霉素和链霉素、胰蛋白酶从Gbico(美国)公司购买所得;组织/细胞总RNA提取试剂盒、细胞凋亡检测试剂盒、CCK8检测试剂盒、Edu检测试剂盒、Western blotting所需分离胶、电泳液、转膜液、洗涤液和特超敏ECL 化学发光试剂等均从天根生化科技有限公司购买所得;Lipofectamine®2000转染试剂盒从Invitrogen(美国)购买所得;反转试剂盒和SYBR Green qPCR从Takara(日本)购买所得;双荧光素酶活性测定试剂盒从Promega(美国)购买所得;Western blotting所需一抗和二抗均从Proteintech公司(美国)购买所得;全蛋白提取试剂盒和BCA蛋白浓度测定试剂盒从北京索莱宝科技有限公司购买所得;其他均为常规化学试剂和常规耗材。
1.3 RNA提取和RT-qPCR
RNA的提取使用北京天根生化科技有限公司的动物组织/细胞RNA提取试剂盒,根据试剂说明书进行提取。提取完成后NanoDrop 2000(Thermo公司,美国)和1.2%琼脂糖凝胶检测RNA样品的浓度和质量。然后根据反转试剂盒说明书获得cDNA。以cDNA为模板,进行RT-qPCR。RT-qPCR的体系为20 μL:10 μmol·μL-1上下游引物各0.8 μL,10 mL SYBR Green qPCR,50 ng·μL-1cDNA 2 mL,6.4 μL ddH2O。qPCR程序为:95 ℃预变性5 s,95 ℃5 s,60 ℃30 s,40个循环。以山羊为内参基因。使用相对定量(2-△△CT)算法计算各基因的相对表达量。RT-qPCR的引物使用Primer 5软件设计,由上海生工生物工程股份有限公司(中国)合成,序列如表1所示。
1.4 Western blotting
使用全蛋白提取试剂盒提取细胞总蛋白。收集培养好的颗粒细胞于1.5 mL离心管中,使用高速离心机4℃12 000 r/min下离心30 min,收集上清,弃沉淀。使用BCA蛋白浓度测定试剂盒测定BCA,根据BCA标准曲线计算蛋白浓度。按照蛋白体积:5×SDS Loading Buffer=4﹕1,将蛋白与5×SDS Loading Buffer混匀后金属水浴锅100 ℃煮沸8 min。每孔加入30 μg蛋白于BeyoGel Plus PAGE预制胶(Tris-Gly,10%,10孔),80 V,25 min;120 V 60 min,观察溴酚蓝胶底部即可停止。电泳结束后,使用150 mA 90 min电泳条件进行转膜,随后使用QuickBlock™ Western封闭液摇床室温封闭2 h。之后加入不同浓度的一抗4℃下摇床封闭过夜,一抗稀释浓度:GAB2(1﹕2000);CCND2(1﹕2000);CDK4(1﹕2000);BAX(1﹕2000);BCL2(1﹕2000);AKT(1﹕2000);Caspace3(1﹕2000);PI3K(1﹕2000);GAPDH(1﹕2000)。TBST洗涤5次,每次5 min。二抗(1﹕1000)室温孵育2 h,二抗洗涤后使用特超敏ECL化学发光试剂显色,Odyssey CLX成像系统(Li-COR)曝光,拍照并保存。使用Image J软件分析条带灰度值,目的蛋白与GAPDH灰度值的比值即为目的蛋白的相对表达水平。

表1 RT-qPCR所使用的引物序列
1.5 载体构建和细胞转染
根据miR-535的序列在上海吉玛制药技术有限公司设计合成miR-535的模拟物(mimic)和抑制剂(inhibitor)。根据NCBI提供的序列,设计合成的过表达载体和干扰载体,过表达(pIRES2- EGFP-)和干扰(si-GAB2)载体在上海生工生物工程股份有限公司合成。
将山羊颗粒细胞以1×106个/孔的密度接种于6孔板,每孔加入2 mL DMEM完全培养基。待细胞密度至70%—80%时,进行细胞转染。弃培养基,加入2 mL PBS洗涤两次。转染6孔板的体系为:取242 μL Opti-MEM和8 μL Lipofectamine 2000试剂充分混匀配成A管。取230 μL Opti-MEM与20 μL 200 nmol·μL-1的载体(miR-535 mimic、miR-535 mimic NC、miR-535 inhibitor、miR-535 inhibitor NC、pIRES2-EGFP-、pIRES2-EGFP-NC、si-、si-NC,miR- 535 mimic+si-,miR-535 mimic+si-NC、miR-535 inhibitor+si-和miR-535 inhibitor+si-NC),充分混匀配成B管,静置5 min。将B管加入A管,混匀后静置20 min后加入6孔板中,之后加入1.5 mL的Opti-MEM。每组设置3个重复,转染6 h后换为DMEM完全培养基培养,48 h后检测基因表达水平或细胞增殖效率。
1.6 双荧光素酶报告基因检测
根据NCBI提供的序列合成GAB2基因3′-UTR- WT 和3′-UTR-MUT(上海吉玛制药技术有限公司)连接至psiCHECK2 载体,筛选阳性克隆并测序确认后,与miR-535 mimic和mimic NC在共转染至HEK293T 细胞系中,培养48 h 后收集细胞至1.5 mL离心管中,1 500 r/min离心5 min,每孔加入75 μL PBS重悬后,移至96 孔白色细胞培养板中。加入75 μL萤火虫荧光素酶,采用多功能酶标仪(MolecularDevices公司,美国)测定荧光值;加入75 μL内参海肾荧光素酶后,测定荧光值。计算萤火虫荧光素酶反应强度/内参海肾荧光素酶反应强度(Firefly Luciferase/Renilla Luciferase)的比值。
1.7 细胞凋亡检测
将山羊颗粒细胞以1×106个/孔的密度接种于6孔板,每孔加入2 mL DMEM完全培养基。待细胞密度至70%—80%时,进行细胞转染。根据细胞凋亡试剂盒说明书进行细胞凋亡实验。转染后的颗粒细胞培养48 h后,PBS洗1次;使用4%多聚甲醛固定30 min,使用PBS洗涤1次;收集细胞,涂片,使细胞黏附在载玻片上;使用甲醛配置的0.3%过氧化氢溶液中室温孵育20 min,PBS洗涤3次;使用免疫染色洗涤液(P0106),冰上孵育2 min,PBS洗涤1次;在载玻片上加50 μL生物素标记液(TdT酶﹕Biotin-dUTP=1﹕24),37 ℃孵育60 min,使用PBS洗涤1次,滴加100 μL标记反应终止液终止反应,室温孵育10 min;加入50 μL Streptavidin-HRP工作液,室温孵育30 min;加入200 μL DAB显色液,室温孵育5 min;之后使用荧光倒置显微镜(德国徕卡公司)观察细胞形态。
1.8 Cell Counting Kit-8 (CCK8)
使用Cell Counting Kit-8 (CCK8),检测颗粒细胞增殖情况。根据CCK8试剂盒说明书,以每孔2×103/100 μL的密度接种于96孔板,每组3个重复。根据试剂商说明书,转染相关载体后分别在细胞生长0、6、12、24、48 h每孔加入10 μL CCK8溶液,培养箱孵育2 h后使用酶标仪测定450 nm的吸光度,之后计算颗粒细胞增殖速率。细胞增殖活力计算:细胞活力(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100[A(加药):具有细胞、CCK-8溶液和药物溶液的孔的吸光度,A(空白):具有培养基和CCK-8溶液而没有细胞的孔的吸光度,A(0加药):具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度]。
1.9 EdU分析
使用EdU细胞增殖检测试剂盒,检测颗粒细胞的增殖情况。根据EdU细胞增殖检测试剂盒说明书,将山羊颗粒细胞以1×106个/孔的密度接种于6孔板,载体转染后培养12 h,待细胞状态正常后等体积加入37 ℃预热的EdU工作液(10 μmol·L-1),孵育3 h。EdU标记细胞完成后,去除培养液,并加入1 mL固定液(免疫染色固定液,P0098),室温固定15 min。洗涤液洗涤3次,每次5 min。去除洗涤液,每孔用1 mL通透液(免疫染色强力通透液,P0097)通透,室温孵育15 min。去除通透液,加入1 mL洗涤液洗涤2次,每次3 min。封闭液室温孵育20 min,洗涤液洗涤3次,每次2 min。每孔加入0.5 mL Click反应液,室温避光孵育30 min,洗涤液洗涤3次,每次5 min。每孔加入200 μL Streptavidin-HRP工作液,室温孵育30 min。洗涤液洗涤3次,每次2 min。荧光显微镜(德国,徕卡)下观察并拍照记录。
1.10 免疫荧光
山羊颗粒细胞以1×106个/孔的密度接种于6孔板,每组3个重复。多聚赖氨酸处理爬片,置入6孔板中,细胞转染载体培养48 h后取出。4%多聚甲醛固定20 min,PBS洗涤3次,每次3 min,10%山羊血清孵育30 min,适量GAB2抗体4 ℃孵育过夜,PBS洗涤3次,每次5 min,适量荧光IgG,37 ℃孵育1 h,PBS洗涤3次,每次5 min。DAPI避光加入染细胞核5 min,PBS洗涤4次,每次5 min。荧光淬灭剂处理,树脂胶密封载玻片,荧光倒置显微镜(德国,徕卡)观察采集图像。
1.11 统计分析
每个试验3个生物学重复,使用SPSS 18.0(SPSS INC. Chicago,IL,USA)软件进行统计分析。RT-qPCR和Western blot数据采用独立样本t检验分析,双荧光素酶报告基因试验通过单因素方差分析进行计算。**<0.01,*<0.05代表组间差异具有统计学意义[27]。
2 结果
2.1 miR-535与GAB2在高、低产羔数云上黑山羊卵巢组织中的表达
为验证本课题组前期云上黑山羊卵巢转录组数据的准确性,使用RT-qPCR鉴定miR-535和在云上黑山羊卵巢组织中的表达量。结果表明,miR-535在高产云上黑山羊卵巢中的表达显著低于低产云上黑山羊中的表达(<0.05)(图1-A);在高产云上黑山羊卵巢中的表达量显著高于低产云上黑山羊卵巢(<0.05)(图1-B)。这与本课题组转录组数据结果一致。

A. miR-535在高、低产羔数云上黑山羊卵巢组织中的mRNA表达;B. GAB2在高、低产羔数云上黑山羊卵巢组织中的mRNA表达。*P<0.05;**P<0.01。下同
2.2 GAB2促进山羊颗粒细胞增殖抑制其凋亡
为了探究对山羊卵巢颗粒细胞的调控作用,分别过表达/干扰后检测山羊颗粒细胞的增殖/凋亡情况。采用免疫荧光技术鉴定转染质粒后GAB2蛋白的表达,过表达后,GAB2表达量显著增多,干扰si-后,GAB2表达量显著降低(图2-A),表明过表达/干扰载体有效。RT-qPCR结果显示过表达后,细胞周期相关基因、基因表达水平显著上调(<0.05),细胞凋亡相关基因的表达水平显著下调(<0.05),的表达水平显著上调(<0.05),干扰后则相反(<0.05)(图2-B)。Western blot的结果与RT-qPCR结果一致(图2-C,D)。CCK8和EdU试验结果表明,过表达显著促进了颗粒细胞的增殖效率,而抑制的表达则相反(图2-E,F)。细胞凋亡染色表明,过表达可显著抑制颗粒细胞的凋亡;而抑制表达则促进了颗粒细胞凋亡(图2-G)。这些结果表明,能够促进山羊颗粒细胞的增殖并抑制其凋亡。

A. 转染pIRES2-EGFP-及NC、si-及NC后,免疫荧光检测GAB2的表达;B. 过表达/抑制后,、、、的mRNA相对表达量;C和D .过表达/抑制表达后,CCND2、CDK4、BCL2和BAX的蛋白表达水平和灰度值分析;E. 过表达/干扰表达后,EdU检测颗粒细胞增殖; F.过表达/抑制表达后,CCK8检测颗粒细胞增殖;G. 过表达/抑制表达后,细胞凋亡检测颗粒细胞凋亡情况
A. Immunofluorescence detection of GAB2 expression after overexpression or inhibition of; B. Relative mRNA expression levels of,,andafteroverexpression or inhibition; C and D. The protein expression levels and gray value analysis of CCND2, CDK4, BCL2 and BAX after overexpression or inhibition of; E. EdU assay of granulosa cell proliferation after overexpression or inhibition of; F. CCK8 assay of granulosa cell proliferation after overexpression or inhibition of; G. Apoptosis detection of granulosa cell proliferation after overexpression or inhibition of
图2促进山羊颗粒细胞增殖抑制其凋亡
Fig. 2promoted the proliferation of goat granulosa cells and inhibited their apoptosis
2.3 山羊miR-535靶向结合GAB2基因3’UTR
为了研究miR-535与之间的关系,通过在线软件Target Scan和miRanda对结合位点保守性进行分析。结果显示,预测的miR-535结合位点位于的3’UTR区(图3-A)。将miR-535 mimics和miR-535 mimics NC与野生型和突变型的双荧光素酶报告载体基因共转染至293T细胞中,双荧光素酶活性检测结果显示,miR-535降低了野生型载体中的相对荧光素酶活性(<0.05)(图3-B)。在颗粒细胞中过表达miR-535后,的表达量显著降低,而抑制miR-535表达后则相反(<0.05)(图3-C—E)。这些结果表明,在山羊颗粒细胞中miR-535可与的3’UTR区相结合,且miR-535直接靶向调控的表达。

A. miR-535和GAB2结合位点保守性预测;B. miR-535 mimics和GAB2 3’UTR区的双荧光素酶活性检测;C. miR-535过表达或抑制后GAB2 mRNA水平表达量检测;D,E. miR-535过表达或抑制后GAB2 蛋白水平表达量检测及灰度分析
2.4 miR-535抑制山羊颗粒细胞增殖促进其凋亡
为了探究miR-535对山羊卵巢颗粒细胞的调控作用,将miR-535 mimics、miR-535 mimics NC、miR-535 inhibitor和miR-535 inhibitor NC转染至山羊颗粒细胞,检测其对山羊颗粒细胞增殖/凋亡的影响。使用RT-qPCR技术检测了质粒转染后miR-535的mRNA相对表达量,结果表明,转染miR-535 mimics后,miR-535的表达量显著上调(<0.05);转染miR-535 inhibitor后,miR-535的表达量显著下调(<0.05)(图4-A),表明mimics/inhibitor载体有效。结果表明,过表达miR-535后,细胞周期相关基因、表达水平显著下调,细胞凋亡相关基因的表达水平显著上调(<0.05),的表达水平显著下调,抑制miR-535表达后则相反(图4-B,C)。Western blotting与RT-qPCR的结果一致(图4-D,E)。CCK8、EdU结果显示,过表达miR-535后,显著抑制了颗粒细胞的增殖能力;抑制miR-535表达后则相反(图4-F,G)。细胞凋亡染色表明,过表达miR-535能够显著促进颗粒细胞的凋亡;抑制miR-535后则显著抑制了颗粒细胞凋亡(图4-H)。这些结果表明,miR-535可以显著抑制山羊颗粒细胞的增殖,并促进其凋亡。
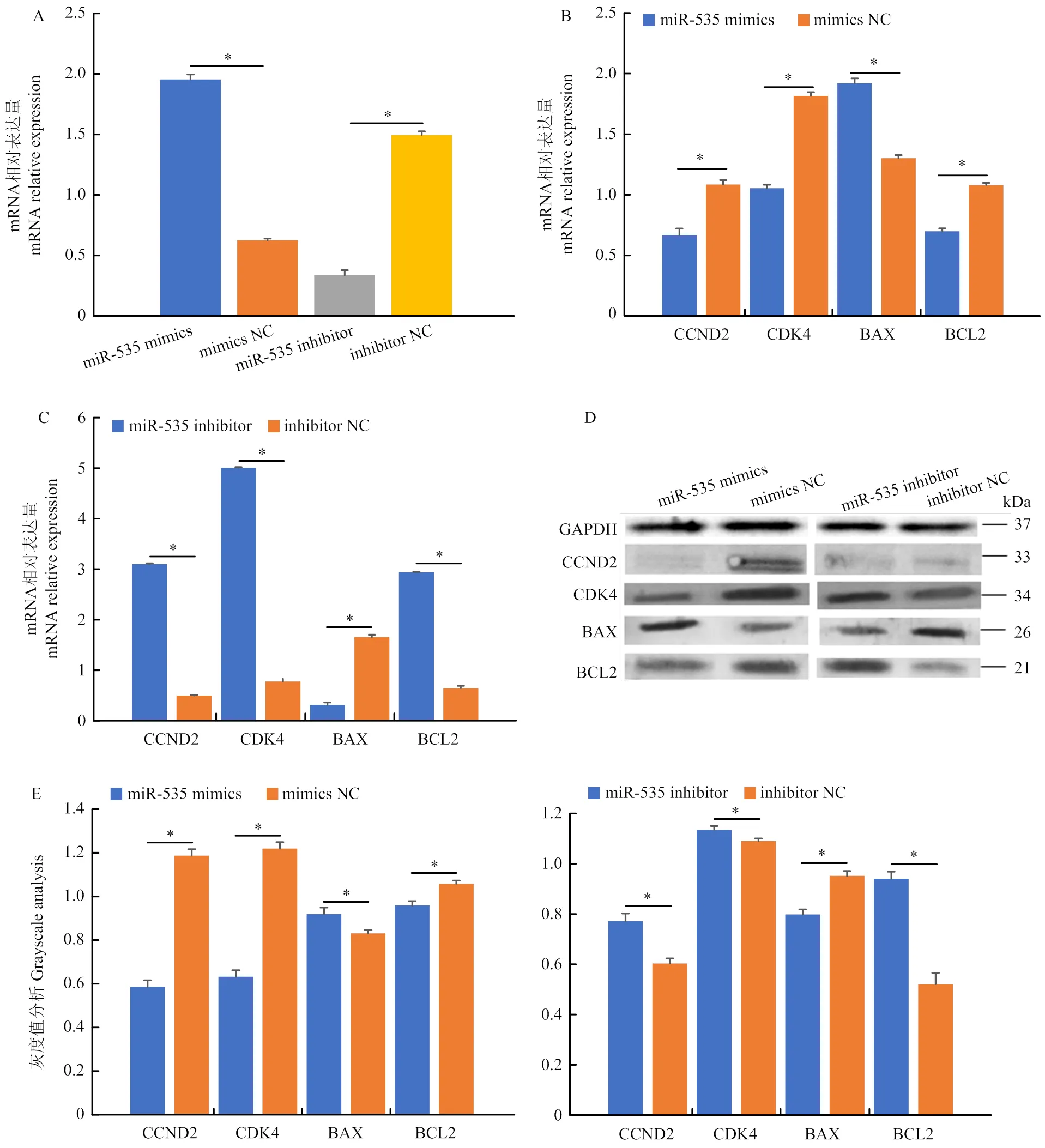
A. 转染miR-535 mimics、miR-535 inhibitor及NC后,miR-535的mRNA相对表达量;B.过表达miR-535后,、、和的mRNA相对表达量;C. 抑制miR-535表达后,、、和的mRNA相对表达量;D和E.过表达或抑制miR-535后,CCND2、CDK4、BCL2和BAX的蛋白表达水平和灰度值分析;F. 过表达或抑制miR-535后,EdU检测颗粒细胞增殖;G. 过表达或抑制miR-535后,CCK8检测颗粒细胞增殖;H. 过表达或抑制miR-535后,细胞凋亡检测颗粒细胞凋亡情况
A. Relative mRNA expression of miR-535 after transfection with miR-535 mimics, miR-535 inhibitor and NC;B. Relative mRNA expression levels of,,andafter miR-535 overexpression; C. Relative mRNA expression levels of,,andafter miR-535 inhibition; D and E. The protein expression levels and grayscale values of CCND2, CDK4, BCL2 and BAX after overexpression or inhibition of miR-535; F. Detection of granulosa cell proliferation by EdU after overexpression or inhibition of miR-535; G. Detection of granulosa cell proliferation by CCK8 after overexpression or inhibition of miR-535 granulosa cell proliferation; H. Apoptosis detection of granulosa cells after overexpression or inhibition of miR-535
图4 miR-535抑制山羊颗粒细胞增殖并促进其凋亡
Fig. 4 miR-535 inhibited proliferation and promoted apoptosis in goat granulosa cells
2.5 GAB2拮抗miR-535的调控作用
为了进一步探究miR-535与是否存在靶向作用调控颗粒细胞的增殖和凋亡。本研究将miR-535 inhibitor+siRNA、miR-535 inhibitor+siRNA NC和miR-535 inhibitor NC+siRNA共转染于颗粒细胞中,miR-535 inhibitor NC+siRNA NC作为对照组,来验证miR-535与基因的靶向调控关系。研究结果表明,与对照组(miR-535 inhibitor NC+siRNA NC)相比,同时抑制miR-535和不抑制GAB2的表达后,细胞周期相关基因、和细胞凋亡相关基因表达水平显著上调,的表达水平显著下调(<0.05);抑制miR-535 的同时抑制后细胞周期相关基因、和细胞凋亡相关基因表达水平显著下调(<0.05),细胞凋亡相关基因的表达水平显著上调(<0.05)(图5)。这些结果表明,山羊卵巢颗粒细胞增殖和凋亡确实受到了miR-535-通路的影响,miR-535与的表达存在拮抗作用。
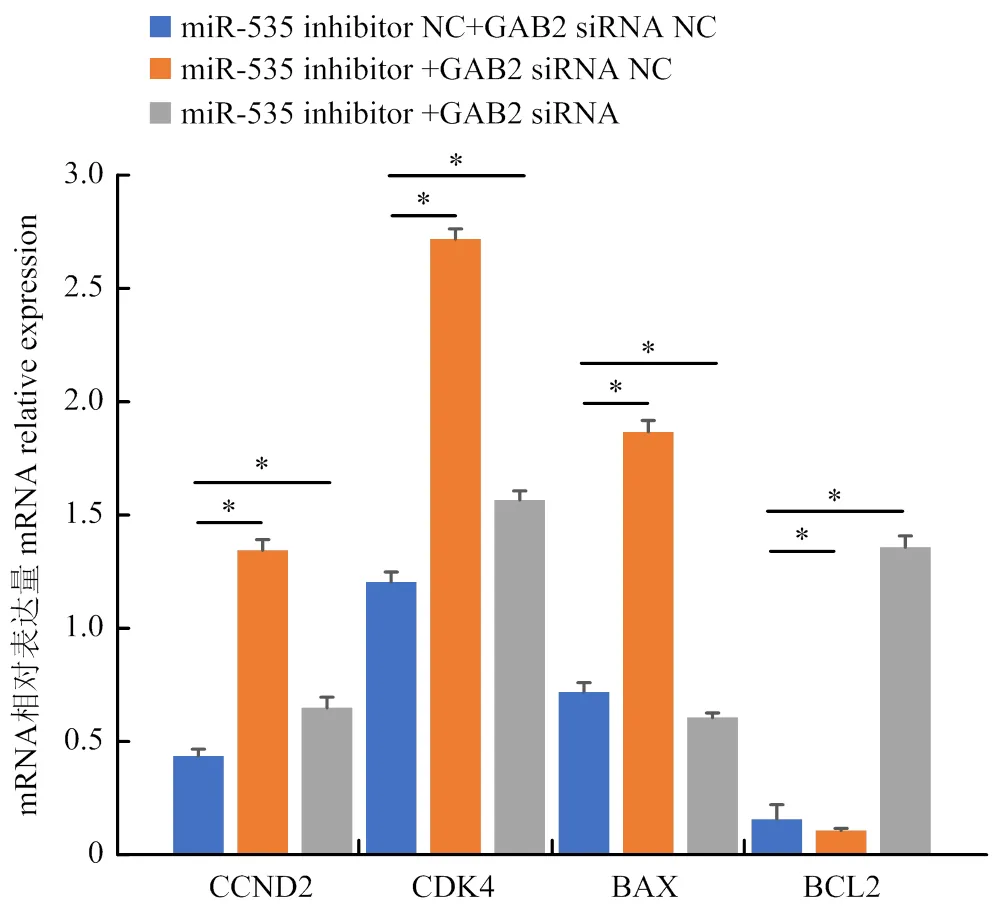
图5 GAB2拮抗miR-535的调控作用
2.6 miR-535靶向GAB2激活PI3K/AKT信号通路
根据生物信息学分析表明,作用于PI3K/ AKT信号通路。STRING分析结果表明,可与PI3K/AKT信号通路的标志因子AKT1具有蛋白互作的关系(图6-A)。因此推测,miR-535靶向调控激活PI3K/AKT信号通路影响颗粒细胞的生长。结果表明,过表达miR-535后,PI3K/AKT信号通路相关基因的表达量显著下调,而抑制miR-535后,PI3K/AKT信号通路相关基因的表达量显著上调(<0.05)(图6-B)。Western blotting结果与RT- qPCR结果一致(<0.05)(图6-C,D)。以上研究结果表明,miR-535靶向调控激活PI3K/AKT信号通路影响颗粒细胞生长。
3 讨论
3.1 山羊miR-535和GAB2在卵巢组织中的表达
卵巢是雌性动物重要的繁殖器官,卵泡是哺乳动物卵巢行使功能的基本单位。从静止卵泡被激活,到生长选择成为优势卵泡的过程中,颗粒细胞起着重要的作用[28]。目前,关于山羊卵巢颗粒细胞增殖的分子机制仍不清晰。研究发现,miR-495-3p能够促进颗粒细胞凋亡,抑制颗粒细胞增殖,刺激类固醇的分泌,从而影响山羊卵泡的发育[29]。在本课题组前期高、低产羔数云上黑山羊卵巢转录组数据中发现相关候选基因和调控元件miR-535可能存在靶向关系,然而,其分子作用机制还有待研究。在本研究中,发现miR-535在云上黑山羊高产卵巢中高表达,在云上黑山羊高产卵巢中低表达,存在负相关关系,与前期转录组数据一致。
3.2 miR-535抑制了山羊卵巢颗粒细胞增殖
在哺乳动物的卵巢中,卵泡中的体细胞(颗粒细胞和卵丘细胞)在卵母细胞成熟和雌性生殖过程中起重要作用[30-31]。在卵泡排卵的过程中,颗粒细胞的数量决定着胚胎发育速率和卵母细胞的成熟[32]。miRNA作为基因表达过程中重要的调节因子,结合互补mRNA并抑制其表达[33]。在哺乳动物的卵巢中miRNA通过结合编码基因的3’-UTR结合后,对编码基因产生沉默作用,导致mRNA的翻译停止[34],如miR-324-3p[35]、miR-101-3p[36]、miR-130a-3p[20]等,但miR-535在山羊颗粒细胞中的作用还未被报道。有研究表明,miR-535的过表达改变了、和的表达,进而影响介导的冷信号转导核心成分以及CBF信号转导通路下游的冷应激响应标记基因的表达,这说明miR-535可以调控基因功能[37]。在本研究中,miR-535抑制了卵巢颗粒细胞的增殖,并降低了EdU阳性细胞数量。这表明miR-535可能是山羊颗粒细胞中重要非编码RNA,值得深入探究其功能。

A. STRING分析与GAB2相关蛋白;B. 过表达或抑制miR-535后AKT1的mRNA相对表达量;C. 过表达或抑制miR-535后AKT1的蛋白表达水平;D. 过表达或抑制miR-535后AKT1的蛋白灰度值分析
3.3 GAB2促进了山羊卵巢颗粒细胞的增殖
作为重要的结合效应蛋白,在众多细胞因子的刺激下,磷酸化含有氨基酸残基的蛋白质,将信号传递给小GTP酶,完成细胞信号传递,在细胞的生长发育等过程中产生重要作用[38]。目前众多研究表明,miRNA可以靶向从而调控细胞的增殖、分化。miR-197通过靶向胶质母细胞瘤中的抑制细胞增殖,抑制母细胞瘤的发展[39];miR-663b通过调控对肝细胞癌起到抑制作用[40];miR-218通过靶向抑制PI3K/AKT/mTOR/VEGFA通路,从而抑制肾细胞癌和血管内皮因子[41];但miR-535对的调控作用还未见报道。本课题组转录组数据库中存在可能作为miR-535的靶向mRNA对颗粒细胞起调控作用。使用双荧光素酶活性报告验证miR-535能够与的3’UTR结合,证实miR-535与存在直接的靶向关系。显著促进了细胞增殖因子和的表达,显著抑制了凋亡因子且促进了的表达。并且促进了卵巢颗粒细胞的增殖,并提高了EdU阳性细胞数量。本研究发现,能够促进颗粒细胞增殖,进一步研究发现miR-535与之间的调控关系,且miR-535能够抑制在颗粒细胞的表达。
3.4 miR-535对其他功能基因的影响
PI3K/AKT信号通路能够参与细胞增殖、分化、自噬和凋亡等生理过程,在细胞稳态和调节过程中起重要作用[42]。作为PI3K/AKT信号通路中重要的标志基因,在PI3K/AKT信号通路调控作用中发挥重要作用。PI3K/AKT信号通路与颗粒细胞增殖或凋亡密切相关,在卵巢发育过程中,FSH与卵泡膜上的受体结合,激活上游蛋白激酶与,从而使下游靶基因和PI3K/AKT信号通路被激活[43]。这表明,可以通过PI3K/AKT途径调控细胞的生长过程。虽然未在山羊中发现miR-535通过PI3K/AKT途径调控颗粒细胞增殖。但是在多个物种中发现miRNA可通过PI3K/AKT途径调控颗粒细胞的增殖、自噬、凋亡和分化[44-47]。本研究发现可与PI3K/AKT信号通路关键基因产生互作关系,并且过表达miR-535可显著抑制的表达。因此推测miR-535-可能通过PI3K/AKT信号通路调控山羊颗粒细胞生长发育,但还需要进一步研究确认其调控机制。
4 结论
本研究验证了miR-535通过靶向调控的表达调控颗粒细胞,可能通过PI3K/AKT途径促进颗粒细胞增殖。这些研究结果为解析山羊多羔性状形成的分子机制及分子育种提供了新的见解。
[1] AERTS J M J, BOLS P E J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and pre-antral follicle development. Reproduction in Domestic Animals = Zuchthygiene, 2010, 45(1): 171-179.
[2] ZHANG H, LIU K. Cellular and molecular regulation of the activation of mammalian primordial follicles: Somatic cells initiate follicle activation in adulthood. Human Reproduction Update, 2015, 21(6): 779-786.
[3] NISSAN T, PARKER R. Computational analysis of miRNA-mediated repression of translation: Implications for models of translation initiation inhibition. RNA, 2008, 14(8): 1480-1491.
[4] TU F, PAN Z X, YAO Y, LIU H L, LIU S R, XIE Z, LI Q F. miR-34a targets the inhibin beta B gene, promoting granulosa cell apoptosis in the porcine ovary. Genetics and Molecular Research, 2014, 13(2): 2504-2512.
[5] LUNDBERG A L, JASKIEWICZ N M, MAUCIERI A M, TOWNSON D H. Stimulatory effects of TGFα in granulosa cells of bovine small antral follicles. Journal of Animal Science, 2022, 100(7): skac105.
[6] LIU Y F, ZHOU Z Y, HE X Y, TAO L, JIANG Y T, LAN R, HONG Q H, CHU M X. Integrated analyses of miRNA-mRNA expression profiles of ovaries reveal the crucial interaction networks that regulate the prolificacy of goats in the follicular phase. BMC Genomics, 2021, 22(1): 812.
[7] TU J J, CHEN Y, LI Z, YANG H, CHEN H, YU Z Y. Long non-coding RNAs in ovarian granulosa cells. Journal of Ovarian Research, 2020, 13(1): 63.
[8] DING C B, YU W N, FENG J H, LUO J M. Structure and function of Gab2 and its role in cancer (Review). Molecular Medicine Reports, 2015, 12(3): 4007-4014.
[9] WÖHRLE F U, DALY R J, BRUMMER T. Function, regulation and pathological roles of the Gab/DOS docking proteins. Cell Communication and Signaling, 2009, 7: 22.
[10] GU H H, NEEL B G. The ‘gab’ in signal transduction. Trends in Cell Biology, 2003, 13(3): 122-130.
[11] LOCK L S, ROYAL I, NAUJOKAS M A, PARK M. Identification of an atypical Grb2 carboxyl-terminal SH3 domain binding site in Gab docking proteins reveals Grb2-dependent and-independent recruitment of Gab1 to receptor tyrosine kinases. The Journal of Biological Chemistry, 2000, 275(40): 31536-31545.
[12] ADAMS S J, AYDIN I T, CELEBI J T. GAB2: a scaffolding protein in cancer. Molecular Cancer Research, 2012, 10(10): 1265-1270.
[13] YANG Y, WU J, DEMIR A, CASTILLO-MARTIN M, MELAMED R D, ZHANG G, FUKUNAGA-KANABIS M, PEREZ-LORENZO R, ZHENG B, SILVERS D N, BRUNNER G, WANG S, RABADAN R, CORDON-CARDO C, CELEBI J T. GAB2 induces tumor angiogenesis in NRAS-driven melanoma. Oncogene, 2013, 32(31): 3627-3637.
[14] DUCKWORTH C, ZHANG L, CARROLL S L, ETHIER S P, CHEUNG H W. Overexpression of GAB2 in ovarian cancer cells promotes tumor growth and angiogenesis by upregulating chemokine expression. Oncogene, 2016, 35(31): 4036-4047.
[15] JAKWERTH C A, KITZBERGER H, POGORELOV D, MÜLLER A, BLANK S, SCHMIDT-WEBER C B, ZISSLER U M. Role of microRNAs in type 2 diseases and allergen-specific immunotherapy. Frontiers in Allergy, 2022, 3: 993937.
[16] JAFARZADEH A, NASERI A, SHOJAIE L, NEMATI M, JAFARZADEH S, BANNAZADEH BAGHI H, HAMBLIN M R, AKHLAGH S A, MIRZAEI H. microRNA-155 and antiviral immune responses. International Immunopharmacology, 2021, 101(Pt A): 108188.
[17] AHERNE S T, LAO N T. Manipulating MiRNA expression to uncover hidden functions. Methods in Molecular Biology, 2017, 1509: 151-160.
[18] SIROTKIN A V, LAUKOVÁ M, OVCHARENKO D, BRENAUT P, MLYNCEK M. Identification of microRNAs controlling human ovarian cell proliferation and apoptosis. Journal of Cellular Physiology, 2010, 223(1): 49-56.
[19] DAI T S, KANG X L, YANG C Y, MEI S, WEI S H, GUO X R, MA Z M, SHI Y G, CHU Y K, DAN X G. Integrative analysis of miRNA-mRNA in ovarian granulosa cells treated with kisspeptin in Tan sheep. Animals, 2022, 12(21): 2989.
[20] ZHU L, JING J, QIN S Q, ZHENG Q, LU J N, ZHU C Y, LIU Y, FANG F G, LI Y S, LING Y H. miR-130a-3p regulates steroid hormone synthesis in goat ovarian granulosa cells by targeting thegene. Theriogenology, 2021, 165: 92-98.
[21] ZHANG T J, HUO S D, WEI S C, CUI S. miR-21, miR-125b, and let-7b contribute to the involution of atretic follicles and corpus lutea in Tibetan sheep ovaries. Animal Science Journal, 2022, 93(1): e13756.
[22] ABDURAHMAN A, AIERKEN W, ZHANG F, OBULKASIM R, ANIWASHI J, SULAYMAN A. miR-1306 induces cell apoptosis by targetinggene in the ovine granulosa cells. Frontiers in Genetics, 2022, 13: 989912.
[23] MA L Z, TANG X R, GUO S, LIANG M Y, ZHANG B, JIANG Z L. miRNA-21-3p targeting of FGF2suppresses autophagy of bovine ovarian granulosa cells through AKT/mTOR pathway. Theriogenology, 2020, 157: 226-237.
[24] GEBREMEDHN S, SALILEW-WONDIM D, HOELKER M, RINGS F, NEUHOFF C, THOLEN E, SCHELLANDER K, TESFAYE D. microRNA-183-96-182 cluster regulates bovine granulosa cell proliferation and cell cycle transition by coordinately targeting FOXO1. Biology of Reproduction, 2016, 94(6): 127, 1-11.
[25] ANDREAS E, HOELKER M, NEUHOFF C, THOLEN E, SCHELLANDER K, TESFAYE D, SALILEW-WONDIM D. microRNA 17-92 cluster regulates proliferation and differentiation of bovine granulosa cells by targeting PTEN andgenes. Cell and Tissue Research, 2016, 366(1): 219-230.
[26] MA L Z, ZHENG Y X, TANG X R, GAO H M, LIU N, GAO Y, HAO L Z, LIU S J, JIANG Z L. miR-21-3p inhibits autophagy of bovine granulosa cells by targeting VEGFA via PI3K/AKT signaling. Reproduction, 2019, 158(5): 441-452.
[27] 王鹏, 韩海银, 李文韬, 刘子嶷, 储明星, 刘玉芳. 可变剪接体WNT4-β对山羊卵泡颗粒细胞增殖和激素分泌的影响. 畜牧兽医学报, 2022, 53(10): 3480-3489.
WANG P, HAN H Y, LI W T, LIU Z Y, CHU M X, LIU Y F. Effect of alternative splicing WNT4-β on follicular granulosa cell proliferation and hormone secretion in goats. Acta Veterinaria et Zootechnica Sinica, 2022, 53(10): 3480-3489. (in Chinese)
[28] JIN Y F, DONG H Y, SHI Y, BIAN L N. Mutually exclusive alternative splicing of pre-mRNAs. Wiley Interdisciplinary Reviews RNA, 2018, 9(3): e1468.
[29] 王磊, 何莉娜, 唐雪, 李碧筠, 黄思艺, 王钰锟, 徐德军, 赵中权. miR-495-3p对山羊卵巢颗粒细胞功能的影响. 畜牧兽医学报, 2022, 53(2): 436-446.
WANG L, HE L N, TANG X, LI B J, HUANG S Y, WANG Y K, XU D J, ZHAO Z Q. Effects of miR-495-3p on ovarian granulosa cell functions in goat. Acta Veterinaria et Zootechnica Sinica, 2022, 53(2): 436-446. (in Chinese)
[30] VELILLA E, IZQUIERDO D, RODRÍGUEZ-GONZÁLEZ E, LÓPEZ-BÉJAR M, VIDAL F, PARAMIO M T. Distribution of prepubertal and adult goat oocyte cortical granules during meiotic maturation and fertilisation: Ultrastructural and cytochemical study. Molecular Reproduction and Development, 2004, 68(4): 507-514.
[31] DADASHPOUR DAVACHI N, KOHRAM H, ZARE SHAHNEH A, ZHANDI M, GOUDARZI A, FALLAHI R, MASOUDI R, YOUSEFI A R, BARTLEWSKI P M. The effect of conspecific ampulla oviductal epithelial cells duringmaturation on oocyte developmental competence and maturation-promoting factor (MPF) activity in sheep. Theriogenology, 2017, 88: 207-214.
[32] TIAN C L, LIU L L, YE X Y, FU H F, SHENG X Y, WANG L L, WANG H S, HENG D, LIU L. Functional oocytes derived from granulosa cells. Cell Reports, 2019, 29(13): 4256-4267.e9.
[33] MICHLEWSKI G, CÁCERES J F. Post-transcriptional control of miRNA biogenesis. RNA, 2019, 25(1): 1-16.
[34] WANG L L, LI C, LI R, DENG Y L, TAN Y X, TONG C, QI H B. microRNA-764-3p regulates 17β-estradiol synthesis of mouse ovarian granulosa cells by targeting steroidogenic factor-1. In Vitro Cellular & Developmental Biology Animal, 2016, 52(3): 365-373.
[35] LIU Y F, CHEN Y L, ZHOU Z Y, HE X Y, TAO L, JIANG Y T, LAN R, HONG Q H, CHU M X. Chi-miR-324-3p regulates goat granulosa cell proliferation by targeting DENND1A. Frontiers in Veterinary Science, 2021, 8: 732440.
[36] AN X P, MA H D, LIU Y H, LI F, SONG Y X, LI G, BAI Y Y, CAO B Y. Effects of miR-101-3p on goat granulosa cellsand ovarian developmentvia STC1. Journal of Animal Science and Biotechnology, 2020, 11: 102.
[37] YUE E K, CAO H, LIU B H. OsmiR535, a potential genetic editing target for drought and salinity stress tolerance in. Plants, 2020, 9(10): 1337.
[38] YIN Y, ZHANG L, LI Y, ZHANG C, HE A Q. Gab2 plays a carcinogenic role in ovarian cancer by regulating CrkII. Journal of Ovarian Research, 2023, 16(1): 79.
[39] TIAN L Q, LIU E Q, ZHU X D, WANG X G, LI J, XU G M. microRNA-197 inhibits cell proliferation by targeting GAB2 in glioblastoma. Molecular Medicine Reports, 2016, 13(5): 4279-4288.
[40] GUO L P, LI B L, MIAO M J, YANG J J, JI J S. microRNA-663b targets GAB2 to restrict cell proliferation and invasion in hepatocellular carcinoma. Molecular Medicine Reports, 2019, 19(4): 2913-2920.
[41] MU L J, GUAN B, TIAN J H, LI X, LONG Q Z, WANG M Y, WANG W, SHE J J, LI X D, WU D P, DU Y F. microRNA-218 inhibits tumor angiogenesis of human renal cell carcinoma by targeting GAB2. Oncology Reports, 2020, 44(5): 1961-1970.
[42] KNIGHT Z A, GONZALEZ B, FELDMAN M E, ZUNDER E R, GOLDENBERG D D, WILLIAMS O, LOEWITH R, STOKOE D, BALLA A, TOTH B, BALLA T, WEISS W A, WILLIAMS R L, SHOKAT K M. A pharmacological map of the PI3-K family defines a role for p110alpha in insulin signaling. Cell, 2006, 125(4): 733-747.
[43] HUNZICKER-DUNN M E, LOPEZ-BILADEAU B, LAW N C, FIEDLER S E, CARR D W, MAIZELS E T. PKA and GAB2 play central roles in the FSH signaling pathway to PI3K and AKT in ovarian granulosa cells. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(44): E2979-E2988.
[44] WEI Q Y, XUE H Q, SUN C J, LI J, HE H R, AMEVOR F K, TAN B, MA M G, TIAN K, ZHANG Z C, ZHANG Y, HE H, XIA L, ZHU Q, YIN H D, CUI C. Gga-miR-146b-3p promotes apoptosis and attenuate autophagy by targeting AKT1 in chicken granulosa cells. Theriogenology, 2022, 190: 52-64.
[45] LI Y Y, WU X H, MIAO S B, CAO Q Y. miR-383-5p promotes apoptosis of ovarian granulosa cells by targeting CIRP through the PI3K/AKT signaling pathway. Archives of Gynecology and Obstetrics, 2022, 306(2): 501-512.
[46] YUAN J S, DENG Y, ZHANG Y Y, GAN X, GAO S Y, HU H, HU S Q, HU J W, LIU H H, LI L, WANG J W.inhibits goose granulosa cell apoptosisPI3K/AKT/Caspase-9 signaling pathway. Animal Reproduction Science, 2019, 200: 86-95.
[47] LI X Y, CHEN H L, ZHANG Z L, XU D J, DUAN J X, LI X D, YANG L, HUA R M, CHENG J Y, LI Q W. Isorhamnetin promotes estrogen biosynthesis and proliferation in porcine granulosa cells via the PI3K/akt signaling pathway. Journal of Agricultural and Food Chemistry, 2021, 69(23): 6535-6542.
miR-535 Targets the GAB2 Gene to Promote Goat Granulosa Cell Proliferation Through Activation of the PI3K/AKT Signaling Pathway
WANG Peng, LIU ZiYi, LIU YuFang, CHU MingXing
Institute of Animal Science, Chinese Academy of Agricultural Sciences/State Key Laboratory of Animal Biotech Breeding, Beijing 100193
【Background】MicroRNAs (miRNAs) are short RNA molecules of 18-25 nt in length that play an important role in the regulation of follicle development in mammalian ovary granulosa cells (GCs). The previous sequencing of the transcriptome of the ovaries of high and low kidding individuals in Yunshang black goats showed that miR-535 was able to influence the kidding number of goats, but the specific regulatory mechanism was not yet clear. 【Objective】The aim of this study was to investigate the molecular mechanisms of miR-535 targeting the GRB2 associated binding protein 2 () and its associated signaling pathway PI3K/AKT affected the proliferation of goat GCs, so as to further investigate the molecular biological regulation mechanism. 【Method】In this study, three high- and low-fertility Yunshang black goats with the kidding number record of more than two litters were selected, and their follicular ovarian tissues were collected after synchronous estrus treatment for collecting primary GCs. The expression of miR-535 andvector was constructed and the effect of candidateon the proliferation of goat GCs was detected using RT-qPCR, Western blot, immunofluorescence, CCK8, EdU and Apoptosis, respectively. The prediction of the targeted relationship between miR-535 andwas performed with miRDB and miRanda software. The Wild-type and Mutant vectors ofwere constructed and the targeting relationship between miR-535 andwas detected by the dual luciferase activity assay. The overexpression/inhibitor miR-535 vector was constructed to explore the effect of its GCs proliferation and downstream gene function. 【Result】The RT-qPCR results showed that the expression ofwas significantly lower in ovarian tissues of Yunshang black goats with high-fertility than that in low-fertility groups, and the expression of miR-535 was the opposite (<0.05). The results of RT-qPCR and Western blot showed that the expression of CCND2, CDK4 and BCL2 was significantly increased (<0.05), while the expression of BAX was significantly decreased (<0.05) after overexpression of<0.05). Dual luciferase reporter assays showed that miR-535 inhibited dual luciferase activity in the 3'UTR region of the GAB2 gene. The results of RT-qPCR and Western blot showed that the expression of GAB2, CCND2, CDK4 and BCL2 in goat GCs was significantly decreased and the expression of BAX was significantly increased after miR-535 overexpression, while the opposite was true after miR-535 inhibition (<0.05). Both EdU and CCK8 assays showed that miR-535 overexpression significantly inhibited the proliferation of GCs, while the opposite was true after miR-535 inhibition (<0.05). Apoptosis assays showed that miR-535 overexpression promoted GCs proliferation and the opposite was true after inhibition of its expression. The expression levels of the PI3K/AKT signaling pathway marker AKT in goat GCs were significantly increased after inhibition of miR-535, respectively (<0.05). 【Conclusion】In conclusion, the results of this study suggested that miR-535 inhibited the proliferation of goat granulosa cells by suppressing the expression of. These results provided a theoretical basis for further investigation of the biological functions of miR-535 regulating goat GCs.
goat kidding number; ovarian granulosa cell proliferation; GAB2gene; miR-535; P13K/AKT signaling pathway

10.3864/j.issn.0578-1752.2023.23.016
2023-03-24;
2023-08-31
国家自然科学基金(32102509)、财政部和农业农村部国家现代农业产业技术体系(CARS-38)、中国农业科学院科技创新工程(CAAS- ZDRW202106和ASTIP-IAS13)
王鹏,E-mail:wp05223414@163.com。通信作者刘玉芳,E-mail:aigaiy@126.com。通信作者储明星,E-mail:mxchu@263.net
(责任编辑 林鉴非)

