种鸽饲粮磷水平对乳鸽血清生化指标、非靶向代谢物及组织中磷转运载体基因表达的影响
安勇,秦士贞,史兆国,龚莉媛,,张帅,计峰
种鸽饲粮磷水平对乳鸽血清生化指标、非靶向代谢物及组织中磷转运载体基因表达的影响

1北京市农林科学院畜牧兽医研究所,北京 100097;2河北工程大学生命科学与食品工程学院,河北邯郸 056009;3甘肃农业大学动物科学技术学院,兰州 730070
【目的】通过探讨亲鸽饲粮中添加不同水平无机磷对乳鸽血清生化指标、非靶向代谢物和小肠及肾脏中磷转运载体基因表达量的影响,为快速生长期乳鸽的磷营养调控提供理论依据。【方法】选取192对健康成年银王鸽(40周龄),随机分为4组,每个处理组8个重复,每个重复6对种鸽,产蛋后由亲鸽自然孵化和哺育乳鸽。试验期包括孵化期和哺育期,共46d。对照组饲喂基础日粮(总磷含量0.3%),其余3个试验组分别在基础日粮中添加0.2%、0.4%和0.8%无机磷,各组饲粮中Ca含量均为1.40%。分别收集7、14和21日龄乳鸽血清分析Ca、P含量,碱性磷酸酶(ALP)活性和甲状旁腺素(PTH)水平;检测鸽乳中Ca和P含量;测定肠道(十二指肠和空肠)磷转运载体(NaPi-Ⅱb、PiT-1、PiT-2)及肾脏磷转运载体(NaPi-Ⅱa、PiT-1、PiT-2)的基因表达水平;检测14和21日龄对照组和磷添加(0.4%和0.8%)组乳鸽血清中的非靶向代谢物。【结果】(1)随着亲鸽日粮中磷添加水平的增加,鸽乳中磷含量极显著上升(<0.01)。(2)饲粮添加磷对乳鸽血清磷、ALP活性和PTH水平均未产生影响,而0.8%磷添加组血清钙含量极显著下降(<0.01)。随着日龄增长,乳鸽血清ALP和PTH水平均显著降低(<0.05)。(3)各日龄乳鸽小肠NaPi-IIb表达水平随亲鸽饲粮磷含量增加均有上升趋势,但差异不显著(>0.05)。7和14日龄乳鸽PiT-1和PiT-2 mRNA在肾脏的表达量均极显著高于肠道(<0.01),但21日龄时肾脏和肠道的表达量相近,甚至PiT-1在肾脏的表达量低于空肠。7和14日龄乳鸽PiT-1 mRNA表达随饲粮磷水平增加而增加,7和21日龄时,0.4%加磷组PiT-2 mRNA表达水平高于0.8%组(<0.05),采样部位和饲粮磷水平对7和14日龄PiT-1基因表达以及21日龄PiT-2基因表达有互作影响(<0.05)。14日龄时,0.8%加磷组肾脏NaPi-Ⅱa mRNA表达水平低于对照组和0.4%处理组。(4)14和21日龄时,对照组和加磷组乳鸽之间的显著差异代谢物中约50%为脂质和类脂质分子,其次是有机酸及其衍生物,再次是苯系物等某些有机物,且差异代谢物涉及到的主要代谢途径包括碳水化合物代谢、蛋白质和氨基酸代谢、遗传物质合成及脂肪代谢等。【结论】(1)亲鸽饲粮中的磷水平显著影响其分泌的鸽乳含磷量,而乳鸽血磷含量较稳定,但是高磷组血钙含量下降,这有可能表明鸽对高磷耐受性较差。(2)乳鸽肾脏中PiT-1和PiT-2 mRNA表达大多随饲粮磷含量增加而增加,具体调控机制有待研究。(3)血液代谢组数据表明磷参与乳鸽体内多种重要的代谢过程,如脂肪代谢和骨骼矿化等。
磷;鸽;生化指标;代谢组;转运载体
0 引言
【研究意义】为了满足动物磷需要,饲粮中需额外添加无机矿物质磷,加强饲粮磷在家禽肠道的吸收规律研究,对生产中磷的高效利用以及减少磷排放对环境的污染都具有重要的理论和现实指导意义[1]。然而,迄今对鸽饲粮中磷的吸收利用规律尚无研究。鸽已发展为我国第四大家禽,鸽肉不仅营养丰富,而且具有较高的药用价值。鸽是晚成鸟,出壳后需要亲鸽哺喂,雌雄亲鸽嗉囊均会分泌鸽乳,随着乳鸽日龄的增加,鸽乳分泌量逐渐减少,哺喂饲料含量增加,约1个月后乳鸽才能独立采食,故本文研究了种鸽饲粮磷水平对鸽乳中磷含量以及乳鸽磷吸收代谢的影响,以期探讨快速生长期乳鸽的磷营养调控。【前人研究进展】磷是家禽必需的矿物元素之一,具有重要的生物学功能,对于核酸代谢、能量代谢、脂质代谢、酶的激活、维持细胞膜完整性和骨骼矿化等都具有重要作用[2]。非靶向代谢组能够提供生物样品中存在的所有代谢物的复合谱,全面挖掘小分子代谢物,从整体反映代谢物的变化[3]。目前代谢组学已应用于了解生物体的营养状况、生理状态或者外界环境之间相互作用的分析研究[4]。众所周知动物血清含有大量磷代谢中间产物和终产物,体内磷稳态维持主要是通过调控肠道磷吸收、骨骼磷的沉积和释放以及肾脏对磷的重吸收过程[5]。鸡小肠磷吸收和肾脏重吸收均受钠依赖性磷酸盐转运蛋白(NaPi-)调控[6],其中肠道参与磷主动吸收的转运载体主要有NaPi-IIb(type IIb Na-dependent Pi cotransporter)、无机磷转运载体1(inorganic Pi transporter 1,PiT-1)和无机磷转运载体2(inorganic Pi transporter 2,PiT-2)三种[7-9]。NaPi-IIb主要在鸡的十二指肠中表达,是小肠中最主要的转运载体[10-13]。而NaPi-IIa主要调控肾脏对磷的重吸收[14-16]。已有研究表明饲粮磷水平是影响肉鸡体内磷转运体表达量的主要因素[5, 13, 17],鸽上尚未见相关研究报道。【本研究切入点】因为磷稳态失衡会导致动物发生严重疾病,故有必要研究鸽体内磷吸收的分子调控机制,探讨磷营养对快速生长期乳鸽的生理作用。【拟解决的关键问题】研究亲鸽饲粮中添加不同水平无机磷对乳鸽血清生化指标(Ca、P、ALP活性和PTH水平)、非靶向代谢物和小肠及肾脏中磷转运载体基因表达量的影响,为快速生长期乳鸽的磷稳态及其营养调控研究提供理论依据。
1 材料与方法
1.1 试验时间和地点
试验于2020年10—12月在北京密云霍书林养殖场进行。
1.2 动物、饲粮和试验设计
本试验共选取192对健康成年银王鸽(40周龄),试验鸽采用笼养,每笼一对亲鸽,内有栖架和蛋窝。试验鸽随机分为4组,每个处理组8个重复,每个重复6对鸽子。受精蛋由种鸽自然孵化,孵化出的乳鸽由亲鸽哺喂,每对亲鸽哺喂2只乳鸽(2+2模式),共384只乳鸽(公母混合)。试验期包括孵化期和哺育期,持续46d,预试期10 d,饲喂对照组低磷饲粮(总磷0.3%),以尽量耗竭亲鸽体内可以动用的磷储存。亲鸽自由采食和饮水,饲粮为玉米-大豆全价颗粒料,鸽舍每天光照16 h,舍内温度控制在(15±5)℃。其余饲养管理按常规操作。
亲鸽日粮的组成和营养水平见表1。对照组饲喂基础日粮,其余3个试验组分别在基础日粮中添加0.2%、0.4%和0.8%无机磷(饲料级CaHPO4·2H2O,纯度≥98.0%,北京康普汇维科技有限公司)。用洗净的建筑砂(不含磷)调整各处理组日粮中的磷酸氢钙用量[12]。各组饲粮中Ca含量均为1.40%。饲料及其他样品中的Ca和P含量分别按照乙二胺四乙酸二钠络合滴定法(GB/T 6437-2018)和钼黄分光光度法(GB/T 6436-2018)进行测定,并用标准物质大豆粉(GBW 10013 (GSB-4),地球物理地球化学勘查研究所)对矿物元素检测质量进行验证。
1.3 样品采集和处理
分别于乳鸽7、14和21日龄时,从每个处理组各重复中随机选取1只健康乳鸽翅静脉采血,2 000×离心15 min后收集血清-20℃保存备测Ca、P、ALP活性和PTH水平,另取部分血清-80℃保存用于非靶向代谢组学分析。血清Ca、P和ALP活性采用全自动生化分析仪(Hitachi 7600,日本)测定,血清PTH水平采用ELISA试剂盒(南京建成生物工程研究所)检测。
采用断颈法致死采样乳鸽,从其嗉囊中收集鸽乳-20℃保存,以备测Ca和P含量。随着乳鸽日龄的增长,鸽乳分泌量逐渐减少,谷物饲料含量增加[18],所以需仔细弃去嗉囊内容物样品中的谷粒饲料,由于部分乳鸽嗉囊内容物量少,故每2份鸽乳样品等量混合为一个待测样[19]。鸽乳样品室温下解冻后,于65℃干燥24 h,然后粉碎过筛。鸽乳中Ca和P含量的测定方法同饲料样品。
小心打开宰后乳鸽的腹腔,取出小肠段,将肠道内容物轻轻挤出。立即剪下十二指肠U型弯曲处(约5 cm)、空肠后段(Meckel’s憩室前约5 cm)和左侧肾脏(左下部位),在生理盐水中漂洗干净后,迅速置于液氮中速冻,后转移至-80℃冰箱中保存待测mRNA表达量。
采用Trizol方法(北京金普来生物科技有限公司)提取样品总RNA,使用琼脂糖凝胶电泳鉴定提取的RNA质量。使用反转录试剂盒(M5 Super QPCR RT kit,北京聚合美生物科技有限公司)将提取的RNA反转录成cDNA,置于-20 ℃保存。采用SYBR Green 实时荧光定量 PCR法(2X Realtime PCR Super mix kit, 北京聚合美生物科技有限公司)测定小肠(十二指肠和空肠段)中NaPi-IIb、PiT-1和PiT-2的mRNA表达水平,以及肾脏中的NaPi-IIa、PiT-1和PiT-2的mRNA表达水平,扩增仪器为CFX Connect PCR instrument(Bio-Rad)。用β-肌动蛋白(β-actin)作为内参基因,上述目的基因和β-actin引物序列见表2。引物均由生工生物工程(上海)股份有限公司合成。反应体系共20 μL:1 μL cDNA,10 μL 2× Realtime PCR Super mix,上游引物和下游引物各0.5 μL,dd H2O补足至20 μL。反应条件如下:95 ℃预变性2 m,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸20 s,循环40次。每个样品测定3个重复,采用2-△△CT法计算目的基因的相对表达量[19-20]。

表1 种鸽试验日粮配方和营养水平(饲喂基础)
1)维生素为每千克日粮提供:维生素A. 9000 IU;维生素D3.2400 IU;维生素E. 24 IU;维生素K3. 3 mg;维生素B1. 2.4 mg;维生素B2. 7.5 mg;维生素B6. 4 mg;维生素B12. 0.026 mg;烟酰胺. 26 mg;D-泛酸. 11 mg;叶酸,1.4 mg;生物素,0.16 mg。2)复合微量元素为每千克日粮提供:铜. 15 mg;铁. 99 mg;锌. 95 mg;锰. 97 mg;碘. 1.35 mg;硒. 0.45 mg。3)为洗净的建筑砂,用于调整各处理组日粮中的磷酸氢钙用量,实测无磷含量。4)粗蛋白、钙和磷为实测值,其余营养指标为计算值
1)Vitamins provided the following per kilogram: Vitamin A. 9000 IU (retinyl acetate); Vitamin D3. 2400 IU; Vitamin E. 24 IU (dl-α-tocopheryl acetate); Vitamin K3. 3 mg; Vitamin B1. 2.4 mg; Vitamin B2. 7.5 mg; Vitamin B6. 4 mg; Vitamin B12. 0.026 mg; Nicotinamide. 26 mg; D-pantothenic acid, 11 mg; Folic acid. 1.4 mg; Biotin. 0.16 mg.2)Minerals provided the following per kilogram: Cu. 15 mg; Fe. 99 mg; Zn. 95 mg; Mn. 97 mg; I. 1.35 mg; Se. 0.45 mg.3)Washed building sand with no detectable P and Ca, was used to adjust the amounts of calcium hydrophosphate in each group diet.4)CP, Ca and total P were analyzed, while all others were calculated data
1.4 代谢组分析血清样本制备
从对照组、0.4%和0.8%无机磷添加组中随机选取14和21日龄的乳鸽血清样品各18份(相同日龄下每组6个样品),室温溶化后,取100 μL血清样本于2 mL离心管中,加入400 μL提取液(乙腈﹕甲醇=1﹕1),涡旋混匀30 s后,低温超声提取30 min(5 ℃,40 KHz),将样品于-20 ℃静置30 min,再离心15 min(4 ℃,13 000×),最后移取上清液上机分析。同时,取等体积的所有样本混合制备成质控样本(QC),在仪器分析过程中,每6个样本中插入一个QC样本,以考察整个分析过程的重复性。
1.5 血清样品的代谢组分析
分析平台为超高效液相色谱串联飞行时间质谱(UPLC-TripleTOF,AB SCIEX)系统。色谱条件:10 μL样本经BEH C18色谱柱(100 mm×2.1 mm i.d.,1.7 µm,Waters)分离后进入质谱检测,流动相A:水(含0.1%甲酸),流动相B:乙腈/异丙醇(1/1)(含0.1%甲酸)。分离梯度:0—0.1 min,流动相B 0%—5%;0.1—2 min,流动相B 5%—25%;2—9 min,流动相B 25%—100%;9—13 min,流动相B维持100%;13.0—13.1 min,流动相B 100%—0%;13.1—16 min,流动相B维持0%。流速为0.40 mL·min-1,柱温为40 ℃。

表2 引物序列表
质谱条件:信号采集采用正负离子扫描模式,质量扫描范围(m/z):50—1 000。离子喷雾电压:正离子电压5 000 V,负离子电压4 000 V,去簇电压80 V,喷雾气50 psi,辅助加热气50 psi,气帘气30 psi,离子源加热温度550 ℃,20—60 V循环碰撞能。
1.6 数据预处理和统计分析
LC-MS原始数据导入代谢组学处理软件Progenesis QI(Waters公司,美国)进行基线过滤、峰识别、积分、保留时间校正、峰对齐,最终得到一个保留时间、质荷比和峰强度的数据矩阵,数据矩阵用80%规则去除缺失值,再进行空缺值填补(原始矩阵中最小值填补)。为减小样品制备及仪器不稳定带来的误差,用总和归一化法对样本质谱峰的响应强度进行归一化,得到归一化后的数据矩阵。同时删除QC样本相对标准偏差(RSD)>30%的变量,并进行log10对数化处理,得到最终用于后续分析的数据矩阵。同时将质谱信息与代谢公共数据库HMDB(http://www.hmdb.ca/)和Metlin(https://metlin.scripps.edu/)数据库进行匹配,得到代谢物信息。
预处理后的数据上传美吉生物云平台(https:// cloud.majorbio.com)进行数据分析。利用R软件包ropls(Version1.6.2)进行主成分分析(PCA)和偏最小二乘法判别分析(PLS-DA,partial least squares discriminant analysis),并使用7次循环交互验证来评估模型的稳定性。此外,进行方差检验和差异倍数分析。显著差异代谢物的选择基于PLS-DA模型得到的变量权重值(VIP)和方差显著性检验值来确定,VIP>1,<0.05的代谢物为显著差异代谢物,并通过KEGG(Kyoto Encyclopedia of Gene Genotype)数据库进行代谢通路注释,获得差异代谢物参与的通路。利用Python软件包scipy(Version1.0.0)进行通路富集分析,并通过Fisher精确检验获得与试验处理最相关的生物学途径。
采用SPSS(version 20.0)软件中的一般线性模型(GLM)程序对血清理化指标和鸽乳钙磷含量进行双因素方差分析,试验因子包括饲粮添加磷水平、乳鸽日龄及二者交互作用;对组织(小肠和肾脏)中磷转运载体基因(NaPi-Ⅱb、PiT-1、PiT-2)表达量进行双因素方差分析,试验因子包括饲粮添加磷水平、采样部位及二者交互作用;对肾脏中NaPi-IIa基因表达量进行单因素(饲粮磷水平)方差分析。差异显著者均用LSD法进行均值比较,以<0.05作为差异显著性检验水平,<0.01为差异极显著。
2 结果
种鸽饲粮添加磷对7、14和21日龄乳鸽体重无任何影响(>0.05),数据已发表[21]。
2.1 鸽乳钙、磷含量
各组种鸽日粮中的总磷含量(测定值)分别为0.30%、0.54%、0.77%和1.28%。乳鸽嗉囊内容物(鸽乳)中的钙和磷含量见表3,随着亲鸽日粮中无机磷添加水平的增加,鸽乳磷含量极显著上升(<0.01)。而0.8%无机磷添加组的鸽乳钙含量极显著低于其他各组(<0.01)。此外,随着乳鸽日龄的增长,鸽乳中钙含量明显上升(<0.01),而磷含量明显下降,其中前期(7—14 d)变化较大(<0.01),后期(14—21 d)变化减缓(0.047)。日龄和磷添加水平对鸽乳磷含量有极显著的交互作用(<0.01)。
2.2 血清钙、磷含量、ALP活性和PTH水平
试验期乳鸽血清中钙、磷、ALP活性和PTH水平见表4。饲粮加磷水平对乳鸽血清磷含量、ALP活性和PTH水平均未产生影响(>0.05),但对血清钙含量有显著影响(<0.01),0.8%无机磷组乳鸽血清钙极显著低于0.2%和0.4%组,且和对照组相比也有下降趋势,但差异不显著(>0.05)。此外,日龄极显著影响乳鸽血清钙含量、ALP活性和PTH水平,与7日龄相比,14日龄乳鸽血清钙极显著提高(<0.01),ALP活性极显著降低(<0.01),PTH水平也显著降低(<0.05);与14日龄相比,21日龄乳鸽血清ALP活性和PTH水平均极显著降低(<0.01)。日龄和磷添加水平对血清磷含量有显著的交互作用(=0.02)。
2.3 磷转运载体(NaPi-IIa、NaPi-IIb、PiT-1和PiT-2)基因表达
饲粮添加磷对7、14和21日龄乳鸽十二指肠和空肠肠段NaPi-IIb表达水平的影响结果列于表5。由表5可知,各日龄乳鸽小肠NaPi-IIb表达水平随亲鸽饲粮磷含量增加均有上升趋势,但差异不显著(>0.05)。不同肠段(十二指肠和空肠)NaPi-IIb表达水平无显著差异,肠段和饲粮加磷水平之间也无互作(>0.05)。
饲粮添加磷对7、14和21日龄乳鸽十二指肠、空肠和肾脏PiT-1和PiT-2表达水平的影响结果列于表6。由表6可见,7和14日龄乳鸽肾脏PiT-1和 PiT-2表达水平均极显著高于十二指肠和空肠(<0.01),然而,21日龄乳鸽十二指肠和肾脏PiT-1表达水平未见明显不同,且空肠PiT-1表达水平最高(<0.01)。21日龄乳鸽不同组织(十二指肠、空肠和肾脏)的PiT-2表达量未见差异。
种鸽饲粮添加磷水平显著影响乳鸽体内PiT-1 mRNA的表达水平。7日龄时,0.8%加磷组乳鸽PiT-1表达水平极显著高于其他各组(<0.01,表6);14日龄时,0.4%和0.8%加磷组乳鸽PiT-1表达水平显著高于其他各组(<0.05);此外,7和21日龄时0.4%加磷组乳鸽PiT-2表达水平显著高于0.8%组(<0.05),而对照组、0.2%和0.8%三组之间无显著差异。7和14日龄时,采样部位和饲粮加磷水平对乳鸽PiT-1表达水平有明显互作(<0.05);21日龄时,采样部位和饲粮加磷水平对乳鸽PiT-2基因表达有极显著互作(<0.01,表6)。
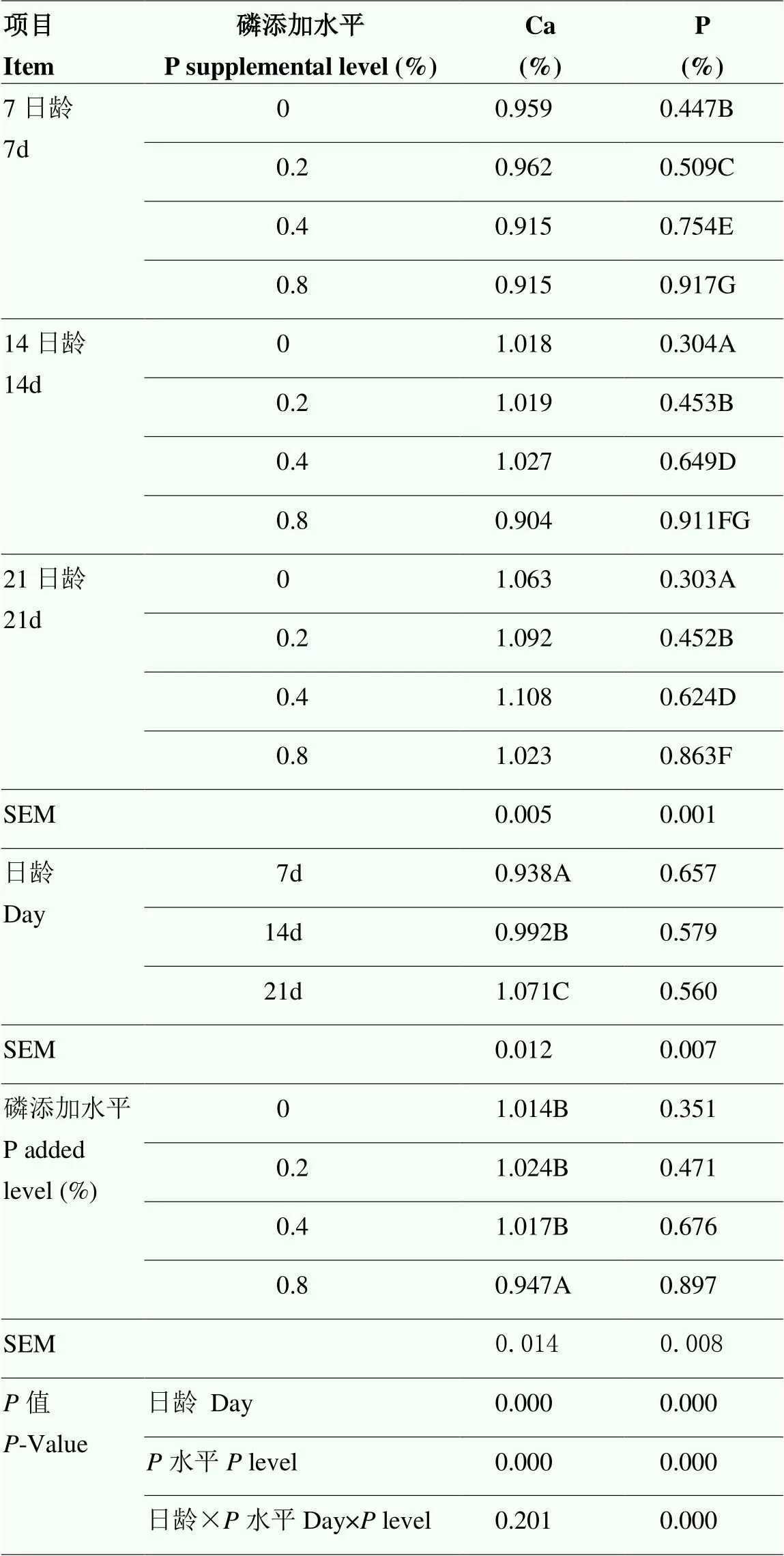
表3 饲粮磷水平和乳鸽日龄对鸽乳中钙和磷含量的影响
数据为每组8个重复的平均值,每2个样品等比例混合为一个测定值。同列不同大写字母表示差异极显著(<0.01),不同小写字母表示差异显著(<0.05)。下同
Each value represents the mean of 8 replicates with one determination of 2 samples in equal ratios. Different capital letters in the same column indicate extremely significant difference (<0.01), and different lowercase letters in the same column show significant differences. (<0.05). The same as below

表4 饲粮磷水平和乳鸽日龄对乳鸽血清钙、磷含量、ALP活性和PTH水平的影响1)
1)数据为每组8个重复的平均值 Each value represents the mean of 8 replicates
不同日龄各组乳鸽肾脏NaPi-IIa表达情况见图1。14日龄时,0.8%加磷组乳鸽NaPi-IIa表达水平显著低于对照组和0.4%组(<0.05);但7和21日龄时,种鸽饲粮加磷水平对乳鸽肾脏NaPi-IIa表达无显著影响(>0.05)。
2.4 乳鸽血清代谢组数据
在14和21日龄乳鸽血清样本中共提取到11 628个质谱峰。经搜库(自建库、Metlin、HMDB等)定性分析,共鉴定出639种代谢物,其中正离子模式鉴定到250种代谢物,负离子模式鉴定到389种代谢物。通过PLS-DA可以有效地区分组间分析值,14和21日龄乳鸽各组样品PLS-DA得分图见图2,图中两组样品分离程度越大,说明分类效果越显著。
如图2所示,所有血清样本均在95%置信区间内,14日龄时,对照组和0.8%加磷组乳鸽样本在正离子模式下有明显的分离趋势,而对照组和0.4%加磷组之间有部分重叠,表明种鸽饲粮中添加0.8%无机磷较0.4%添加水平对14日龄乳鸽代谢的影响更大。当乳鸽21日龄时,0.4%和0.8%加磷组有部分重叠,而对照组与其他两组样品能明显分开,表明对照组与其他加磷组相比乳鸽代谢有明显不同。为了验证PLS-DA模型是否存在过拟合,对模型进行验证,以确保后续结果可靠,设置检验为200次,R2和Q2分别用来评价PLS-DA模型的解释能力和预测能力,累计值越大,说明模型越稳定可靠,验证模型结果(图3)显示Q2截距小于R2,Q2回归线截距小于0,且回归直线呈现左低右高的趋势,表明PLS-DA模型稳健可靠,未发生过拟合,可进一步根据VIP分析筛选差异代谢物。

表5 饲粮加磷水平对不同日龄乳鸽小肠NaPi-IIb基因表达水平的影响
数据为每组6个样品的平均值(n=6)。NaPi-IIb mRNA表达水平是以β-actin mRNA表达水平为基础的相对数值,且用对照组乳鸽十二指肠样品基因表达的ΔCt平均值校正其余各组分析值
Each value represents the mean of 6 replicates (n=6). Data were presented as the mean fold changes in relative expression of NaPi-IIb, compared with β-actin, calculated relative to the respective values in duodenum of squabs in the control group

NaPi-Ⅱa mRNA表达水平是以β-actin mRNA表达水平为基础的相对数值,且用对照组乳鸽肾脏该基因表达的ΔCt平均值校正其余各组分析值。a,b柱形图上方字母不同表示差异显著(P<0.05)

表6 饲粮加磷水平对不同日龄乳鸽小肠和肾脏PiT-1和PiT-2基因表达水平的影响
数据为每组6个样品的平均值(n=6)。同行标不同大写字母表示差异极显著(<0.01),同行标不同小写字母表示差异显著(<0.05)。PiT-1和PiT-2 mRNA表达水平是以β-actin mRNA表达水平为基础的相对数值,且用对照组乳鸽十二指肠样品相应基因表达的ΔCt平均值校正其余各组分析值
Each value represents the mean of 6 replicates (n=6). Means within the same row lacking a common upper superscript differ (<0.01), means within the same row lacking a common lower superscript differ (<0.05). Data were presented as the mean fold changes in relative expression of PiT-1 and PiT-2 respectively, compared with β-actin, calculated relative to the respective values in duodenum of squabs in the control group

Component1第一主成分解释度,Component2第二主成分解释度:(A1)正离子模式,14日龄;(A2)负离子模式,14日龄;(B1)正离子模式,21日龄;(B2)负离子模式,21日龄
通过单因素ANOVA检验值初步筛选对照组、0.4%和0.8%加磷组乳鸽血清中的差异代谢物(<0.05),在14和21日龄乳鸽样本中分别筛选出110和39种差异代谢物,再通过PLS-DA模型的VIP值对差异代谢物进一步检验(VIP>1),筛选VIP>1、<0.05的代谢物为组间差异代谢物。因为上述PLS-DA检验结果表明对照组和加磷组样品区别大于不同加磷水平组,所以本文仅讨论对照组与加磷组(0.4%和0.8%)的比较结果。
14日龄时对照组和0.4%加磷组共筛选出21种差异代谢物,包括9种正离子和12种负离子化代谢物,其中有6种丰度显著上调(<0.05),15种丰度显著下调(<0.05),注释到HMDB数据库的差异代谢物可分为如下6种类型:脂质和类脂质分子(10种)、有机酸及其衍生物(3种)、苯基丙酮和聚酮(2种)、苯系物(1种)、有机氧化合物(1种)和有机杂环化合物(1种)。14日龄时对照组和0.8%加磷组共鉴定出37种差异代谢物,包括13种正离子和24种负离子化代谢物,其中有4种丰度显著上调(<0.05),33种丰度显著下调(<0.05),注释到HMDB数据库的差异代谢物可分为如下7种类型:脂质和类脂质分子(10种)、有机酸及其衍生物(10种)、有机杂环化合物(8种)、苯系物(2种)、苯基丙酮和聚酮(2种)、木酚素、新木酚素和相关化合物(1种)和有机氧化合物(1种)。
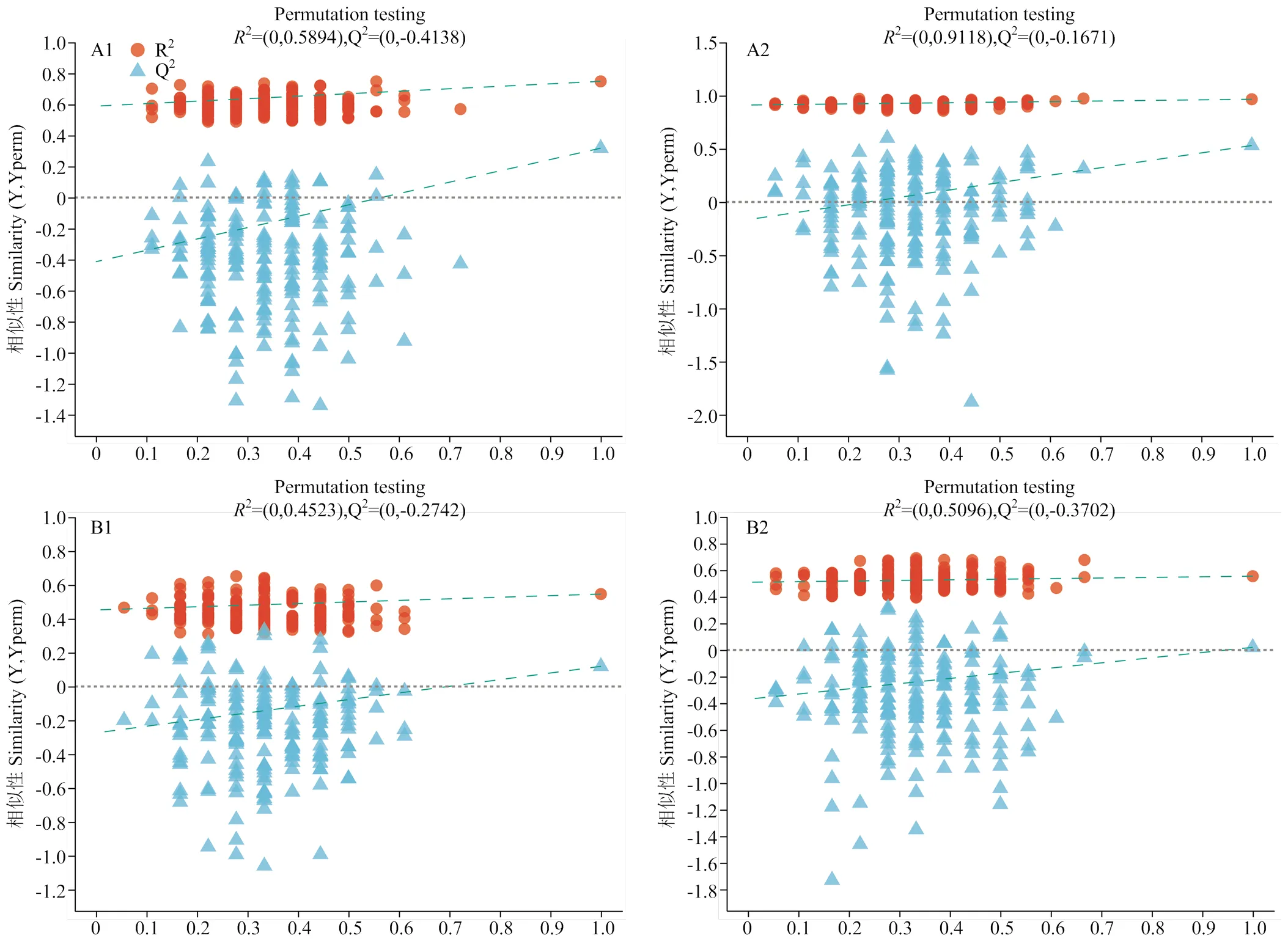
(A1)正离子模式,14日龄;(A2)负离子模式,14日龄;(B1)正离子模式,21日龄;(B2)负离子模式,21日龄
21日龄时对照组和0.4%加磷组共鉴定出15种差异代谢物,包括8种正离子和7种负离子化代谢物,其中有10种丰度显著上调(<0.05),5种丰度显著下调(<0.05),注释到HMDB数据库的差异代谢物可分为如下5种类型:脂质和类脂质分子(6种)、有机酸及其衍生物(3种)、苯基丙酮和聚酮(1种)、苯系物(1种)和有机聚合物(1种)。21日龄时对照组和0.8%加磷组共鉴定出22种差异代谢物。包括7种正离子和15种负离子化代谢物,其中有12种丰度显著上调(<0.05),10种丰度显著下调(<0.05),注释到HMDB数据库的差异代谢物可分为如下4种类型:脂质和类脂质分子(11种)、有机酸及其衍生物(7种)、苯系物(2种)和有机氧化合物(1种)。由此可知定性到的与试验处理相关的大多数差异代谢物为脂质和类脂质分子,其次是有机酸及其衍生物。表7和8分别列出了14和21日龄时对照组和2个加磷组之间共同的差异代谢物的质谱信息、VIP、表达及值情况,14日龄时共同差异代谢物有9种,21日龄共同差异代谢物有4种。
利用MetaboAnalyst软件对乳鸽血清中的差异代谢物进行KEGG通路富集分析。当校正值<0.05时,认为此通路存在显著富集情况,试验结果表明,14日龄时对照组和0.4%加磷组乳鸽血清样本中21种具有显著差异的代谢物共注释到2条显著富集的代谢通路,主要涉及消化功能(胆汁分泌)及碳水化合物代谢(戊糖和葡萄糖醛酸的相互转化);而同日龄对照组和0.8%加磷组差异代谢物注释到维生素B6及能量代谢(氧化磷酸化)途径,但校正值未达到显著水平(表9);21日龄时对照组和0.4%加磷组乳鸽血清样本中15种具有显著差异的代谢物共注释到2条显著富集的代谢通路,主要涉及脂质代谢(胆酸合成)及感官系统(味觉传导);而同日龄对照组和0.8%加磷组差异代谢物注释到神经系统(多巴胺能突触)、内分泌系统(催乳素和胰高血糖素信号通路)、碳水化合物代谢(柠檬酸循环、乙醛酸和二羧酸代谢)、氨基酸代谢(苯丙氨酸、酪氨酸和色氨酸的生物合成、β-丙氨酸、丙氨酸、天冬氨酸和谷氨酸及组氨酸代谢)、二级代谢产物生物合成(Monobactam)、感官系统(味觉传导)、维生素代谢(硫胺素)、转录(氨基酰-tRNA生物合成)及消化功能(蛋白质消化和吸收)等(校正<0.05)。

表8 21日龄乳鸽血清中对照组与2个加磷组之间的共同差异代谢物

表9 14和21日龄乳鸽血清中对照组与加磷组之间的差异代谢物KEGG通路富集分析
3 讨论
3.1 鸽乳钙、磷含量
在乳鸽出壳的前几天,亲鸽嗉囊上皮细胞层开始脱落并分泌一种物质——鸽乳,鸽乳是乳鸽早期生长过程中获得营养物质的唯一来源,前人研究表明乳鸽相对生长速度快、生长强度大,与鸽乳所提供的营养密不可分[18, 22]。本试验结果表明随着亲鸽日粮中无机磷添加水平的增加,鸽乳中的磷含量极显著上升,说明亲鸽采食的饲料营养水平对其分泌的鸽乳的营养成分具有显著影响。所有处理组饲粮中Ca含量均为1.40%,但0.8%添加组的鸽乳钙含量极显著低于其余各组。鸡饲粮中适宜的钙磷比一般为2﹕1到1﹕1,本试验0.8%无机磷添加组种鸽饲粮钙磷比虽在此适宜范围内,其分泌的鸽乳中钙含量却降低,说明鸽体内对磷的利用情况可能不同于鸡,本研究团队前期研究表明鸽嗉囊中的微生物多样性最丰富[23],ZELLER等[24]证明微生物来源的内源性和外源添加的植酸酶在肉鸡嗉囊中对降解植酸具有协同作用,故有理由推测鸽对饲料中植酸磷的利用优于鸡,从而对添加高磷饲料的耐受性较差,另一方面,也有报道指出肉鸡摄入高磷不利于体内钙的代谢[25-26],当饲粮含磷量为1.10%—1.15%(钙水平为0.9%)时肉鸡采食量和日增重均明显降低[27],本试验中高磷组鸽乳钙含量显著降低的产生原因有待进一步研究。
鸽乳富含矿物元素[28],本试验中鸽乳钙含量随着日龄(7—21 d)增长而上升,而磷含量随着日龄(7—21 d)增长而下降,前人也报道钙含量随日龄(1—28 d)增加线性增加,磷含量线性减少[29],0—3日龄鸽乳中Ca的含量比4—6日龄中降低11.8%,P提高18.2%[30],本次研究结果与前人报道一致,鸽乳中矿物元素的变化趋势可能与乳鸽在不同生长阶段的生理需求有关。
3.2 血清钙、磷、ALP活性和PTH水平
已知血清磷是反映机体磷营养水平的敏感指标,本试验中乳鸽血清磷未受试验处理的影响,表明乳鸽能高效利用鸽乳中的磷,同时对血磷含量具有一定的调控能力,其值维持在一定生理范围内,不随鸽乳磷含量的变化而变化。但0.8%加磷组乳鸽血清钙含量极显著低于0.2%和0.4%组,有意思的是,乳鸽血清中钙含量的变化趋势与饲粮加磷对鸽乳中钙含量的影响结果一致,即高磷处理不仅降低了鸽乳钙含量,也降低了乳鸽血清钙水平,这验证了鸽对高磷饲料的耐受性较差的说法[21]。
PTH是参与调控钙磷代谢的重要激素之一,其主要作用是维持血钙浓度正常,通过加强破骨作用,使钙从骨中动员出来。此外,PTH通过破骨细胞活动使骨磷进入血液。前人报道饲粮中添加0%—0.45%无机磷对22—42日龄肉仔鸡血清PTH水平无显著影响[31],本试验中乳鸽PTH的分泌也未受试验处理的影响,与前人报道一致。此外,饲粮磷缺乏对7—42日龄肉鸡血清ALP活力无显著影响[32],本试验中乳鸽血清ALP活性未受鸽乳磷水平的影响,其变化趋势与肉鸡报道一致。本研究中ALP活力和PTH水平均随着乳鸽日龄增加显著降低,这可能与幼龄动物的生长发育有关。
3.3 磷转运载体(NaPi-IIa、NaPi-IIb、PiT-1和PiT-2)基因表达
目前国内外普遍认为,鸡等家禽肠道磷吸收的主要部位是小肠[33],而磷在小肠各段中的主要吸收部位具有种属特异性,利用结扎肠段技术研究磷在哺乳动物小肠中的主要吸收部位时发现,大鼠小肠磷吸收的主要部位是十二指肠和空肠,而小鼠的主要部位是回肠[34]。目前尚未查阅到有关鸽体内磷吸收特性的研究报道,由于鸽为飞禽,肠道前段发挥的生理功能更为重要,故本试验比较了乳鸽十二指肠和空肠段磷转运载体的基因表达情况。不同日龄乳鸽十二指肠和空肠NaPi-Ⅱb mRNA表达水平均无差异,7和14日龄十二指肠和空肠PiT-1表达无差异,14和21日龄十二指肠和空肠PiT-2表达也无差异,结果表明磷转运载体的基因表达量在十二指肠与空肠之间几乎无区别,而肉鸡NaPi-Ⅱb mRNA主要在十二指肠表达,空肠次之,回肠几乎不表达;且肠道后段是PiT-1和PiT-2基因的主要表达部位[35]。磷转运载体表达量在肉鸽肠道各段之间的差异小于肉鸡可能与其生理特点有关,鸽消化道与体型的比例是7﹕1,而鸡是8﹕1,较短的消化道的优点主要是有利于飞行,肠道长度较短可通过发育良好的肠绒毛网以及肠道内酸性更强进行补偿。
有研究报道,低磷日粮可促进肉仔鸡小肠中NaPi-Ⅱb mRNA的表达[33, 35],但本试验中各日龄乳鸽小肠NaPi-IIb表达水平随亲鸽饲粮磷含量增加均有上升趋势,且饲粮添加磷显著促进7和14日龄乳鸽磷转运载体PiT-1的基因表达,21日龄时0.4%加磷组PiT-2 mRNA表达量最高。肉鸡试验表明,0.45%非植酸磷水平组7、14和21日龄肉仔鸡十二指肠PiT-1 mRNA表达量显著低于对照组[35],由上可知,本试验结果有别于肉鸡磷转运载体表达随饲粮磷水平的变化规律,原因可能与动物种类不同有关,表明鸽肠道对磷的吸收调控可能不同于鸡,关于鸽体内磷转运载体的表达及其调控未见任何报道,具体作用机制尚有待研究。
在正常生理条件下,肾脏是无机磷排泄的主要途径。在不同的饲粮磷情况下,关于肠道磷吸收及肾脏磷排泄有两种不同的观点,一种认为当饲粮磷超过需要量时,肠道磷吸收会降低[36],但另有研究者认为,该情况下肠道磷吸收不会降低,只是肾脏磷的排泄增加[37]。另外肾脏还具有重吸收磷的功能,本试验7和14日龄乳鸽PiT-1和PiT-2 mRNA在肾脏的表达量均极显著高于肠道,表明PiT-1和PiT-2在幼龄乳鸽肾脏重吸收磷过程中具有重要作用,而随着年龄增长,肠道发育成熟,其在肾脏中的重要性降低。此外,鸡肾脏中存在磷转运蛋白NaPi-Ⅱa,其在肾脏的磷重吸收中发挥重要作用[38-39]。随饲粮非植酸磷水平增加,22—42日龄肉鸡肾脏NaPi-Ⅱa mRNA表达量呈线性下降[31],但41周龄矮小型蛋鸡肾脏NaPi-Ⅱa mRNA表达量随日粮中非植酸磷水平的提高而线性增加[40]。而本试验中0.8%加磷组14日龄乳鸽NaPi-Ⅱa表达水平显著低于对照组和0.4%组。上述研究结果不一致的原因可能与试验动物的种类、年龄和饲粮营养组成等因素有关。
3.4 乳鸽血清非靶向代谢组
众所周知,磷以多种形式参与动物体内众多的物质形成及代谢过程,如与脂蛋白结合形成磷脂蛋白,参与细胞膜磷脂双分子层的构建;以ATP形式参与体内能量代谢,为维持细胞的正常生长并发挥其生理功能提供能量;以磷酸根形式参与机体遗传物质DNA、RNA的组成,在动物遗传信息的传递中发挥重要作用。此外,磷还具有维持体液酸碱稳态等作用。目前家禽磷营养研究大多集中在不同日粮磷水平对体内特异性功能指标的调控作用,而关于鸽对磷吸收代谢未见报道。代谢组学使用高通量方法定量测定生物样品中的小分子代谢物,被认为是疾病早期诊断、生物标志物鉴定和代谢途径表征的有力工具。为初步了解快速生长期乳鸽的磷稳态及其营养作用,本试验研究了亲鸽饲粮中添加不同水平无机磷对乳鸽血清非靶向代谢物的影响。
本试验结果表明,14和21日龄加磷组和对照组乳鸽之间的显著差异代谢物中约50%为脂质和类脂质分子,其次是有机酸及其衍生物,再次是苯系物等某些有机物,证明了磷在肉鸽体内的主要功能为参与脂肪代谢。磷是三磷酸腺苷、核酸、磷脂和多种辅酶的重要组成成分,在糖降解、能量和脂质代谢等过程中发挥着重要的作用。饲料缺磷可导致黑鲷体内氧化磷酸化受损,从而抑制三羧酸循环[41]。肉鸡[27]和蛋鸡[42]试验也表明,日粮磷水平的提高使得肝脏脂肪酶活性显著增加,且饲喂低磷饲粮的肉鸡胸肉脂肪酸含量较高,高磷可能影响鸡肉中饱和脂肪酸和多不饱和脂肪酸含量,尤其是长链脂肪酸,高磷抑制肝脏中苹果酸酶活性,提高胰腺脂肪酶活性[27],而关于磷对肉鸽脂肪代谢的调控机制有待研究。此外,与对照组相比,14日龄加磷组乳鸽血清中的小分子代谢物葫芦素B显著下调,饲粮中添加0.4%和0.8%无机磷使血清中葫芦素B含量分别降低为对照组的56%和50%,对小鼠的研究表明葫芦素B可通过诱导血管生成从而促进骨再生,临床上有望作为骨骼缺失的治疗药物[43],本试验表明磷参与调控肉鸽骨骼组织的形成和维持[21],其具体调控机制有待深入研究。
试验中差异代谢物涉及到的代谢途径包括碳水化合物代谢、蛋白质和氨基酸代谢以及遗传物质合成等。受饲粮添加磷影响的碳水化合物代谢途径涉及戊糖和葡萄糖醛酸的相互转化、柠檬酸循环、乙醛酸和二羧酸代谢,其中柠檬酸和琥珀酸(亚乙基二羧酸)均被认为是三羧酸循环中的关键参与者;受饲粮添加磷影响的氨基酸代谢途径有苯丙氨酸、酪氨酸和色氨酸的生物合成、β-丙氨酸、丙氨酸、天冬氨酸和谷氨酸及组氨酸代谢,其中丙氨酸、天冬氨酸和谷氨酸等氨基酸代谢通路都与嘌呤核苷酸的从头合成有关;磷还参与体内胆汁分泌、胆酸合成等脂质代谢。综上所述,磷在肉鸽体内参与多种非常重要的代谢过程。
4 结论
(1)亲鸽饲粮中的磷水平显著影响其分泌的鸽乳含磷量,而乳鸽血磷含量较稳定,但是高磷组血钙含量下降,这有可能表明乳鸽对高磷耐受性较差。
(2)乳鸽肾脏中PiT-1和PiT-2 mRNA表达大多随饲粮磷含量增加而增加,具体调控机制有待研究。
(3)血液代谢组数据表明磷参与乳鸽体内多种重要的代谢过程,如脂肪代谢和骨骼矿化等。
致谢:感谢北京密云霍书林养殖场、河北灵寿县田佳家庭农场和山东武城县广运林海肉鸽养殖家庭农场在试验实施过程中提供的帮助。
[1] AHMADI H, RODEHUTSCORD M. A meta-analysis of responses to dietary nonphytate phosphorus and phytase in laying hens. Poultry Science, 2012, 91(8): 2072-2078.
[2] NIE W, YANG Y, YUAN J M, WANG Z, GUO Y M. Effect of dietary nonphytate phosphorus on laying performance and small intestinal epithelial phosphate transporter expression in Dwarf pink-shell laying hens. Journal of Animal Science and Biotechnology, 2013, 4(1): 34.
[3] LIU X J, LOCASALE J W. Metabolomics: A primer. Trends in Biochemical Sciences, 2017, 42(4): 274-284.
[4] GOLDANSAZ S A, GUO A C, SAJED T, STEELE M A, PLASTOW G S, WISHART D S. Livestock metabolomics and the livestock metabolome: A systematic review. PLoS ONE, 2017, 12(5): e0177675.
[5] SABBAGH Y, GIRAL H, CALDAS Y, LEVI M, SCHIAVI S C. Intestinal phosphate transport. Advances in Chronic Kidney Disease, 2011, 18(2): 85-90.
[6] LI J H, YUAN J M, MIAO Z Q, GUO Y M. Effects of age on intestinal phosphate transport and biochemical values of broiler chickens. Asian-Australasian Journal of Animal Sciences, 2017, 30(2): 221-228.
[7] BAI L, COLLINS J F, GHISHAN F K. Cloning and characterization of a type III Na-dependent phosphate cotransporter from mouse intestine. American Journal of Physiology Cell Physiology, 2000, 279(4): C1135-C1143.
[8] MURER H, HERNANDO N, FORSTER L, BIBER J. Molecular mechanisms in proximal tubular and small intestinal phosphate reabsorption (plenary lecture). Molecular Membrane Biology, 2001, 18(1): 3-11.
[9] FORSTER I C, HERNANDO N, BIBER J, MURER H. Phosphate transporters of the SLC20 and SLC34 families. Molecular Aspects of Medicine, 2013, 34(2/3): 386-395.
[10] YAN F, ANGEL R, ASHWELL C M. Characterization of the chicken small intestine type IIb sodium phosphate cotransporter. Poultry Science, 2007, 86(1): 67-76.
[11] LI J H, YUAN J M, GUO Y M, SUN Q J, HU X F. The influence of dietary calcium and phosphorus imbalance on intestinal NaPi-IIb and calbindin mRNA expression andparameters of broilers. Asian-Australasian Journal of Animal Sciences, 2012, 25(4): 552-558.
[12] LIU S B, HU Y X, LIAO X D, LU L, LI S F, ZHANG L Y, TAN H Z, YANG L, SUO H Q, LUO X G. Kinetics of phosphorus absorption in ligated small intestinal segments of broilers. Journal of Animal Science, 2016, 94(8): 3312-3320.
[13] HU Y X, LIAO X D, WEN Q A, LU L, ZHANG L Y, LUO X G. Phosphorus absorption and gene expression levels of related transporters in the small intestine of broilers. British Journal of Nutrition, 2018, 119(12): 1346-1354.
[14] HILFIKER H, HATTENHAUER O, TRAEBERT M, FORSTER I, MURER H, BIBER J. Characterization of a murine type II sodium- phosphate cotransporter expressed in mammalian small intestine. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(24): 14564-14569.
[15] WERNER A, KINNE R K H. Evolution of the Na-Picotransport systems. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2001, 280(2): R301-R312.
[16] TENENHOUSE H S. Regulation of phosphorus homeostasis by the type Ⅱa na/phosphate cotransporter. Annual Review of Nutrition, 2005, 25: 197-214.
[17] HUBER K, ZELLER E, RODEHUTSCORD M. Modulation of small intestinal phosphate transporter by dietary supplements of mineral phosphorus and phytase in broilers. Poultry Science, 2015, 94(5): 1009-1017.
[18] SHETTY S, BHARATHI L, SHENOY K B, HEGDE S N. Biochemical properties of pigeon milk and its effect on growth. Journal of Comparative Physiology B, 1992, 162(7): 632-636.
[19] ZHANG X Y, ZHANG N N, WAN X P, LI L L, ZOU X T. Gene expression of amino acid transporter in pigeon (Columbia livia) intestine during post-hatch development and its correlation with amino acid in pigeon milk. Poultry Science, 2017, 96(5): 1120-1131.
[20] SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols, 2008, 3(6): 1101-1108.
[21] JI F, ZHANG S, AN Y, WANG Z, SHAO Y X, DU S H, LI X, SUN X S. Influence of dietary phosphorus concentrations on the performance of rearing pigeons (), and bone properties of squabs. Poultry Science, 2022, 101(4): 101744.
[22] GILLESPIE M J, STANLEY D, CHEN H L, DONALD J A, NICHOLAS K R, MOORE R J, CROWLEY T M. Functional similarities between pigeon ‘milk’ and mammalian milk: induction of immune gene expression and modification of the microbiota. PLoS ONE, 2012, 7(10): e48363.
[23] JI F, ZHANG D Y, SHAO Y X, YU X H, LIU X Y, SHAN D C, WANG Z. Changes in the diversity and composition of gut microbiota in pigeon squabs infected with. Scientific Reports, 2020, 10: 19978.
[24] ZELLER E, SCHOLLENBERGER M, KÜHN I, RODEHUTSCORD M. Dietary effects on inositol phosphate breakdown in the crop of broilers. Archives of Animal Nutrition, 2016, 70(1): 57-71.
[25] RAMA RAO S V, RAJU M V L N, REDDY M R, PAVANI P. Interaction between dietary calcium and non-phytate phosphorus levels on growth, bone mineralization and mineral excretion in commercial broilers. Animal Feed Science and Technology, 2006, 131(1/2): 135-150.
[26] ROMÁN-GARCÍA P, CARRILLO-LÓPEZ N, FERNÁNDEZ-MARTÍN J L, NAVES-DÍAZ M, RUIZ-TORRES M P, CANNATA-ANDÍA J B. High phosphorus diet induces vascular calcification, a related decrease in bone mass and changes in the aortic gene expression. Bone, 2010, 46(1): 121-128.
[27] LI X K, WANG J Z, WANG C Q, ZHANG C H, LI X, TANG C H, WEI X L. Effect of dietary phosphorus levels on meat quality and lipid metabolism in broiler chickens. Food Chemistry, 2016, 205: 289-296.
[28] DAVIES W L. The composition of the crop milk of pigeons. The Biochemical Journal, 1939, 33(6): 898-901.
[29] 孙晓珊, 林冬梅, 邵玉新, 王铮, 黄建国. 不同日龄鸽乳粗蛋白质和矿物元素含量变化规律的研究. 中国畜牧兽医, 2022, 49(5): 1697-1706.
SUN X S, LIN D M, SHAO Y X, WANG Z, HUANG J G. Study on the changes of crude protein and mineral elements in pigeon milk at different ages. China Animal Husbandry & Veterinary Medicine, 2022, 49(5): 1697-1706. (in Chinese)
[30] 曾秋凤. 0-10日龄乳鸽人工鸽乳的研制及其饲用价值的研究[D]. 长沙: 湖南农业大学, 2002.
ZENG Q F. Studies on crop milk substitute for squabs from hatching to ten days of age & its feeding value in pigeon[D]. Changsha: Hunan Agricultural University, 2002. (in Chinese)
[31] 江勇. 22~42日龄肉仔鸡玉米—豆粕型饲粮非植酸磷需要量研究[D]. 北京: 中国农业科学院, 2013.
JIANG Y. Study on dietary non-phytate phosphorus requirement of broiler chicks from 22 to 42 days of age[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013. (in Chinese)
[32] 邢冠中. 饲粮钙、磷缺乏对肉仔鸡骨骼钙、磷代谢利用和佝偻病发病率的影响[D]. 秦皇岛: 河北科技师范学院, 2019.
XING G Z. Effects of dietary calcium and phosphorus deficiency on bone calcium and phosphorus metabolism and rickets incidence in broilers[D]. Qinhuangdao: Hebei Normal University of Science & Technology, 2019. (in Chinese)
[33] 刘松柏. 肉仔鸡对饲料标准磷利用率、可利用磷需要量及小肠磷吸收机制研究[D]. 北京: 中国农业科学院, 2012.
LIU S B. Studies on standardized phosphorus availabilities in feedstuffs, available phosphorus requirement and mechanism of phosphorus absorption in the small intestine of broiler chicks[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese)
[34] MARKS J, SRAI S K, BIBER J, MURER H, UNWIN R J, DEBNAM E S. Intestinal phosphate absorption and the effect of vitamin D: A comparison of rats with mice. Experimental Physiology, 2006, 91(3): 531-537.
[35] 胡义信. 饲粮非植酸磷水平对肉仔鸡小肠磷吸收及其相关磷转运载体基因表达的影响[D]. 北京: 中国农业科学院, 2016.
HU Y X. Effect of dietary non-phytate phosphorus level on intestinal phosphorus absorption and gene expressions of related phosphate transporters of broilers[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese)
[36] KETAREN P P, BATTERHAM E S, DETTMANN E B, FARRELL D J. Phosphorus studies in pigs. British Journal of Nutrition, 1993, 70(1): 289-311.
[37] FERNÁNDEZ J. Calcium and phosphorus metabolism in growing pigs. II. Simultaneous radio-calcium and radio-phosphorus kinetics. Livestock Production Science, 1995, 41(3): 243-254.
[38] DUDAS P L, VILLALOBOS A R, GOCEK-SUTTERLIN G, LAVERTY G, RENFRO J L. Regulation of transepithelial phosphate transport by PTH in chicken proximal tubule epithelium. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2002, 282(1): R139-R146.
[39] HUBER K, HEMPEL R, RODEHUTSCORD M. Adaptation of epithelial sodium-dependent phosphate transport in jejunum and kidney of hens to variations in dietary phosphorus intake. Poultry Science, 2006, 85(11): 1980-1986.
[40] 聂伟. 日粮磷水平对矮小型蛋鸡产蛋性能、蛋壳品质及钙磷吸收的影响[D]. 北京: 中国农业大学, 2013.
NIE W. Effects of dietary phosphorus levels on laying performance, egg shell quality and Ca and P absorption in laying hens with drawf gene[D]. Beijing: Chinese Agricultural University, 2013. (in Chinese)
[41] SHAO Q J, MA J J, XU Z R, HU W L, XU J Z, XIE S Q. Dietary phosphorus requirement of juvenile black seabream,. Aquaculture, 2008, 277(1/2): 92-100.
[42] 马霞, 朱连勤, 朱风华, 郭振环. 低磷或低钙高能量日粮对蛋鸡脂肪代谢的影响//中国畜牧兽医学会家畜内科学分会2009年学术研讨会论文集. 青岛, 2009: 274-277.
MA X, ZHU L Q, ZHU F H, GUO Z H. Effect of high-energy diets containing low-P or low-ca on lipid metabolism of laying hens. Proceedings of Chinese Association of Veterinary Internal Medicine. Qingdao, 2009: 274-277. (in Chinese)
[43] CHENG W X, LIU Y Z, MENG X B, ZHENG Z T, LI L L, KE L Q, LI L, HUANG C S, ZHU G Y, PAN H D, QIN L, WANG X L, ZHANG P. PLGA/β-TCP composite scaffold incorporating cucurbitacin B promotes bone regeneration by inducing angiogenesis. Journal of Orthopaedic Translation, 2021, 31: 41-51.
Influences of Phosphorus Level in Diet of Parent Pigeons on Biochemical Index, Untargeted Metabolomics Profile of Serum, and Gene Expression of Phosphate Transporters in Squabs

1Institute of Animal Husbandry and Veterinary Medicine, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097;2College of Life Science and Food Engineering, Hebei University of Engineering, Handan 056009, Hebei;3College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070
【Objective】The aim of this study was to investigate the effects of different levels of inorganic phosphorus (P) on serum biochemical parameters, non-targeted metabolites, and expression of phosphate transporter genes in the small intestine and kidney of pigeon, so as to provide a theoretical basis for the regulation of phosphorus nutrition in pigeon during the period of rapid growth.【Method】A total of 192 pairs of parental Silver King pigeons (40 weeks of age) were randomly allocated to four treatment groups, each consisting of eight replicates of 6 pairs per replicate. The study lasted for 46 days including the phases of egg-hatching and squab-rearing. Dietary treatments included the basal diet (containing 0.3% of P), the basal diet supplemented with 0.2%, 0.4%, or 0.8% inorganic P. The calcium (Ca) content in diets of parent birds were kept at 1.40% in every group. The levels of Ca, P, PTH and ALP activity in serum of 7, 14 and 21 d old squabs were determined, and the content of Ca and P in crop milk were analyzed. The gene expression of Pi transporters (NaPi-Ⅱb, PiT-1, and PiT-2) in small intestine (duodenum and jejunum), and Pi transporters (NaPi-Ⅱa, PiT-1, and PiT-2) in kidney of squabs were determined. Serum metabolome profiles of 14 and 21 d old squabs in the groups of control, 0.4% and 0.8% P-supplemented were analyzed. 【Result】(1) The P contents in crop milk sampled from squabs were very significantly (<0.01) increased by P supplementation in diets of parent pigeons. (2) No significant effect of P supplementation in diet of parent birds on serum P level, ALP activity and PTH level of squabs were observed in this study. However, the serum Ca content in birds of 0.8% P supplemental group decreased very significantly (<0.01). The serum ALP and PTH level of squabs significantly decreased with increased age (<0.05).(3) There was a tendency of increased gene expression of NaPi-IIb in small intestine of squabs with dietary P levels of breeding birds, however, the difference was not significant (>0.05). The expression profile of PiT-1 and PiT-2 in kidney of squabs at the age of 7 and 14 d were very significantly higher (<0.01) than those in duodenum and jejunum. However, the difference of the mRNA expression level of PiT-1 and PiT-2 between kidney and intestine was not observed at the age of 21 d, and the PiT-1 value of kidney samples was even lower than that of jejunum. The mRNA expression levels of PiT-1 of 7 and 14 d old squabs were significantly increased by dietary P levels of breeding birds. The mRNA expression of PiT-2 in the group of dietary 0.4% P supplementation was significantly higher (<0.05) than that of 0.8% group when the squabs were 7 and 21 d old. The interaction of tissue and dietary P levels was significant (<0.05) on PiT-1 mRNA level of 7 and 14 d, and PiT-2 mRNA level of 21 d old birds. The mRNA expression level of NaPi-IIa in kidney of 14 d squabs significantly decreased in the group of 0.8% P supplementation, compared with the control and 0.4% group. (4) At the age of 14 and 21 d, about half of the significantly different metabolites among the control and P-added groups were included in the category of lipids and lipid-like molecules, organic acids and derivatives was the second, and benzenoids next. The biological pathways involved in the metabolism of differentially expressed metabolites were mainly carbohydrate metabolism, metabolism of protein and amino acids, translation and lipid metabolism etc. 【Conclusion】(1) There was a significant effect of P supplementation in the diet of parent pigeons on P content in crop milk fed to squabs. The values of serum P of young birds were stable. However, the serum Ca of squabs in the group of highest dietary P treatment decreased, which might indicate that pigeons were intolerant to high dietary P level. (2) The expression levels of P transporters (PiT-1 and PiT-2) mRNA in the kidney mostly increased with dietary P supplementation. The regulation mechanisms of P reabsorption in pigeons need to be studied further. (3)The serum metabolome profiles of squabs indicated that P was involved in many important metabolic processes, such as lipid metabolism and bone mineralization etc.
phosphorus; pigeon; biochemical index; metabolome; transporter

10.3864/j.issn.0578-1752.2023.23.017
2023-03-15;
2023-05-25
北京市农林科学院改革与发展课题(XMS201906)、北京市农林科学院畜牧兽医研究所课题(201705)
安勇,E-mail:982356929@qq.com。通信作者计峰,E-mail:jifengji@sina.com
(责任编辑 林鉴非)

