卵泡输出率对多囊卵巢综合征不孕症患者妊娠结局的影响
曾月萍 张明霞
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是导致育龄妇女出现不孕症的重要基础疾病之一[1];PCOS 相关不孕症占所有不孕症患者的比例高达34.87%[2]。临床上高达60% 的PCOS 患者需要通过体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)助孕治疗才能成功妊娠[3]。卵巢控制性促排卵(controlled ovarian hyperstimulation,COH)是辅助生殖治疗(assisted reproductive therapy,ART)中的重要过程,对提高PCOS的妊娠率具有重要意义[4]。COH 的成功实施依赖于个体具有合适的卵巢反应性和卵母细胞发育潜能,因此准确评估个体的卵巢反应性和卵母细胞发育潜能是COH 实施的重要基础,但目前临床尚无可以同时准确预测卵巢反应性和卵母细胞发育潜能的指标[5]。为了可以准确预测窦卵泡对外源性卵泡刺激素(follicle stimulating hormone,FSH)的反应性,GENRO 等[6]在窦卵泡计数(antral follicular count,AFC)和排卵前成熟卵泡计数(preovulatory folliclecount,PFC)的基础上,构建卵泡输出率(follicular output rate,FORT)指标,该指标指在COH 过程结束时注射人绒毛膜促性腺激素(human chorionic gonadotropi,hCG)日的成熟卵泡数量与窦卵泡数的比值,即FORT =PFC/AFC。该指标在ART 中预测卵巢反应性具有一定可行性,但FORT 对PCOS 不孕症患者妊娠相关指标及结局的影响尚未见广泛报道。本研究拟评估不同FORT 分组中,PCOS 患者在相关临床资料、妊娠相关指标及妊娠结局等方面的差异,探讨FORT 在该类患者中的实际意义和应用价值。此文的研究结果为基于卵泡输出率干预多囊卵巢综合征不孕症患者的后期标准制定提供了借鉴内容。
1 资料与方法
1.1 一般资料
2018 年6 月—2021 年6 月福建医科大学附属第二医院收治的249 例PCOS 不孕症患者作为研究对象,根据既往报道[7],以FORT 值(65%)分组,将患者分为高FORT 组(n=125)和低FORT 组(n=124)。纳入标准:(1)经妇科医生确诊为PCOS 相关性不孕症患者,患者需同时具有PCOS 病史,且满足不孕症诊断标准[8]。(2)试验前患者各项基础性激素分泌正常。(3)具有IVF-ET治疗指征。(4)意识清楚,既往无精神性疾病史。(5)受试对象愿意接受至少2 年的随访。排除标准:(1)具有子宫或卵巢手术史的患者。(2)既往有子宫内膜异位症、子宫腺肌病、输卵管积水等病史的患者。(3)存在严重焦虑心理的患者。患者被充分告知研究的目的、方法及随访计划,其自愿参加本研究并签署知情同意书。本研究经福建医科大学附属第二医院伦理审查通过。
高FORT 组患者年龄(31.05±3.27)岁,确诊不孕症病程(4.32±1.87)年,身体质量指数(body mass index,BMI)(22.57±2.15)kg/m2;首次IVF-ET 患者82 例,经COH治疗后再接受IVF-ET 患者43 例。低FORT 组患者年龄(31.14±3.15)岁,确诊不孕症病程(4.29±1.93)年,BMI(21.84±1.99)kg/m2;首次IVF-ET 患者85 例,经COH 治疗后再接受IVF-ET 患者39 例。两组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 辅助生殖技术方案
1.2.1 COH 方案
所有患者于月经周期第2~3 天使用长效促性腺激素释放激素激动剂(gonado-trophin releasing hormone agonist,GnRH-a)(达菲林,法国益普生公司,注册证号X20000428,规格:3.75 mg/支)3.75 mg 降调节治疗,治疗后30 d 行阴道彩超并检测血清激素水平[FSH、雌二醇(estradiol,E2)、孕酮(progesterone,P)、黄体生成素(luteinizing hormone,LH)]。若GnRH-a 降调节治疗达到预期标准(内膜厚度≤5 mm、双侧窦卵泡直径≤5 mm,FSH ≤5 IU/L、LH ≤5 IU/L、E2<50 ng/L、P<1 μg/L),则使用促性腺激素(gonadotropin,Gn)进行COH。随后,每日给予重组FSH(瑞士默克雪兰诺公司,注册证号S20160040,规格:100 IU/支)促进卵泡发育成熟。根据卵泡发育大小及血清LH、E2水平调整Gn 用量和使用时间。COH 过程中,可以根据卵泡发育情况适当添加人绝经期促性腺激素(human menopausal gonadotropin,hMG)(丽珠医药集团股份有限公司,国药准字H10940274,规格:75 U/支)。
1.2.2 取卵、体外受精(in vitro fertilization,IVF)及胚胎移植
当阴道彩超或妇科彩超提示患者双侧卵巢至少2 枚卵泡直径超过18~20 mm 时,结合血清E2水平确定hCG 扳机时间,于hCG 扳机当晚皮下注射重组人绒促性素(瑞士默克雪兰诺公司,注册证号S20110045,规格:250 μg:0.5 mL/支)250 μg,注射后36~38 h 进行标准取卵手术。取卵当日给予孕酮凝胶(瑞士默克雪兰诺公司,国药准字H20140552,规格:8%:90 mg/支),1 支/d,阴道给药进行黄体支持。同一天,男方取精,行人工授精,16~18 h 评价受精情况,以原核(pronucleus,PN)个数作为评价标准,若2PN 为正常受精,0PN 为不受精,而1PN 或≥3PN 为异常受精。受精完成3~5 d 后行新鲜胚胎移植。新鲜胚胎移植后14 d 进行血清β-hCG 水平检测,以确定是否成功妊娠。若血清β-hCG ≥5 IU/L,则属于生化妊娠;移植后30~35 d 行彩超检查发现宫腔内出现孕囊、卵黄囊和心管搏动则为临床妊娠。
1.3 观察指标
1.3.1 血清FSH、E2、P 水平比较
于基础日、hCG 注射日分别抽血化验,检测患者血清FSH、E2、P 水平。
1.3.2 子宫内膜厚度比较
于hCG 注射日完善彩超检查,确定患者子宫内膜厚度。
1.3.3 降调天数比较
记录患者开始使用长效GnRH-a 的日期与hCG 注射日的时间间隔。
1.3.4 优质胚胎率及临床妊娠率比较
记录每个患者的优质胚胎率及临床妊娠率,取两组患者的平均优质胚胎率及临床妊娠率作为研究指标。优质胚胎率=(Ⅰ级+Ⅱ级)胚胎数/2PN 卵裂胚胎数×100% ;临床妊娠率=临床妊娠周期数/ 移植周期数×100%。
1.4 统计学方法
采用R 4.2.0 统计学软件进行数据分析。计量资料以()表示,采用t检验;计数资料以n(%)表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者血清FSH、E2、P 水平比较
基础日,高FORT 组FSH、E2两种激素水平与低FORT 组相似,差异无统计学意义(P>0.05)。注射日,高FORT 组FSH 水平低于低FORT 组,差异有统计学意义(P<0.05),而高FORT 组E2水平高于低FORT 组,差异有统计学意义(P<0.05)。高FORT 组注射日P 水平高于低FORT 组,差异有统计学意义(P<0.05)。见表1。
表1 高FORT 组与低FORT 组患者血清FSH、E2、P 水平比较()
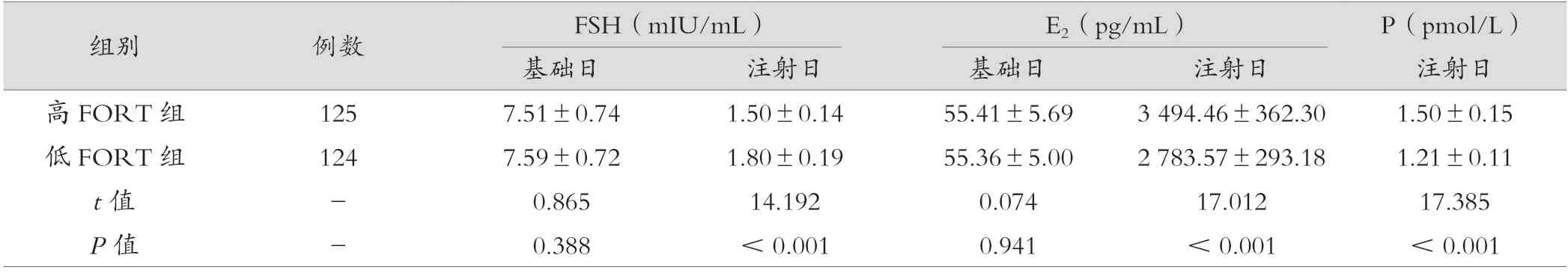
表1 高FORT 组与低FORT 组患者血清FSH、E2、P 水平比较()
2.2 两组患者子宫内膜厚度比较
高FORT 组注射日子宫内膜厚度为(12.53±1.21)mm,低FORT组为(11.17±1.18)mm,差异有统计学意义(t=8.978,P<0.001)。
2.3 两组患者降调天数比较
高FORT 组降调天数为(14.55±1.44)d,低FORT组为(16.20±1.63)d,差异有统计学意义(t=8.467,P<0.001)。
2.4 两组患者优质胚胎率及临床妊娠率比较
高FORT 组优质胚胎率为(70.36±6.62)%,低FORT组为(64.54±5.38)%,差异有统计学意义(t=7.609,P<0.001)。高FORT 组临床妊娠率为(60.15±5.90)%,低FORT 组为(55.87±5.56)%,差异有统计学意义(t=5.890,P<0.001)。
3 讨论
PCOS 是育龄妇女高发且常见的内分泌及代谢紊乱性疾病,其发病机制尚不清楚,但卵泡发育障碍、胰岛素抵抗和高雄激素血症是PCOS 的主要临床特征[9-10]。PCOS 相关不孕症占所有不孕症患者的比例高达34.87%[2]。因此,PCOS 是生殖医学领域研究最受关注的研究热点之一,揭示PCOS 的发病机制,提高其妊娠率对提高夫妻幸福感、稳定社会和谐具有重要意义[8]。尽管30%~40%的PCOS 患者经过标准促排卵治疗后可以获得成功妊娠,临床上仍然有不少PCOS 患者需要通过IVF-ET 助孕治疗才能成功妊娠[3]。COH 是该类患者实施辅助生殖治疗的重要过程,主要利用外源性Gn 刺激卵泡生长,增加成熟卵泡的数量,从而最终提高受精卵形成率,提高优质胚胎个数,增加助孕成功概率[4]。由于不同个体的窦卵泡对FSH 具有不同的敏感性,目前临床尚无可以同时准确预测卵巢反应性和卵母细胞发育潜能的指标[5]。AFC 是指在行妇科超声检查的时候,对卵巢中的窦卵泡数量进行计数,其数量与卵巢储备功能有关,可以在一定程度上反映女性的生育能力[11]。但对于ART 患者来说,AFC 无法对妊娠结局做出精确预测[11]。PFC 则是指在排卵前进行彩超下成熟卵泡(16~22 mm)计数,其数值可在一定程度上预测卵母细胞的质量,但该数值容易受到AFC 的影响,从而不能对卵巢反应性做出很好地预测。AFC 和PFC 均不能同时准确预测卵巢反应性和卵母细胞发育潜能,因此,2011 年GENRO 等[6]在AFC 和PFC 的基础上,提出了FORT 指标。目前国内已有一些学者探讨了FORT 对辅助生殖患者助孕结局的预测作用[12-13];并且探讨了不同FORT 水平下,不孕患者的妊娠结局差异[7]。从现有一些研究资料可以看出,FORT 指标在ART 中预测卵巢反应性具有一定可行性,但FORT 对PCOS 不孕症患者的妊娠相关指标及结局是否有类似的影响还不清楚。
本研究中,笔者对2018 年6 月—2021 年6 月福建医科大学附属第二医院收治的249 例PCOS 不孕症患者进行研究,探讨不同FORT 水平下,PCOS 不孕症患者的妊娠相关指标及结局是否存在显著差异。首先,本研究结合既往研究报道的分组数据确定FORT 分组阈值。本研究采用汪银等[7]的FORT 阈值65%,将患者分为高FORT 组和低FORT组。从既往一些研究来看,也有学者采用3 组分类法,通常以33%和66%分位值作为分组阈值[14-15]。虽然分组方式不同,但均证明高FORT 患者其窦卵泡对外源性FSH 具有更高的反应性,且与临床妊娠率呈正相关[15]。在本研究中,笔者发现,与低FORT 组患者相比,经相同剂量GnRH-a 降调节治疗后,高FORT 组FSH 水平低于低FORT 组,E2水平高于低FORT组,P 激素水平高于低FORT 组,这些激素水平的差异性改变反映了不同FORT 水平患者具有不同的卵巢反应性,高水平FORT 患者其降调节治疗效果更佳,更容易促进卵子成熟。汪银等[7]在子宫内膜异位症不孕症患者中发现类似的研究结果。从子宫内膜厚度角度来看,高FORT 组注射日子宫内膜厚度高于低FORT 组,更容易创造受精着床条件。而降调天数来看,高FORT 组降调天数少于低FORT 组,同样反映高水平FORT 患者降调节效率更高。从优质胚胎率及临床妊娠率角度来看,本研究中,高FORT 组患者优质胚胎率和临床妊娠率均显著高于低FORT 组患者,这与其他类型不孕症结果一致[5,16]。目前研究发现,高FORT 与hCG 注射日E2水平呈显著正相关,也与不孕症患者的获卵数、受精数呈正相关,与临床妊娠率呈显著正相关,这说明高FORT 状态有利于不孕症患者实施辅助生殖[17-18]。
综上所述,PCOS 不孕症患者高FORT 状态可以提高窦卵泡对外源性FSH 的反应性,提高优质胚胎率及临床妊娠率。以FORT 作为干预指标,通过提高患者的FORT 水平,可能会改善患者的卵巢潜能。如何提高FORT,改善不孕症患者妊娠结局值得未来进一步探索和研究。

