大肠杆菌过表达EutJ、EutG对庆大霉素的耐药性分析
翁嘉仪 俞丹丹 张裕丹 高媛媛

翁嘉仪,俞丹丹,张裕丹,等.大肠杆菌过表达EutJ、EutG对庆大霉素的耐药性分析[J].福建农业科技,2023,54(9):69-74.
收稿日期:2023-07-20
作者简介:翁嘉仪,女,1999年生,硕士研究生,主要从事细菌耐药研究。
*通信作者:高媛媛,女,1979年生,博士,副教授,主要从事细菌耐药机理及防治技术研究(E-mail:541175559@qq.com)。
基金项目:福建省自然科学基金面上项目(2020J01175)。
摘 要:为筛选新的耐药关键基因并研究其耐药机制以缓解细菌耐药难题。通过构建乙醇胺利用伴侣蛋白EutJ、醇脱氢酶EutG过表达菌株,对两株菌进行庆大霉素杀伤测试,以携带空质粒对数期野生型大肠杆菌的杀伤效果作为对照,进一步测定其最小抑菌浓度(MIC),并通过抑菌圈检测抗生素摄取等方法,对乙醇胺代谢与细菌耐受的关联进行研究。结果表明:过表达EutJ、EutG后大肠杆菌能通过降低菌体内抗生素浓度,以提高在庆大霉素杀伤条件下的存活率,证明eutJ、eutG基因可作为帮助细菌逃逸抗生素攻击的潜在耐受相关基因。因此,乙醇胺代谢关键酶EutJ、EutG有望成为免疫佐剂或新型抗生素研发的作用靶标。
关键词:乙醇胺利用伴侣蛋白EutJ;醇脱氢酶EutG;庆大霉素;耐药性
中图分类号:Q 93 文献标志码:A 文章编号:0253-2301(2023)09-0069-06
DOI: 10.13651/j.cnki.fjnykj.2023.09.011
Drug Resistance Analysis of the Overexpression of EutJ and EutG to Gentamicin
WENG Jia-yi, YU Dan-dan, ZHANG Yu-dan, GAO Yuan-yuan*
(Fujian University Key Laboratory of Cellular Stress Response and Metabolic Regulation/
College of Life Science, Fujian Normal University, Fuzhou, Fujian 350108, China)
Abstract: In order to screen the new drug-resistant key genes and study their drug resistance mechanisms to alleviate the problem of bacterial resistance, by constructing the overexpression strains of the ethanolamine-utilizing chaperone protein EutJ and the alcohol dehydrogenase EutG, the killing tests of gentamicin were performed on the two strains. Then, by taking the killing effect of the wild-type Escherichia coli carrying the empty plasmid in logarithmic phase as the control group, the minimum inhibitory concentration (MIC) was further determined, and the correlation between the ethanolamine metabolism and bacterial tolerance was studied through the detection of antibiotic uptake by inhibition zone. The results showed that after the overexpression of EutJ and EutG, Escherichia coli could reduce the concentrations of antibiotics in the bacteria to improve the survival rate under the condition of gentamicin killing, which proved that the genes of eutJ and eutG could be used as the potential tolerance-related genes to help the bacteria escape from the antibiotic attacks. Therefore, the key enzymes of ethanolamine metabolism, EutJ and EutG, were expected to be the targets for the development of immune adjuvants or new antibiotics.
Key words: Ethanolamine-utilizing chaperone protein EutJ; Alcohol dehydrogenase EutG; Gentamicin; Drug resistance
自1966年慶大霉素(Gentamicin)被我国王岳教授首次从小单孢菌中分离后,便广泛用于临床和兽医治疗[1]。庆大霉素属于氨基糖苷类抗生素,具有广谱抗菌性和速效杀菌性[2],但由于长期的不合理使用,导致耐药细菌(Antibiotic-resistant bacteria)的大量出现,这让庆大霉素的利用效率大大降低[3-4]。现已发现的耐药细菌有耐甲氧西林金黄色葡萄球菌(MRSA)[5]、耐万古霉素肠球菌(VRE)[6]、耐碳青霉烯鲍曼不动杆菌[7]、多重耐药铜绿假单胞菌[8]和多重耐药的大肠杆菌[9]。为缓解日益严重的细菌耐药问题,不仅需要研制能够应对的抗生素药物,同时还应筛选更多潜在的药物靶点[10-11]。已有研究发现涉及许多偶联反应的代谢途径是多重靶向抗生素的理想靶标,例如参与类异戊二烯生物合成及催化甾醇和大肠杆菌细胞壁生物合成后期阶段的酶是甲氧西林和万古霉素等抗生素的靶标[12]。乙醇胺(Ethanolamine, EA)以磷脂酰乙醇胺的形式存在,是大肠杆菌细胞膜的基本成分,同时作为重要的碳氮替代来源[13]。而乙醇胺利用伴侣蛋白EutJ、醇脱氢酶EutG在乙醇胺代谢中发挥着不可缺少的作用[14-17],因此推测其可作为大肠杆菌新耐药靶点。目前对EutJ、EutG与抗生素耐药性的研究较少,也未有证据表明这两种蛋白与细菌耐受性有直接关系,但有研究认为EutG活性对工程菌株中异丁醛向异丁醇的转化有关,并参与自然环境中四环素的降解[18-19]。
为探讨乙醇胺代谢与细菌耐药的关联问题,本研究通过使用pCA24N表达载体构建大肠杆菌乙醇胺代谢相关蛋白过表达菌株BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG),并与携带pCA24N空质粒的野生型大肠杆菌进行庆大霉素杀伤情况比较,以测试过表达EutJ、EutG菌株对庆大霉素耐受性的影响,经过测定最小抑菌浓度排除其为耐药菌后,进一步利用抑菌圈检测抗生素摄取方法检测EutJ、EutG过表达菌株的胞内抗生素浓度,以便深入了解乙醇胺代谢相关蛋白EutJ、EutG对大肠杆菌庆大霉素耐药性的影响,并挖掘了EutJ、EutG蛋白在细菌耐药方面的新功能,希望为研制抗生素基因抑制型佐剂提供有效的靶点。
1 材料与方法
1.1 试验材料
1.1.1 菌株与质粒 本试验所用菌株为实验室保藏野生型大肠杆菌BW25113,质粒载体为pCA24N。
1.1.2 试验仪器与试剂 试验仪器:超低温冰箱(-80℃)、恒温水平震荡摇床、凝胶琼脂电泳仪、SDS-PAGE电泳仪、凝胶成像仪、恒温培养箱(37℃)、高压灭菌锅、超净工作台、震荡涡旋仪、金属浴。试剂:庆大霉素(25 mg·mL-1)由ddH2O配置而成,氯霉素(35 mg·mL-1)用分析乙醇配制而成。以上抗生素储液均用0.22 μm滤膜过滤除菌后备用。考马斯亮蓝R250染料,6×Loading Buffer, 10% SDS,洗脱液。0.01 mol·L-1 PBS缓冲液(每1 L包含NaCl 8 g、KCl 0.2 g、Na2HPO4 1.42 g、KH2PO4 0.27 g)經过高温高压灭菌后使用,100 mg·mL-1溶菌酶用0.22 μm滤膜过滤除菌后备用。
1.1.3 培养基 LB培养基:每1 L包含氯化钠10 g、酵母粉5 g、蛋白胨10 g;MHB培养基(由北京索莱宝科技有限公司提供);LB固体培养基:LB固体培养基需在LB液体培养基中加入7.5 g琼脂后高温高压灭菌,在培养基温热时倒入无菌培养皿中,待凝固后备用。以上培养基均经过高温高压灭菌。
1.2 试验方法
1.2.1 大肠杆菌EutJ、EutG过表达菌株的构建 将实验室超低温冰箱保藏的ASKA文库中的带有pCA24N(eutJ)、pCA24N(eutG)的菌株JM109选取出来,划线至带有氯霉素抗性的平板中,于恒温培养箱培养16 h后,挑取带有pCA24N(eutJ)、pCA24N(eutG)的菌株单克隆进行菌落PCR,将PCR产物用1%琼脂凝胶电泳分离,并送样测序。待测序正确后,用EasyPure Plasmid MiniPrep Kit试剂盒提取质粒。在微融的野生型大肠杆菌BW25113感受态中加入2 μL提取的质粒,冰上静止30 min后,在预热充分的42℃金属浴上热激90 s,迅速放于冰上静止2 min,在EP管中加入1 mL LB后,放置摇床复苏1 h,将复苏后的菌液浓缩涂布于含有氯霉素的抗性板中,与37℃恒温培养基过夜培养后,挑取单菌落接种于LB,培养至平台期后保菌备用。
1.2.2 考马斯亮蓝染色法验证蛋白表达情况 将保藏的过表达菌株接种于新鲜LB,过夜培养至平台期后,以1∶100转接于含35 μg·mL-1 氯霉素的LB中,以220 r·min-1,37℃摇床培养至对数期OD600 0.45~0.55后,加入终浓度为1 mmol·mL-1的IPTG,摇床诱导30 min后,取500 μL菌液于1.5 mL EP管中,用12000 r·min-1离心2 min,彻底去除上清,加入25 μL 10% SDS溶液和25 μL Loading Buffer,震荡混匀后,于99.9℃金属浴煮样15 min,待样品澄清透明后,冷却至室温。将获得的蛋白样用15%的SDS-PAGE凝胶电泳进行分离。分离完成后用将胶切下考马斯亮蓝R250染色40 min,染色至蛋白分离胶呈深蓝色后,用洗脱液洗脱至清晰的蛋白条带出现。
1.2.3 EutJ、EutG过表达菌株对氨基糖苷类抗生素庆大霉素耐受性测验 将平台期BW25113-pCA24N(empty)、BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)接种于新鲜LB,以1∶100转接于含35 μg·mL-1 氯霉素的LB中,置于摇床培养至对数期OD600 0.45~0.55后,加入终浓度为1 mmol·mL-1的IPTG,摇床诱导30 min,取100 μL菌液于EP管中,12000 r·min-1离心去上清,加入同体积的0.01 mol·L-1 PBS缓冲液重悬作为对照样品备用。取诱导至OD600≈0.8的菌液1 mL于灭菌后的玻璃摇菌管。分别加入终浓度5 μg·mL-1庆大霉素,在处理时间1、2、3 h分别取100 μL菌液,12000 r·min-1离心去上清,加入同体积的0.01 mol·L-1 PBS缓冲液,充分混匀作为处理样品备用。将以上样品用PBS缓冲液10倍稀释后点板,吹干后放置37℃培养箱培养12 h后观察菌的生长状况。
1.2.4 EutJ、EutG过表达菌株对庆大霉素MIC测定 将庆大霉素用2倍稀释法在含氯霉素的MHB培养基中稀释成相应浓度(0、0.5、1、2、4、8、16、32 μg·mL-1),再分别取200 μL含庆大霉素MHB培养基按照浓度从小到大排列加入96孔板中备用。将平台期BW25113-pCA24N(empty)、BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)转接于新鲜MHB培养基中,摇床培养至对数期OD600 0.45~0.55,用1 mmol·mL-1 IPTG诱导30 min后,将得到的OD600≈0.8的菌液1∶5稀释,取2 μL稀释后的菌液加入对应的板孔中。将加样完毕的放置在37℃培养箱中,静置培养24 h后,用移液枪轻轻吹打菌液混匀,观察菌株在不同浓度抗生素条件下的生长情况。
1.2.5 EutJ、EutG过表达菌株胞内庆大霉素浓度测定 为测试BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)对庆大霉素耐受性是否是由于对抗生素的摄取减少导致的。首先将野生型BW25113培养至OD600≈0.3,用PBS稀释50后,取1 mL菌液均匀的涂布在含有固体LB培养基的10 cm×10 cm方型培养基上晾干备用。其次将BW25113-pCA24N(empty)、BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)培养至OD600≈0.5,加入终浓度为1 mmol·mL-1的IPTG诱导30 min后,取50 μL菌液离心去上清,再加入等体积的PBS缓冲液,震荡后点板在琼脂培养基上。另取2个1 mL诱导后的BW25113-pCA24N(empty)、BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)菌液于玻璃摇菌管中,在上述菌液中加入终浓度15、25 μg·mL-1 Genta置于37℃、220 r·min-1摇床处理1 h。同时取900 μL BW25113-pCA24N(empty)菌液于1.5 mL EP管中,12000 r·min-1、离心2 min,彻底去除上清,加入25 μL溶菌酶工作液,分别加入浓度梯度为20、30、40、50、60 μg·mL-1的庆大霉素,涡旋充分震荡后,放入摇床孵育1.5 h以制备标准品。待样品处理完毕,取50 μL菌液离心去上清,加入等体积PBS缓冲液,震荡后点板在琼脂培养基上。另取900 μL处理后菌液在EP管中,同上述方法离心彻底去除上清后,加入25 μL溶菌酶工作液,充分涡旋,放入摇床孵育1.5 h制成处理样品。将孵育后的标准品和处理样品,用液氮反复冻融3次,每次10 s,使细胞充分破碎。为使溶菌酶失活,需用90℃金属浴煮样10 min。最后,取5 μL孵育后的标准品和处理样品点在涂布过BW25113的方型培养基上。将点好样品的方型培养基置于37℃恒温培养箱过夜培养后观察出圈情况。
2 结果与分析
2.1 EutJ、EutG过表达菌株的构建
由图1可知,所构建的EutJ、EutG过表达菌株目的基因长度正确。由图2可知,目的片段eutJ、eutG基因测序结果与NCBI上大肠杆菌K-12 MG1655菌株eutJ、eutG基因一致。由图3可知,考马斯亮蓝染色结果显示BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)能够表达目的蛋白EutJ、EutG。综上结果表明EutJ、EutG过表达菌株构建成功。
2.2 过表达EutJ、EutG菌株对氨基糖苷类抗生素庆大霉素的耐受分析
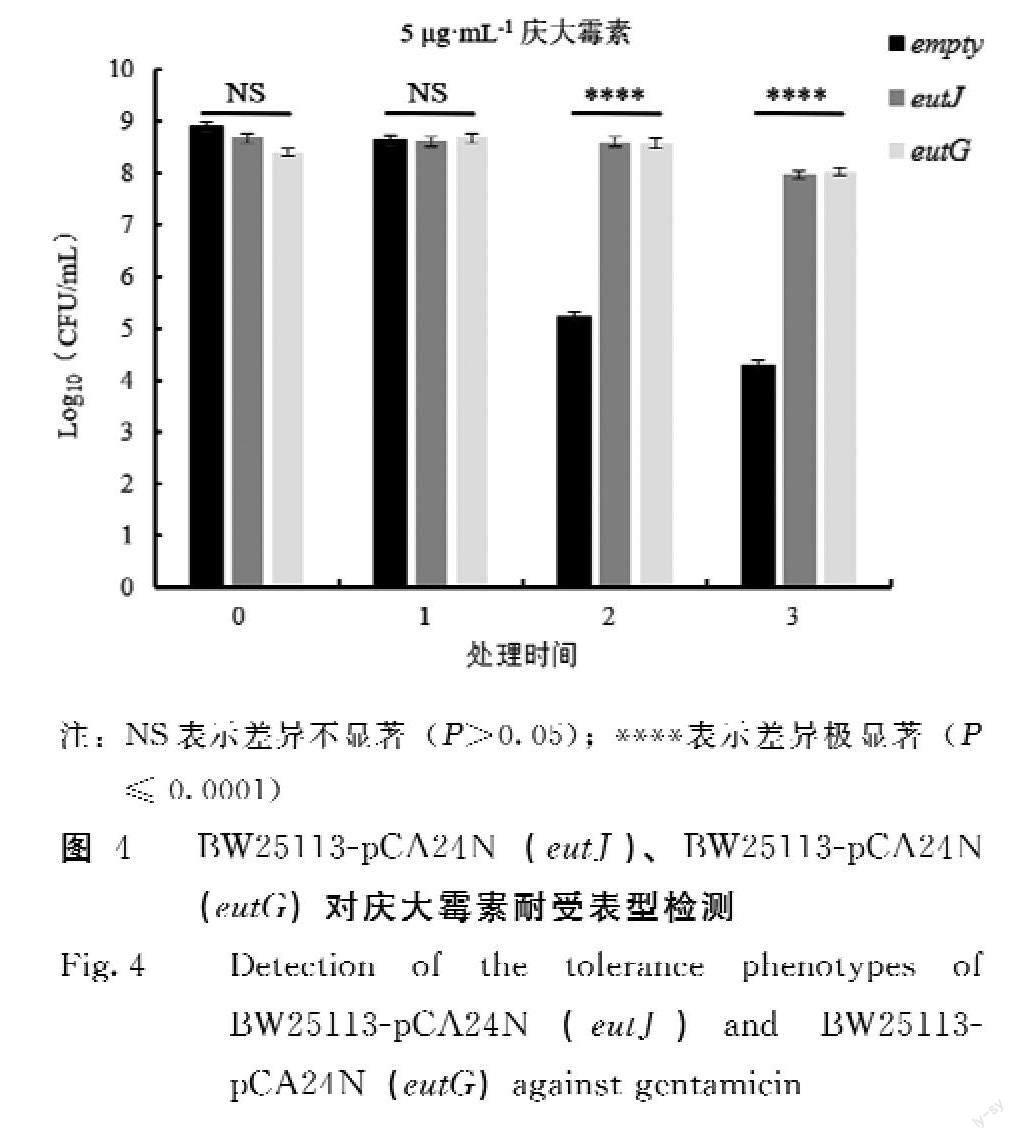
由图4可知,BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)在抗生素未处理时的菌量基本一致,用5 μg·mL-1 Genta处理1 h后菌量无显著差异,但处理2 h和3 h,相比于BW25113-pCA24N(empty),BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)存活菌量对比空质粒菌株高了4个数量级,呈现明显的耐受表型,差异极显著。结果表明,过表达EutJ、EutG能增加野生型大肠杆菌BW25113对庆大霉素的抵抗力。
2.3 EutJ、EutG过表达菌株对庆大霉素MIC测定
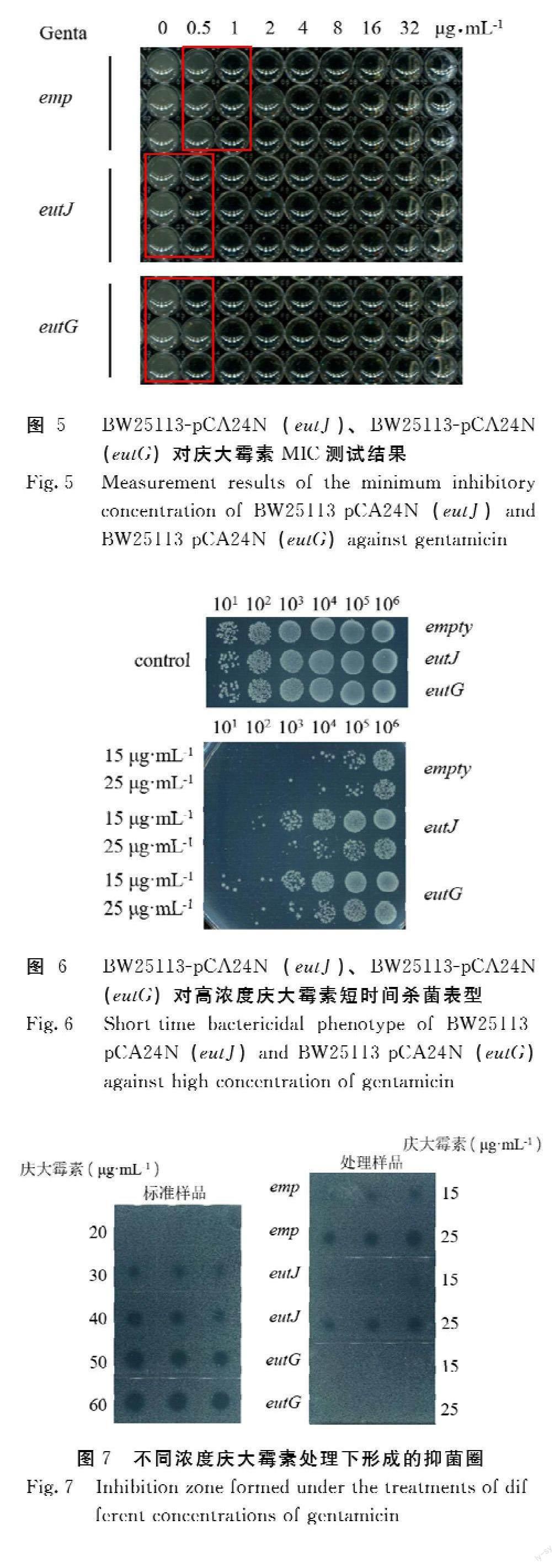
由图5可知,BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)对庆大霉素的MIC为0~0.5 μg·mL-1,并未高于对照组,由此说明BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)不属于耐药菌。
2.4 EutJ、EutG过表达菌株胞内庆大霉素浓度测定
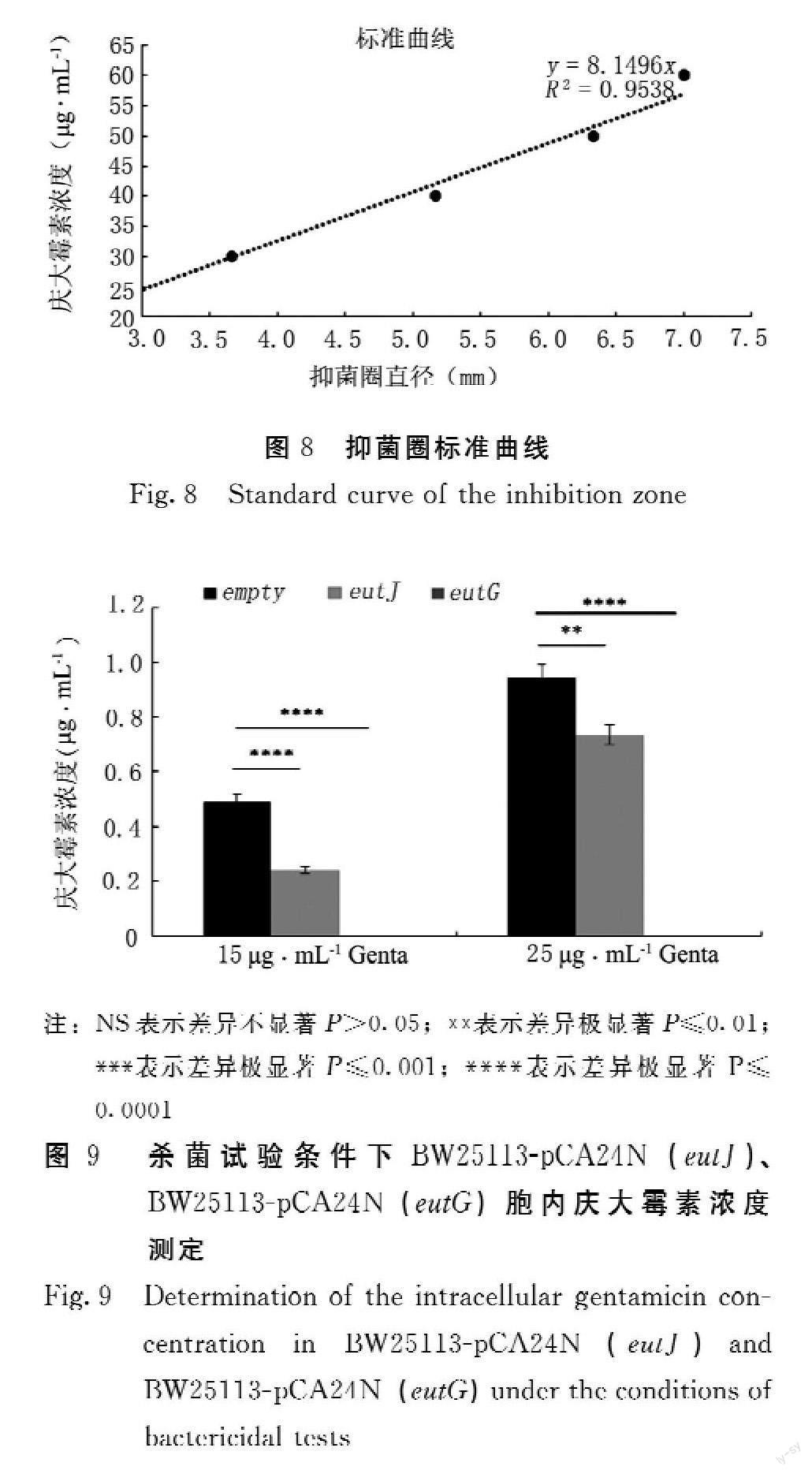
由图6可知,与BW25113-pCA24N(empty)相比,BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)在15、25 μg·mL-1 Genta处理1 h的杀菌条件下,细菌存活率高2~3个数量级。根据图7标准样品出圈直径绘制标准曲线如图8所示。将图7处理样品抑菌圈对应直径标准曲线可得到处理样品胞内抗生素浓度。由图9可知,BW25113-pCA24N(eutJ)、BW25113-pCA24N(eutG)相较于BW25113-pCA24N(empty)胞内庆大霉素含量减少。
3 结论与讨论
抗生素的发现为医疗、养殖、农业等领域带来了巨大的好处,但抗生素的滥用也导致耐药细菌的产生。因此,迫切需要开发新的抗生素以跟上细菌耐药的步伐。目前可以通过基于全细胞的表型筛选、基于靶标的筛选或基因筛选来识别新的可药用靶标和新类别的抗菌化合物[12]。
本研究通过表型验证得到对庆大霉素耐受的乙醇胺代谢相关基因eutJ、eutG,通过MIC测试过表达EutJ、EutG的MIC不改变,即未产生耐药菌。而研究表明,当细菌间歇性暴露于抗生素时,耐受性也可能在耐药性的演变中发挥关键作用[20]。因此筛选能够抑制这些耐受相关基因的靶向化合物显得格外重要。本研究结果发现,大肠杆菌过表达EutJ、EutG能通过降低胞内抗生素水平来抵抗殺伤,极端自然条件或人为造成的高浓度抗生素环境是否会造成EutJ、EutG表达量自主上调,而EutJ、EutG的上调是如何造成胞内抗生素水平含量降低,是否有其他导致庆大霉素耐受的机制,例如,抗生素外排增加、代谢途径变缓慢、ATP水平降低、活性氧水平降低等,有待进一步深入的探究。
参考文献:
[1]简心韵,邓子新,孙宇辉.氨基糖苷抗生素庆大霉素:基础研究的新进展及应用研究的新潜力[J].生物工程学报,2015,31(6): 829-844.
[2]WANG S,YANG Z,LIU Y,et al.Application of topical gentamicin-a new era in the treatment of genodermatosis[J].World journal of pediatrics,2021,17(6):568-575.
[3]姬书会,邱孜博.我国畜牧业中滥用抗生素的危害和对策[J].中国畜禽种业,2022,18(12):59-62.
[4]杨祎祎.畜禽养殖业抗生素滥用危害及预防措施[J].北方牧业,2023(14):6-7.
[5]WITTE W.Community-acquired methicillin-resistant Staphylococcus aureus: what do we need to know?[J].Clinical microbiology and infection,2009,15(7):17-25.
[6]POOLE T L,HUME M E,CAMPBELL L D,et al.Vancomycin-resistant Enterococcus faecium strains isolated from community wastewater from a semiclosed agri-food system in Texas[J].Antimicrobial agents and chemotherapy,2005,49(10):4382-4385.
[7]MUNOZ-PRICE L S,WEINSTEIN R A.Acinetobacter infection[J].The New England journal of medicine,2008,358(12):1271-1281.
[8]PATERSON D L.The epidemiological profile of infections with multidrug-resistant Pseudomonas aeruginosa and Acinetobacter species[J].Clinical infectious diseases,2006,43(2):43-48.
[9]PITOUT J D.Enterobacteriaceae that produce extended-spectrum β-lactamases and AmpC β-lactamases in the community:the tip of the iceberg?[J].Current pharmaceutical design,2013,19(2):257-263.
[10]KAKOULLIS L,PAPACHRISTODOULOU E,CHRA P, et al.Mechanisms of Antibiotic Resistance in Important Gram-Positive and Gram-Negative Pathogens and Novel Antibiotic Solutions[J].Antibiotics(Basel,Switzerland),2021,10(4):415.
[11]DHANDA G,ACHARYA Y,HALDAR J.Antibiotic Adjuvants:A Versatile Approach to Combat Antibiotic Resistance[J].ACS omega,2023,8(12):10757-10783.
[12]SILVER L L.Multi-targeting by monotherapeutic antibacterials[J].Nature reviews Drug discovery,2007,6(1):41-55.
[13]RANDLE C L,ALBRO P W,DITTMER J C.The phosphoglyceride composition of Gram-negative bacteria and the changes in composition during growth[J].Biochimica et biophysica acta,1969,187(2):214-220.
[14]HELD M,QUIN M B,SCHMIDT-DANNERT C.Eut bacterial microcompartments:insights into their function,structure,and bioengineering applications[J].Journal of molecular microbiology and biotechnology,2013,23(4/5):308-320.
[15]HELD M,KOLB A,PERDUE S,et al.Engineering formation of multiple recombinant Eut protein nanocompartments in E.coli[J].Sci Rep,2016,6:24359.
[16]KOFOID E,RAPPLEYE C,STOJILJKOVIC I,et al.The 17-gene ethanolamine(eut)operon of Salmonella typhimurium encodes five homologues of carboxysome shell proteins[J].Journal of bacteriology,1999,181(17):5317-5329.
[17]KAVAL K G,GARSIN D A.Ethanolamine Utilization in Bacteria[J].mBio,2018,9(1):e00066-18.
[18]SHAO S,HU Y,CHENG J,et al.Biodegradation mechanism of tetracycline(TEC)by strain Klebsiella sp.SQY5 as revealed through products analysis and genomics[J].Ecotoxicology and environmental safety,2019,185:109676.
[19]RODRIGUEZ G M,ATSUMI S.Isobutyraldehyde production from Escherichia coli by removing aldehyde reductase activity[J].Microbial cell factories,2012,11:90.
[20]ZHOU Y,LIAO H,PEI L,et al.Combatting persister cells:The daunting task in post-antibiotics era[J].Cell insight,2023,2(4):100104.
(責任编辑:林玲娜)

