产脂肪酶菌株的筛选及鉴定
陈美莲 白睿璇 林琳

陈美莲,白睿璇,林琳.产脂肪酶菌株的筛选及鉴定[J].福建农业科技,2023,54(9):63-68.
收稿日期:2023-08-20
作者简介:陈美莲,女,1987年生,博士,助理研究员,主要从事微生物学分子生物方面研究。
基金项目:福建省教育厅中青年教师教育科研项目(JAT190627);福建省自然科学基金项目(2020J05177)。
摘 要:为了挖掘更多的产脂肪酶菌种资源,通过橄榄油平板检测(透明圈观察),采用高通量从海水、滩涂泥壤以及滨海植物分离筛选了324株真菌菌株,在pH 9.4的平板上筛选获得了48个候选产脂肪酶菌株;经ITS序列分析,初步鉴定了其中的12个菌株,分别为镰刀菌、青霉属、枝孢菌、交链孢属等,其中多数为枝孢属和青霉属;进一步利用氢氧化钠滴定法检测其中2个菌株(#89和#260)培养24 h的发酵液,#89菌株产生的脂肪酶酶活为(6.92±2.40)U·mL-1,#260菌株产生的脂肪酶酶活为(7.67±1.70)U·mL-1。
关键词:脂肪酶;菌株资源;ITS序列;筛选
中图分类号:Q 936 文献标志码:A 文章编号:0253-2301(2023)09-0063-06
DOI: 10.13651/j.cnki.fjnykj.2023.09.010
Screening and Identification of Lipase-producing Strains
CHEN Mei-lian1,2, BAI Rui-xuan1, LIN Lin1,2
(1. College of Materials and Chemical Engineering, Minjiang University, Fuzhou, Fujian 350108,
China; 2. Institute of Oceanography, Minjiang University, Fuzhou, Fujian 350108, China)
Abstract: In order to explore more lipase-producing strain resources, 324 fungal strains were isolated and screened from the plants in seawater, coastal wetland & mud soil and coastal areas by high throughput through the olive oil plate detection (transparent circle observation). Forty-eight candidate lipase-producing strains were screened on the plate with pH 9.4. Through the ITS sequence analysis, 12 strains were preliminarily identified as Fusarium, Penicillium, Cladosporium, Alternaria, etc., most of which were Cladosporium and Penicillium. The fermentation broth of the two strains (#89 and #260) cultured for 24 h was further detected by using the titration method of sodium hydroxide. The lipase activity produced by #89 strain was (6.92±2.40) U·mL-1, and the lipase activity produced by #260 strain was (7.67±1.70) U·mL-1.
Key words: Lipase; Strain resources; ITS sequence; Screening
脂肪酶(Lipase,EC3.1.1.3),即三酰基甘油酰基水解酶,是一類特殊的酯键水解酶,可催化水解、酯化、酯交换、对映体拆分等多种化学反应[1]。与化学催化剂相比,脂肪酶催化的反应具有低能耗、选择性好和转化率高等优点,被广泛应用于洗涤工业、食品加工、医药和化妆品生产、生物能源合成和皮革加工等多个工业领域[2-3]。
微生物脂肪酶种类多、作用温度和pH值范围广泛、稳定性和活性均较高、且对底物纯度要求不严、便于工业生产和获取,是工业脂肪酶的主要来源。据统计,2018年微生物脂肪酶的市场消费约为4.25亿美元,预计到2023年将达到5.902亿美元[4]。随着高效筛选技术和基因工程、蛋白质工程技术的应用,目前已有不少微生物脂肪酶实现了商业化生产[5]。我国虽也很早开始开展对脂肪酶的研究开发,但目前已实现工业化生产的菌种种类少、产量低,多数企业还是依赖昂贵的进口脂肪酶,因此,挖掘新的或质量更优的脂肪酶产生菌种具有重要研究意义。目前常用的产脂肪酶菌株的初筛方法主要有:以溴甲酚紫为指示剂的油脂平板筛选法、以罗丹明 B为指示剂的平板筛选法、三丁酸甘油酯平板透明圈法、以橄榄油乳化液为底物的平板透明圈法等,通过以上方法,越来越多的产脂肪酶菌株被筛选获得[6-10]。而ITS序列,指真菌5.8S、18S和28S rDNA序列之间的转录间隔(Internal Transcribed Spacer),在自然中变异较快,在绝大多数真菌中表现出序列多态性,且其序列片段较小,易于分析,故被广泛用于快速鉴定各种真菌[11]。
筛选不同来源的脂肪酶产生菌是脂肪酶研究的基础,特别是一些极端环境或特殊生境中的产脂肪酶菌种具有重大开发潜力。生活在海水、滩涂泥壤以及滨海植物中的微生物,因其特殊的生境,具有更高的耐盐性、耐碱性等抗逆性,同时也可能具有更好的酶学特性。因此,本研究以橄榄油为底物,通过橄榄油平板检测(透明圈观察),采用高通量从海水、滩涂泥壤以及滨海植物分离筛选324株真菌菌株,在pH 9.4的碱性平板上初步获得候选脂肪酶产生菌,并通过ITS序列分析鉴定了其中的12个菌株,研究结果可为后期的脂肪酶酶学性能改造研究(如产酶最适条件优化、作用条件改进等)提供基础数据,从而拓展微生物脂肪酶的应用价值。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 海洋生物与药物福建省高校工程研究中心从海水、滩涂泥壤以及滨海植物中分离得到的真菌(共324株),并以菌丝块置于无菌水(含20%甘油)中,于-20℃冻存。
1.1.2 主要药品及试剂 PDA预制粉末(主要成分为马铃薯浸粉6 g·L-1、葡萄糖20 g·L-1、琼脂 20 g·L-1,青岛高科园海博生物技术有限公司),橄榄油、氢氧化钠、氯化钾、异丙醇(分析纯,国药集团化学试剂有限公司),聚乙烯醇124型、甘氨酸(上海麦克林生化科技股份有限公司),Taq PCR Mix、DNA Marker[天根生化科技(北京)有限公司];引物由北京擎科生物科技股份有限公司合成。
1.1.3 试验仪器 电热恒温水浴锅(上海精宏实验室设备公司)、匀浆机(江苏东鹏科技有限公司)、超净工作台(苏净集团苏州安泰空气技术有限公司)、智能光照培养箱(宁波赛福实验仪器有限公司)、多样品组织研磨仪(上海净信实业发展有限公司)、台式离心机(艾本德中国有限公司)、微量紫外分光光度计(赛默飞世尔科技公司)、基因扩增仪(北京东胜创新生物科技有限公司)、凝胶成像仪(上海天能科技有限公司)、pH计(德国赛多利斯公司)等。
1.2 试验方法
1.2.1 菌株的活化与培养 在无菌条件下,切取一小块供试菌株的菌丝块,转接至新的PDA固体培养基平板上进行活化,于恒温培养箱中,28℃、黑暗、倒置培养3~5 d,拍照记录供试菌株的菌落形态。
1.2.2 橄榄油固体平板制作 量取适量橄榄油与2倍体积的4%聚乙烯醇混匀,匀浆器高速搅拌使之乳化;在缓冲液(不同pH值)中加入2%琼脂,加热融化后与适量的橄榄油乳化液(5%)混勻,制成厚度约为2 mm的橄榄油固体平板,用打孔器等距离打孔(孔径为2 mm)。
1.2.3 产脂肪酶菌株的平板筛选 用无菌牙签挑取一小团上述活化培养的供试菌株的气生菌丝,转接至橄榄油固体平板的孔中,于恒温培养箱中,28℃、黑暗、正置培养1~5 d,在此期间,每天观察并记录透明圈的形成情况,并拍照;有透明圈形成的菌株即为候选脂肪酶产生菌。
1.2.4 候选产脂肪酶菌株的基因组DNA的快速提取 于1.5 mL无菌离心管中,加入少量石英砂,及420 μL提取缓冲液(1 mol·L-1 KCl),切取适量菌丝块(约5 cm×7 cm)于上述离心管中,利用多样品组织研磨仪进行组织破碎,65 Hz振荡2 min,之后12000 r·min-1,离心10 min;吸取200 μL上清液至新的离心管中,加入0.6倍体积(即120 μL)的异丙醇,上下颠倒混匀,于-20℃冷冻1 h以上,使DNA沉淀;之后12000 r·min-1,离心10 min,弃上清液;用70%乙醇洗涤1次,12000 r·min-1,离心5 min后,弃乙醇,室温下静置5~10 min,待酒精挥发之后,加入60 μL无菌水,溶解DNA;样品保存于4℃冰箱。
1.2.5 候选产脂肪酶菌株的ITS序列扩增、测序分析 按上述步骤提取候选菌株的基因组DNA,利用ITS序列通用引物(ITS1:5′CTTGGTCATTTAGAGGAAGTAA 3′,ITS4:5′TCCTCCGCTTATTGATATGC 3′)进行PCR扩增,取少量产物进行凝胶电泳验证,确认有条带后,再将所得PCR产物送公司(生工生物)测序,最后通过NCBI的Blast功能(https://blast.ncbi.nlm.nih.gov/Blast.cgi),将上述测序所得的样品ITS序列与数据库(如GenBank)中已知序列进行比对分析。
1.2.6 产脂肪酶菌株发酵的粗酶液制备 为进一步检测候选菌株所产脂肪酶的活性,无菌条件下将上述获得的候选产脂肪酶菌株接种于发酵培养基[橄榄油乳化液10
mL·L-1,( NH4)2SO4 1 g·L-1,K2HPO4 1 g·L-1,MgSO4·7H2O 1 g·L-1,NaCl 0.5 g·L-1,蛋白胨20 g·L-1,蔗糖5
g·L-1,自然pH]中,28℃、180 r·min-1培养24~48 h,离心收集上清液,即为粗酶液。
1.2.7 氢氧化钠滴定法检测粗酶液中脂肪酶活力 将橄榄油乳化液与0.1 mol·L-1 Gly-NaOH(pH 9.4)缓冲液1∶3混合乳化后吸取8 mL于烧杯中37℃水浴5 min,加入50 μL 粗酶液后立即计时,反应10 min后将其放入95℃水浴中温浴5 min终止反应,取出反应液后常温放置2 min,再用pH计测量初始pH,用0.02 mol·L-1 NaOH滴定反应液至pH=10,记录消耗NaOH体积,根据消耗的碱量计算其酶活力。
酶活(U·mL-1)=40×(V1-V2)×n÷t其中,V1为待测样品消耗的NaOH体积(mL);V2为空白对照消耗的NaOH体积(mL);n为稀释倍数;t为酶作用时间。
2 结果与分析
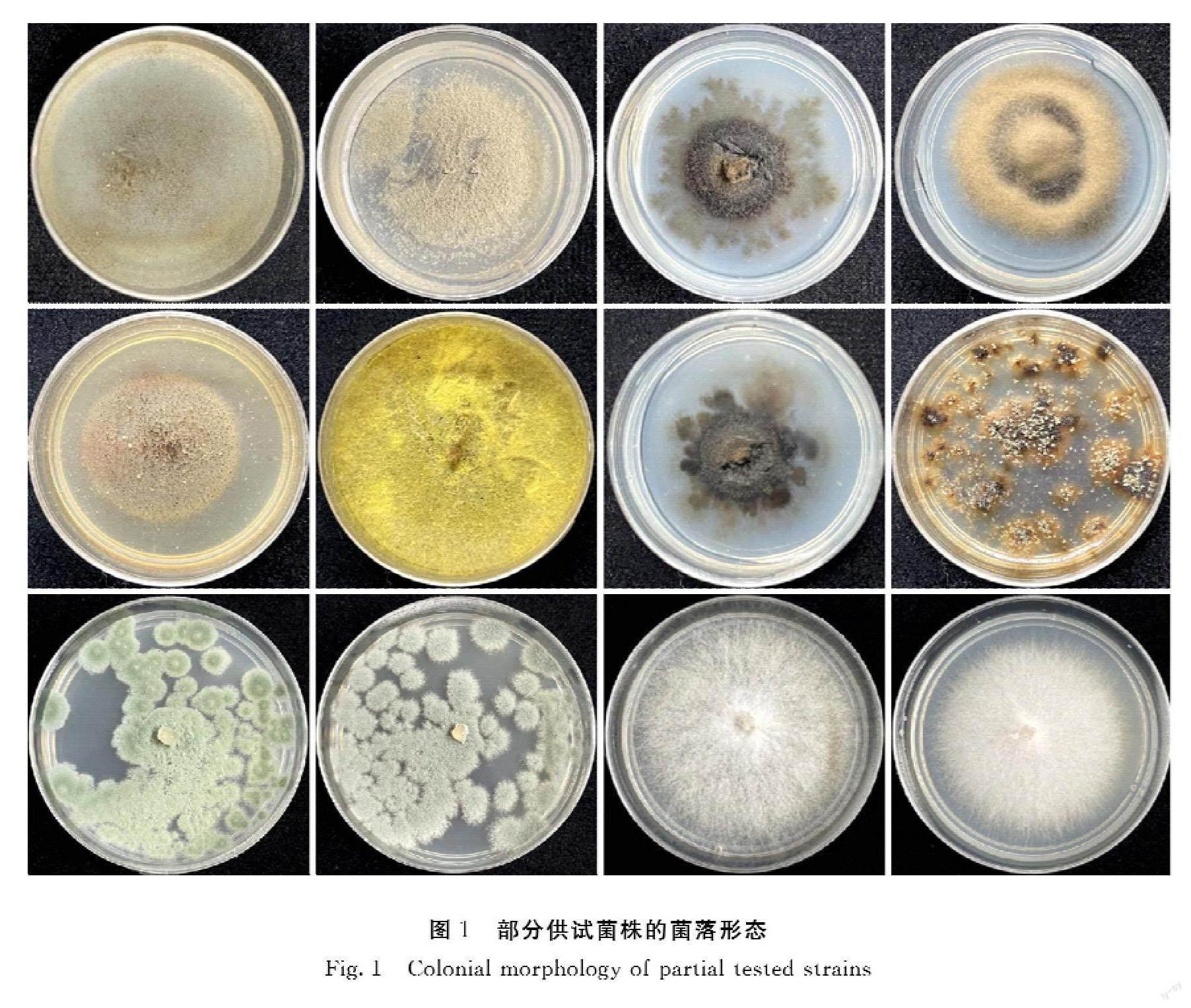
2.1 供试菌株的菌落形态观察
由图1可知,供试菌株的菌落形态各异,说明待测菌株比较多样化。
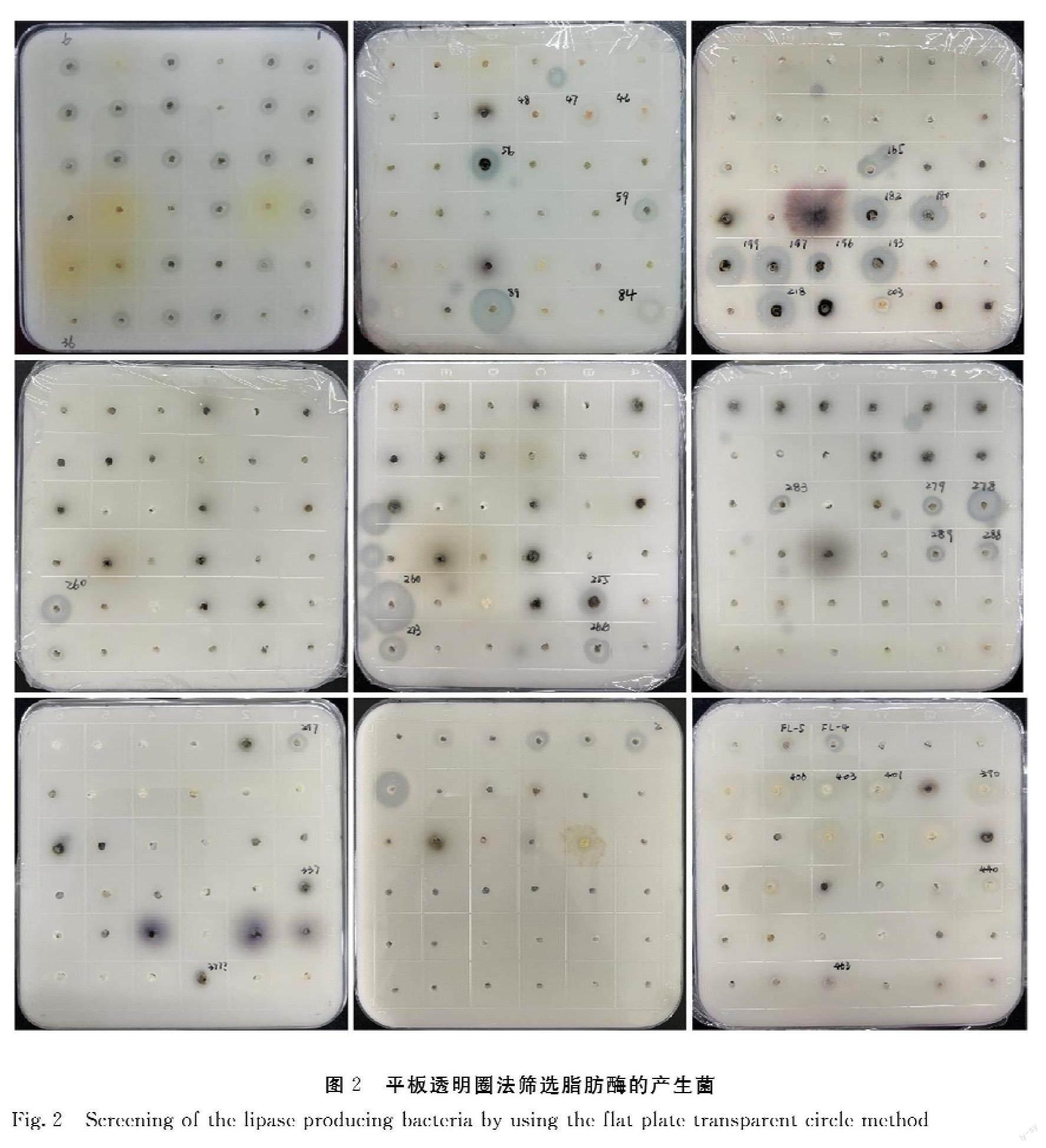
2.2 产脂肪酶菌株的筛选
采用橄榄油固体检测平板筛选324株真菌菌株。由图2可知,在碱性(pH 9.4)的检测板中,有多个菌株(共48个)可形成透明圈,且透明圈大小不一(直径为0.5~1.2 cm),以上结果说明这些候选菌株为碱性脂肪酶产生菌,且产生的脂肪酶活性强弱不一。
2.3 候选产脂肪酶菌株的鉴定
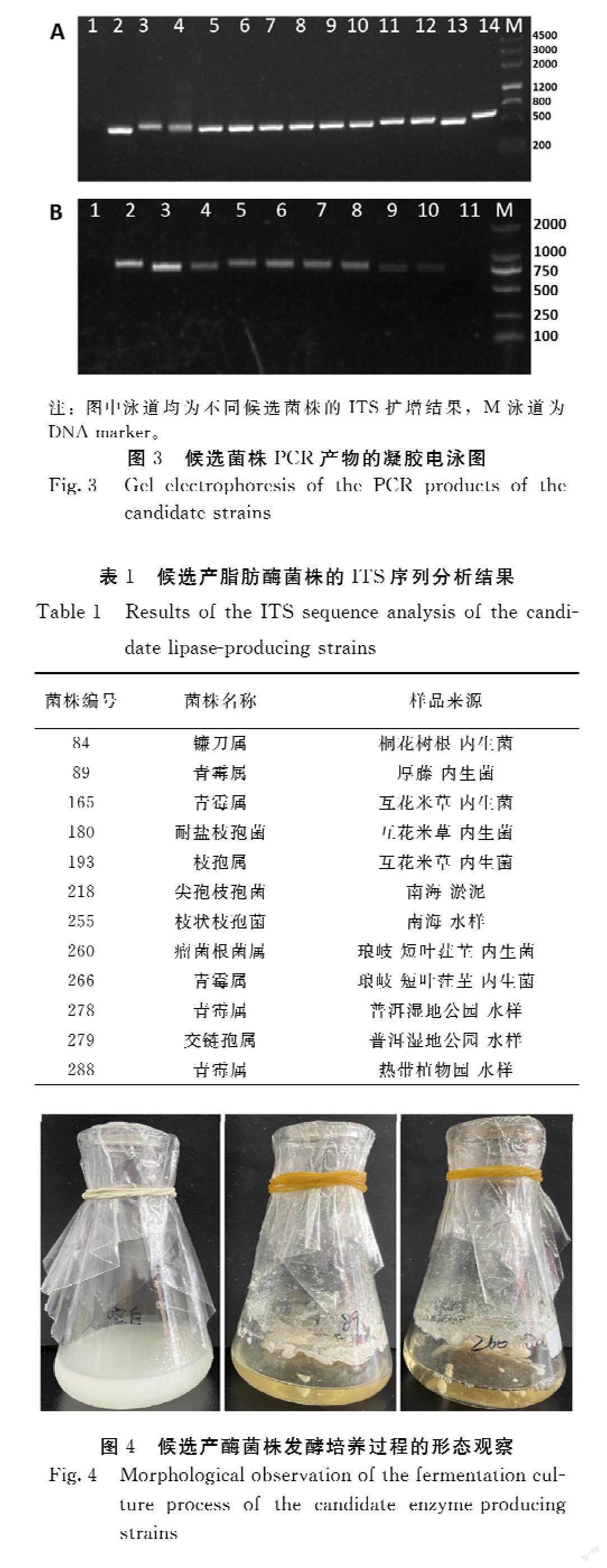
2.3.1 ITS序列扩增与测序 ITS序列扩增的凝胶电泳结果(图3)显示,所检测的样品均是在750 bp左右有1条特异的条带,符合ITS序列的特征,表明后续可直接将PCR产物送公司进行测序分析。
2.3.2 测序结果比对分析 由表1可知,ITS序列分析结果显示,所检测的12个候选产脂肪酶菌株分别有镰刀菌、青霉、枝孢菌、交链孢属等,主要鉴定到属,其中多数为枝孢属和青霉属。
2.3.3 脂肪酶活力测定 由图4可知,所检测的2个产酶菌株(#89、#260)在培养过程中,发酵培养液逐渐变清澈,推测是培养液中酶的底物(橄榄油乳化物)被消耗减少造成的,进一步说明了这两个菌株产生的脂肪酶具有一定的活性。
由表2可知,在培养24 h所得的粗酶液中,#89菌株产生的脂肪酶酶活为(6.92±2.40)U·mL-1,#260菌株产生的脂肪酶酶活为(7.67±1.70)U·mL-1。橄榄油平板检测结果显示,所得粗酶液在平板上均能诱导透明圈产生,且#89的透明圈更大一些,但滴定结果是#260的酶活更高,推测可能跟碱滴定法的不稳定性以及菌株本身的产酶条件、作用pH范围、作用温度等有关,后续将通过其他试验进一步验证。
3 结论与讨论
本研究利用橄榄油平板透明圈法筛选,初步获得了多个碱性产脂肪酶菌株,这些菌株主要来自海水、滩涂泥壤以及滨海植物中分离的真菌;进一步通过ITS序列分析,初步鉴定了其中的12个产酶菌株,多数为枝孢属和青霉属。后续将通过以下试验进一步鉴定菌种及其产生的脂肪酶的酶学性能:一是观察形态学特征,根据《常见与常用真菌》鉴别[12];二是根据ITS序列比对结果,进一步构建目标菌株的ITS rDNA系统发育树[13-14];三是通过單因素试验和正交试验确定产酶条件[15];四是结合平板检测和对硝基苯酚法分析目标脂肪酶的酶学性质,以及不同条件对其活力、稳定性的影响等[16-17]。
相较于传统的化学催化剂,脂肪酶具有高度的催化特异性,其带来的副反应较少,对提升产物的品质有很好的作用。工业用脂肪酶大多来源于微生物,但由于天然微生物来源的脂肪酶的作用条件、稳定性等无法满足诸多生产的实际需求,因此,国际范围内工业上应用的脂肪酶主要是通过分子改造而获得的具有优良特性的工程菌生产的。目前,丹麦的诺和诺德公司、美国的杜邦公司、荷兰皇家帝斯曼集团以及丹麦的汉森公司是全球脂肪酶的主要供应商(http://www.marketsandmarkets.com, 2020)。近几年,国内在微生物产脂肪酶菌种的筛选、发酵条件的优化、基因工程及蛋白质工程改造等方面,均有深入研究并取得了一定的成果,但尚未见其大量应用于生产的相关报道。因此,挖掘更多酶活力高、产量高和成本较低的脂肪酶产生菌,或是运用已有的和开发新的技术去改良已知脂肪酶的酶学特性,均有利于提高微生物脂肪酶的应用前景,帮助其实现商业价值。
参考文献:
[1]ACTION D L.Lipase pancréatique sur les esters en emulsion[J].Biochimica et Biophysica Acta,1958,30(3):513-521.
[2]SHARMA R,SHARMA N.Microbial lipase mediated by health beneficial modification of cholesterol and flavors in food products: A review[J].Recent Pat Biotechnol,2018,12(2):81-91.
[3]GOPINATH S C,ANBU P,LAKSHMIPRIYA T,et al.Strategies to characterize fungal lipases for applications in medicine and dairy industry[J].Biomed Res Int,2013:154549.
[4]PREM C,ENESPA,RANJAN S,et al.Microbial lipases and their industrial applications: A comprehensive review[J].Microbial Cell Factories,2020,19(69):DOI:10.1186/s12934-020-01428-8.
[5]PATEL N,RAI D,SHIVAM,et al.Lipases:Sources,production, purification,and applications[J].Recent Pat Biotechnol.2019,13(1):45-56.
[6]王乐,刘松,尹艳丽,等.一株酸性脂肪酶高产菌株的筛选与鉴定[J].食品安全质量检测学报,2017,8(12):4509-4515.
[7]蒋翠翠,尚昊,张素芳,等.产脂肪酶菌株的筛选、酶学特性及其接种对酸肉风味物质的影响[J].食品科学,2023,44(10):106-113.
[8]RABBANI M,BAGHERINEJAD M R,SADEGHI H M,et al.Isolation and characterization of novel thermophilic lipase-secreting bacteria[J].Braz J Microbiol,2014,44(4):1113-1119.
[9]GRIEBELER N,POLLONI A E,REMONATTO D,et al.Isolation and screening of lipase-producing fungi with hydrolytic activity[J].Food and Bioprocess Technology,2011,4(4):578-586.
[10]SADATI R,BARGHI A,ABBASI L R.Isolation and screening of lipolytic fungi from coastal waters of the southern caspian sea(north of Iran)[J].Jundishapur J Microbiol,2015,8(4):e16426.
[11]陳剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785-37863792.
[12]中国科学院微生物研究所.常见与常用真菌[M].北京:科学出版社,1978.
[13]郭威,郭晓军,袁洪水,等.高效脂肪酶产生真菌的筛选、鉴定及产酶条件优化[J].饲料工业,2013(4):6.
[14]KANTAK J B,BAGADE A V,MAHAJAN S A, et al.Isolation, identification and optimization of a new extracellular lipase producing strain of Rhizopus sp[J].Appl Biochem Biotechnol,2011,164(7):969-978.
[15]吴子君,陈思沅,杜昭君,等.产脂肪酶菌株的筛选、鉴定及产酶条件优化[J].河南工业大学学报(自然科学版),2021,42(6):10-16.
[16]郝文惠,王凡羽,郭玉,等.南极深海沉积物中产低温脂肪酶菌株的筛选与基因克隆[J].应用海洋学学报,2014,(3):306-311.
[17]MEHTA A,KUMAR R,GUPTA R.Isolation of lipase producing thermophilic bacteria:optimization of production and reaction conditions for lipase from Geobacillus sp[J].Acta Microbiol Immunol Hung,2012,59(4):435-450.
(责任编辑:林玲娜)

