稻瘟病对常香粳1813产量和大米品质的影响
陶菊红,李亚娟,季向东,张 涛
(1.常熟市农业科学研究所,江苏 常熟 215500; 2.常熟理工学院端木银熙水稻育种研究推广中心,江苏 常熟 215500; 3.常熟市农业技术推广中心,江苏 常熟 215500)
水稻是世界上最重要的粮食作物之一,然而,水稻生产受到稻瘟病(rice blast)、纹章枯萎病(sheath blight)、白叶枯病(bacterial blight)和病毒性疾病等各种疾病的制约[1],其中稻瘟菌引起的稻瘟病是影响水稻可持续生产最致命的疾病之一[2]。全世界超过85个国家发现有稻瘟病菌危害,每年因稻瘟病而造成了全球约30%的水稻产量损失,相当于可以养活6000万人[3-4]。
稻瘟菌是一种子囊菌真菌,病变主要发生在叶领、茎秆、茎秆节、穗颈节,严重影响水稻产量和品质[5-7]。对孟加拉国3个芳香水稻品种穗颈瘟感染的研究显示籽粒不育率提高,籽粒大小和产量下降,而且种子产量和质量的下降程度与感染病菌的严重程度呈正相关[8]。育种过程中,抗性水稻品种的选育和栽培是控制稻瘟病菌感染和稳定产量最有效方法[9],比如中国水稻研究所应用分子标记辅助筛选技术将Pita、Pib和Pid2导入高感品种盐丰47中,选育出高抗品种盐粳144,其产量和外观品质明显提高[10]。尽管稻瘟病菌感染会危害水稻产量已经成为共识,且科学家们利用现代分子育种手段导入稻瘟病抗性基因改良优良水稻种质资源的经验逐渐成熟,但稻瘟病菌对大米品质尤其是食味品质的影响报道较少。
常香粳1813是优良食味中熟晚粳,是常熟市农业科学研究所2020年通过江苏省审定品种,具有良好的应用前景。本研究通过对常香粳1813基因组稻瘟病抗性基因鉴定,并对其孕穗期幼穗进行稻瘟病菌接种试验,检测成熟期种子千粒重、长宽比,以及大米加工品质、食味品质各参数变化情况,分析稻瘟病菌感染对种子生产和大米品质的影响,进而为抗病育种和优质稻米品种的选育和推广提供数据参考。
1 材料与方法
1.1 供试材料
本研究所用的种质材料为常香粳1813,是常熟市农业科学研究所选育品种,对照组和试验组于2022年种植于常熟市农业科学研究所水稻育种创新基地,统一水肥管理。
1.2 试验设计
为了研究稻瘟病菌感染后对种子产量和大米品质的影响,对孕穗期的常香粳1813进行了稻瘟病菌(江苏省内稻瘟病菌优势小种的代表菌株混合液)接种试验。接种后50 d,空白对照组种子成熟。收取试验组(接种稻瘟病菌)和空白对照组叶片、稻穗进行观察以及种子千粒重、长、宽等参数分析;随后对试验组和对照组谷粒进行了糙米、精米加工,对两者糙米率、整精米率、垩白率、垩白度等相关参数进行了分析;最后检测了试验组和对照组大米的总蛋白、总脂肪、总淀粉和直链淀粉的含量,探索稻瘟病感染对常香粳1813大米食味的影响。
1.3 基因组测序和分析
用常香粳1813的幼苗进行了全基因组测序(安诺基因,北京),开展了生物信息学分析,对其所有基因进行了组装和基因注释(烈冰生物,上海)。
1.4 稻瘟病菌接种和抗性水平评价
常香粳1813试验组和对照组稻瘟病菌接种和抗性评价方法参考文献[11]。
1.5 千粒重测定
谷粒千粒重、长、宽、长宽比均通过SC-G型考种及千粒重自动分析仪(万深,杭州)进行测定,每个测定重复5组。
1.6 稻米品质分析
利用大米外观品质检测分析仪(万深,杭州)分析大米的外观品质和加工品质,包括长宽比、垩白粒率、垩白度、糙米率、精米率。糙米率和精米率的分析参照国家标准GB/T5495-2008《稻谷出糙率检验》和GB/T 21719-2008《稻谷整精米率检验法》。
1.7 稻米总蛋白含量测定
称取精米粉沫(60目筛)试样0.2 g左右,置于100 mL消煮管中(勿将样品黏附在瓶颈上)。加入5 mL浓硫酸,轻轻摇匀并放置数小时。加入适量双氧水,在管口放一弯颈小漏斗,在消煮炉上380℃消煮。1 h取下稍冷,加双氧水 1 mL,重复2~3次,消煮到溶液呈无色或清亮后,再加热5~10 min,以除尽剩余的双氧水。将消煮管取下至冷却,并用少量水冲洗弯颈漏斗,洗液流入消煮管。将消煮液无损的洗入50 mL容量瓶中,混匀待测。另外做3个空白。
蒸馏前配制好氢氧化钠、硫酸标准液、混合指示剂,对定氮仪进行充分预热,进行空蒸馏清洗管道,直至读数稳定。吸取上述待测液5.00 mL,注入凯氏定氮仪(沛欧,上海)蒸馏管中,参数设置后,对待测液进行测定。
样品中蛋白质含量可根据公式计算:
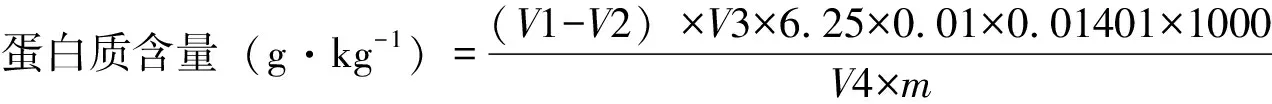
注:V1为滴定体积(mL);V2为空白滴定体积(mL);V3为消解定容体积(mL);6.25为氮换算成蛋白质的平均系数;0.01为硫酸标准溶液浓度(mol·L-1);0.01401为每毫克当量氮的克数;V4为取液体积(mL);M为样品质量(g)。
1.8 稻米总脂肪含量测定
称取精米粉末(60目筛)试样2~5 g,准确至0.001 g,全部移入滤纸筒内。将滤纸筒放入索氏抽提器(菲跃,杭州)的抽提筒内,连接已干燥至恒重的接收瓶,由抽提器冷凝管上端加入无水乙醚或石油醚至瓶内容积的2/3处,于水浴上加热,使无水乙醚或石油醚不断回流抽提(6~8次·h-1),一般抽提6~10 h。提取结束时,用磨砂玻璃棒接取1滴提取液,磨砂玻璃棒上无油斑表明提取完毕。称量取下接收瓶,回收无水乙醚或石油醚,待接收瓶内溶剂剩余1~2 mL时在水浴上蒸干,再于(100±5)℃干燥1 h,放干燥器内冷却0.5 h后称量。重复以上操作直至恒重(直至两次称量的差不超过2 mg)。
样品中粗脂肪含量可根据公式计算:
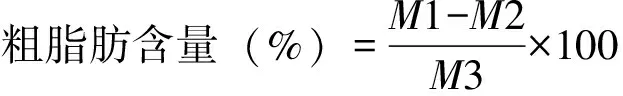
注:M1为烘干后总质量(g);M2为空瓶质量(g);M3为样品质量(g)。
1.9 稻米总淀粉含量测定
取干净的15 mL离心管,称约50 mg干样(60目),准确至0.001 g,加2 mL 80%乙醇,混匀,70℃放置2 h,其间涡旋混匀,取出冷却至室温。加2 mL去离子水,混匀,12000 r·min-1离心10 min,弃上清。加4 mL 80%乙醇,混匀,12000 r·min-1离心10 min,弃上清,重复2次。加入2 mL 2 mol·L-1氢氧化钾,用手将离心管上下颠倒混匀,置于冰上摇20 min。加入8 mL 1.2 mol·L-1的醋酸钠缓冲溶液(pH=3.8),涡旋均匀。加入0.1 mL耐热α-淀粉酶,再加入0.1 mL淀粉葡糖苷酶,涡旋均匀,置于50℃水浴锅中,孵育30 min,其间间断涡旋均匀。用蒸馏水将0.1 mL样品稀释至1 mL,取液体0.05 mL至新的EP管中,加入1.5 mL GOPOD试剂,涡旋混匀,于50℃下孵育20 min。同时取0.05 mL葡萄糖标准溶液,加入1.5 mL GOPOD试剂,50℃反应20 min,510 nm处测定吸光度。
样品中总淀粉含量可根据以下公式计算:
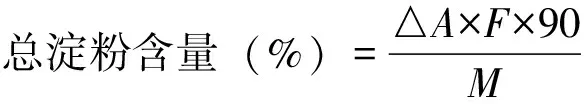
注:ΔA为样品OD值减去空白OD值;F为葡萄糖的OD值;M为样品质量;90为换算系数。
1.10 稻米直链淀粉含量测定
取干净的15 mL离心管,称取适量样本(约10 mg)。加入100 μL 95%酒精,900 μL NaOH溶液,涡旋混匀。沸水煮13 min,待冷却后定容至10 mL,摇匀后静置10 min。取干净的15 mL离心管,依次加入0.5 mL上清,0.1 mL乙酸和0.2 mL碘化钾溶液,定容至10 mL,室温避光放置10 min,620 nm处测定吸光值。
标准曲线制定:称取直链淀粉和支链淀粉标样各10 mg,加入0.1 mL酒精和0.9 mL NaOH,沸水煮10 min,冷却后定容至10 mL。按如下比例混匀(表1),取混样0.5 mL加入离心管,按测定方法同样品一起测定。
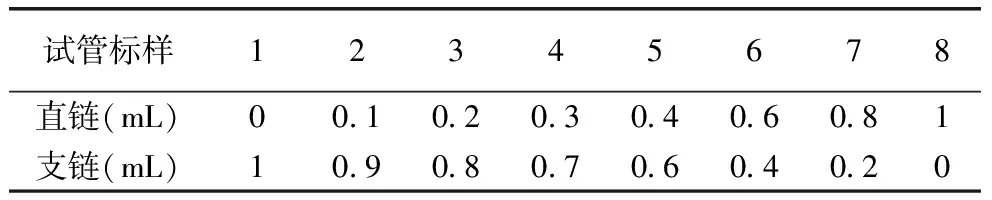
表1 淀粉标准溶液配方
1.11 数据分析
所有数据用SigmaPlot 12.0分析,用GraphPad Prism 6.05进行统计学分析。不同组之间的显著性差异用Student′st和one-way ANOVA检验。所有数据以平均值±标准差表示。P<0.05视作差异显著。
2 结果与分析
2.1 常香粳1813稻瘟病抗性基因分析
根据序列比对结果和现有稻瘟病抗性基因功能位点报道,常香粳1813中Pid2(LOC_Os06g29810)、Pid3(LOC_Os06g22460)和Pib(LOC_Os02g57305)基因属于稻瘟病抗性基因,而Bsr-d1(LOC_Os03g32230)、Pita(LOC_Os12g18360)、Pit(LOC_Os01g05620)、Pi21(LOC_Os04g32850)、Pi37(LOC_Os01g57310)、Pi36(LOC_Os08g05440)、Pita2(LOC_Os12g18729)、Pish(LOC_Os01g57340)则对稻瘟病菌无抗性。
2.2 稻瘟病菌感染后常香粳1813种子产量和质量变化分析
由图1可知,试验组剑叶表面有明显的褐色病斑,且叶片顶部干枯面积较对照组明显大(图1A)。试验组稻穗顶部一些谷粒明显干秕,而中下部灌浆的谷粒外稃表面有明显的褐色斑点(图1B和1C)。同时,对这些灌浆的谷粒进行了千粒重和长宽比分析,结果显示试验组和对照组谷粒的千粒重分别约为19.98 g和23.42 g,且显著性分析显示试验组较对照组显著下降;而两者长宽比分别约为2.27和2.23,试验组较对照组显著上升(P<0.05)(图2)。
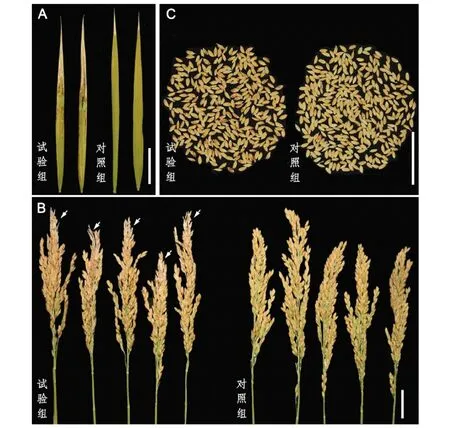
注:(A)稻瘟病菌感染后叶片出现锈斑和干枯现象。(B)稻瘟病菌感染后稻穗顶部有明显的秕谷,稻谷外稃有明显的锈斑。箭头指示秕谷。(C)稻瘟病菌感染后谷粒外观比较。A和C中标尺为3.5 cm,B中标尺为3 cm
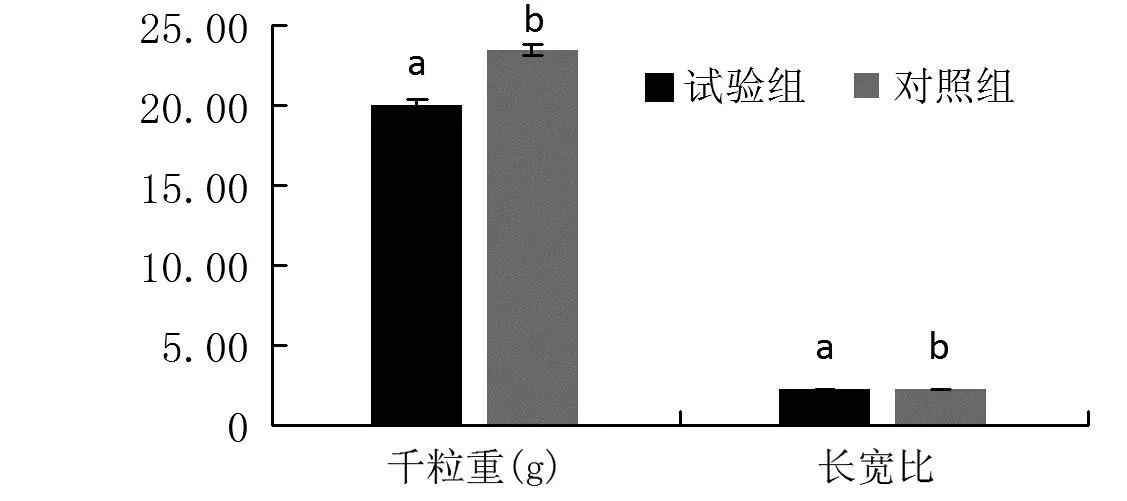
注:数据为平均值±标准差,n≥3,图中不同小写字母表示不同处理间差异达显著水平(P<0.05)
2.3 稻瘟病菌感染后常香粳1813大米加工品质分析
由图3可知,和对照组比较,试验组加工后的精米色泽稍发黄。由图4可知,试验组大米的出糙率和整精米率分别约为0.80和0.68,而对照组分别为0.84和0.70,显著性分析试验组出糙率和整精米率都显著低于对照组;且同谷粒长宽比情况相似,试验组大米长宽比同样显著高于对照组(P<0.05)。由图5可知,试验组和对照组加工整精米的垩白度分别约为5.51和2.14,且两者差异显著(P<0.05),但两者垩白率无显著差别。

注:图中标尺为3 cm。
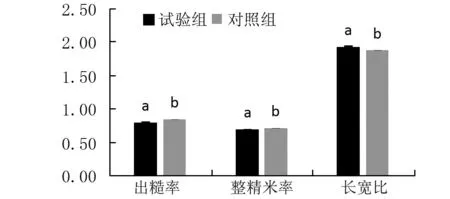
注:数据为平均值±标准差,n≥3,图中不同小写字母表示不同处理间差异达显著水平(P<0.05)
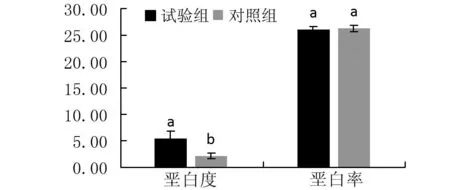
注:数据为平均值±标准差,n≥3,图中不同小写字母表示不同处理间差异达显著水平(P<0.05)
2.4 稻瘟病菌感染后常香粳1813大米主要物质含量发生变化
由图6可知,常香粳1813试验组和对照组总脂肪含量分别约为0.38%和0.80%(图6A),而两者总蛋白含量分别约为88.11 g·kg-1和66.03 g·kg-1(图6B),总淀粉含量分别约为75.98%和80.76%(图6C),而两者直链淀粉含量分别约为7.93%和9.15%(图6C),显著性分析发现两者这些参数差异均达显著水平(P<0.05)。
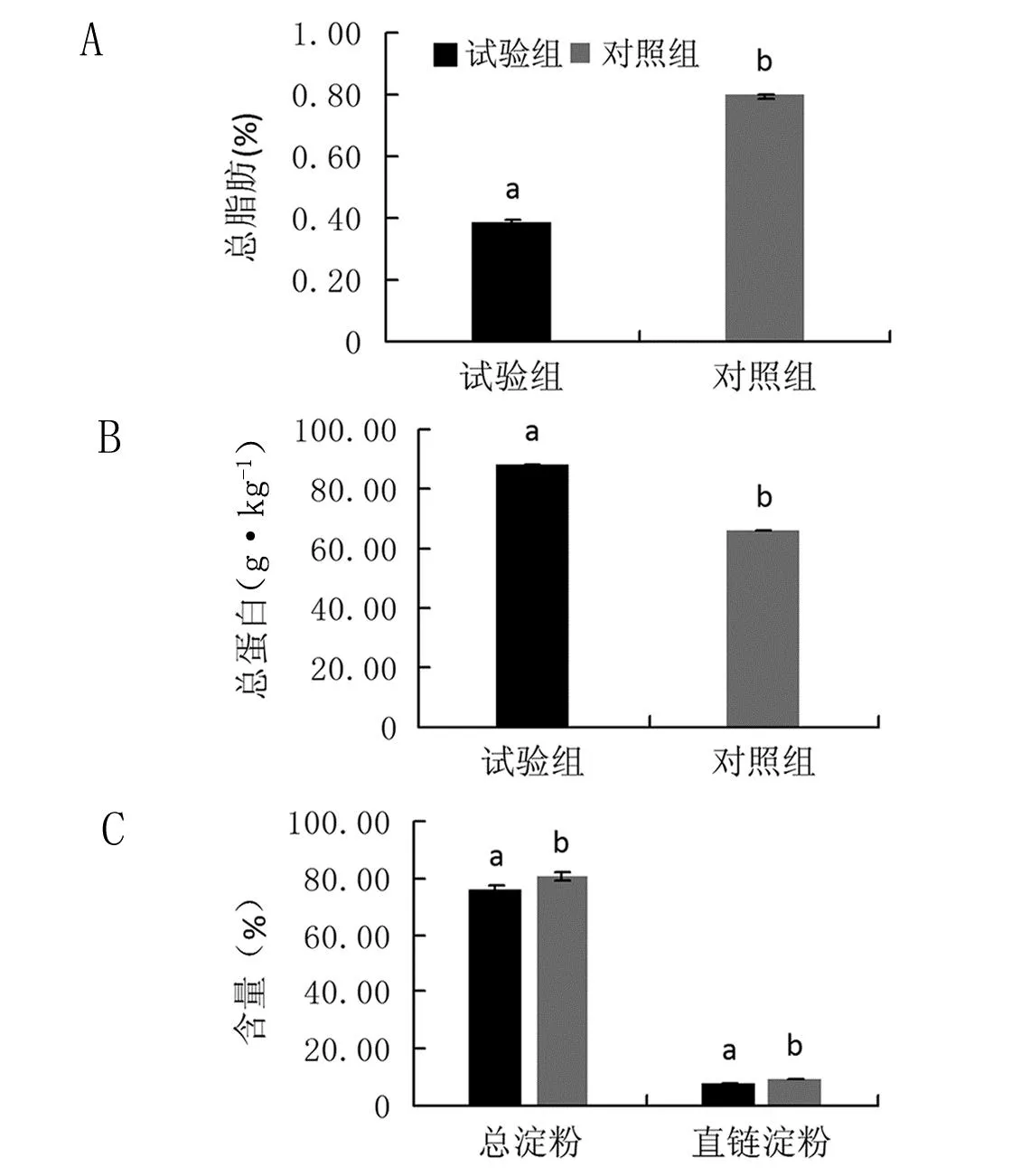
注:数据为平均值±标准差,n≥3,图中不同小写字母表示不同处理间差异达显著水平(P<0.05)
3 讨论与结论
稻瘟病是最严重的水稻病害之一,由于稻瘟病菌的不稳定性,全球水稻生产受到稻瘟病的威胁一直没有解除[12]。利用经典的植物育种技术,育种家已经开发出了许多适应全球不同水稻种植地区的抗稻瘟病品种。常香粳1813是适宜江苏省沿江和苏南稻区种植的香软米水稻品种,根据试验结果显示,常香粳1813基因组含有Pid2、Pid3和Pib稻瘟病抗性基因。其中Pib基因对东南亚稻瘟病菌小种具有广谱抗性[13-14],Pid2和Pid3则对特异性稻瘟病菌小种有抗性[15-17]。因此,常香粳1813基因组中多个稻瘟病抗性基因的存在,使常香粳1813对稻瘟病菌具备一定免疫抗性,并顺利通过江苏省品种审定。
水稻穗瘟对粮食生产造成的损失最为严重[18-19]。对常香粳1813孕穗期幼穗接种稻瘟病菌后,虽然常香粳1813表现出明显的抗性,但其穗顶部仍有一小部分瘪粒,且中下部谷粒外稃表面有明显的褐色病斑,千粒重下降,谷粒长宽比上升,说明稻瘟病菌感染对其灌浆过程有明显的影响,谷粒不够饱满。这进一步证实稻瘟病会造成种子产量和质量的下降[8,20]。
本研究中,试验组大米色泽变暗黄,出糙率和精米率显著下降,而垩白度和长宽比显著上升,说明常香粳1813感染稻瘟病菌后大米的加工品质明显下降。蛋白质含量、淀粉含量和结构有显著的功能特征,能够很好地指示大米食味性能[21],本研究中试验组大米的总蛋白含量显著增加,总淀粉含量、直链淀粉含量和总脂肪含量却都显著减少。因为高口感值的大米往往具有较高的直链淀粉含量以及较低的蛋白质含量[22],所以这些结果说明稻瘟病菌的感染明显影响了常香粳1813的食味品质。而且大麦的研究也表明蛋白质含量的增加与直链淀粉含量显著负相关[21],本试验结果进一步验证了该观点。
本研究证明常香粳1813品种中存在多个抗病性基因,因此具备了对稻瘟病菌的一定抗性,但是稻瘟病菌感染对软香米常香粳1813的种子、大米产量和品质还有显著的影响,因此优质、高产、抗病品种的选育需要结合分子标记、产量、品质相关指标参数的结合验证,这也是今后育种过程中需要关注的方面。

