基于NLRP3 炎症小体探讨三石汤治疗痛风性关节炎的机制研究
朴勇洙,齐明明,聂双莲,潘国雄,张 皓,王欣波
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江哈尔滨 150040)
痛风性关节炎(gouty arthritis,GA)是由嘌呤代谢异常、血尿酸体内堆积所引起的炎症性病变,其临床表现以脚趾、踝、膝等关节及周围组织红肿热痛为主。作为一种常见的关节炎症性病变,GA 在我国的发病率正在逐年增高,并呈现年轻化的趋势[1,2]。该病在男性中的发病率要高于女性,不同的生活环境能导致发病率出现浮动[3]。
血尿酸在体内过度堆积出现过饱和状态导致了尿酸钠(MSU)结晶的析出,后者在关节组织中的沉积会通过多种信号通路的异常激活,刺激白细胞介素1β(interleukin 1β,IL-1β)和IL-18 等炎症因子异常分泌,进而促使GA 中的炎症形成[4,5]。NLRP3炎症小体为NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、适 配 蛋 白(apoptosis-associated speck-like protein containing a CARD,ASC)与含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase-1)组成的信号转导复合物,在MSU 的刺激下NLRP3 炎症小体激活,并通过活化的Caspase-1 切割Pro-IL-1β,从而导致IL-1β 的成熟和分泌,进而产生炎症联机反应[6,7]。三石汤出自《温病条辨》:“暑湿蔓延三焦…三石汤主之”,具有清热利湿,宣统三焦的功效。本研究通过佛波酯诱导分化巨噬细胞,以MSU 诱导建立NLRP3 活化模型,通过观察巨噬细胞中P2X7R/PKR 信号通路的表达。在此基础上,通过巨噬细胞-滑膜细胞共培养体系,从而阐明三石汤治疗GA 的分子机制。
1 材料与方法
1.1 实验动物与细胞
40 只雄性SD 大鼠7 周龄,由黑龙江中医药大学实验动物中心(动物生产合格证号:SCXK(黑)2018-007)提供并饲养于黑龙江中医药大学动物实验中心,室温20~25 ℃,循环光照,自由饮水。
THP-1(人单核细胞白血病)和MH7A(人类风湿关节炎成纤维滑膜细胞)细胞株购买于武汉普诺赛生命科技有限公司。
1.2 试剂与仪器
三石汤(滑石30 g、生石膏30 g、寒水石15 g、杏仁15 g、竹茹15 g、银花15 g、白通草10 g)购于黑龙江中医药大学第一附属医院草药局,制备为浓缩液备用。佛波酯购于爱必信上海生物科技有限公司(货号abs9107);MSU 购于美国Sigma 公司(货号U2875);P2X7R 抑制剂(AZ10606120 dihydrochloride)购 于 美 国 MedChemExpress 公 司( 货 号HY-108669);RPMI-1640 培养液购于美国Gibco 公司(货号C11875500BT);丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide Dismutase,SOD)、CCK8 测定试剂盒和谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-PX)均购于江苏酶免实业有限公司(货号20111016R、20111011R、MM-70349 R1 与 20111008R);NLRP3、IL-18、IL-1β、Caspase-1、GSDMD、P2X7R、PKR 一抗购买于武汉三鹰生物技术有限公司(货号:68102-1-Ig、60070-1-Ig、66737-1-Ig、81482-1-RR、66387-1-Ig、28207-1-AP、66646-1-Ig);p-PKR 和HRP 标记羊抗兔IgG 二抗购买于美国Abcam 公司(货号:ab32036和ab150113)。Annexin V-FITC 细胞凋亡检测试剂盒和细胞活性氧检测试剂盒均购自碧云天生物技术有限公司(货号分别为C1062S 和S0033M)。酶标仪、电泳槽和电泳仪购自美国Bio-Rad 公司(型号 分 别 为PR4100、Mini-PROTEAN Tetra 和PowerPac HC);流式细胞仪购自上海聚慕医疗器械有限公司(型号为Wmini52);恒温细胞培养箱购自美国赛默飞公司(型号为HERACELL150i)。
1.3 方法
1.3.1 含药血清制备 根据实验需求在饲养一周后以10 只一组的规格将大鼠分为空白组和三石汤低、中、高剂量组。三石汤浓缩液规格为26.16 g/kg、52.32 g/kg 和104.64 g/kg 每次1 mL。空白组给予等体积生理盐水治疗。每日1 次,为期1 周。治疗后以腹腔注射的方式麻醉大鼠,并于腹主动脉取血。3 500 r/min 离心10 min 后收集血清,水浴灭活30 min 后,滤膜过滤后备用。
1.3.2 细胞诱导分化 THP-1 以RPMI-1640 培养液(含有10%FBS、1%青-链霉素双抗和β-巯基乙醇)进行培养,培养箱设置:37 ℃、含5%CO2、2~3 d换液1 次。将对数生长期的细胞接种于6 孔板(1×106个/mL),并 加 入 佛 波 酯(160 nmol/L)诱 导THP-1 向巨噬细胞分化,以细胞贴壁状态提示分化成功。
1.3.3 细胞分组与药物干预 将1.3.2 中巨噬细胞以2.5×105个/mL 的密度接种于6 孔板,每孔900 μL。根据方案分组并进行药物干预。(1)空白组:900 μL 培养基+100 μL 空白血清;(2)模型组:900 μL 培养基+100 μL 空白血清+MSU 400 μmol/L;(3)三 石 汤 低 剂 量 组:900 μL 培 养 基+MSU 400 μmol/L+100 μL 含药血清(26.16 g/kg);(4)三石汤中剂量组:900 μL 培养基+MSU 400 μmol/L+100 μL 含药血清(52.32 g/kg);(5)三石汤高剂量组:900 μL 培养基+MSU 400 μmol/L+100 μL 含药血清(104.64 g/kg);(6)抑 制 剂 组:900 μL 培 养 基+100 μL 空 白 血 清+ AZ10606120 dihydrochloride 10 mmol/L。
1.3.4 细胞共培养体系 滑膜细胞用DMEM 培养(含20%FBS、1%双抗)传代培养,并置于CO2浓度为5%和37 ℃孵育箱中进行孵育。接着以1×105/mL 的密度将处于对数生长期的滑膜细胞置于Transwell 小室的上层,并随后将Transwell 小室置于6 孔板内,与上述的各组的巨噬细胞构建共培养体系。
1.3.5 流式细胞术检测 于48 h 后收集1.3.3 中各组巨噬细胞,1 000 r/min 离心5 min,弃上清,加入PBS 重 悬 后1 000 r/min 离 心5 min,PBS 洗 涤2 次,弃上清液,留100 μL 细胞于离心管内,混匀,置于冰上,以DCFH-DA 为荧光探针,上机检测。
分离滑膜细胞并以PBS 进行洗涤,随后收集沉淀并添加100 μL 的Binding buffer 将细胞进行悬浮处理,分别向细胞悬液中加入Annexin V-FITC(5 μL)及PI(1 μL)于避光环境下孵育15 min 后上流式细胞仪进行检测。以Annexin V-FITC 阳性表示细胞凋亡早期阶段,以Annexin V-FITC 和PI 双阳性表示细胞凋亡晚期阶段,以二者之和表示细胞的凋亡水平。
1.3.6 Western blot 检测 于48 h 后 收集1.3.3 中各组巨噬细胞,加入适当的RIPA 于冰上进行细胞裂解。随后以2 000 r/min 的速度离心15 min 后取上清液。BCA 法检测蛋白的浓度。取25 μg 的蛋白上样,采用SDS-PAGE 分离蛋白质后转膜至PVDF,用5%脱脂牛奶在室温下封闭处理1 h。加入稀释后的一抗:NLRP3、IL-1β、IL-18、Caspase-1、GSDMD、P2X7R、PKR、p-PKR、PKR 和β-actin,4 ℃孵育过夜后加入HRP 标记的羊抗兔IgG 二抗,常温下继续孵育2 h,利用凝胶成像系统进行拍照,研究以β-actin 作为内参,以计算目的蛋白的相对表达水平。
1.3.7 CCK8 检测化膜细胞活性 滑膜细胞接种于96 孔板,待细胞贴壁根据不同组别给予相应药物处理,设 置6 个复孔,37 ℃、5% CO2培养48 h,加入CCK8 孵育2 h,于450 nm 波长检测吸光度。
1.4 统计学处理
采用SPSS 软件(版本26.0)进行统计学分析,多组间数据的比较采用ANOVA 进行,组间两两数据的的对比采用LSD 进行检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 三石汤对巨噬细胞ROS 水平的影响
如图1 和表1 中所示,模型组巨噬细胞ROS 水平与空白组相比较显著的增加,差异比较具有统计学意义(P<0.05)。而三石汤低剂量、中剂量、高剂量和抑制剂组巨噬细胞ROS 的水平与模型组相比较显著的降低,差异比较均具有统计学意义(P<0.01)。
表1 各组巨噬细胞ROS 水平的比较(n=3,±s,%)Tab 1 Comparison of ROS levels of macrophages in each group(n=3,±s,%)

表1 各组巨噬细胞ROS 水平的比较(n=3,±s,%)Tab 1 Comparison of ROS levels of macrophages in each group(n=3,±s,%)
注:与空白组相对比,*P<0.05,**P<0.01;与模型组相对比,●P<0.05,●●P<0.01。
ROS 9.27±0.47 33.87±1.59**28.43±1.21●●18.63±0.76●●13.57±0.81●●14.40±0.62●●278.928 0.000组别空白组模型组三石汤低剂量组三石汤中剂量组三石汤高剂量组抑制剂组FP
2.2 三石汤对巨噬细胞氧化应激的影响
如表2 所见,与空白组相比,模型组巨噬细胞SOD 和GSH-PX 的 活 性 显 著 降 低,MDA 的 含 量 显著增加,差异均具有统计学意义(P<0.01)。与模型组相比,三石汤低剂量、中剂量、高剂量和抑制剂组巨噬细胞SOD 和GSH-PX 的活性显著增加,MDA的含量显著的降低,差异比较均具有统计学的意义(P<0.05 和P<0.01)。
表2 各组巨噬细胞氧化应激指标的比较(n=3,±s)Tab 2 Comparison of oxidative stress indicators of macrophages in each group(n=3,±s)
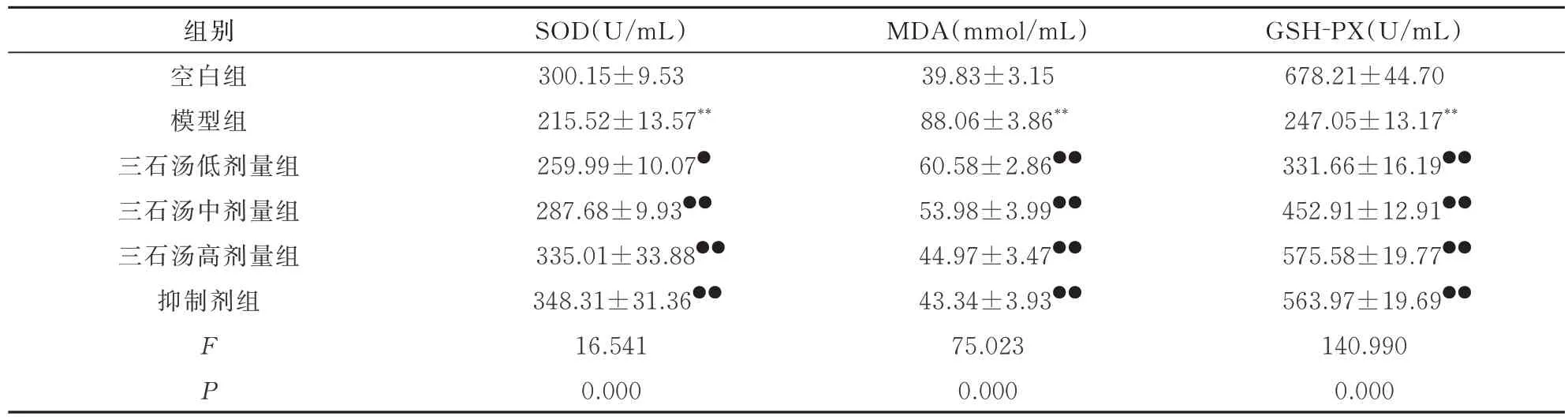
表2 各组巨噬细胞氧化应激指标的比较(n=3,±s)Tab 2 Comparison of oxidative stress indicators of macrophages in each group(n=3,±s)
注:与空白组相对比,*P<0.05,**P<0.01;与模型组相对比,●P<0.05,●●P<0.01。
组别空白组模型组三石汤低剂量组三石汤中剂量组三石汤高剂量组抑制剂组SOD(U/mL)300.15±9.53 MDA(mmol/mL)39.83±3.15 GSH-PX(U/mL)678.21±44.70 215.52±13.57**88.06±3.86**247.05±13.17**259.99±10.07●60.58±2.86●●331.66±16.19●●287.68±9.93●●53.98±3.99●●452.91±12.91●●335.01±33.88●●44.97±3.47●●575.58±19.77●●563.97±19.69●●140.990 0.000 FP 348.31±31.36●●16.541 0.000 43.34±3.93●●75.023 0.000
2.3 三石汤对巨噬细胞NLRP3 炎症小体的影响
如图2 所示,与空白组相比,模型组巨噬细胞NLRP3、Mature IL-1β、Pro IL-1β、Mature IL-18、Pro IL-18、Mature Caspase-1 和GSDMD-NT 蛋白的表达水平显著上调,GSDMD-FL 蛋白的表达显著下调,差异均具有统计学意义(P<0.01)。而巨噬细胞中Pro-Caspase-1 蛋白的表达则无明显改变,组间相比差异无统计学意义(P>0.05)。三石汤低剂量、中剂量、高剂量和抑制剂组巨噬细胞NLRP3、Mature IL-1β、Pro IL-1β、Mature IL-18、Pro IL-18、Mature Caspase-1 和GSDMD-NT 蛋白的表达水平与模型组相比较显著下调,GSDMD-FL 蛋白的表达显著上调,差异均具有统计学意义(P<0.01),而巨噬细胞中Pro-Caspase-1 蛋白的表达无明显变化,差异无统计学意义(P>0.05)。见表3 和表4。
表3 各组巨噬细胞NLRP3、IL-1β 和IL-18 蛋白表达的比较(n=3,±s)Tab 3 NLRP3 and IL-1 of macrophages in each group β Comparison with IL-18 protein expression(n=3,±s)

表3 各组巨噬细胞NLRP3、IL-1β 和IL-18 蛋白表达的比较(n=3,±s)Tab 3 NLRP3 and IL-1 of macrophages in each group β Comparison with IL-18 protein expression(n=3,±s)
注:与空白组相对比,*P<0.05,**P<0.01;与模型组相对比,●P<0.05,●●P<0.01。
组别空白组模型组三石汤低剂量组三石汤中剂量组三石汤高剂量组抑制剂组NLRP3/β-actin 0.18±0.04 Mature IL-1β/β-actin 0.05±0.01 Mature IL-18/β-actin 0.02±0.01 Pro IL-18/β-actin 0.08±0.01 0.93±0.04**0.70±0.07**Pro IL-1β/β-actin 0.05±0.02 0.98±0.12*0.76±0.15**0.93±0.07**0.67±0.07●●0.51±0.03●●0.69±0.18●●0.37±0.04●●0.66±0.14●●0.33±0.07●●0.37±0.08●●0.48±0.10●●0.22±0.09●●0.38±0.09●●0.20±0.04●●0.34±0.04●●0.46±0.13●●0.09±0.01●●0.11±0.03●●0.15±0.02●●73.760 0.000 FP 0.17±0.01●●122.841 0.000 0.33±0.04●●52.349 0.000 0.38±0.04●●23.267 0.000 0.07±0.02●●42.359 0.000
表4 各组巨噬细胞Caspase-1 和GSDMD 蛋白表达的比较(n=3,±s)Tab 4 Comparison of Caspase-1 and GSDMD protein expression in macrophages of each group(n=3,±s)

表4 各组巨噬细胞Caspase-1 和GSDMD 蛋白表达的比较(n=3,±s)Tab 4 Comparison of Caspase-1 and GSDMD protein expression in macrophages of each group(n=3,±s)
注:与空白组相对比,*P<0.05,**P<0.01;与模型组相对比,●P<0.05,●●P<0.01。
组别Mature Caspase-1/Pro-Caspase-1 GSDMD-NT/β-actin GSDMD-FL/β-actin 0.99±0.07 0.11±0.01**0.38±0.04●●0.51±0.10●●0.90±0.04●●0.91±0.04●●111.320 0.000空白组模型组三石汤低剂量组三石汤中剂量组三石汤高剂量组抑制剂组FP 0.06±0.03 0.96±0.04**0.74±0.08●●0.29±0.05●●0.09±0.04●●0.11±0.04●●182.648 0.000 0.01±0.01 0.80±0.15**0.52±0.06●0.26±0.09●●0.13±0.04●●0.10±0.02●●43.512 0.000
2.4 三石汤对巨噬细胞P2X7R/PKR 信号通路的影响
如图3 和表5 所示,与空白组相比,模型组巨噬细胞P2X7R 和p-PKR 蛋白的表达显著的上调,组间比较差异均具有统计学意义(P<0.01)。而巨噬细胞中Total-PKR 蛋白的表达则无明显的改变,组间比较差异无统计学意义(P>0.05)。三石汤低剂量、中剂量、高剂量和抑制剂组巨噬细胞P2X7R 和p-PKR 蛋白的表达水平与模型组相比较显著下调,差异均具有统计学意义(P<0.05 和P<0.01),而巨噬细胞中Total-PKR 蛋白的表达无明显的变化,组间比较差异无统计学意义(P>0.05)。

图3 各组巨噬细胞P2X7R/PKR 信号通路相关蛋白表达水平的比较Fig 3 Comparison of the expression levels of P2X7R/PKR signaling pathway related proteins in macrophages of each group
表5 各组巨噬细胞P2X7R/PKR 信号通路相关蛋白表达水平的比较(n=3,±s)Tab 5 Comparison of expression levels of P2X7R/PKR signaling pathway related proteins in macrophages of each group(n=3,±s)
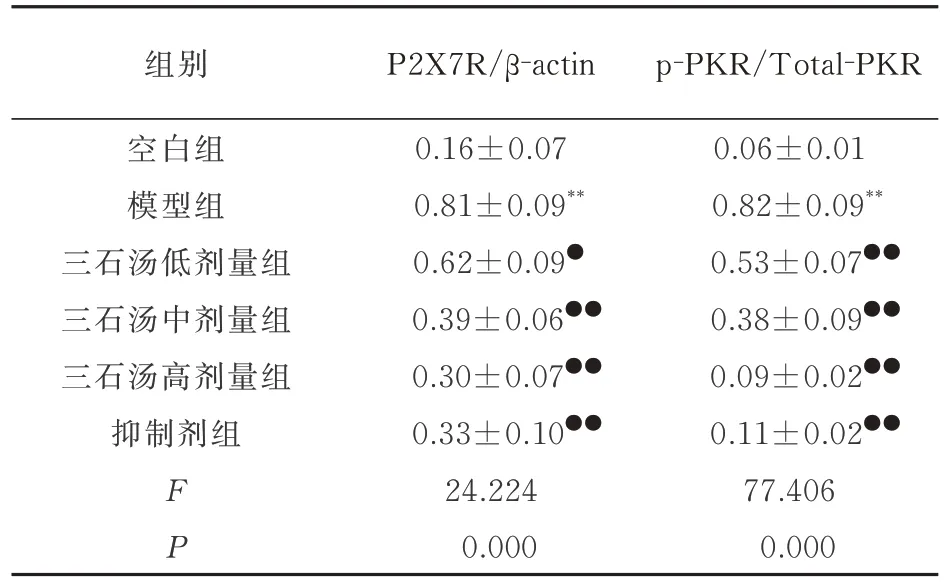
表5 各组巨噬细胞P2X7R/PKR 信号通路相关蛋白表达水平的比较(n=3,±s)Tab 5 Comparison of expression levels of P2X7R/PKR signaling pathway related proteins in macrophages of each group(n=3,±s)
注:与空白组相对比,*P<0.05,**P<0.01;与模型组相对比,●P<0.05,●●P<0.01。
组别空白组模型组三石汤低剂量组三石汤中剂量组三石汤高剂量组抑制剂组P2X7R/β-actin 0.16±0.07 p-PKR/Total-PKR 0.06±0.01 0.81±0.09**0.82±0.09**0.62±0.09●0.53±0.07●●0.39±0.06●●0.38±0.09●●0.30±0.07●●0.09±0.02●●0.11±0.02●●77.406 0.000 FP 0.33±0.10●●24.224 0.000
2.5 三石汤对滑膜细胞活性的影响
如表6 所示,模型组滑膜细胞的活性与空白组相对比显著的降低,组间比较差异均具有统计学意义(P<0.01)。三石汤中剂量、高剂量及抑制剂组滑膜细胞的活性与模型组相比较显著的增加,组间比较差异均具有统计学意义(P<0.05 和P<0.01)。
表6 各组滑膜细胞活性和凋亡水平的比较(n=3,±s)Tab 6 Comparison of activity and apoptosis levels of Synovial cell in each group(n=3,±s)
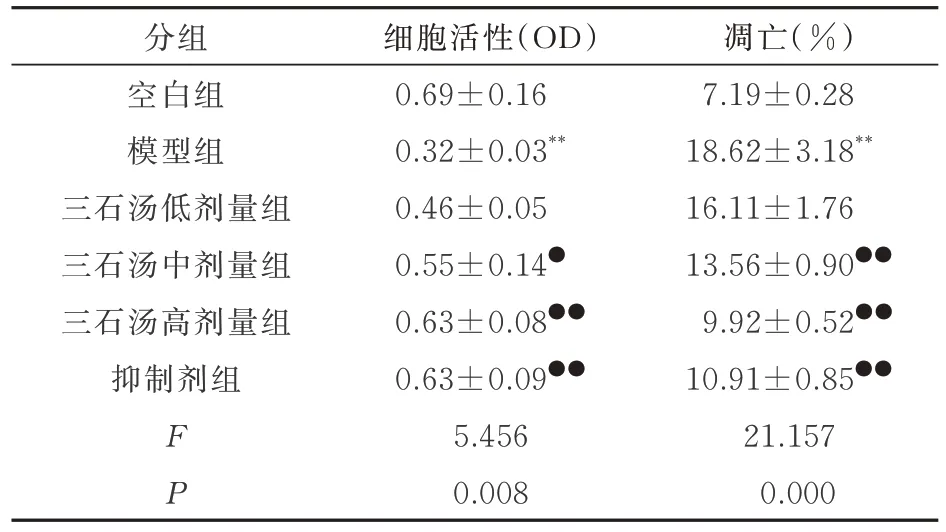
表6 各组滑膜细胞活性和凋亡水平的比较(n=3,±s)Tab 6 Comparison of activity and apoptosis levels of Synovial cell in each group(n=3,±s)
注:与空白组相对比,*P<0.05,**P<0.01;与模型组相对比,●P<0.05,●●P<0.01。
凋亡(%)7.19±0.28 18.62±3.18**16.11±1.76 13.56±0.90●●9.92±0.52●●10.91±0.85●●21.157 0.000分组空白组模型组三石汤低剂量组三石汤中剂量组三石汤高剂量组抑制剂组FP细胞活性(OD)0.69±0.16 0.32±0.03**0.46±0.05 0.55±0.14●0.63±0.08●●0.63±0.09●●5.456 0.008
2.6 三石汤对滑膜细胞凋亡的影响
如图4 和表6 所示,模型组滑膜细胞的凋亡水平与空白组相比较显著的增加,组间比较差异均具有统计学意义(P<0.01)。三石汤中剂量、高剂量和抑制剂组滑膜细胞的凋亡水平与模型组相比显著的降低,差异均具有统计学意义(P<0.05和P<0.01)。

图4 各组滑膜细胞凋亡水平的比较Fig 4 Comparison of apoptosis levels of synovial cells in each group
3 讨论
氧化应激是一种由外界刺激导致的机体内活性氧(reactive oxygen species,ROS)及内源性抗氧化防御系统之间失衡,使细胞受到的氧化损伤超过其承受范围而使机体出现应激反应。ROS 是一类高度活性的氧化分子,在常态下具有抵抗病原体侵害和传递细胞内信号的作用。病态下,ROS 生成增加并且机体对ROS 的清除能力减弱,导致氧化应激加 剧,损 害 细 胞 的 结 构 和 功 能[7]。MDA、SOD 和GSH-PX 是评估机体氧化应激反应的标志性指标[8]。MDA 是脂质过氧化反应的产物之一,可反馈氧 化 应 激 和 细 胞 损 伤 程 度[9]。SOD 和GSH-PX 是抗氧化酶指标,能够清除氧自由基和其他氧化物,保护细胞免受氧化应激的损伤,其水平越高标示细胞具有较好的抗氧化能力,反之则表示细胞对氧自由基的清除能力越差[8]。研究证明氧化应激是导致GA 发生的重要愿意之一,中医药能够通过抑制氧化应激水平达到治疗GA 的的效果[10]。本研究发现,MSU 诱导能够提高巨噬细胞ROS 水平和MDA的含量,并抑制巨噬细胞SOD 和GSH-PX 的活性。三石汤呈剂量依赖式降低巨噬细胞ROS 水平和MDA 的 含 量,并 提 升 巨 噬 细 胞SOD 和GSH-PX 的活性。
孤立MSU 的并不能引发GA,需要激活NLRP3 炎症小体进而引起GA 中炎症的产生[11]。NLRP3 炎症小体是一种细胞内的多蛋白复合体,与包括GA 在内的多种炎症性疾病相关[12,13]。其组成包括NLRP3、ASC 和Pro-Caspase-1 三部分。MSU 可刺激NLRP3 诱导蛋白质复合体的形成,促进前体Caspase-1 自身割活化,活化后的Caspase-1 对胞浆中pro-IL-1β 和pro-IL-18 进行剪切,使其转化为活性 形 式 的IL-1β 和IL-18[14,15]。Caspase-1 还 能 切 割活化GSDMD 蛋白,促使细胞膜通道生成和IL-1β和IL-18 外排,最终导致细胞炎症性死亡[16]。在NLRP3 炎症小体激活的过程中,ASC 作为连接蛋白不仅连接了受体蛋白和Caspase-1 反应器,其C 端还能够亮氨酸序列可识别包括MSU 在内的多种内源性危险信号[17]。本研究结果显示,MSU 诱导能够上 调 巨 噬 细 胞NLRP3、Mature IL-1β、Pro IL-1β、Mature IL-18、Pro IL-18、Mature Caspase-1 和GSDMD-NT 蛋白的表达水平,下调GSDMD-FL 蛋白的表达水平。三石汤呈剂量依赖式抑制巨噬细胞NLRP3、Mature IL-1β、Pro IL-1β、Mature IL-18、Pro IL-18、Mature Caspase-1 和GSDMD-NT 蛋白的表达水平,上调GSDMD-FL 蛋白的表达水平,从而抑制NLRP3 炎症小体的活化。
P2X7R 是一种ATP 感受性离子通道受体,在炎症性疾病发生和发展中起到重要作用[18]。P2X7R 与ATP 结合后能够导致Na+和Ca2+的内流和K+的外流,从而诱导NLRP3 炎症小体中的NLRP3、ASC 及Caspase-1 的活化,并引起血清炎症因子(如IL-1β 和IL-18 等)的释放,导致靶器官的损伤[19]。有研究证明中医药能够通过抑制P2X7R 介导的炎症信号通路,达到改善GA 大鼠关节指征的效果[20]。PKR 是一种RNA 蛋白酶,可通过磷酸化达到激活状态从而参与调控细胞的生长、分化、增殖和凋亡等过程。研究显示P2X7R 可通过调节PKR 磷酸化来影响NLRP3 炎症小体活性,而抑制PKR 磷酸化水平也可实现明显降低NLRP3 表达的效 果[21,22]。本 研 究 中MSU 诱 导 上 调 了 巨 噬 细 胞P2X7R 和p-PKR 蛋白的表达,而三石汤含药血清呈剂量依赖式抑制巨噬细胞P2X7R 和p-PKR 蛋白的表达,其中高剂量三石汤效果与抑制剂效果相当。
滑膜细胞是关节滑膜中的主要细胞类型,在GA 的发病中具有重要的意义。研究证明,MSU 诱导能够上调滑膜细胞中NLRP3 炎症小体的表达及相关炎症因子的释放,进而促使了炎症反应的发生[23]。另有研究证明中药可通过抑制滑膜组织炎症反应及凋亡达到治疗GA 的效果[24]。本研究结果显示MSU 可通过巨噬细胞降低滑膜细胞活性,并促进滑膜细胞凋亡。三石汤含药血清呈剂量依赖式增加滑膜细胞活性并抑制滑膜细胞凋亡,其中高剂量三石汤效果与抑制剂效果相当。
三石汤由飞滑石、生石膏、寒水石、杏仁、竹茹、银花、白通草等组成,具有祛邪通窍并除三焦湿热聚集的功效。方中滑石甘寒、清上利下,除热祛湿,和表里而利阴阳,以为君药。生石膏,寒水石皆取其寒,助君清热利窍,又能解肌止渴。银花清热解毒亦助君之用。此三者用之为臣。杏仁宣上焦肺气,助气化以除湿。竹茹清泻中焦,促邪从出行于下窍。此二者用之为佐。白通草上通下达,通行药力,又能导热排湿于下窍,用之为使。
综上所述,NLRP3 炎症小体在痛风性关节炎的发生发展中具有重要地位,而三石汤可通过P2X7R/PKR 信号通路从而抑制NLRP3 炎症小体激活,从而抑制滑膜细胞凋亡,达到治疗GA 的效果。
作者贡献度说明:
朴勇洙:为本课题总负责;王欣波:为全部实验过程协调人员;齐明明: 文献检索;聂双莲:后期数据统计分析工作;潘国雄,张皓:动物实验。
所有作者声明不存在利益冲突关系。

