基于Notch1 信号通路调控巨噬细胞极化改善佐剂关节炎大鼠关节炎症的机制
程 静,万 磊,赵 磊,李 舒,李方泽,胡赛赛,陈莹莹
(1.安徽中医药大学,安徽 合肥 230031;2.安徽中医药大学第一附属医院风湿科,安徽 合肥 230031)
类风湿性关节炎(RA)是一种由免疫系统对其自身关节组织的异常攻击引起的系统性自身免疫性疾病[1]。RA 患者的滑膜组织增殖并增厚,有许多浸润性炎症细胞。聚集的免疫细胞通过促进滑膜成纤维细胞的增殖和激活破骨细胞直接参与滑膜炎的发展[2]。RA 滑膜中大多数免疫细胞是巨噬细胞,是产生参与RA 病理发展的主要促炎细胞因子[3]。国内外研究表明,巨噬细胞(Mφ)可以被分化为M1 和M2,M1 型Mφ 以CD80+和CD86+为代表,M2 型Mφ 以CD206+和CD163+为代表。M1 型巨噬细胞可通过释放白细胞介素-1β(IL-1β)、IL-6、肿瘤坏死因子-a(TNF-a)等促炎因子参与RA 发生发展,M2 型Mφ 释放IL-4、IL-10、IL-13 等抑炎因子减轻炎症[4,5]。
研究表明,Notch 是调控巨噬细胞功能的重要分子。活化Notch 信号可调控Mφ 向M1 型极化,发挥促炎效应;阻断Notch 信号可诱导Mφ 向M2 型极化,发挥抗炎效应[6]。Notch 信号通路的表达和活化能够刺激滑膜细胞,从而促进 RA 中促炎因子的产生[7]。前期课题组动物实验研究表明,Notch 信号的活化可调节巨噬细胞的M1 型极化,从而促进佐剂性关节炎(adjuvant arthritis,AA)的发生[8]。本研究通过复制AA 大鼠模型,探究Notch1 信号通路在AA 大鼠关节炎指数(AI)、足趾肿胀度、血清中细胞因子(IL-4、IL-1β、IL-10、TNF-α)及M1/M2 巨噬细胞表达的影响,进一步研究Notch1/Jagged1/RBP-Jκ/Hes1 信 号 轴 在AA 大 鼠 滑 膜M1/M2 型 巨噬细胞极化中的作用及分子机制。
1 材料与方法
1.1 实验动物
18 只清洁级SD 雄性大鼠,体重(195±15)g。动物购自安徽医科大学实验动物中心。本研究遵循安徽中医药大学第一附属医院实验动物伦理委员会的规定,动物伦理编号AHUCM-rats-2021022。
1.2 主要试剂和仪器
弗氏完全佐剂(美国Sigma公司,货号MB9887);白 细 胞 介 素-4(interleukin-4,IL-4) 、IL-10、IL-1β、TGF-α 试剂盒(武汉基因美公司,货号:JYM0651 Ra、JYM0297Ra、JYM0636Ra、JYM0612Ra);兔Notch1、Jagged1、Hes-1 抗体:均购自abcam,货号分别 为:ab53457,ab108293,ab120934;兔RBP-Jκ 抗体:bioss,货 号:bs-3906R。Notch1 通 路 抑 制 剂(FLI-06):上海蓝木化工有限公司,货号:S8894。流式细胞仪(贝克曼公司);倒置显微镜(OLYMPUS 公司);离心机(上海和欣科教设备有限公司);电泳仪、电泳槽(上海天能科技有限公司)。
1.3 分组、造模及给药
将18 只大鼠按随机对照表分为3 组,即健康组、模型组和Notch1 抑制剂组,每组6 只。MC 和FLI 大 鼠 构 建AA 大 鼠 模 型[9]。2 周 后 开 始 给 药,Notch1 抑制剂组:制成0.224 mg/mL 混合液,0.056 mg/0.25 mL/100 g 尾静脉注射,隔天1 次;健康组及模型组:生理盐水2 mL/只灌胃1 次/d。给药30 d。
1.4 关节炎症症状的测定
在造模前1 天、致炎后第30 天测量每组SD 大鼠的右后足关节容积,计算各组大鼠右后足关节肿胀度(E)[10]。致炎后第30 天开始观察,对其进行全身性的观察,并计算AI。AI 评分正常为0 分,1 处关节肿胀为1 分,2 处关节肿胀为2 分,2 处以上关节肿胀为3 分,全部肢体有肿胀为4 分。
1.5 流式细胞仪测定巨噬细胞极化标志物
大鼠新鲜血液100 μL,加入抗鼠CD80-PE 0.25 μg、CD163-AF647 0.25 μg。根据操作手册流式细胞仪检测CD80+、CD163+细胞表达。
1.6 ELISA 方法测定炎症细胞因子的表达
从腹主动脉采血,按照 ELISA 说明书操作,检测炎症细胞因子的 OD 值,绘制IL-4、IL-1β、IL-10、TNF-α 标 准 曲 线,计 算 出 大 鼠 血 清IL-4、IL-1β、IL-10、TNF-α 浓度。
1.7 Western Blot 测定相关蛋白表达水平
用蛋白提取试剂盒提取滑膜总蛋白,电泳分离,采用半干法转膜使蛋白质从胶转移至膜上,用室温5%的脱脂奶粉封闭膜2 h。免疫反应:室温下,将Notch1、Jagged1、Hes1、RBP-Jκ 抗体1/2 000稀释后,和膜一起孵育2 h, 化学发光法显色并拍照。计算各组Notch1、Jagged1、Hes1、RBP-Jκ 条带的灰度值,以目的条带与内参β-actin 灰度值的比值做为滑膜Notch1、Jagged1、Hes1、RBP-Jκ 蛋白的相对表达量。
1.8 统计学方法
采用 SPSS 27.0 统计软件,Correlation Analysis法检测相关性,ANOVA 法检测方差分析,独立样本t检验两组间的对比,P<0.05 为差异具有统计学意义。
2 结果
2.1 Notch1 抑制剂对AA 大鼠E 及AI 的影响
模型组 AA 大鼠的E 及AI 均较健康组明显增高(P<0.01);Notch1 抑制剂组的E 及AI 均较模型组明显降低(P<0.01)。见表1。
表1 各组大鼠E、AI 比较(n=6, ±s)Tab 1 Comparison of E and AI in each group of rats(n=6,±s)

表1 各组大鼠E、AI 比较(n=6, ±s)Tab 1 Comparison of E and AI in each group of rats(n=6,±s)
注:对 比NC 组,△△P<0.01;对 比MC 组,▲P<0.05,▲▲P<0.01。
关节炎指数(分)0.00±0.00 6.85±1.69△△4.97±0.75▲组别NC MC FLI右后足关节肿胀度(%)44.74±11.92 80.26±17.53△△47.30±17.59▲▲
2.2 Notch1 抑制剂对AA 大鼠M1、M2 表面标志物的影响
MC 组 AA 大鼠CD80+细胞的表达量较 NC组显著增加,而CD163+细胞的表达量较 NC 组显著减少(P<0.01);Notch1 抑制剂组,CD80+细胞的表达量显著低于MC 组,CD163+细胞的表达量显著高于MC 组(P<0.01)。见表2,图1、2。

图1 各组CD80+流式细胞图Fig 1 CD80 + flow cytometry of each group

图2 各组CD163+流式细胞图Fig 2 CD163+ flow cytometry of each group
表2 各组巨噬细胞极化标志物的比较(n=6, ±s)Tab 2 Comparison of macrophage polarization markers in different groups(n=6, ±s)

表2 各组巨噬细胞极化标志物的比较(n=6, ±s)Tab 2 Comparison of macrophage polarization markers in different groups(n=6, ±s)
注:对比NC 组,△△P<0.01;对比MC 组,▲▲P<0.01。
组别NC MC CD80 0.92±0.15 4.10±0.49△△CD163 5.49±0.39 1.19±0.37△△3.60±0.47▲▲FLI 2.04±0.21▲▲
2.3 Notch1 抑制剂对AA 大鼠IL-4、IL-1β、IL-10、TNF-α 水平的影响
MC 组与 NC 组相比,IL-1β 和TNF-α 的表达显著增加(P<0.01),而IL-4 和IL-10 的表达显著减少(P<0.01);FLI 组IL-1β 和TNF-α 的表达显著低于MC 组(P<0.05),IL-4 和IL-10 的 表 达 显 著 高 于MC 组(P<0.01);见表3。
表3 各组大鼠炎症细胞因子水平的比较(n=6, ±s)Tab 3 Comparison of inflammatory cytokine levels in rats of each group(n=6, ±s)

表3 各组大鼠炎症细胞因子水平的比较(n=6, ±s)Tab 3 Comparison of inflammatory cytokine levels in rats of each group(n=6, ±s)
注:对比NC 组,△△P<0.01;对比MC 组,▲▲P<0.01,▲P<0.05。
组别NC IL-4 10.71±0.55 IL-1β 46.23±5.89 IL-10 67.81±3.91 TNF-α 42.00±7.99 MC 2.87±0.28△△153.60±13.02△△19.36±2.25△△177.41±7.94△△87.41±5.33▲FLI 6.82±0.23▲▲72.67±5.66▲30.00±0.99▲▲
2.4 Notch1 抑制剂对AA 大鼠关节滑膜组织中Notch1、Jagged1、Hes1、RBP-Jκ 蛋白的影响
MC 组 大 鼠 中Notch1、Jagged1、Hes1、RBP-Jκ的表达均明显高于NC 组(P<0.01);Notch1 抑制剂组滑膜组织中Notch1、Jagged1、Hes1、RBP-Jκ 的表达明显低于MC 组(P<0.05)。见表4,图3。

图3 各组大鼠Notch1/Jagged1/RBP-Jκ/Hes1 蛋白表达Fig 3 The protein expression of Notch1 / Jagged1 /RBP-Jκ / Hes1 in each group of rats
表4 各组大鼠Notch1、Jagged1、Hes1 及RBP-Jκ 表达水平比较(n=6, ±s)Tab 4 Comparison of Notch1, Jagged1, Hes1 and RBP-Jκ expression levels in each group of rats(n=6, ±s)

表4 各组大鼠Notch1、Jagged1、Hes1 及RBP-Jκ 表达水平比较(n=6, ±s)Tab 4 Comparison of Notch1, Jagged1, Hes1 and RBP-Jκ expression levels in each group of rats(n=6, ±s)
注:与NC 组比较,△△P<0.01;与MC 组比较,▲P<0.05。
组别NC MC FLI RBP-Jκ 0.41±0.13 0.90±0.21△△0.61±0.16▲Notch1 0.15±0.13 0.73±0.12△△0.44±0.19▲Jagged1 0.10±0.04 0.54±0.12△△0.35±0.01▲Hes1 0.19±0.01 1.45±0.50△△0.46±0.08▲
2.5 AA 大鼠巨噬细胞极化标志物与Notch1、Jagged1、Hes1、RBP-Jκ 蛋白的相关性分析
相 关 性 分 析 显 示,CD80 与Notch1、Jagged1、Hes1、RBP-Jκ 蛋白成正相关(P<0.01),CD163 与Notch1、Jagged1、Hes1、RBP-Jκ 蛋白成负相关(P<0.01),见表5。
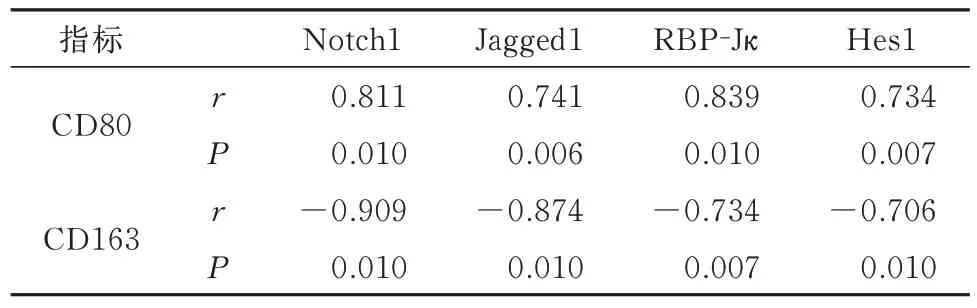
表5 CD80、CD163 与其他指标相关性分析Tab 5 Correlation analysis of CD80, CD163 and other indicators
3 讨论
RA 是一种自身免疫性炎症性疾病,受累关节破坏不可逆主要特征为免疫细胞浸润和滑膜炎症,在RA 中,活化的滑膜成纤维细胞产生促炎细胞因子和趋化因子,导致特征性关节炎症和软骨破坏[11,12]。研 究 发 现,IL-4、IL-10 和TNF-α 是RA 发生、发展过程中的关键因素,它们参与Th1 介导的炎症反应,导致软骨和骨破坏[13]。M1 型巨噬细胞是 RA 关节软骨炎症的关键调控分子,M2 巨噬细胞通过分泌IL-10 等细胞因子发挥抗炎活性并有利于组织修复,IL-4 可以诱导M1 巨噬细胞标志物表降低和M2 巨噬细胞标志物增加[14-16]。研究表明,诱导从M1 极化为抗炎M2 巨噬细胞的治疗可能是更好地控制RA 异常炎症反应[17]。本次研究结果表明,与NC 组 对 比,MC 组IL-1β、TNF-α 表 达 水 平 明 显升高,IL-4、IL-10 表达水平明显降低;CD80+细胞表达明显升高,CD163+细胞表达明显降低;Notch1、Jagged1、Hes1、RBP-Jκ 蛋白表达水平显著升高,表明AA 大鼠体内的巨噬细胞向M1 型巨噬细胞极化,抑制抗炎细胞因子的分泌,促进促炎细胞因子的表达;异常激活AA 大鼠体内的Notch1/Jagged1 /RBP-Jκ/Hes1 信号轴研究结果验证了课题组前期研究,在RA 发病中,Notch 信号通路和巨噬细胞极化的调控作用密切相关。
Notch 信 号 通 路 包 含Notch 受 体(Notch1)和Notch 配体(Jagged-1)[18]。Notch 信号激活可能对巨噬细胞中的免疫防御机制产生负调节,同时可以促进 细 胞 因 子 分 泌 并 加 重RA[19]。Notch1 和Jagged1结合之后,再与转录因子RBP-Jκ 相结合,从而形成一个转录复合物,进而调控靶基因Hes1的表达,导致巨噬细胞的炎症极化向M1 型分化,促进IL-1β、TNF-α 等促炎细胞因子的形成,能参与RA 的发展过程。抑制Notch 信号通路传导引起巨噬细胞极化从M1 型向M2 型分化,可能参与治疗RA 的过程[20-22]。本 次 实 验 研 究 发 现,Notch1 抑 制 剂 组 的IL-1β、TNF-α 表达水平明显低于MC 组,IL-4、IL-10表 达 水 平 明 显 高 于MC 组;与Su 等[23]研 究 结 果相似。
RBP-Jκ 依赖性Notch 通路是一种参与关节维持和关节软骨稳态的新途径[24]。Yang 等[25]研究发现,抑制Notch1 受体和Jagged1 配体和Hes1 的表达可促进巨噬细胞极化为M2 巨噬细胞。相关性分析,CD80 与Notch1、Jagged1、Hes1、RBP-Jκ 蛋白成正相关,CD163 与Notch1、Jagged1、Hes1、RBP-Jκ 蛋白成负相 关,Notch1 与Jagged1 结合后,与RBP-Jκ结合形成转录复合物,从而调节靶基因Hes1的表达,可以使巨噬细胞向M1 极化。结果表明,Notch1/Jagged1/RBP-Jκ/Hes1 信号轴与M1、M2 相关。本研究结果显示,Notch1 抑制剂组可以显著下调滑膜组织中Notch1、Jagged1、Hes1、RBP-Jκ 蛋白表达,而与MC 组相比较,Notch1 抑制剂组大鼠E、AI 显著降低;CD80+细胞表达明显降低,CD163+细胞表达明显升高;对比前期研究,本研究进一步明确了抑制Notch1 信号通路可以通过调控巨噬细胞向M2 型极化,上调IL-4 和IL-10 表达,下调IL-1β和TNF-α 表达,来改善AA 大鼠的炎症反应。
综上所述,通过抑制Notch1/Jagged1/RBP-Jκ/Hes1 信号轴,可调控M1 型向M2 型巨噬细胞极化,改善AA 大鼠的免疫炎症反应,这为以后临床研究提供了技术和科学基础。
作者贡献度说明:
程静:完成试验、分析数据、撰写论文;万磊:进行实验设计,为论文提供方向;赵磊采集标本; 李舒,李方泽,胡赛赛,陈莹莹:收集资料。
所有作者声明不存在利益冲突关系。

