青砖茶特色中药茶饮的减肥作用研究
解晓敏,马梦君,韦华琴,武 阳,晏 彪,汤 民,杨 旭,马 萍*
1. 湖北科技学院 药学院,湖北 咸宁 437100;2. 湖北省智慧康养产业技术研究院,湖北 咸宁 437100;3. 咸宁市农业科学院,湖北 咸宁 437100;4. 湖北科技学院 基础医学院/咸宁市健康环境工程技术研究中心,湖北 咸宁 437100
近年来,肥胖症的发病率大幅度增加,然而更重要的是肥胖症患者合并的多种其他疾病如糖尿病、高血压、心血管疾病及心理健康等危险程度已超过肥胖本身,且亚洲人患糖尿病和高血压的绝对风险都高于其他人群[1,2]。当患有慢性疾病如糖尿病和心血管疾病时,与仅仅患有肥胖症相比,残疾率和死亡率都会显著提高。因此,肥胖症及其相关的代谢性疾病已成为影响人类生活质量的主要因素。
氧化应激是由体内氧化与抗氧化作用之间不平衡引起的,最近越来越多的研究集中在中药对抗氧化应激的作用上[3]。据报道,决明子的各种提取物具有很强的抗氧化潜力。一种从决明子中分离出来的蒽醌衍生物Obtusin 具有显著的抗氧化活性[4]。有研究报道,决明子在小鼠巨噬细胞中表现出抗炎和抗氧化作用[5]。有研究确定荷叶潜在的黄酮类生物活性成分并通过细胞和动物实验评价其抗氧化和抗炎作用,为荷叶的食用和药用价值提供参考[6]。茯苓是一种重要的真菌,具有很高的药用和营养价值[7]。有报道,茯苓激活肝FXR,可激活PPARa,抑制SREBP-1c,减少脂质沉积[8]。绞股蓝,也被称为“绞股兰”,是亚洲国家的传统药物和凉茶[9]。决明子、荷叶、茯苓和绞股蓝都具有一定的调节脂质代谢与降血脂的作用,并且决明子、荷叶及茯苓等都具有抗炎作用。
茶作为天然饮料,具有多种药理与保健功效[10,11]。青砖茶的减肥效果已被证明[12]。青砖茶中茶多酚、茶多糖含量较多,是青砖茶发挥药理功效的主要化学物质组分。有许多研究证明,茶多酚和茶多糖具有抗氧化及抗炎作用[13]。有研究表明,贮存年限会影响黑茶的品质,黑茶越陈越好[14]。本试验通过将十年青砖陈茶与一年新茶作对照,研究储存年限对青砖茶品质的影响。同时将青砖茶与决明子、荷叶、绞股蓝和茯苓按3 ∶2 ∶2 ∶1 ∶2(质量比)比例混匀制成青砖茶特色中药减肥茶饮,探究青砖茶中药特色茶饮缓解氧化应激和炎症效果,为中药茶饮的开发利用提供思路与参考。
1 材料与方法
1.1 试验动物与试剂
1.1.1 试验动物
5 周龄SPF 级雄性C57BL/6J 小鼠48 只,批号SCXK(辽)20200001,购自辽宁长生生物技术股份有限公司,饲养于湖北科技学院基础医学院动物房。小鼠购入后先适应性饲养1 周,试验期间小鼠均在室温(24 ± 2)℃、相对湿度(50 ± 5)%、光/暗周期12 h/12 h 的环境下喂养,并按试验动物使用的3 R原则给予人道关怀。
1.1.2 药品与试剂
2012 年青砖茶(执行标准GB/T 9833.9—2002)、2022 年青砖茶(执行标准GB/T 9833.9—2002)、茯苓(执行标准《中国药典》2020 年版第一部)、决明子(执行标准《中国药典》2020 年版)、荷叶(执行标准《中国药典》2020 年版)、绞股蓝(执行标准《中国药典》2020 年版)及高脂饲料[许可证号SCXK(京)2008—0006,小黍有泰(北京)生物科技有限公司]。硫代巴比妥酸(批号20160226)、三氯乙酸(批号20180112)、氢氧化钠(批号C14465746)等,均购自国药集团化学试剂有限公司;LDL 试剂盒(批号202203)、HDL试剂盒(批号202203)、TG 试剂盒(批号202203)、TC 试剂盒(批号202203)、8-OHdG 试剂盒(批号202203)、IL-6 试剂盒(批号202203)、IL-1β 试剂盒(批号202203),均购自上海酶联生物科技有限公司;活性氧ROS检测试剂盒(批号22192211),北京普利莱基因技术有限公司。
1.1.3 仪器设备
电子天平(奥豪斯,常州);5424R 低温冷冻离心机(Eppendorf,德国);Power wave XS 酶标仪、ELx800 荧光酶标仪(美国Bio-Tek仪器有限公司);HH-42 三用电热恒温水箱(北京长源实验仪器厂)。
1.2 试验方法
1.2.1 小鼠分组及处理
适应性喂养1 周后,将48 只5 周龄C57BL/6J雄性小鼠随机分为4 组:空白对照组(Control)、肥胖模型组(Obesity)、新茶减肥组(New Tea,NT)和陈茶减肥组(Old Tea,OT),每组12 只。前5 周单纯造模,给予空白对照组普通饲料喂养,其他组均给予高脂饲料喂养,期间每周测量身长和体重。从第6 周开始,NT 组给予灌胃2022 年青砖茶特色中药茶饮(新茶),OT 组给予灌胃2012 年青砖茶特色中药茶饮(十年陈茶)。Control 组和Obesity 组给予灌胃生理盐水为对照,期间每天监测小鼠体重,每周监测小鼠体长。第17 周结束给药,肥胖模型组体重达正常对照组体重的120%,小鼠肥胖模型建立成功(图1)。

图1 实验流程图Figure 1 Experimental flow chart
1.2.2 青砖茶特色中药茶饮的配制
分别将2022 年青砖茶、2012 年青砖茶、决明子、荷叶、绞股蓝和茯苓用研磨打粉机磨成粉末,按照青砖茶、决明子、荷叶、绞股蓝、茯苓的质量比3 ∶2 ∶2 ∶1 ∶2 混匀制作成青砖茶特色中药茶饮配方粉末。根据人体每天能够承受的适宜饮茶量,依据《动物与人体的每千克体重剂量折算系数表》(表1)转换成小鼠每天最大饮茶量。具体方法为已知A 种动物每千克体重用药量,预估算B 种动物每千克体重用药剂量时可先通过表1 找出折算系数(W),再按下式计算:B种动物的剂量(mg/kg)=W×A 种动物的剂量(mg/kg)。已知人体可承受的青砖茶饮用量为17 g/d,需折算为小鼠量。查A 种动物为成人,B 种动物为小鼠,交叉点为折算系数W= 9.01,故小鼠每日灌胃青砖茶量应为2.56 mg/g。
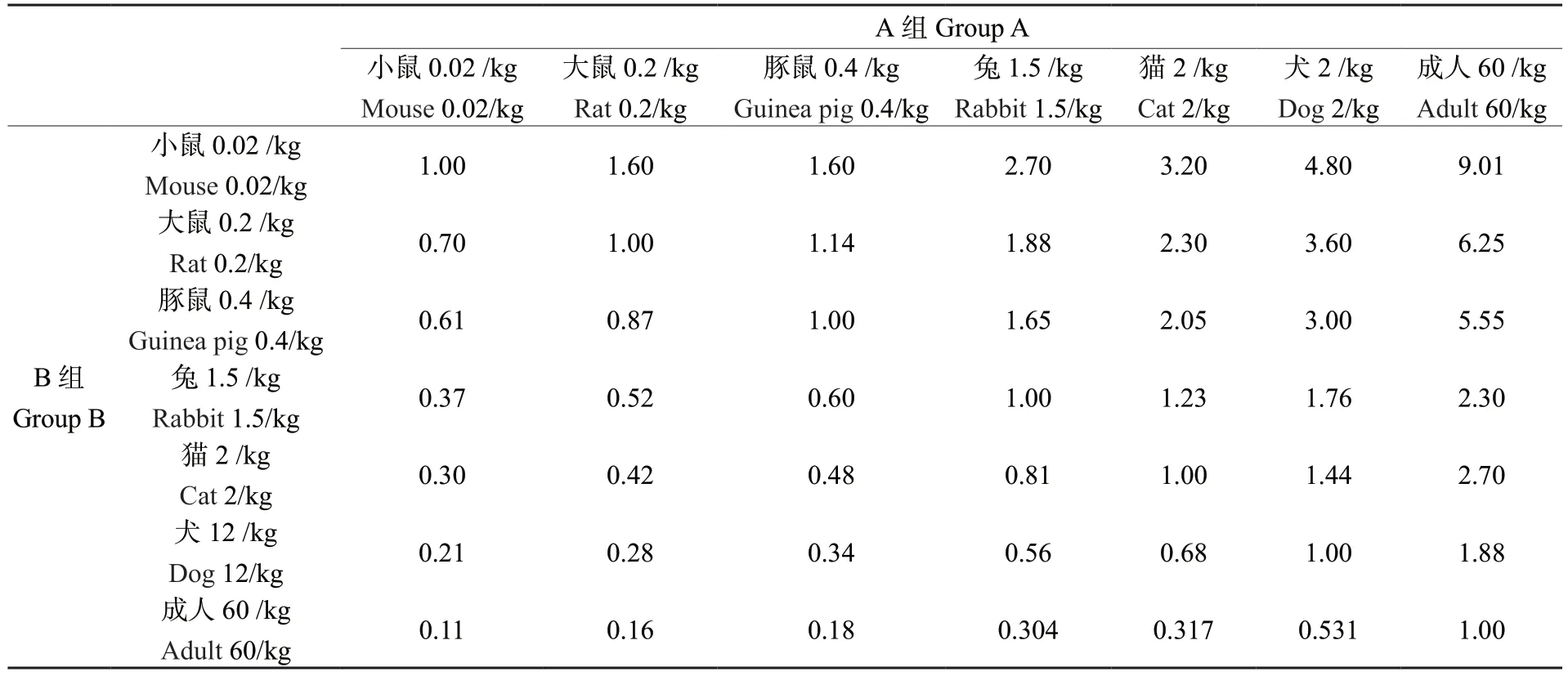
表1 动物与人体体重剂量折算系数(W)表Table 1 Conversion coefficients (W) of dose per kilogram of body weight for animals and humans
1.2.3 肥胖生化指标测定
造模成功后,将小鼠放入代谢笼中,12 h后将收集的尿液1500 r/min 离心10 min,取上清液分装放置于-80℃冰箱。留取尿液后用10%水合氯醛麻醉小鼠,剪去小鼠颈部下方皮肤,露出小鼠胸骨柄及肋间,于左侧第二肋间与第三肋间且靠近胸骨柄处用1 mL 注射器缓慢抽取心脏血液0.8 ~ 1.0 mL,再缓慢放入1.5 mL 的EP 管中,室温下静置30 min 后,25℃、3 000 r/min 条件下离心15 min,取上清液于新的EP管中放入-80℃冰箱,备用。
小鼠心脏取血结束后,取完整的肝组织,用PBS(pH 7.5)洗净,滤纸上吸干水分,称重,冰浴条件下根据肝组织净重:PBS = 1 ∶9的体积比制成10%的肝组织匀浆。随后在4℃、10 000 r/min 的条件下离心15 min,取上清液分装放置于-80℃冰箱。使用ELISA 试剂盒检测TG、TC、LDL 及HDL。操作步骤严格按照说明书进行。
1.2.4 8-OH-dG 的测定
使用ELISA 试剂盒检测8-OH-dG。操作步骤严格按照说明书进行。
1.2.5 炎症因子的测定
使用ELISA 试剂盒检测IL-6 和IL-1β。操作步骤严格按照说明书进行。
1.2.6 ROS 的测定
使用DCFH-DA(2,7-dichlorofluorescin diacetate)探针方法。用PBS : 肝匀浆上清 =9 ∶1 的体积比稀释肝匀浆上清,并将荧光染料DCFA-DA 按1 ∶1 000 000 稀释。之后再1 ∶1 加入稀释匀浆液和稀释后的DCFA-DA 荧光染料于酶标板中,轻微摇匀,室温下避光静置5 min,置于酶标仪中检测吸光度。
1.2.7 MDA 的测定
取50 μL 肝匀浆上清及200 μL 0.6%TBA 至1.5 mL的EP管中,沸水浴煮15 min,冷水中降温,10 000 r/min、4℃条件下离心5 min,取上清液100 μL 至酶标板上,用全波长酶标仪分别测量450 nm、532 nm 及600 nm 波长下的吸光度。MDA浓度(mol·L-1)= 6.45(A532-A600)-0.56×A450。
1.2.8 HE 及油红O 染色肝脏组织病理学观测
将小鼠肝脏组织分离,切大小合适的块状组织,用4%多聚甲醛缓冲液固定48 h,制作病理切片,进行苏木精-伊红(HE)和油红O 染色,光学显微镜下观察各组小鼠肝脏组织病理学变化情况。
1.3 数据统计分析
所有数据均以平均值 ± 标准误差(SEM)表示。日期分析和图表生成使用GraphPad Prism 9.0 软件(Origin Lab,Berkeley,CA,USA)进行。方差比较后进行Tukey-Kramer 检验。p< 0.05被认为具有显著性差异。
2 结果
2.1 小鼠体重及身长
表2 和图2 分别显示各组小鼠最后一天体重及Lee’s 指数情况。与空白对照组相比,肥胖造模组的体重及Lee’s 指数明显升高;与肥胖造模组相比,NT 组和OT 组的体重及Lee’s 指数均明显下降。

表2 青砖茶特色中药茶饮对肥胖小鼠体重的影响Table 2 Effect of Qing brick tea special Chinese herbal tea on the body weight of obese mice
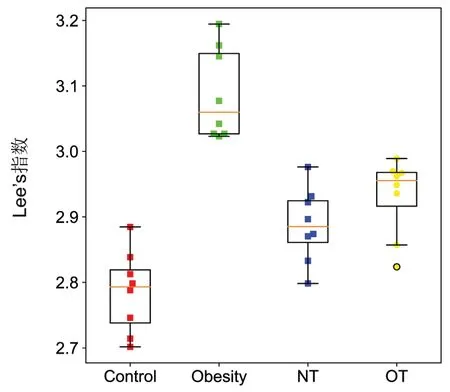
图2 不同处理组小鼠最后一天Lee’s 指数Figure 2 Lee’s index on the last day of mice in different treatment groups
2.2 小鼠血清中TC、TG 含量及匀浆中TC、TG、HDL、LDL 含量
图3A 显示各处理组小鼠血清中肥胖指标TC、TG 含量的测定结果。与空白对照组相比,肥胖造模组TC 和TG 含量明显升高;与肥胖造模组相比,NT 组和OT 组的TC 和TG 含量均明显下降,且OT 组下降更为显著;与NT 组比较,OT 组血清中TG 含量下降且有显著性差异。

图3 小鼠TC、TG、HDL、LDL 含量Figure 3 TC, TG, HDL, LDL content in mice
图3B 显示各处理组匀浆中肥胖指标TC、TG、HDL 及LDL 含量的测定结果。与空白对照组相比,肥胖造模组TC、TG 及LDL 含量明显升高;与肥胖造模组相比,NT 组和OT 组的TC、TG 及LDL 含量均明显下降,且OT 组TC、TG 含量下降更为显著;与NT 组比较,OT 组匀浆中TC 含量下降且有显著性差异。
图3C 为各处理组小鼠肥胖指标TC、TG、HDL 及LDL 的气泡图,圆圈大小及颜色深浅代表指标含量的多少。与空白对照组相比,肥胖造模组TC、TG 及LDL 的圆圈更大且颜色更深;与肥胖造模组相比,NT 组和OT 组TC、TG 及LDL 的圆圈更小且颜色更浅,且OT 组比NT 组更为显著。
2.3 小鼠肝组织HE 染色及油红O 染色
与空白对照组比较,Obesity 组、NT 及OT组小鼠肝细胞内存在大量脂质空泡、气球样变性(图4A,HE 染色),且Obesity 组最为明显,NT 组次之。

图4 小鼠肝组织病理切片Figure 4 Histopathological section of mouse liver
与空白对照组比较,Obesity 组、NT 及OT组小鼠肝细胞内脂滴增多(图4B,油红O 染色)。NT 和OT 治疗后,油红染色均显示肝细胞内脂滴显著减少且OT 组更为明显。
2.4 氧化应激指标
与空白对照组相比,肥胖造模组ROS 和MDA 含量升高,具有显著性差异;与肥胖造模组相比,NT 组和OT 组ROS、MDA 及8-OH-dG含量均明显下降,且OT 组ROS 和MDA 含量下降更为显著(图5)。
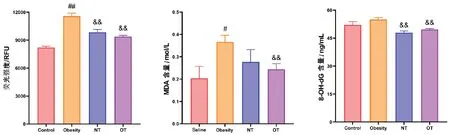
图5 氧化应激指标的测定结果Figure 5 Measurement results of oxidative stress indicators
2.5 炎症因子变化
如图6 所示。与空白对照组相比,肥胖造模组IL-6 及IL-1β 均升高,且具显著性差异;与肥胖造模组相比,NT 组和OT 组IL-6 含量明显下降,且OT 组ROS 和MDA 含量下降更为显著。
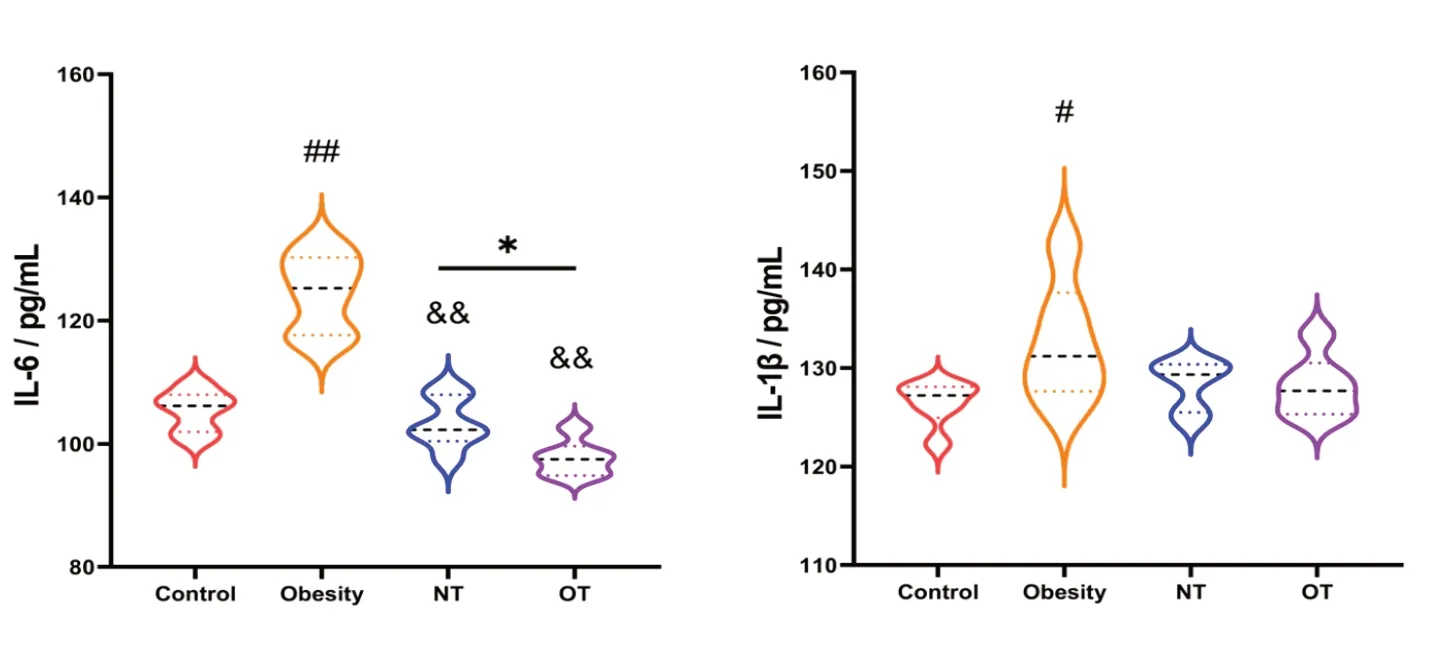
图6 炎症因子测定结果Figure 6 Measurement results of inflammatory factors
3 讨论
本研究所建立的肥胖症模型是指体内储存的脂肪超过理想体重的20%以上[15],是一种由遗传因素、环境因素等多种原因相互作用引起的慢性代谢性疾病,其发生机制是因为能量摄入超过能量消耗导致体内脂肪过度蓄积和体重超常。有研究表明,昼夜节律改变和肠道微生物对肥胖及其复杂的相关性代谢性疾病有关[14]。在控制肥胖和肥胖相关的代谢疾病渐渐成为一种全球流行病的趋势下,我们主要从饮食方面入手探讨青砖茶特色中药茶饮的减肥效果及机制。
小鼠日常标准食物的脂肪含量一般在17%左右[16]。为了建立肥胖模型,本试验使用的高脂食物脂肪含量达60%,几乎是正常的三倍多。对野生型小鼠来说,长期食用高脂食物会使体重快速增加,导致脂肪肝。目前,肥胖症的表观检测指标主要是体重和体长,处理组超过对照组20%视为肥胖,体长以Lee’s 指数判断。Lee’s[17]越大,则肥胖程度越高。本试验结果表明,Obesity 组的体重均超过了空白对照组平均体重的20%,即造模成功。与Obesity 组相比,NT 组和OT 组的体重及Lee’s 指数明显下降,即均具有一定的减肥效果。
进一步的试验结果表明,HE 染色后肝组织的细胞核和细胞质分别被染色为蓝色和红色。与空白对照组相比,Obesity 模型组的肝脏出现脂肪变性、肝细胞肿大和细胞质中大量脂肪滴空泡。显然,NT 和OT 干预小鼠的肝脏肿大在一定程度上减轻了,细胞质中的脂肪滴液泡减少了。与空白对照组比较,油红O 染色后Obesity 组小鼠肝细胞内脂滴增多,同时NT 组和OT 组相对不明显,表明NT 和OT 显著减轻了高脂饲料诱导的肝组织形态学变化且OT 组更明显。以上病理切片表明,NT 和OT 组的中药配方可减轻肥胖症,且十年陈茶的效果更好。
有文献报道,在基线时肥胖与甘油三酯、总胆固醇和高密度脂蛋白胆固醇呈正相关,与低密度脂蛋白呈负相关[18]。研究表明,多项肥胖指标显示出正相关的HDL-C 浓度,有文献则表明当脂肪摄入量增加时HDL-C 浓度会相应下降,从而增加患者患上心脏病的危险性[19]。本试验结果显示,Obesity 组小鼠甘油三酯、总胆固醇及低密度脂蛋白显著升高,NT 和OT 组相对Obesity 组发生明显的下降。
从中医的角度来看,中医身体成分在人体成分分类中起着核心作用[20]。根据中医理论,肥胖属于“浊证”范畴,主要是脾脏“升降失调”所致[21]。砖茶中的茶多酚促进脂肪分解和减肥的生物活性受到了较广泛的关注[22]。决明子、荷叶、茯苓和绞股蓝等其具有的健脾、益气、利湿作用,对于减肥有很大功效[23-26]。
在肥胖症中,脂肪量与人类和动物的全身氧化应激有关[27]。在哺乳动物中,肥胖和肥胖相关并发症会影响线粒体代谢,从而有利于ROS 的产生和氧化应激的发展[28]。8-羟基脱氧鸟苷(8-OH-dG)是一种氧化性DNA 损伤副产物,也是氧化应激普遍存在的标志物[29]。丙二醛(MDA)是脂质过氧化过程的终产物之一,也是最常见的氧化应激生物标志物之一[30]。肥胖会增加氧化应激引起的脂质过氧化水平[31]。本研究探讨了小鼠灌胃青砖茶特色中药茶饮降脂是否会伴随着氧化应激的缓解,结果表明仅进行高脂饲料喂养的小鼠ROS、MDA 及8-OHdG 含量均明显增强。与Obesity 组相比,NT 组和OT 组的ROS、MDA 及8-OH-dG 含量显著降低,表明小鼠灌胃青砖茶特色中药茶饮降脂过程中伴随着氧化应激的缓解。有研究表明,炎症是肥胖中氧化应激升高的一种表现[32],同时,也是另一个重要来源[33]。本试验同时探讨了小鼠灌胃青砖茶特色中药茶饮在降脂过程中是否伴随着炎症因子的产生。试验结果表明,与空白对照组比,Obesity 组、NT 组和OT 组的IL-6 含量显著升高,且NT 组和OT 组相对于Obesity 组含量有明显下降趋势。说明小鼠灌胃青砖茶特色中药茶饮可以抑制氧化应激因子的产生,促进炎症因子的释放,达到减肥的效果,且陈茶比新茶更加明显。
综上,青砖茶特色中药配方可通过促进炎症因子的释放,抑制氧化应激因子的产生,达到减肥的效果,且陈茶比新茶更加明显。

