基于线粒体CO Ⅰ基因的6 个鲤亚科种群遗传结构研究
■ 文|广东省农业技术推广中心 姚东林 朱静璇 罗文范 何元文
清远市农业科技推广服务中心 王超
华南农业大学海洋学院 谢少林
鲤(Cyprinus carpiolinnaeus)是中国最常见的鲤属鱼类,伍献文先生将中国的鲤分为四个亚种,其中华南鲤是鲤在华南地区亚种,分布于珠江水系及其南部包括海南岛在内的华南地区,华南鲤是华南地区分布最为广泛的鲤属鱼类,遍布于华南地区各水系。三角鲤(Cyprinus multitaeniatapellegrin et chevey)分类上为鲤属、中鲤亚属(Mesocyprinus Fang),又名黄板鲫、黄鲫和江鲫,其分布范围很小,主要分布于我国广西珠江水系支流的西江流域,据资料记载在越南的红河也有少量分布。尖鳍鲤(Cyprinus acutidorsalisWang)分类上为鲤属、鲤亚属(Cyprinus linnaeus,s.Str.),又名海鲤、海鲫,是我国特有的生活于咸淡水中的鲤科鱼类,目前仅在我国的广西钦江出海口有发现分布。须鲫(Carassioidescantonensis Heincke)属于鲤亚科须鲫属(Carassioides Oshima),又名黄鲫、江鲫,据报道仅在在我国珠江流域和海南岛等少数地方有分布,且数量较少。目前已知须鲫分布范围小,且相关报道很少。2013年有研究报道我国云南地区也有须鲫的发现。除此之外于《中国鲤科鱼类志》和《海南岛淡水及河口鱼类志》等文献中也有报道。
细胞线粒体的COⅠ基因序列(细胞色素c氧化酶I)作为分子标记具有诸多优势:有相对保守而又有足够的变异、序列长度合适、可用通用引物扩增和测序等,COⅠ分子标记作为DNA条形码可以快速鉴定物种,近年来被广泛地应用于物种鉴定。
因此,本研究选取了华南地区5个水系作为采样点,采集了华南鲤、尖鳍鲤、三角鲤和须鲫共6个地理种群,其中包括:华南鲤的海南万泉河种群、珠江水系主干河流网的高明河(肇庆)种群和广东东部榕江种群;广西钦江水系的尖鳍鲤种群;广西珠江水系西江的三角鲤种群;海南万泉河水系的须鲫种群。
一、材料与方法
1.仪器
超净工作台;立式电热压力蒸汽灭菌器;超纯水系统;PCR仪;RDY-SPIZ琼脂糖水平电泳仪;小型高速冷冻离心机;漩涡震荡器;台式恒温振荡箱,电热恒温水浴锅;ALPHA IMAGER 2200凝胶成像分析系统;JY600+型双恒电泳仪;-80℃超低温冰箱;-20℃冰箱;电子分析天平;微量移液器等。
2.实验试剂与试剂盒
无水乙醇,75%乙醇,去离子水,双蒸水,琼脂糖、TIANGEN蛋白酶K(20mg/mL)、琼脂糖、Tris平衡酚、苯酚、氯仿、异戊醇、核酸染色剂EB(溴化乙锭)、6×Loading buffer上样品缓冲液、DL2000DNAmarker、TIANGENDNA 提取试剂盒、TIANGEN普通琼脂凝胶DNA回收试剂盒、2×TAQPCRMAasterMIX等。
3.自配实验试剂
50×TAE电泳缓冲液;1×TAE电泳缓冲液;苯酚:氯仿:异戊醇(25∶24∶1);组织细胞裂解液;E缓冲液(pH8.0)等。
4.样品采集与处理
样品采集地点和种类如表1所示。将采集的鱼取一小块鳍条或者肌肉组织,放置于装有无水乙醇的5mL离心管中保存待测。
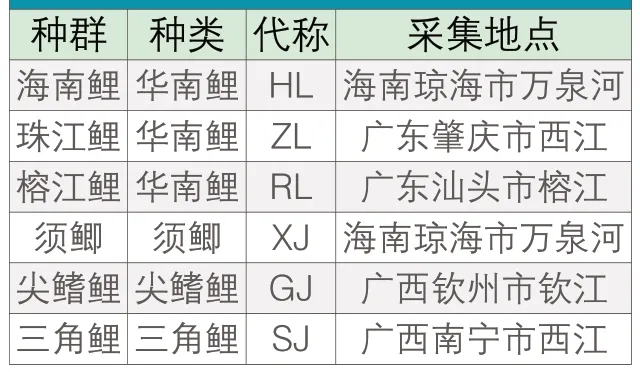
表1 样品采集地点和种类
5.DNA提取和检测
提取:本研究DNA提取分为两种,分别为自配试剂提取和试剂盒提取,试剂盒提取按照TIANGEN试剂盒说明书操作。
检测:取5µL已提取的DNA样品液并加入1µL的 6×Loading buffer上样品缓冲液混匀,用移液枪逐个加入凝胶点样孔中,同时保留一孔点上DL2000的DNAmarker,设置电压120V进行恒定电压电泳,定时30min,取出凝胶放入凝胶成像系统,打开电脑软件进行观察,拍照并记录DNA提取情况。
6.引物设计和PCR扩增
本研究根据已经报道的鲤科目鱼类相关序列, 线粒体C OⅠ序列引物采用引物:FishF1:5'-TCAACCAACCACAA AGACATTGGCAC-3',FishR1:5'-TAGACTTCTGGGTGGCCAA AGAATCA-3'。
线粒体COⅠ序列引物FishF1/FishR1PCR扩增程序:94.0℃预变性4min;94.0℃变性30s,60℃退火30s,72.0℃延伸1min,35个循环;最后72.0℃延伸5min,4℃保存。
7.DNA序列测定
将PCR所得产物PCR直接进行琼脂糖凝胶电泳检测,将检测所得DNA条带的产物送往上海美吉生物医药科技有限公司广州测序部进行DNA序列测序。
8.数据处理
采用Chromas软件查看序列的测序效果,并以此为依据判断测序是否准确。使用MEGA6.06软件的ClustalW功能进行序列比对,并进行人工矫正,去除受干扰序列片段后计算碱基组成比例、平均碱基数、简约信息位点等数值。使用DNASP软件进行中性假说检验(Fu's Fs-test和Tajima's D算法)和核苷酸分析,并计算平均核苷酸差异值和核苷酸多样性。使用Allequin V3.5.1.3软件分析单倍型多样性和单倍型组成等。
二、结果
1.PCR扩增结果
获得清晰的条带,如图1、2所示。

图1 COⅠ序列FishF1/FishR1引物的PCR扩增结果,从左边数起:1~3三角鲤,4~6为尖鳍鲤,7~9为须鲫,10为mark。

图2 COⅠ标记FishF1/FishR1的PCR扩增结果,从左边数起:1为mark,2~4为海南鲤,5~7为珠江鲤,8~10为榕江鲤。
2.COⅠ序列结构和变异
一共获得COⅠ序列共109个,其中:海南鲤19个;珠江鲤16个;榕江鲤17个;须鲫18个;尖鳍鲤18个;三角鲤21个。利用MEGA6.0比对线粒体控制区序列,并去除两端不准确的序列,获得610bp的序列(珠江鲤有一个序列多出一个碱基,为611bp)。各种群COⅠ序列的A+T平均含量(54.09±0.56)高于C+G的平均含量(45.92±0.56)。在六个种群中,须鲫的A+T比例最高,为54.76%,而三角鲤最低,为53.12%,而海南鲤、珠江鲤、榕江鲤和尖鳍鲤分别为53.99%、54.34%、54.37%、53.94%,可见六个种群COⅠ序列的碱基组成差异不大。
3.基于线粒体COⅠ的遗传多样性分析
根据表3和表4,可以发现COⅠ序列总样本间的简约信息位点为92个,平均核苷酸差异值为31.094,核苷酸多样性值为0.05097,单倍型多样性为0.884。在六个群体中,珠江鲤的简约信息位点数目(ZL)最多,为5个,而其次依次为:海南鲤、榕江鲤都为4个,而须鲫、尖鳍鲤和三角鲤没有简约信息位点。基于COⅠ序列,珠江鲤简约信息位点数目,核苷酸多样性和单倍型多样性等指标最大,这从一定程度上说明了珠江鲤的COⅠ序列多样性最大,其次分别是海南鲤和榕江鲤,而须鲫、尖鳍鲤和三角鲤COⅠ序列的多样性非常小,明显小于三个鲤群体,其中尖鳍鲤没有COⅠ序列变异,而须鲫和三角鲤分别只有一个单点突变位点,没有简约信息位点。
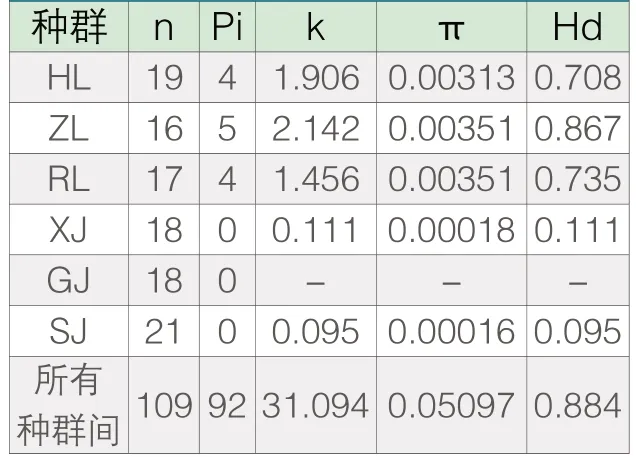
表3 CO Ⅰ序列位点信息和多样性分析
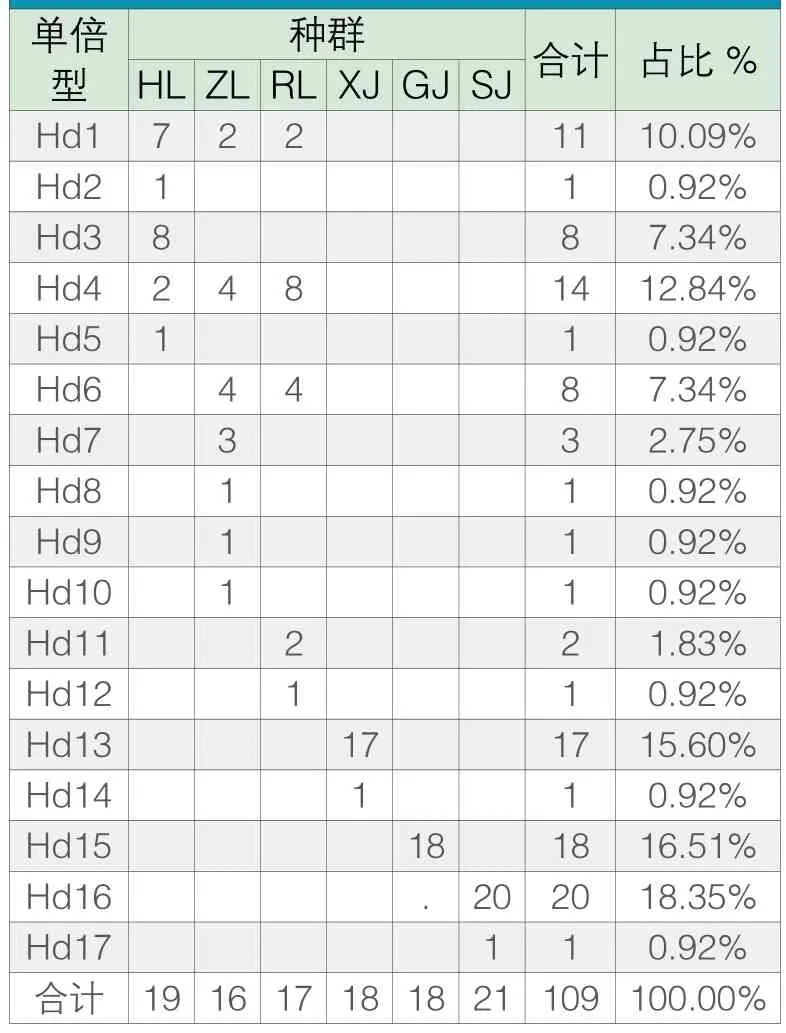
表4 CO Ⅰ序列单倍型在各种群间的分布
在六个群体109个COⅠ序列中共有17种单倍型,其中海南鲤、珠江鲤和榕江鲤有两种三者共有的单倍型,为Hd1和Hd4。而海南鲤和珠江鲤除了Hd1和Hd4外没有其他共同单倍型。珠江鲤和榕江鲤除了Hd1和Hd4外,还有Hd6为共同单倍型。此外,海南鲤有3种特有单倍型,为Hd2、Hd3、Hd5;珠江鲤有4种特有单倍型,分别为Hd7~Hd10;须鲫有两种单倍型,都为特有单倍型,其中Hd13单倍型有17个个体,而Hd14单倍型的个体仅为1个;尖鳍鲤只有一种单倍型,为特有单倍型;三角鲤有两种单倍型,都为特有单倍型,其中Hd16为20个个体,而Hd17仅为一个个体。
4.种群动态分析和中性检验
由表5 可得,而在基于COⅠ的遗传距离中三个华南鲤种群的遗传距离在0.0024~0.0035之间,而须鲫、尖鳍鲤和三角鲤的内部遗传则接近于0,说明华南鲤三个种群基于COⅠ序列的种内差异水平大致相同,而须鲫、尖鳍鲤和三角鲤种群内的COⅠ序列则几乎没有差距。
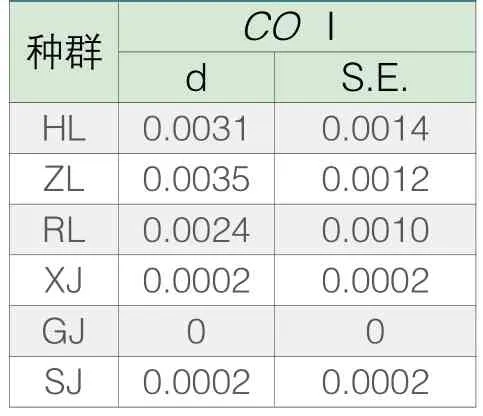
表5 各种群内部基于线粒体CO Ⅰ的Kimura 双参数模型遗传距离和标准差
根据表6,基于线粒体COⅠ序列的Tajima's D和Fu's Fs statistic值中,当以所有群体为对象时,中性检测数值为正数且有显著性差异(P<0.05),说明了在以所有种群线粒体COⅠ为检验对象时,群体间变异符合中性假说,且可以认为在种群间在较近历史内没有发生较大的种群扩张。
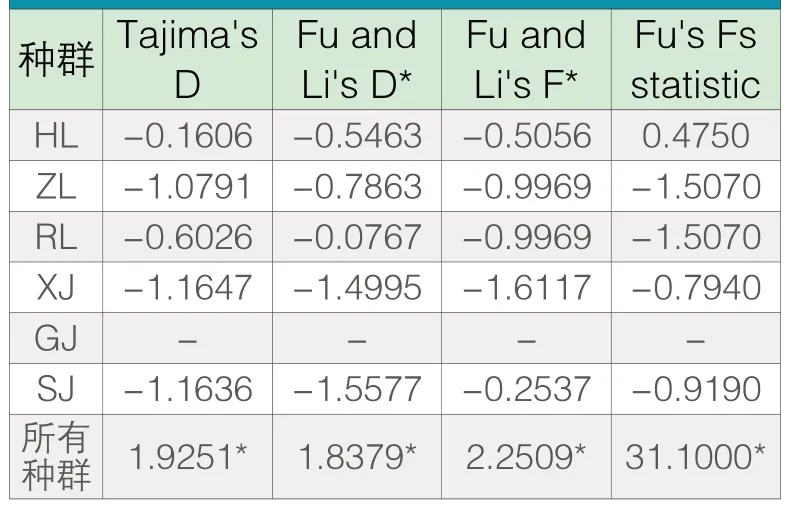
表6 基于线粒体CO Ⅰ序列的中性检验
三、讨论
三个华南鲤种群在COⅠ序列上存在共同单倍型,其中基于线粒体的三个种群共同单倍型只有一个,而海南鲤和珠江鲤两者之间共同单倍型为5个,珠江鲤和榕江鲤两者的共同单倍型为3个。此外,海南鲤和榕江鲤并没有共同单倍型,这也说明了珠江鲤可能是海南鲤和榕江鲤的发源地,通过冰期或者地貌运动等原因分别进入到不同流域。基于总群体Tajima's D和Fu's Fs statistic的中性检测值符合中性学说,说明群体内的简约位点和单点突变等多数突变是中性的,且近期并没有较大的自然选择压力。此外,本研究发现尖鳍鲤、三角鲤和须鲫三者没有出现共同单倍型,由此可见,三者之间在短期内没有出现种群交流,同时说明彼此间种群分化较大。而三角鲤和须鲫与华南鲤之间也没有共同单倍型,这也说明了三角鲤和须鲫在较近的历史内没有和华南鲤有基因交流,且物种分离的历史比较久远。
单倍型多样性和核苷酸多样性是衡量种群遗传多样性(Genetic diversity)的重要指标,可以作为物种保护的重要参考。本研究表明,基于线粒体COⅠ标记的单倍型多样性中,珠江鲤遗传多样性最高,为0.867,其次为榕江鲤和海南鲤种群,分别为0.735和0.708,而核苷酸多样性珠江鲤(0.00351)和榕江鲤(0.00351)一致,高于海南鲤(0.00313),这说明了海南鲤虽然具备较高的单倍型多样性,但是没有足够的时间积累核苷酸多样性,单倍型之间的核苷酸差异小于珠江鲤和榕江鲤。此外,须鲫、尖鳍鲤和三角鲤种群基于COⅠ序列的核苷酸多样性较低,核苷酸多样性分别为0.00018、0和0.00016;而基于COⅠ序列的单倍型多样性分别为0.111、0和0.095,其多样性指标远低于华南鲤的三个种群。这表明须鲫、尖鳍鲤和三角鲤的COⅠ序列上还没积累足够的变异。由于须鲫、尖鳍鲤和三角鲤种群的中性检测Tajima's D和Fu's Fs statistic值都没有出现具有显著差异性的负值,因此不能证明其在短期内经历过种群扩张。本研究认为须鲫、尖鳍鲤和三角鲤种群基于COⅠ序列多态性低的可能原因有两个:一是须鲫、尖鳍鲤和三角鲤都是分布范围很小的地方性品种,且受到时间、空间等因素影响,本研究采样的种群多样性也受到限制,容易出现近缘个体,也可能是遗传多样性较小的原因之一。二是地方特有种往往生存竞争力较低,容易受到外来入侵物种和外界环境的干扰而导致种群规模大量减少,当种群规模恢复后其种群容易出现同质性高而多样性低的特点,且COⅠ序列的碱基突变速率相对于线粒体控制区较慢,而须鲫、尖鳍鲤和三角鲤的线粒体COⅠ序列上还没积累足够多的变异。
———榕江苗族蜡染

