α-羟基-γ-丁内酯类衍生物的设计、合成及抗植物病毒活性
贺宏伟, 徐 丹,2, 徐 功*,,2
(1.植保资源与病虫害治理教育部重点实验室,西北农林科技大学 植物保护学院,陕西 杨凌 712100;2.陕西省天然产物化学生物学重点实验室,西北农林科技大学 化学与药学院,陕西 杨凌 712100)
植物病毒是一类危害农作物的重要病原,可侵染粮食作物、经济作物、园艺观赏植物而使得植物产量下降和品质降低。使用抗病毒药剂是防治植物病毒病不可缺少的有效手段[1-3]。然而,目前仅有少数商品化药剂用于防治植物病毒病,如宁南霉素、病毒唑、香菇多糖、氨基寡糖素等[4],这些药剂因其药效有限 (一般低于60%) 而受到较大限制[5]。因此,创制高效、安全、环境友好的新型抗病毒药剂迫在眉睫。结构新颖的天然产物是新型农药的重要来源[6-8],它不仅可以提供独特的作用方式,还具有良好的环境相容性[9],因此以天然产物作为先导化合物开发新型抗植物病毒剂受到了广泛的关注[10],这对于开发绿色抗植物病毒剂具有重要的意义。
木脂素是一类由苯丙素氧化聚合而成的天然产物,广泛存在于植物中[11],具有抗氧化[12]、抗肿瘤[13]、杀虫[14]、抑菌[15]和抗病毒[16-18]等多种生物活性。2012 年,高雪梅等[19]从烟草Nicotiana Tabacum中分离得到一种降木脂素类化合物nicotlactone A (图式1),其核心骨架含有γ-丁内酯结构,通过抗病毒活性测试发现,nicotlactone A 在浓度20 μmol/L 下对烟草花叶病毒 (TMV) 的抑制率达到58.4%,表现出较高的抗病毒活性,优于对照药剂宁南霉素和病毒唑等。另外,其他含有γ-丁内酯或者四氢呋喃结构的木脂素类化合物,如nicotnorlignan A、nicotnorlignan C、nicotlactone B、austrobailignan 和clinopodphenol B 也表现出一定的抗病毒活性[20-23](图式1)。
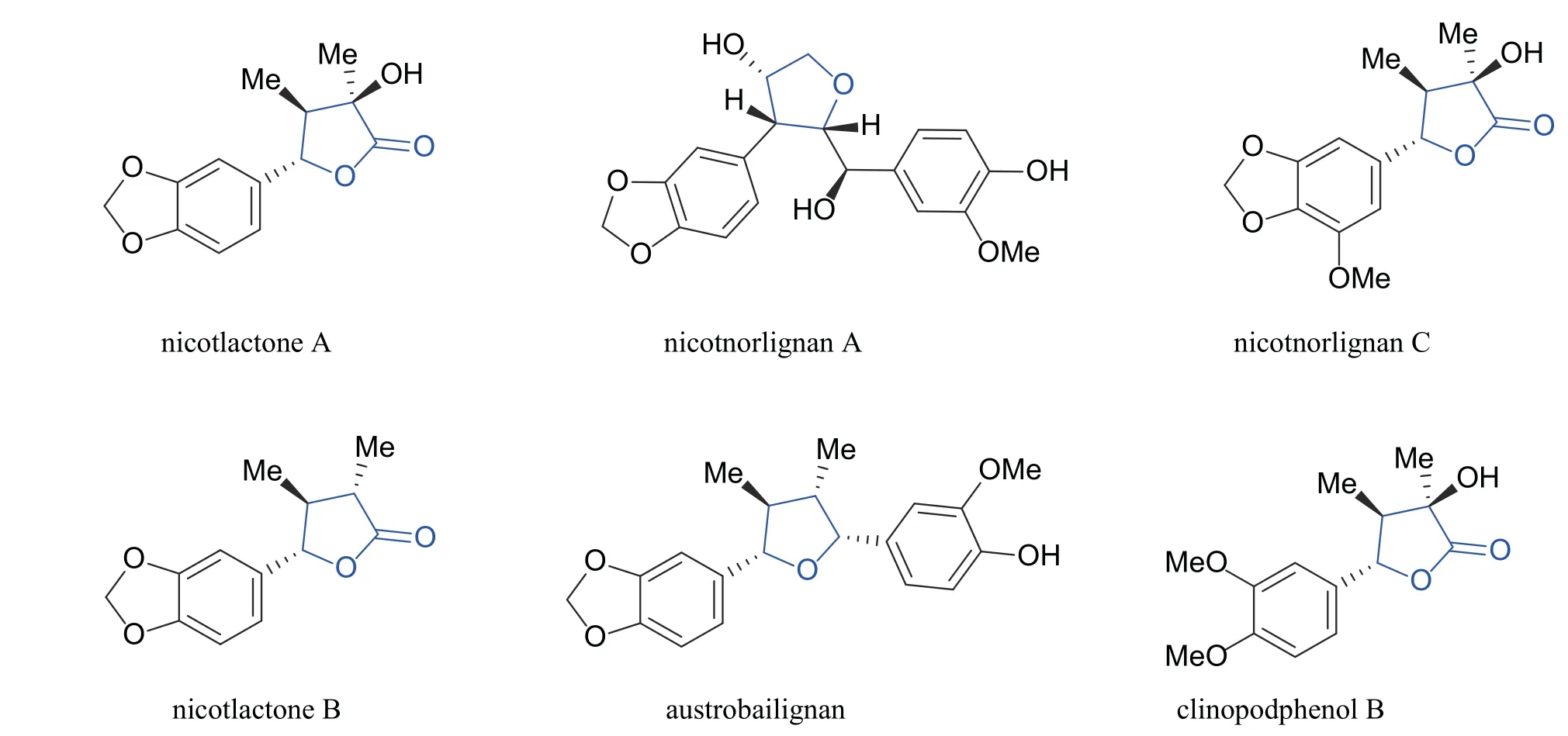
图式 1 含有γ-丁内酯或四氢呋喃结构片段的木脂素类天然产物Scheme 1 Natural products containing γ-butyrolactone or tetrahydrofuran structural fragments
基于nicotlactone A 具有较好的抗TMV 活性,本课题组近期对nicotlactone A (L1,图式2)的合成和构效关系进行了研究,结果发现:γ-丁内酯环上8 位甲基对该类化合物的抗TMV 活性影响较小[24],合成的(±)-nicotlactone A (L1) 和(±)-8-demethylnicotlactone A (L2,图式2) 在500 μg/mL下对TMV 的钝化活性分别为78.3%和72.8%,优于阳性对照病毒唑 (53.5%),且与宁南霉素 (73.6%)活性相当。化合物L2 的合成是以苯并[1,3]二氧杂-5-甲醛为原料,经Babier 反应和Mukaiyama 水合反应2 步所得,合成路线相对简短,然而存在关键步骤Mukaiyama 水合反应不易放大,且产物以非对映体混合物的形式存在的问题,从而限制了化合物L2 的规模化合成和进一步应用。基于此,本研究以化合物L2 为先导化合物,通过骨架跃迁的策略,将苯环迁移到9'位甲基,设计合成一系列具有全新骨架的α-羟基-γ-丁内酯类化合物并对其抗病毒活性进行评价,以期找到易于合成的高抗病毒活性候选化合物。
目标化合物的设计见图式2,合成路线见图式3。
1 实验部分
1.1 仪器与试剂
Burker AV-400 核磁共振波谱仪 (以TMS 为内标,氘代二甲基亚砜或氘代氯仿为溶剂),柱层析硅胶 (筛孔径48~75 μm) 和薄层层析硅胶板(GF254型) 均购于青岛海洋化工厂;所用试剂均为市售分析纯或化学纯。

图式 2 目标化合物的设计Scheme 2 Design of the target compounds
1.2 化合物的合成
1.2.1 中间体化合物 (2a~2b,6a~6r,7a~7c) 的合成 以化合物2a 的合成为例。参考文献反应条件[25-26],在氮气保护下,将苯并[1,3]二氧杂-5-甲醛(1a,300.2 mg,2 mmol) 和α-溴代丁内酯 (396.0 mg,2.4 mmol) 溶于8 mL 无水叔丁醇和四氢呋喃 (3 : 1)的混合溶剂中。将反应体系置于0 ℃下,在30 min内分批加入t-BuOK (269.3 mg,2.4 mmol),并将所得悬浮液在相同温度下搅拌1 h,最后将得到的淡黄色混合物移至室温下继续搅拌12 h。待反应结束后,用冰水 (20 mL) 淬灭反应。分离有机相,并用乙酸乙酯萃取水相,合并有机相后用饱和食盐水 (20 mL) 洗涤,无水MgSO4干燥,过滤,旋转蒸发得到中间体化合物2a,无需纯化直接投入下一步反应。
1.2.2 目标化合物 (3a~3b,8a~8r,9a~9c) 的合成以化合物3a 的合成为例。参考文献方法[27],向反应管中依次加入2a (234.1 mg,1 mmol)、Pd/C (25 mg,10% Pd) 和20 mL 乙酸乙酯,随后加入甲酸 (30 μL,2 mmol) 和三乙胺 (112 μL,2 mmol),在80 ℃下封管反应3 h。冷却至室温,经硅藻土抽滤,滤出Pd/C 催化剂,减压旋转蒸发脱除溶剂,获得粗产物。通过硅胶柱色谱法 (V(乙酸乙酯) :V(石油醚)=1 : 3 至1 : 1) 纯化粗产物,得到目标化合物3a。
3-(苯并[d][1,3]二氧杂环-5-基甲基)-3-羟基四氢呋喃-2-酮 (3a):白色固体, 81%, m.p.119.8-121.3 ℃;1H NMR(400 MHz, CDCl3)δ6.80-6.69 (m, 2H), 6.72-6.63 (m, 1H),5.95 (s, 2H), 4.30 (ddd,J=9.1, 8.3, 4.4 Hz, 1H), 3.87 (ddd,J=9.1, 8.0, 7.1 Hz, 1H), 2.97 (s, 2H), 2.42-2.25 (m, 2H);13C NMR (101 MHz, CDCl3)δ178.8, 148.0, 147.2, 127.8, 123.4,110.5, 108.6, 101.3, 75.3, 65.3, 43.3, 34.1; HRMS-ESI (m/z)(M + Na)+计算值259.0577, 测试值259.0580.
3-(2,3-二氢苯并[b][1,4]二氧杂环-6-基甲基)-3-羟基四氢呋喃-2-酮 (3b):白色固体, 77%, m.p.132.7-134.3 ℃;1H NMR (400 MHz, CDCl3)δ6.80 (d,J=8.2 Hz, 1H), 6.76 (d,J=2.1 Hz, 1H), 6.70 (dd,J=8.2, 2.1 Hz, 1H), 4.29 (td,J=8.7,4.3 Hz, 1H), 4.24 (s, 4H), 3.90-3.80 (m, 1H), 2.94 (d,J=1.7 Hz, 2H), 2.41-2.22 (m, 2H);13C NMR (101 MHz, CDCl3)δ178.8, 143.6, 143.2, 127.4, 123.1, 118.9, 117.6, 75.3, 65.4, 64.4(2C), 42.8, 34.1; HRMS-ESI (m/z) C13H14NaO5+(M + Na)+计算值273.0733, 测试值273.0743.
3-[(2-氟苯基) 甲基]-3-羟基四氢呋喃-2-酮 (8a):白色固体, 86%, m.p.133.4-135.1 ℃;1H NMR (400 MHz, CDCl3)δ7.27-7.14 (m, 2H), 7.08-6.91 (m, 2H), 4.27 (td,J=8.6, 4.5 Hz, 1H), 3.98 (dt,J=9.1, 7.4 Hz, 1H), 3.10-2.93 (m, 2H),2.35-2.11 (m, 2H);13C NMR (101 MHz, CDCl3)δ178.9,161.5 (d,J=244.7 Hz), 132.7 (d,J=4.1 Hz), 129.4 (d,J=8.3 Hz), 124.5 (d,J=3.6 Hz), 121.7 (d,J=15.5 Hz), 115.5 (d,J=22.6 Hz), 75.3, 65.6, 35.5 (d,J=1.8 Hz), 34.2 (d,J=1.9 Hz);HRMS-ESI (m/z) C11H11FNaO3+(M + Na)+计算值233.0584,测试值233.0588.
3-[(3-氟苯基) 甲基]-3-羟基四氢呋喃-2-酮 (8b):白色固体, 84%, m.p.130.2-131.5 ℃;1H NMR (400 MHz, CDCl3)δ7.34-7.24 (m, 1H), 7.01 (dt,J=16.2, 7.0 Hz, 3H), 4.33 (ddd,J=9.5, 8.0, 5.0 Hz, 1H), 3.91 (dt,J=9.3, 7.4 Hz, 1H), 3.34-3.16(m, 1H), 3.12-2.95 (m, 2H), 2.40-2.17 (m, 2H);13C NMR (101 MHz, CDCl3)δ178.9, 162.9 (d,J=246.4 Hz), 136.9 (d,J=7.3 Hz), 130.2 (d,J=8.3 Hz), 126.0 (d,J=2.9 Hz), 117.2 (d,J=21.4 Hz), 114.6 (d,J=20.9 Hz), 75.3, 65.6, 42.8 (d,J=1.8 Hz), 34.0;HRMS-ESI (m/z) C11H11FNaO3+(M + Na)+计算值233.0584,测试值233.0589.
3-[(4-氟苯基) 甲基]-3-羟基四氢呋喃-2-酮 (8c):白色固体, 75%, m.p.126.1-128.4 ℃;1H NMR (400 MHz, CDCl3)δ7.25-7.18 (m, 2H), 7.06-6.95 (m, 2H), 4.31 (ddd,J=9.1, 8.0,4.9 Hz, 1H), 3.86 (dt,J=9.1, 7.4 Hz, 1H), 3.34-3.11 (m, 1H),3.07-2.96 (m, 2H), 2.39-2.23 (m, 2H);13C NMR (101 MHz,CDCl3)δ179.0, 162.4 (d,J=246.0 Hz), 131.8, 131.7, 130.2 (d,J=3.4 Hz), 115.7, 115.5, 75.4 (d,J=1.4 Hz), 65.5, 42.4, 34.0;HRMS-ESI (m/z) C11H11FNaO3+(M + Na)+计算值233.0584,测试值233.0589.
3-[(2-氯苯基) 甲基]-3-羟基四氢呋喃-2-酮 (8d):白色固体, 33%, m.p.118.2-120.1 ℃;1H NMR (400 MHz, CDCl3)δ7.44-7.29 (m, 1H), 7.27 (d,J=6.6 Hz, 2H), 7.14 (dd,J=6.0,2.7 Hz, 1H), 4.34 (ddd,J=17.5, 8.7, 4.2 Hz, 1H), 3.93 (dt,J=9.4, 7.4 Hz, 1H), 3.06-2.95 (m, 2H), 2.35-2.24 (m, 2H);13C NMR (101 MHz, CDCl3)δ178.7, 136.6, 134.5, 131.8, 130.3,128.5, 127.8, 75.2, 65.5, 42.7, 34.0; HRMS-ESI (m/z)C11H12ClO3+(M + H)+计算值227.0469, 测试值227.0479.
3-[(3-氯苯基) 甲基]-3-羟基四氢呋喃-2-酮 (8e):白色固体, 36%, m.p.125.3-126.2 ℃;1H NMR (400 MHz, CDCl3)δ7.36-7.27 (m, 3H), 7.24-7.18 (m, 1H), 4.39-4.26 (m, 1H),3.85 (ddt,J=49.8, 9.0, 7.5 Hz, 1H), 3.11-2.97 (m, 2H),2.44-2.24 (m, 2H);13C NMR (101 MHz, CDCl3)δ178.8,134.3, 131.6, 130.2, 128.9, 128.8, 127.6, 75.2, 65.4, 42.6, 34.0;HRMS-ESI (m/z) C11H11ClNaO3+(M + Na)+计算值249.0289,测试值249.0298.
3-[(4-氯苯基) 甲基]-3-羟基四氢呋喃-2-酮 (8f):白色固体, 67%, m.p.133.5-135.5 ℃;1H NMR (400 MHz, CDCl3)δ7.34-7.27 (m, 2H), 7.23 (dtd,J=8.1, 4.5, 3.7, 2.0 Hz, 2H), 4.24(td,J=8.7, 4.4 Hz, 1H), 3.74 (dt,J=9.0, 7.6 Hz, 1H), 3.03 (s,2H), 2.88 (d,J=9.8 Hz, 1H), 2.40-2.20 (m, 2H);13C NMR (101 MHz, CDCl3)δ179.0, 134.3, 130.2 (2C), 128.8 (2C), 127.6,75.4, 65.4, 43.6, 34.1; HRMS-ESI (m/z) C11H12ClO3+(M + H)+计算值227.0469, 测试值227.0479.
3-羟基-3-[(2-甲基苯基) 甲基]四氢呋喃-2-酮 (8g):白色固体, 89%, m.p.=124.1-126.7 ℃;1H NMR (400 MHz,CDCl3)δ7.37-7.17 (m, 4H), 4.40 (dt,J=9.1, 6.3 Hz, 1H), 4.02(q,J=7.8 Hz, 1H), 3.31-3.10 (m, 2H), 2.95 (s, 1H), 2.43 (m,5H);13C NMR (101 MHz, CDCl3)δ178.9, 137.3, 132.8,130.9, 130.9, 127.6, 126.3, 75.5, 65.5, 39.5, 34.5, 20.2; HRMSESI (m/z) C12H14NaO3+(M + Na)+计算值229.0835, 测试值229.0842.
3-羟基-3-[(3-甲基苯基) 甲基]四氢呋喃-2-酮 (8h):白色固体, 91%, m.p.108.2-110.5 ℃;1H NMR (400 MHz,CDCl3)δ7.41 (t,J=7.4 Hz, 1H), 7.30 (d,J=7.6 Hz, 1H), 7.25(d,J=8.2 Hz, 2H), 4.48 (td,J=8.7, 4.4 Hz, 1H), 3.98 (dt,J=9.1,7.6 Hz, 1H), 3.23 (s, 2H), 2.62-2.55 (m, 1H), 2.54 (s, 3H),2.48 (dd,J=13.3, 8.1 Hz, 1H);13C NMR (101 MHz, CDCl3)δ179.1, 138.4, 134.2, 130.9, 128.6, 128.3, 127.2, 75.4, 65.4,43.4, 34.1, 21.5; HRMS-ESI (m/z) C12H14NaO3+(M + Na)+计算值229.0835, 测试值229.0840.
3-羟基-3-[(4-甲基苯基) 甲基]四氢呋喃-2-酮 (8i):白色固体, 83%, m.p.115.3-118.4 ℃;1H NMR (400 MHz,CDCl3)δ7.13 (s, 4H), 4.27 (td,J=8.7, 4.2 Hz, 1H), 3.77 (dt,J=8.7, 7.5 Hz, 1H), 3.02 (s, 2H), 2.42-2.24 (m, 5H);13C NMR(101 MHz, CDCl3)δ179.0, 137.3, 131.1, 130.1 (2C), 129.5 (2C),75.4, 65.3, 43.2, 34.1, 21.2; HRMS-ESI (m/z) C12H14NaO3+(M + Na)+计算值229.0835, 测试值229.0836.
3-羟基-3-[(2-甲氧基苯基) 甲基]四氢呋喃-2-酮 (8j):白色固体, 88%, m.p.139.8-142.1 ℃;1H NMR (400 MHz,CDCl3)δ7.31-7.26 (m, 1H), 7.17 (dd,J=7.4, 1.7 Hz, 1H),6.99-6.86 (m, 2H), 4.33 (td,J=8.6, 3.8 Hz, 1H), 4.09 (td,J=8.8, 6.8 Hz, 1H), 3.84 (s, 3H), 3.50 (s, 1H), 3.34 (d,J=13.9 Hz, 1H), 2.88 (d,J=13.9 Hz, 1H), 2.36 (ddd,J=13.1, 6.7, 3.8 Hz, 1H), 2.22 (dt,J=13.1, 8.4 Hz, 1H);13C NMR (101 MHz,CDCl3)δ178.7, 157.7, 132.1, 129.1, 123.3, 121.2, 110.9, 75.6,65.3, 55.6, 36.9, 34.6; HRMS-ESI (m/z) C12H14NaO4+(M +Na)+245.0784 计算值245.0784, 测试值245.0786.
3-羟基-3-[(3-甲氧基苯基) 甲基]四氢呋喃-2-酮 (8k):白色固体, 86%, m.p.130.1-133.2 ℃;1H NMR (400 MHz,CDCl3)δ7.23 (d,J=7.8 Hz, 1H), 6.86-6.75 (m, 3H), 4.28 (td,J=8.7, 4.3 Hz, 1H), 3.82 (s, 1H), 3.79 (s, 3H), 3.03 (s, 2H),2.80 (s, 1H), 2.44-2.24 (m, 2H);13C NMR (101 MHz, CDCl3)δ178.9, 159.9, 135.8, 129.8, 122.5, 115.9, 113.0, 75.4, 65.4,55.4, 43.6, 34.2; HRMS-ESI (m/z) C12H14NaO4+(M + Na)+245.0784 计算值245.0784, 测试值245.0793.
3-羟基-3-[(4-甲氧基苯基) 甲基]四氢呋喃-2-酮 (8l):白色固体, 83%, m.p.154.5-155.8 ℃;1H NMR (400 MHz,CDCl3)δ7.16 (d,J=8.6 Hz, 2H), 6.85 (d,J=8.5 Hz, 2H), 4.26(td,J=8.7, 4.4 Hz, 1H), 3.84-3.70 (m, 4H), 3.03 (s, 1H), 3.00(s, 2H), 2.40-2.23 (m, 2H);13C NMR (101 MHz, CDCl3)δ179.1, 159.1, 131.2, 126.2, 114.2, 75.5, 65.3, 55.4, 42.7, 34.1;HRMS-ESI (m/z) C12H14NaO4+(M + Na)+245.0784 计算值245.0784, 测试值245.0794.
3-[(3,4-二甲氧基苯基) 甲基]-3-羟基四氢呋喃-2-酮 (8m):白色固体, 69%, m.p.159.2-161.3 ℃;1H NMR (400 MHz,CDCl3)δ6.77 (d,J=5.4 Hz, 3H), 4.25 (td,J=8.6, 4.5 Hz, 1H),3.84 (s, 6H), 3.75 (dt,J=9.1, 7.5 Hz, 1H), 2.99 (d,J=2.2 Hz,2H), 2.39-2.21 (m, 2H);13C NMR (101 MHz, DMSO-d6)δ179.2, 149.0, 148.5, 126.7, 122.3, 113.2, 111.3, 75.5, 65.4,56.0, 55.9, 43.1, 34.1; HRMS-ESI (m/z) C13H16NaO5+(M + Na)+计算值275.0890, 测试值275.0896.
3-[(2,3,4-三甲氧基苯基) 甲基]-3-羟基四氢呋喃-2-酮(8n):白色固体, 66%, m.p.157.5-159.8 ℃;1H NMR (400 MHz, CDCl3)δ6.86 (d,J=8.4 Hz, 1H), 6.64 (d,J=8.4 Hz, 1H),4.34 (td,J=8.6, 4.0 Hz, 1H), 4.16-4.07 (m, 1H), 3.92 (d,J=1.0 Hz, 3H), 3.89-3.78 (m, 6H), 3.20 (d,J=14.0 Hz, 1H), 2.79 (d,J=14.0 Hz, 1H), 2.33 (ddd,J=13.3, 7.1, 4.3 Hz, 1H), 2.18 (dt,J=13.2, 8.2 Hz, 1H);13C NMR (101 MHz, CDCl3)δ178.7,153.5, 152.0, 142.2, 125.9, 120.4, 107.6, 75.6, 65.3, 61.2, 61.0,56.1, 36.8, 34.4; HRMS-ESI (m/z) C14H18NaO6+(M + Na)+计算值305.0996, 测试值305.1004.
3-[(3,4,5-三甲氧基苯基) 甲基]-3-羟基四氢呋喃-2-酮(8o):白色固体, 84%, m.p.164.3-166.2 ℃;1H NMR (400 MHz, CDCl3)δ6.45 (s, 2H), 4.30 (td,J=8.5, 4.7 Hz, 1H), 3.86(d,J=1.9 Hz, 1H), 3.84 (s, 6H), 3.83 (s, 3H), 3.00 (d,J=3.2 Hz,2H), 2.34 (ddd,J=17.0, 7.9, 5.2 Hz, 2H);13C NMR (101 MHz,CDCl3)δ178.8, 153.4, 137.5, 129.9, 107.2, 75.4, 65.4, 61.0,56.3, 43.9, 34.3; HRMS-ESI (m/z) C14H18NaO6+(M + Na)+计算值305.0996, 测试值305.1000.
3-羟基-3-[4-(三氟甲基) 苯基]甲基-四氢呋喃-2-酮 (8p):白色固体, 67%, m.p.127.5-130.1 ℃1H NMR (400 MHz,CDCl3)δ7.58 (d,J=8.0 Hz, 2H), 7.39 (d,J=7.9 Hz, 2H), 4.35(ddd,J=9.3, 7.7, 5.4 Hz, 1H), 3.97 (dt,J=9.2, 7.3 Hz, 1H), 3.37(s, 1H), 3.19-2.97 (m, 2H), 2.37-2.22 (m, 2H);13C NMR (101 MHz, CDCl3)δ178.8, 138.7, 138.7, 130.7(2C), 129.9 (q,J=32.5 Hz), 125.6 (q,J=3.6 Hz), 124.2 (q,J=272.7 Hz), 75.2,65.6, 42.7, 34.1; HRMS-ESI (m/z) C12H11F3NaO3+(M + Na)+计算值283.0552, 测试值283.0562.
3-羟基-3-[4-氰基苯基]甲基-四氢呋喃-2-酮 (8q):白色固体, 71%, m.p.130.1-132.3 ℃;1H NMR (400 MHz, CDCl3)δ7.63 (d,J=7.9 Hz, 2H), 7.38 (d,J=7.9 Hz, 2H), 4.38 (dt,J=9.3, 6.5 Hz, 1H), 4.03 (dt,J=9.5, 7.3 Hz, 1H), 3.18-3.01 (m,2H), 2.30 (t,J=6.9 Hz, 2H);13C NMR (101 MHz, CDCl3)δ178.2, 140.1, 132.4 (2C), 131.1 (2C), 118.7, 111.6, 75.0, 65.5,43.1, 34.2; HRMS-ESI (m/z) C12H12NO3+(M + H)+计算值218.0812, 测试值218.0820.
3-苄基-3-羟基四氢呋喃-2-酮 (8r):白色固体, 84%,m.p.110.3-113.5 ℃;1H NMR (400 MHz, CDCl3)δ7.29-7.21(m, 3H), 7.20-7.16 (m, 2H), 4.21 (td,J=8.7, 4.3 Hz, 1H), 3.70(dt,J=9.1, 7.6 Hz, 1H), 3.00 (s, 2H), 2.35-2.16 (m, 2H);13C NMR (101 MHz, CDCl3)δ179.1, 134.2, 130.2 (2C), 128.8(2C), 127.6, 75.4, 65.4, 43.5, 34.0; HRMS-ESI (m/z)C11H12NaO3+(M + Na)+计算值215.0679, 测试值215.0685.
3-羟基-3-(吡啶-2-基甲基) 四氢呋喃-2-酮 (9a):黄色固体, 46%, m.p.133.5-135.2 ℃;1H NMR (400 MHz, CDCl3)δ8.53-8.47 (m, 1H), 7.68 (td,J=7.7, 1.8 Hz, 1H), 7.24-7.13 (m,2H), 4.44 (ddd,J=9.2, 7.5, 5.9 Hz, 1H), 4.25 (ddd,J=9.1, 7.3,6.3 Hz, 1H), 3.24-3.08 (m, 2H), 2.33 (dddd,J=41.5, 13.2, 7.4,6.1 Hz, 2H);13C NMR (101 MHz, CDCl3)δ177.2, 157.2,148.3, 137.6, 124.5, 122.5, 74.8, 65.3, 41.2, 36.3; HRMS-ESI(m/z) C10H12NO3+(M + H)+计算值194.0812, 测试值194.0822.
3-羟基-3-(吡啶-3-基甲基) 四氢呋喃-2-酮 (9b):淡黄色固体, 34%, m.p.128.4-130.3 ℃;1H NMR (400 MHz, CDCl3)δ8.53-8.43 (m, 2H), 7.65 (dt,J=7.9, 2.0 Hz, 1H), 7.27 (s, 1H),4.39 (ddd,J=9.2, 7.2, 6.1 Hz, 1H), 4.10 (dt,J=9.1, 7.0 Hz, 1H),3.12 (d,J=14.0 Hz, 1H), 2.30 (td,J=7.2, 6.7, 1.6 Hz, 2H);13C NMR (101 MHz, CDCl3)δ178.2, 150.7, 148.2, 138.5, 131.0,123.7, 74.7, 65.5, 40.1, 34.7; HRMS-ESI (m/z) C10H12NO3+(M + H)+计算值194.0812, 测试值194.0821.
3-羟基-3-(吡啶-4-基甲基) 四氢呋喃-2-酮 (9c):淡黄色固体, 31%, m.p.136.0-137.8 ℃;1H NMR (400 MHz, CDCl3)δ8.53-8.47 (m, 2H), 7.26-7.19 (m, 2H), 4.37 (td,J=8.7, 4.0 Hz, 1H), 4.17-4.08 (m, 1H), 3.36-3.13 (m, 2H), 2.42 (ddd,J=13.3, 6.9, 4.1 Hz, 1H), 2.28 (dt,J=13.3, 8.2 Hz, 1H);13C NMR (101 MHz, CDCl3)δ178.7, 148.9 (2C), 143.5, 125.4 (2C),75.5, 65.7, 39.1, 34.1; HRMS-ESI (m/z) C10H12NO3+(M + H)+计算值194.0812, 测试值194.0816.
1.3 抗病毒活性测试
供试病毒为烟草花叶病毒 (TMV),供试植株为心叶烟 (TMV 寄主),均为西北农林科技大学植物保护学院植物病毒学团队提供。
对照药剂:8%宁南霉素 (ningnanmycin) 水剂,购于德强生物股份有限公司;98%病毒唑 (ribavirin)原药,购于安耐吉化学。
1.3.1 烟草花叶病毒提纯 选取接种21 d 以上,受到TMV 病毒系统侵染的普通烟Nicotiana tabacumK326 植株的上部叶片,剪掉叶脉后按文献报道的方法[28]提纯。
1.3.2 供试药液的配制 称取2 mg 目标化合物置于1.5 mL 离心管中,加入25 μL 二甲基亚砜(DMSO) 使其溶解,用含体积分数为1% Tween 80的二次蒸馏水定容至4 mL,将其配制成500 μg/mL的药液。取1 mL 上述药液,加入等体积含1% Tween 80 的二次蒸馏水,配制成250 μg/mL 的药液,再依次稀释,配制成125、62.5、31.25 μg/mL 的系列质量浓度药液,用于测定化合物的EC50值。同法配制病毒唑药液。用二次蒸馏水代替上述含1%Tween 80 的二次蒸馏水进行稀释,配制宁南霉素供试药液。
1.3.3 体外钝化TMV 活性测定 采用半叶枯斑法[29-30]测定。选取健康、生长旺盛5~6 叶期的心叶烟,将500 μL 供试化合物药液与20 µg/mL 的TMV 病毒等体积混合30 min 后接种到心叶烟左半叶,右半叶接种蒸馏水与TMV 病毒等体积混合液,作为对照。采用常规机械摩擦法接种。每处理3~5 片烟叶,试验重复3 次,对照药剂为病毒唑和宁南霉素。在温度为 (25 ± 1) ℃、光照10 000 lx的培养箱中保湿培养3~4 d 后,观察叶片上的枯斑数,记录对照组和化合物处理组的枯斑数,分别记作N1和N2,按照 (1) 式计算抑制率 (I)。
1.3.4 保护活性测定 选取健康、生长旺盛的5~6 叶期心叶烟为枯斑寄主,药剂处理浓度及培养条件同1.3.3 节。将化合物左半叶进行药物处理,右半叶进行清水处理。在施药12 h 后于整个叶片接种TMV 病毒,测定化合物对TMV 病毒侵染心叶烟草的保护作用。每处理3~5 个叶片,重复3 株,对照药剂为病毒唑和宁南霉素。待接种叶出现明显的枯斑后,记录枯斑数目,根据公式(1) 计算抑制率,并进行统计分析。
1.3.5 治疗活性测定 选取健康、生长旺盛的5~6 叶期心叶烟为枯斑寄主,药剂处理浓度及培养条件同1.3.3 节。用TMV 病毒摩擦接种整个叶片,6 h 后用供试化合物处理心叶烟左半叶,右半叶用清水处理。每处理3~5 个叶片,重复3 株,对照药剂为病毒唑和宁南霉素。待接种叶出现明显的枯斑后,记录枯斑数目,根据公式 (1) 计算抑制率,并进行统计分析。
1.3.6 生物统计方法 试验数据利用SPSS Statistics 23.0 软件进行方差分析,P< 0.05 表示两者差异显著。
2 结果与讨论
2.1 目标化合物的合成及波谱分析
中间体的合成是以相应的取代苯甲醛为起始原料,经Darzens 缩合反应制备而得。获得中间体化合物后,通过钯催化加氢还原获得相应的α-羟基-γ-丁内酯类目标化合物3a~3b、8a~8r 和9a~9c。以8a (图式4) 的波谱为例进行说明。1H NMR中,化学位移和多重峰δ2.35-2.11 (m, 2H)为丁内酯结构中11 号碳上氢的位移和裂峰,化学位移和多重峰δ4.27 (td,J= 8.6, 4.5 Hz, 1H), 3.98 (dt,J=9.1, 7.4 Hz, 1H)为丁内酯结构中7 号碳上两个氢的位移和裂峰,化学位移和多重峰3.10-2.93 (m,2H)是13 号碳上氢的位移和裂峰,化学位移在δ7.27-7.14 处的峰为1 和2 位苯环氢的吸收峰,化学位移在δ7.08-6.91 处的峰为3 和4 位苯环氢的吸收峰;13C NMR 中,化学位移在δ178.9 吸收峰为丁内酯结构中9 位羰基碳的信号峰,化学位移和裂峰δ161.5 (d,J= 244.7 Hz)是苯环上6 号位的碳信号峰,同时受到氟的影响而裂成双峰,δ132.7 (d,J= 4.1 Hz), 129.4 (d,J=8.3 Hz), 124.5 (d,J= 3.6 Hz), 121.7 (d,J= 15.5 Hz), 115.5 (d,J= 22.6 Hz)是苯环上其余5 个碳的化学位移和裂峰情况,化学位移为δ75.3 为化合物8a 中10 位碳的信号峰,化学位移为δ65.6 为化合物8a 中7 位碳的信号峰,化学位移在δ35.5 和34.2 为化合物8a 中13 和11 位碳的信号峰。

图式 4 化合物8a 的化学结构式Scheme 4 Structural formula of compound 8a
2.2 抗病毒活性
采用半叶枯斑法测定的α-羟基-γ-丁内酯类化合物3a~3b、8a~8r 和9a~9c 的钝化活性、保护活性和治疗活性结果见表1。可以看出:在500 μg/mL质量浓度下,目标化合物表现出一定的抗病毒活性,其中3a、8c、8h 及8m~8o 对TMV 的钝化活性超过50%,特别是化合物8o 的钝化活性达到72.8%,优于对照药剂病毒唑 (59.1%),同时表现出中等的治疗活性 (50.5%) 及保护活性 (51.8%);对于保护活性,化合物8h、8l 和8o 抑制率大于50%,其中化合物8l 的保护活性达到58.6%,优于抗病毒对照药剂病毒唑 (45.4%),且与宁南霉素(60.2%) 和先导化合物L2 (58.2%) 活性相当;对于治疗活性,目标化合物活性均较差,只有8m 和8o 抑制率大于50%。

表1 α-羟基-γ-丁内酯类衍生物在500 μg/mL 质量浓度下抗TMV 活性Table 1 Antiviral activities of α-hydroxy γ-butyrolactone derivatives against TMV at 500 μg/mL
为了进一步确定α-羟基-γ-丁内酯类系列化合物对TMV 的抑制活性,选择钝化及保护活性较好的化合物 (> 50%) 以及先导化合物L2 进行了EC50值的测定,结果见表2。

表2 部分α-羟基-γ-丁内酯类化合物对TMV 的EC50 值Table 2 The EC50 values of the selected α-hydroxy γ-butyrolactones against TMV
由表2 数据可以看出:不同化合物对TMV 的钝化活性有所差异,其中化合物8o 表现出最好的抑制活性,其EC50值为226.2 μg/mL,优于对照药剂病毒唑 (308.4 μg/mL),与先导化合物L2(228.8 μg/mL) 相当,但与宁南霉素有一定差距;不同化合物对TMV 的保护活性也有所差异,其中化合物8l 表现出最好的抑制活性,其EC50值为382.3 μg/mL,与先导化合物L2 (384.6 μg/mL) 相当,但活性低于宁南霉素 (223.5 μg/mL)。
通过对表1 和表2 中的抗病毒活性数据进行分析可以发现,化合物结构与活性存在一定相关性。比较化合物3a 和3b 发现,苯并二氧杂戊环化合物3a 的钝化和治疗活性分别为51.5%和36.5%,强于苯并二氧杂己环化合物3b (33.8%和30.5%)。
对于8a~8r 系列,可以看出苯环上引入不同的取代基后化合物的抗病毒活性呈现出较大差异。当苯环上引入给电子基团如甲氧基,可提高化合物的抗病毒活性。如,化合物8j (R = 2-OMe)、8k (R = 3-OMe)、8l (R = 4-OMe) 在500 μg/mL 下的钝化活性分别为39.6%、32.5%和42.6%,大于未取代的化合物8r (R = H) 的钝化活性 (25.5%),同时也强于吸电子氯取代的化合物8d~8f (11.8%~30.5%)。值得注意的是,苯环上氟取代的化合物8a~8c 表现出较好的抗病毒活性,其在500 μg/mL下对TMV 的钝化活性分别为45.6%、43.2% 和53.5%,同时三氟甲基取代的化合物8p (R = 4-CF3)的钝化活性 (44.6%) 大于8i (R = 4-CH3) 的钝化活性 (26.4%),这一现象可能是由于氟原子取代的化合物具有良好的脂溶性,同时氟原子电负性较强,可通过改变化合物的电子效应、理化性质提高生物活性等。
对比多取代化合物8m~8o 发现,引入多取代甲氧基可以显著提高化合物对TMV 的活性。化合物8m~8o 对TMV 的钝化活性 (52.5%~72.8%) 整体强于单取代甲氧基系列8j~8l 的钝化活性(32.5%~42.6%),通过进一步活性筛选,化合物8o 表现出较好的抑制活性,对TMV 的钝化活性的EC50为226.2 μg/mL 与先导化合物L2 (228.8 μg/mL)相当。
3 结论
本研究结合本课题组前期研究,应用骨架跃迁策略,设计合成21 个α-羟基-γ-丁内酯类衍生物,并测定了它们对TMV 的钝化、保护和治疗活性。结果表明,目标化合物对TMV 均表现出一定的抑制活性,其中化合物8o 表现出最好的钝化活性,其EC50值为226.2 μg/mL,优于对照药剂病毒唑 (EC50值308.4 μg/mL),与先导化合物L2 (EC50值228.8 μg/mL) 相当。另外,化合物L2 具有一个手性中心,其结构简单易合成,这为天然产物抗病毒农药的开发提供了新先导或候选化合物。