针刀微创联合鼠神经生长因子夹脊穴位注射治疗对带状疱疹后遗神经痛大鼠脊髓背角自噬水平的影响
苑宝文 魏玲 李筹忠
(1贵州省骨科医院神经内科,贵州 贵阳 550000;2毕节市第一人民医院针灸科;3贵州省人民医院神经外科)
带状疱疹是由水痘-带状疱疹病毒(VZV)感染引起的急性疱疹性皮肤病,部分患者疱疹消退后局部皮肤仍遗留神经痛,即为带状疱疹后遗神经痛(PHN)。PHN主要表现为局部皮肤灼热、敏感、针刺样疼痛及麻木。疼痛剧烈且持续时间较长,严重影响患者生活质量〔1〕。张爱民等〔2〕研究表明PHN的维持可能与脊髓自噬过度激活有关。刘永达等〔3〕也发现自噬活性的改变可能参与神经病理性痛的发生。章军等〔4〕发现针刀微创治疗组可以有效缓解患者疼痛,其治疗效果高于毫针围刺组。于云等〔5〕通过观察30例接受华佗夹脊穴针刺法与30例接受针刀阻滞松解法治疗PHN患者的临床疗效,发现针刀阻滞松解法对患者疼痛、焦虑、睡眠质量等方面的改善优于华佗夹脊穴针刺法。鼠神经生长因子(mNGF)具有促进突起生长、神经元营养的功能,研究显示mNGF联合普瑞巴林、奥卡西平、红光均具有很好的治疗效果,但会产生头晕、嗜睡、过敏等不良反应〔6~8〕。而针刀微创联合mNGF夹脊穴位注射在治疗PHN中是否通过调节细胞自噬活性发挥治疗功效尚未报道。本研究观察针刀微创联合mNGF夹脊穴位注射治疗对PHN模型大鼠的影响,探讨脊髓背角自噬改变在其中的可能作用。
1 材料与方法
1.1实验动物 100只体质量为200~240 g的SPF级雄性SD大鼠购自中生北动(北京)科技发展有限公司〔SYXK(京)2020-0051〕。饲养环境为22~25 ℃、湿度50%~60%、周期光照12 h、自由饮水、进食。1 w后用于实验。
1.2主要试剂和仪器 mNGF(厦门北大之路生物有限公司);非洲绿猴肾母纤维细胞(CV-1,美国ATCC细胞库);白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α、酶联免疫吸附试验(ELISA)检测试剂盒(武汉博士德生物有限公司);免疫组化试剂盒(上海齐一生物科技有限公司);TUNEL染色试剂盒(安徽佰欧晶医学科技有限公司);酵母自噬相关基因6的哺乳动物同源体(Beclin1)、微管相关蛋白轻链(LC3)-Ⅱ、自噬调控多功能蛋白(p62)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)、磷酸化核糖体40 S小亚基S6蛋白激酶(P-S6K)、半胱氨酸蛋白酶(Caspase)-3抗体(武汉博欧特生物科技有限公司);NX-1R高速台式冷冻离心机(天津鼎昊源生物科技有限公司);蛋白电泳仪、转膜仪、凝胶成像系统(美国Bio-Rad公司);透射电镜(日本JEOL公司)。
1.3动物分组与造模 分组:100只大鼠随机分为对照组、模型组、mNGF肌肉注射(肌肉注射)组、mNGF夹脊穴位注射(穴位注射)组、针刀微创联合mNGF夹脊穴位注射(针刀联合)组。模型制作:VZV感染CV-1细胞,培养2 d后用磷酸盐缓冲液(PBS)洗涤并制成细胞悬液,进行带状疱疹病毒接种;腹腔注射2.5%戊巴比妥钠(45 mg/kg)麻醉大鼠,将50 μl细胞密度为1.2×108个/ml的细胞悬液接种至大鼠左趾蹼中,对照组注射等量生理盐水;接种3~4 d后,测定造模大鼠机械缩足阈值(MWT)降低表明造模成功。干预:肌肉注射组给予肌肉注射mNGF〔2.1 μg/(kg·d)〕,1次/d,共14 d;穴位注射组给予夹脊穴位注射mNGF〔2.1 μg/(kg·d)〕,1次/d,共14 d;针刀联合组在穴位注射组基础上进行针刀治疗,1次/w,共2 w(操作方法:大鼠常规消毒、切点皮下浅筋膜下浸润麻醉,戴无菌手套,于脊柱或神经敏感点垂直进针刀,刺破皮肤,针刀与皮肤平行,行横向扇形切割,松解粘连带,退出针刀,无菌纱布按压3 min);对照组、模型组不做处理。
1.4行为学实验测定大鼠MWT 采用电子测痛仪测定干预后1、7和14 d时机械痛阈值。用探头垂直刺激大鼠后足底部,逐渐增加力度,待其出现舔足、抬足和躲避等行为时,记录电子测痛仪显示最大值。每隔10 min检测1次,连续检测5次。
1.5收集标本 MWT检测结束后,将大鼠断头处死,取L4~L6脊髓组织,部分加入9倍生理盐水制成匀浆,1 000 r/min离心10 min后,收集上清液,置于液氮保存备用;部分以4%多聚甲醛固定;部分置于-80 ℃冰箱中保存;部分胰蛋白酶消化制成细胞悬液。
1.6ELISA检测脊髓组织炎症因子IL-1β、IL-6、TNF-α水平 取冻存的脊髓组织上清液,按照ELISA操作说明书配制标准品和检测溶液,加入抗体和显色剂,在酶标仪450 nm下测定吸光度,根据标准曲线算出IL-1β、IL-6、TNF-α水平。
1.7TUNEL染色检测脊髓神经细胞凋亡 4%多聚甲醛固定脊髓组织,制成石蜡切片。经脱蜡、抗原修复、阻断内源性过氧化物酶活性、二氨基联苯胺(DAB)显色、复染、盐酸酒精分化、返蓝、脱水、透明、中性胶封片等,于显微镜(×400)下观察,使用ImageJ图像处理软件统计凋亡细胞数量。细胞凋亡指数=(凋亡细胞数/总细胞数)×100%。
1.8免疫组化染色检测脊髓组织Beclin1、LC3-Ⅱ、p62表达水平 取脊髓组织石蜡切片,经脱蜡、乙醇梯度脱水、高压抗原修复后分别滴加Beclin1、LC3-Ⅱ、P62一抗(1∶200)孵育过夜,加入二抗(1∶500)孵育20 min,DAB显色液显色,苏木素复染,乙醇梯度脱水、透明、封片,于显微镜(×200)下镜检。
1.9透射电镜观察脊髓组织自噬泡形成 取L4~L6脊髓组织,胰蛋白酶消化制成细胞悬液,接种于6孔板上培养48 h,收集细胞,加入4%戊二醛,4 ℃固定1 h,常规电镜固定、脱水、包埋,制成超薄切片,于透射电镜下观察细胞自噬泡和亚细胞超微结构。
1.10Western印迹检测脊髓组织Beclin1、LC3-Ⅱ、p62、p-mTOR、p-S6K、Caspase-3蛋白表达水平 取脊髓组织,加入适量裂解液提取总蛋白,二喹啉甲酸(BCA)法定量后制样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离蛋白,转膜,室温封闭2 h,分别加入Beclin1、LC3-Ⅱ、p62、p-mTOR、p-S6K、Caspase-3一抗(1:500)4 ℃过夜。加入二抗(1∶5 000)室温孵育2 h,避光加入ECL发光液,Bio-rad凝胶成像仪记录蛋白灰度并拍照,以β-actin作为对照,对各组蛋白进行相对定量分析。
1.11统计学分析 采用SPSS16.0软件进行χ2检验、方差分析。
2 结 果
2.1各组不同时间点PWT比较 与对照组相比,模型组给药后相同时间PWT明显降低(P<0.05);与模型组相比,肌肉注射组、穴位注射组、针刀联合组给药后7 d和14 d时PWT明显升高(均P<0.05)。见表1。

表1 各组不同时间点PWT的比较
2.2各组脊髓组织炎症因子IL-1β、IL-6、TNF-α水平比较 与对照组相比,模型组IL-1β、IL-6、TNF-α含量明显增加(均P<0.05);与模型组相比,肌肉注射组、穴位注射组、针刀联合组IL-1β、IL-6、TNF-α含量明显降低(均P<0.05)。见表2。
表2 各组脊髓组织炎症因子IL-1β、IL-6、TNF-α水平比较
2.3各组脊髓组织神经细胞凋亡比较 与对照组〔(3.17±0.59)%〕相比,模型组细胞凋亡水平〔(34.28±3.85)%〕明显升高(P<0.05);与模型组相比,肌肉注射组、穴位注射组、针刀联合组细胞凋亡水平明显降低〔(22.69±2.43)%、(16.81±1.38)%、(11.76±1.54)%,P<0.05〕;针刀联合组抗凋亡效果最佳(P<0.05)。见图1。

图1 各组脊髓组织神经细胞凋亡(TUNEL染色,×400)
2.4免疫组化染色检测各组脊髓组织Beclin1、LC3-Ⅱ、P62蛋白表达 Beclin1、LC3-Ⅱ、P62蛋白阳性染色为棕黄色。对照组脊髓组织Beclin1、LC3-Ⅱ、P62少量表达;与对照组相比,模型组Beclin1、LC3-Ⅱ蛋白表达明显减少,P62表达明显增多(P<0.05);与模型组相比,肌肉注射组、穴位注射组、针刀联合组Beclin1、LC3-Ⅱ表达水平明显增多,P62表达水平明显减少(P<0.05);针刀联合组各蛋白变化量最明显。见表3、图2。
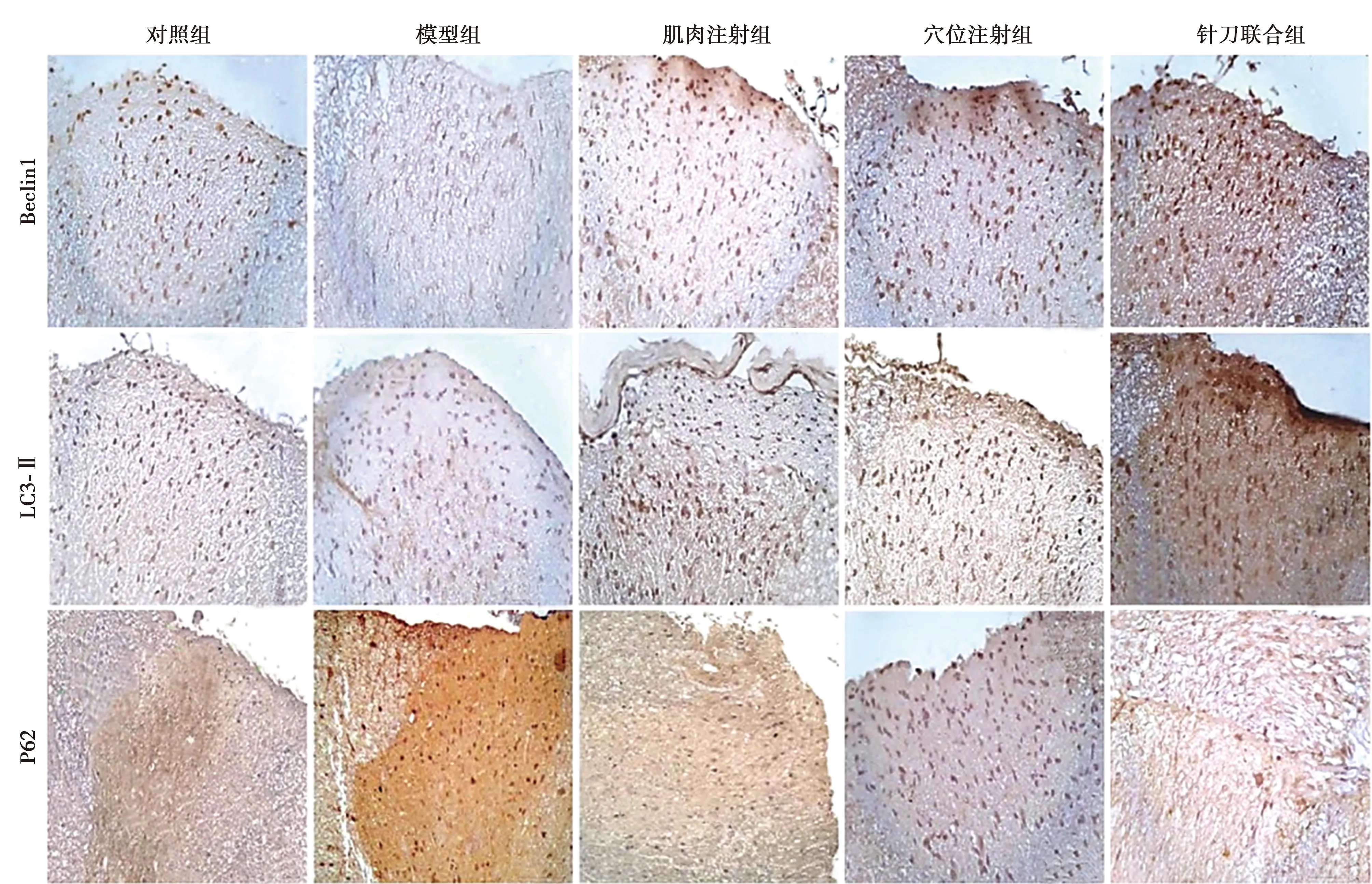
图2 各组脊髓组织Beclin1、LC3-Ⅱ、p62蛋白表达(免疫组化染色,×200)
表3 各组脊髓组织Beclin1、LC3-Ⅱ、P62蛋白表达水平
2.5各组脊髓组织自噬泡的形成比较 对照组细胞核、线粒体等结构形态正常,细胞质内存在极少自噬泡;模型组存在少量自噬泡;与模型组相比,肌肉注射组、穴位注射组、针刀联合组自噬泡数量明显增加;针刀联合组自噬泡数量多于其他组。见图3。

图3 各组脊髓组织自噬泡的形成(×8 000)
2.6各组脊髓组织Beclin1、LC3-Ⅱ、P62、p-mTOR、p-S6K、Caspase-3蛋白水平比较 与对照组相比,模型组Beclin1、LC3-Ⅱ、p-mTOR、p-S6K、Caspase-3水平明显升高,P62水平明显降低(P<0.05);与模型组相比,肌肉注射组、穴位注射组、针刀联合组Beclin1、LC3-Ⅱ水平明显升高,P62、p-mTOR、p-S6K、Caspase-3水平明显降低(P<0.05)。见图4、表4。
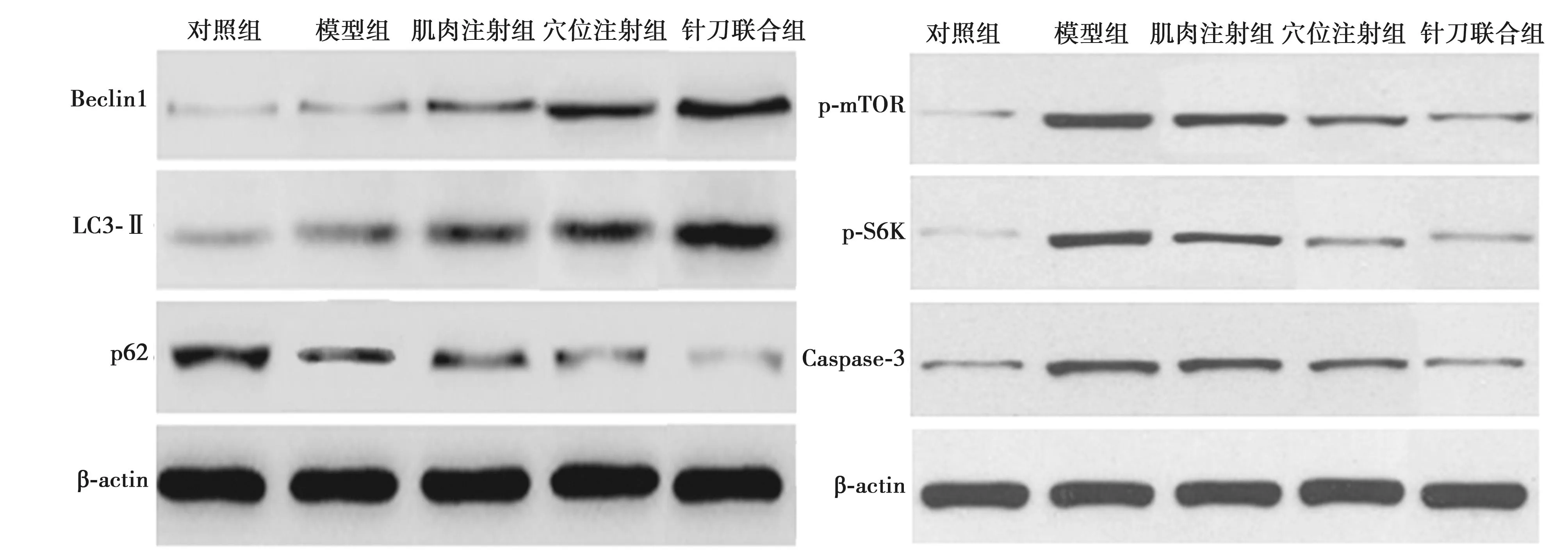
图4 各组脊髓组织Beclin1、LC3-Ⅱ、P62、p-mTOR、p-S6K、Caspase-3表达
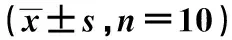
表4 各组脊髓组织Beclin1、LC3-Ⅱ、P62、p-mTOR、p-S6K、Caspase-3相对表达水平
3 讨 论
mNGF可以修复受损的神经细胞,促进神经形成,并且有效改善疼痛症状,广泛用于治疗神经系统疾病。如周礼志等〔9〕发现mNGF可有效著缓解PHN患者疼痛、缩短治疗时间,其效果强于腺苷钴胺。夹脊穴位注射可以使多种感受器兴奋,产生具有明显抑制疼痛的电位,达到活血止痛的作用。黄彬〔10〕发现电针结合穴位注射mNGF治疗Ramsay Hunt综合征的疗效高于电针组,明显降低后遗神经痛的发生率。部分患者在带状疱疹急性发作期后,易造成皮下粘连,粘连组织会压迫周围神经,影响受损神经恢复。针刀治疗可以松解局部粘连组织,减轻病变组织压力,促进炎症消退,达到消炎镇痛、祛除麻木、恢复功能的作用。郭慧等〔11〕发现穴位注射联合小针刀可有效减轻PNH患者的疼痛,具有较高的治疗效果。本研究说明,针刀微创联合夹脊穴位注射射mNGF能有效减轻PHN疼痛。
在正常状态下,神经系统自噬水平较低,在病理刺激下,自噬状态会被激活,从而启动应激防御,促进神经元的生存。自噬涉及多种信号通路,其中mTOR信号通路在突触可塑性的形成和维持中起关键作用,并且可以抑制自噬。Beclin1是自噬泡形成的特异性基因,与自噬启动有关。LC3蛋白是酵母自噬基因Atg8的同系物,是最常用的自噬蛋白标志物,LC3-Ⅱ定位在自噬体膜上,其含量与自噬泡数量呈正相关。p62作为一种特异的泛素结合蛋白,可与LC3选择性结合形成自噬溶酶体被降解,p62增多表明自噬受到抑制。陈雪玲等〔12〕发现雷帕霉素通过降低mTOR、下游效应分子p70S6K1和4EBP1的表达水平,激活自噬信号蛋白的表达,抑制弗氏佐剂诱导的大鼠炎性疼痛。Feng等〔13〕发现辛二酰苯胺异羟肟酸可减轻神经性疼痛,并通过抑制mTOR信号通路促进星形胶质细胞和脊髓背角神经元细胞的自噬通量。吕丹等〔14〕发现电针预处理能抑制mTOR信号通路,增加LC3Ⅱ、Beclin-1水平,降低p62水平,从而增强脊髓背角细胞的自噬功能,最终产生抗炎镇痛的作用。本研究说明,针刀微创联合夹脊穴位注射射mNGF通过抑制mTOR信号通路增强PHN大鼠脊髓背角自噬水平。
神经细胞凋亡是疼痛发生的重要机制,增强自噬能抑制神经元凋亡,而抑制自噬则会增加凋亡〔15〕。陈云婷等〔16〕发现,PHN小鼠脊髓组织中Caspase-3表达升高,神经细胞凋亡明显增多。Chou等〔17〕发现胶质细胞源性神经营养因子可以降低IL-6、IL-1β、Beclin1、Caspase-3、Caspase-9的表达量,减轻由慢性缩窄性损伤诱导的周围神经损伤引起的细胞凋亡和自噬。本研究说明,针刀联合组通过增强PHN大鼠脊髓背角自噬水平抑制细胞凋亡,与上述研究结果一致。
PHN患者血清中IL-1β、IL-6和TNF-α过度表达,而高水平的IL-1β、IL-6和TNF-α可对神经系统造成损伤,引起疼痛〔18〕。徐俊涛等〔19〕发现,PHN模型大鼠脊髓中IL-1β和TNF-α水平明显升高。马洪涛等〔20〕发现富氢液可以增加LC3Ⅱ和Beclin 1水平,降低IL-1β和TNF-α水平,通过激活自噬减轻PHN大鼠的机械痛敏和炎症因子的释放。本研究说明,针刀微创联合夹脊穴位注射射mNGF通过增强PHN大鼠脊髓背角自噬水平抑制炎症反应,与上述研究结果一致。

