白藜芦醇调控TLR4/NF-κB信号通路对溃疡性结肠炎大鼠炎症反应的影响
刘景鸿 万云 刘晓龙 叶鹏 顾秋平 (赣州市人民医院消化内科,江西 赣州 341000)
溃疡性结肠炎是一种反复发作的自发性炎症性肠道疾病,其病因不明,且病情轻重不等〔1〕。大多数患者发病时多以腹泻、黏液脓血便、腹痛等为主要表现〔2,3〕。近年来该病的发病率逐年上升,且极易复发。目前为止该病的治疗方法仍旧是以药物治疗为主,但是许多免疫抑制类药物多存在不可耐受的副作用,并且会引发一系列并发症〔4〕,因此,寻找安全性及疗效较好的新型药物至关重要。白藜芦醇是一种存在于花生或植物中的酚类化合物,有研究已证实其具有抵抗炎症、免疫调节、抵抗肿瘤增殖等作用〔5,6〕。近年来有研究指出,该药材还具有抵抗癌细胞的能力,可以通过调控mTOR来抑制肝癌细胞的增殖;还可以抑制肺癌细胞的发生发展〔7,8〕。研究发现Toll样受体(TLR)4/核转录因子(NF)-κB是溃疡性结肠炎的重要信号通路之一,与炎症和免疫息息相关,其激活后在机体的炎症、免疫反应、细胞凋亡等过程中起枢纽作用〔9〕。但是白藜芦醇是否可以通过调控TLR4/NF-κB通路对溃疡性结肠炎大鼠的炎症反应有一定的作用,还不够明确,因此,本文观察白藜芦醇对溃疡性结肠炎大鼠炎症反应的影响,并探讨其相关机制。
1 资料与方法
1.1实验动物与分组 选取50只9周龄左右的SD雄性大鼠,体质量260 g左右,购自北京科宇动物养殖中心,饲养与无菌环境中,温度27 ℃左右;湿度:55%左右,自由进食,适应性喂养1 w后进行实验。将其随机分为:空白组、模型组、白藜芦醇低、中、高剂量组,每组各10只。
1.2仪器与试剂 白藜芦醇(纯度≥99%,美国Sigma公司)、磷酸盐缓冲液(PBS,成都中仕石化有限公司)、石蜡(瑞沃德生命科技有限公司)、乙醇、生理盐水(南京化学试剂有限公司)、所需试剂盒(上海酶联生物科技有限公司)、离心机、凝胶成像仪(上海无陌光学仪器有限公司)、酶标仪、PCR仪、电泳仪(大龙兴创实验仪器有限公司)、组织匀浆机(深圳欣博盛生物科技有限公司)、所需抗体(美国Thermo公司)。
1.3模型制备 采用2,4,6-三硝基苯磺酸(TNBS)灌肠法制备模型〔10〕,大鼠适应性饲养7 d,禁食不禁水24 h后开始造模,首先对除空白组外的大鼠进行麻醉,仰卧位置于鼠台上,然后快速将0.65 ml的TNBS结合乙醇溶液灌入,空白组则灌入等体积生理盐水,大鼠均快速注入后捏紧肛门,提取大鼠尾巴数分钟,以防注倒流。大鼠清醒后开始常规饲养,自由饮食。第2天开始除空白组和模型组外,白藜芦醇低、中、高剂量组分别腹腔注射白藜芦醇(10、50、100 mg/kg),连续给药7 d,而空白组和模型组则不处理。
1.4苏木素-伊红(HE)染色观察大鼠组织病理变化 先将大鼠麻醉,仰卧固定,打开腹部暴露脏器,小心摘取肝脏、肺脏后,用生理盐水充分冲洗后再固定,流水冲洗并采用酒精脱水,再将组织块置于既溶于酒精又溶于石蜡的透明剂中,放入保温箱中。待石蜡完全浸入组织块后包埋,连续5 μm切片,进行染色,然后观察各组大鼠结肠组织的病理学变化,并进行评分,评分=炎症分数+溃疡深度分数+肠壁增厚分数+隐窝破坏情况分数。
1.5酶联免疫吸附试验(ELISA)检测各组大鼠血清炎性细胞因子 将大鼠颈部的皮向后撸,使大鼠的眼睛突出后采集血液,离心后置于-80 ℃环境中待检,采用ELISA检测大鼠血清肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-1β、IL-10的表达,严格按照说明书操作。
1.6Western印迹检测各组组织TLR4/NF-κB信号通路的相关蛋白表达 取组织总蛋白进行测定,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),分离后进行转膜用牛血清白蛋白(BSA)封闭聚偏氟乙烯(PVDF)膜1 h,脱脂封闭后加入TLR4、NF-κB抗体;吸尽一抗孵育时的洗涤液后加入稀释好的二抗慢慢摇动;再次摇动洗涤,进行化学发光反应,然后浸入显影液中显色、最后凝胶成像,计算蛋白表达。
1.7PCR检测各组组织中TLR4、NF-κB mRNA表达 提取血清总RNA,按逆转录试剂盒说明书要求,将提取的总RNA反转录成cDNA,然后再进行扩增,以GAPDH为内参,检测相对表达:ΔCt=目的基因Ct-内参基因Ct,引物序列:TLR4正向5′-CCTGTGGACAAGGTCAGCAACTC-3′,反向5′-CACTCAGACTCGGCACTTAGCAC-3′;NF-κB正向5′-TGAG-TCCCGCCCCTTCTAAA-3′,反向5′-CCTGGATCACTTCAATGGCCT-3′;GAPDH正向5′-GGAGCGAGATCCCTCCAAAAT-3′,反向5′-GGCTGTTGTCATACTTC-TCATGG-3′。
1.8分子对接 运用YASARA分子模拟软件进行结构优化,运用软件AutoDock4.0进行刚性分子对接,白藜芦醇构象的搜索使用 Lamarchian遗传算法,能量匹配通过半经验自由能的计算。验证白藜芦醇与TLR4/NF-κB的相互作用。
1.9统计学方法 采用SPSS21.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1各组结肠组织病理结果比较 空白组结肠结构清晰,黏膜上皮结构较好,细胞排列整齐均匀,无浸润。模型组结肠黏膜、黏膜下层见大量炎性细胞浸润,且结构紊乱,溃疡已达到肌层,固有层结构破坏严重。白藜芦醇各剂量组结肠黏膜、黏膜下层炎性胞浸润明显减少,结构开始逐渐清晰,水肿、糜烂现明显减轻,且随着剂量增加,溃疡明显减少。且与空白组相比,模型组及白藜芦醇高、中、低剂量组病理评分显著升高,而白藜芦醇各剂量组病理评分显著下降,且呈剂量依赖性(P<0.05),见图1、表1。

表1 各组病理组织评分、炎性细胞因子水平

图1 各组结肠组织病理学(HE染色,×100)
2.2各组血清炎性细胞因子 与空白组相比,模型组及白藜芦醇各组TNF-α、IL-6、IL-1β水平显著较高,IL-10水平显著较低;与模型组相比,白藜芦醇各组TNF-α、IL-6、IL-1β水平显著较低,IL-10水平显著较高,且随着剂量的增加而变化(P<0.05),见表1。
2.3各组TLR4/NF-κB信号通路相关蛋白和mRNA表达 与空白组相比,模型组TLR4、NF-κB蛋白和mRNA表达显著较高(P<0.05),白藜芦醇用药后,TLR4、NF-κB蛋白和mRNA表达显著下降,且随着剂量的增加而显著降低(P<0.05),见表2、图2。

表2 各组结肠组织中TLR4、NF-κB蛋白和mRNA表达比较

1~5:空白组、模型组、白藜芦醇低剂量组、白藜芦醇中剂量组、白藜芦醇高剂量组图2 各组TLR4、NF-κB蛋白表达
2.4分子对接结果 分子对接时Grid Box分子对接格点包含整个模型,分子对接格点为94×86×113,格点间距为0.375 nm。分别选择O00206TLR4、P19838NF-κB的晶体结构从uniprot中下载,序列号分别为4G8A、3GUT,分辨率分别为2.40Å、3.59Å,结合能分别为-6.37、-5.31;结合模式见图3、图4。
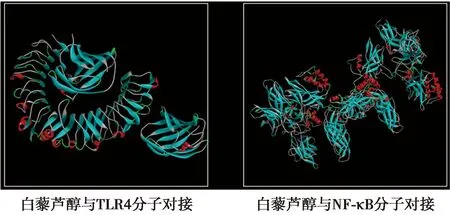
图3 白藜芦醇和TLR4/NF-κB作用的3D图

图4 白藜芦醇和TLR4/NF-κB作用的2D图
3 讨 论
研究认为溃疡性结肠炎有关,病因与免疫炎症通路密切相关〔11〕。目前为止,普遍接受的机制是在易感人群中肠道免疫的平衡被破坏,从而产生许多促炎因子,导致免疫紊乱〔3〕。且该病极易发展为结肠癌,因此,早期的治疗显得至关重要。但目前的常规化疗药物有极其严重的耐药反应,并且长时间使用,还会伴有副作用,严重影响患者的生存质量〔12〕。白藜芦醇具有吸收快、代谢迅速的特点,排泄方式通过尿液排出,所以其副作用较低〔13〕。Ruan等〔14〕指出,白藜芦醇通过调节产生炎症的酶和途径表现出抗感染活性,并提到其可以抑制许多癌症和肿瘤发生和转移。NF-κB是溃疡性结肠炎发病时关键的调控因子,其可以调控促炎因子的表达,影响炎症,也有研究发现TLR4在该病发生发展中起到了枢纽的作用〔15,16〕。
本研究首先证实了大鼠造模成功;其次说明了白藜芦醇对溃疡性大鼠有较好的保护作用。赵承满等〔17〕认为抗炎症类药物可通过调控炎症介质对该病有一定的治疗作用。本研究结果说明白藜芦醇可能是调节TNF-α、IL-6、IL-1β因子的水平对淋巴细胞进行抑制,避免大鼠发生免疫反应;白藜芦醇可以通过对TLR4介导的信号通路调控TLR4及NF-κB蛋白及基因表达,减少促炎因子的释放,从而抑制免疫反应,减轻大鼠结肠组织的炎症损伤。这与顾怡康等〔18〕的研究结论也基本一致。
姚君等〔19〕研究指出,白藜芦醇可提高溃疡性结肠炎大鼠肠道的IL-10的水平,从而下调T细胞和巨噬细胞转录分泌的致炎因子的作用,最终抑制细胞免疫反应,使肠道免疫炎症反应得到了一定的控制。但是其具体调控通路并未指出。王坚衡等〔20〕研究表明白藜芦醇可以改善溃疡性结肠炎大鼠的病理学改变,是通过调控通过抑制TLR4活性,以阻止其下游的核转录因子NF-κB的激活,阻碍其信号传递而实现的,但对其炎症介质的研究并不深入。在本研究分子对接实验中表明白藜芦醇具备抵抗溃疡性结肠炎的作用,其机制可能与炎症通路及炎症介质密切相关。
综上,白藜芦醇可以减轻溃疡性结肠炎大鼠的肠道炎症反应,对大鼠具有保护作用,其机制可能是通过调控TLR4/NF-κB信号通路,从而调节炎症因子实现的,但本文只是初步探讨,还需后续研究进一步验证。

