不同年龄女性甲亢患者碘131 干预前后骨代谢指标比较
丁利平,刘玉林,周彦,常远
(河南省开封市中心医院核医学科,河南 开封 475000)
甲亢是内分泌系统常见疾病[1]。 研究表明甲亢患者血液中甲状腺素的升高可能造成机体诸多系统损害,如干扰正常骨代谢,从而引发骨量流失,造成骨密度降低或骨质疏松症[2]。 目前,对甲亢临床首选药物治疗, 抗甲亢类药物作用机制主要为阻止离子碘氧化, 从而使甲状腺素的分泌与合成减少,进一步使血液中甲状腺激素减少,最终解除过多的甲状腺素对机体的损害[3]。 但是长期服用此类药物会产生较多不良反应。 大量临床实践表明,甲亢患者采取碘131 治疗,具有安全方便、疗效显著的特点[4],因此许多西方国家首选碘131 治疗成人甲亢。 但是对于甲亢伴有低骨量及骨质酥松患者能否仅给予碘131 治疗,从而恢复其骨密度,目前尚具有争议。 有研究表明, 甲亢患者在单纯碘131 治疗过程中骨密度 (Bone mineral density,BMD)可随着甲亢的缓解而改善[5],但也有研究表明,甲亢患者使用单一碘131 治疗一年后,股骨颈与髋关节BMD 恢复程度无法达到正常水平[6]。 基于此,本研究拟探讨不同年龄女性甲亢患者碘131治疗前后骨代谢指标变化情况, 旨在明确甲亢患者采取碘131 治疗对其骨代谢的影响, 从而为甲亢伴骨量减少患者是单一用药还是联合用药提供理论依据。 现将研究结果报告如下。
1 一般资料与方法
1.1 一般资料 选取本院2019 年2 月至2020 年6月收治的甲亢女性患者240 例作为研究对象,依据年龄和绝经情况将其分为A 组青年患者(60例);年龄21 岁~35 岁,平均(28.7±7.6)岁,病程6~15 月,平均(11.4±5.9)月;B 组中年未绝经患者(60例);年龄35 岁~49 岁,平均(42.3±7.3)岁;C 组中年围绝经及已绝经10 年患者(60 例);年龄50 岁~59 岁,平均(55.4±4.5)岁及D 组老年患者(60 例),年龄60 岁~75 岁,平均(67.7±7.4)岁。四组患者除年龄外,其他基本资料差异均无统计学意义(P>0.05)。
1.2 纳入与排除标准 纳入标准(依据第七版《内科学》中甲状腺相关诊断标准):(1)患者具有甲亢典型症状,通过生化测定甲状腺功能、甲状腺显影及检查碘摄取率水平, 明确诊断为甲亢患者;(2)治疗前停用含碘药物、含碘食物、及抗甲状腺药物达2 周以上;(3) 临床资料完整, 肝肾功能正常;(4)同意治疗方案者。
排除标准:(1)非首次发病患者;(2)治疗前进行钙剂、维生素D、及糖皮质激素治疗者;(3)甲亢同时伴有肝肾功能、及心肺功能不全者,或伴有恶性肿瘤等; (4)甲亢伴结节性甲状腺肿、胸骨后甲状腺肿等;(5)哺乳期及妊娠期甲亢患者。
1.3 方法
1.3.1 碘131 治疗 240 例患者均停用其他抗甲亢类治疗药物,采用碘131 氯化钠口服溶液(原子高科股份有限公司 国药准字H10960250)治疗。首先运用断层积分法确定甲状腺质量。 根据公式:甲状腺质量 (g)*每克甲状腺应给予碘131 理论用量/甲状腺对碘131 的最大吸收率(%)=碘131 实际一次性空腹口服剂量。 其中规定每克甲状腺应给与的理论剂量为2.6MBq~3.7MBq。
1.3.2 骨代谢指标及BMD 测定 骨代谢指标测定:分别于治疗前、治疗后6 月及12 月后采集患者空腹静脉血。 运用化学发光免疫夹心法检测骨钙素(BGP)及降钙素(CT)水平(深圳新产业生物医学,设备MAG2000 及配套试剂)。 运用免疫分析法(试剂盒由上海纪宁提供) 测定β 胶联降解产物(β-CTx)及Ⅰ型胶原氨基端延长肽(PINP)。
骨密度测定: 由科室高资历专业人员运用Norland XR-600 双能X 线骨密度仪测定患者腰椎骨密度。 检查前需测量患者身高、体重,并输入相关信息;检查时患者需除去手机、钥匙、钱包、手表、皮带、拉链、钮扣、硬币、银行卡等影响X 线穿透作用物品,检查中患者取仰卧位、双腿垫高,检查人员打开激光定位灯,将扫描灯移至剑突下2 cm处,依次采集图像,至脐下2 cm 处结束。 操作结束后保存、分析图像,得出结果。
1.4 观察指标及指标判定 观察指标:测定四组患者治疗前、 治疗6 月及12 月后骨代谢指标(BGP、CT、β-CTx、PINP) 及BMD 水平; 并采用单因素ANOVA 比较四组上述各指标组间差异;且用LSD事后多重比较将BGP、CT、β-CTx、PINP 组间差异进行两两比较, 采用重复测量方差分析比较四组患者BGP、CT、β-CTx、PINP 及BMD 各测量时点差异。
指标判定:β-CTx 参考值范围: 绝经前为0.08 ng/mL~0.72 ng/mL, 绝经后为0.10 ng/mL~0.79 ng/mL。 PINP 参考范围:绝经前为15.13 ng/mL~58.89 ng/mL,绝经后为16.27 ng/mL~73.87 ng/mL。骨钙素参考范围:4.8~10.2 μg/L。 降钙素参考范围:0.2~0.5 ng/mL。
1.5 统计学分析 采用SPSS 22.0 作为统计分析软件,计量资料用(±s)表示,组间比较采用单因素ANOVA,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 四组患者骨代谢指标比较 四组患者治疗前、治疗6 月及12 月后外周血BGP、CT、β-CTx、PINP水平描述性统计见表1。 单因素ANOVA 方差分析结果显示, 治疗前四组外周血BGP、CT、β-CTx、PINP 水平无显著差异(P>0.05);治疗6 月及12 月后四组上述各指标存在显著差异(P<0.05)。事后多重比较显示,治疗6 月及12 月后A、B、D 组外周血BGP、CT、β-CTx、PINP 水 平 显 著 低 于C 组 (P<0.05),且差异具有统计学意义(P<0.05)。且治疗12月后,A、B 组外周血CT、β-CTx、PINP 水平显著低于D 组;组内比较,A、B、C、D 四组,治疗6 月12 月后,外周血BGP、CT、β-CTx、PINP 水平显著低于治疗前 (P<0.05), 治疗12 月后A、B、D 组外周血BGP、CT、β-CTx、PINP 水平显著低于治疗6 月后(P<0.05),C 组外周血BGP、CT、β-CTx、PINP 水平与治疗6 月比较,差异不具有统计学意义(P>0.05)。
表1 四组患者外周血BGP、CT、β-CTx、PINP 水平比较(±s)

表1 四组患者外周血BGP、CT、β-CTx、PINP 水平比较(±s)
注:与治疗前比较*P<0.05,与治疗后6 月比较cP<0.05,与C 组比较aP<0.05,与D 组比较bP<0.05。
时间 组别 n BGP(mg/L) CT(μg/L) β-CTx(μg/L) PINP(mg/L)治疗前60 60 60 60治疗6 月60 60 60 60治疗12 月ABCDFPABCDFPABCDFP 60 60 60 60 11.97±7.46 11.12±7.31 11.94±7.64 11.09±7.63 0.256 0.857 8.23±6.12*a 8.26±6.51*a 10.35±6.45*8.24±6.24*a 3.640 0.014 5.32±5.32*ac 5.56±5.41*ac 10.23±5.34*5.12±4.97*ac 12.470 0.001 0.86±0.45 0.76±0.51 0.79±0.47 0.78±0.46 0.507 0.678 0.58±0.21*a 0.61±0.24*a 0.73±0.34*0.62±0.24*a 3.853 0.010 0.26±0.14*abc 0.28±0.16*abc 0.68±0.32*0.41±0.03*ac 60.577 0.001 0.97±0.03 0.98±0.04 0.97±0.03 0.98±0.05 1.356 0.257 0.43±0.23*a 0.49±0.27*a 0.85±0.32*0.58±0.24*a 35.472 0.001 0.32±0.06*abc 0.34±0.07*abc 0.81±0.04*0.47±0.02*ac 436.381 0.001 75.93±0.13 75.94±0.11 75.95±0.09 75.94±0.12 0.311 0.818 42.61±0.11*a 42.64±0.12*a 62.69±0.11*42.63±0.13*a 533.182 0.001 18.32±0.12*abc 18.31±0.11*abc 59.61±0.13*19.31±0.12*ac 174.29 0.001
2.2 四组患者治疗前后BMD 水平比较 四组患者治疗前、 治疗6 月及12 月后BMD 水平描述性统计见表2。 单因素ANOVA 方差分析结果显示,治疗前四组股骨颈、 腰椎L1~L4 的BMD 差异不具有统计学意义(P>0.05)。 治疗6 月及12 月后四组间BMD 水平存在显著差异(P<0.05)。 事后多重比较显示, 治疗6 与12 月后A、B 组股骨颈、 腰椎L1~L4 的BMD 水平显著高于C、D 组(P<0.05)。 组内比较,A、B 组治疗6 月及治疗12 月后,股骨颈、 腰椎L1~L4 的BMD 水平较治疗前显著升高(P<0.05)。
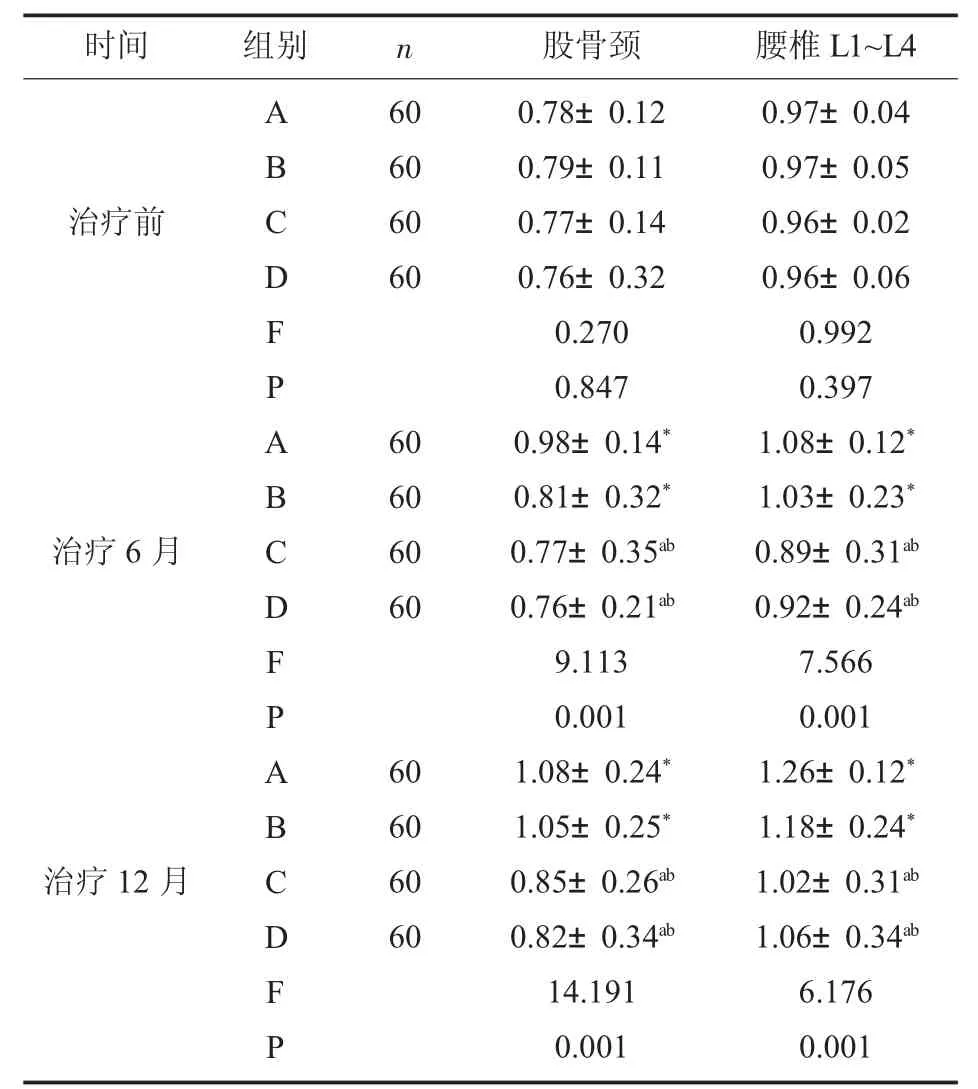
表2 四组股骨颈、腰椎L1~L4 的BMD 水平比较
3 讨论
骨吸收与形成失衡通常会造成骨量减少,从而引发骨质疏松[7]。 该病发病机制错综复杂,多是由环境、遗传、疾病等因素相互作用的结果[8]。 其发生过程是动态变化的,目前,虽无法直接测定其发生情况,但可间接通过测定骨代谢指标,从而了解其严重程度[9]。 近年来,研究表明,甲亢可引发骨量丢失,甚至造成骨质疏松[10~11]。 其机理可能为,骨组织中存在三碘甲状腺原氨酸(T3)与四碘甲状腺原氨酸(T4)受体[11],当机体甲状腺激素分泌正常时,甲状腺素可通过作用于T3、T4 受体,调节骨代谢,维持骨生长发育[12]。 而当机体处于甲亢状态时,会分泌大量甲状腺素, 从而激活破骨细胞与成骨细胞活性,且破骨细胞活性大于成骨细胞,从而加速骨吸收与骨转化[13]。因此骨代谢出现转换率增高的状态。 其表现为,在正常成人5~7 月的骨转化周期基础上,骨转化时间约缩短一半,从而最终导致骨矿物质流失,甚至发生骨质疏松[14]。
目前对甲亢首选药物治疗, 但是长时间服用甲亢治疗药物容易引发诸多不良反应[15]。碘131 治疗甲亢具有安全、高效的特点,因此美国等西方国家将碘131 作为治疗成人甲亢首选药物。 但是对于甲亢伴有骨量流失、骨质疏松患者,能否仅给与单一碘131 治疗,从而改善其骨密度。 本研究选取240 例甲亢伴低骨量女性患者,依据年龄及绝经情况分为四组。 结果显示, 青年女性甲亢患者经碘131 治疗12 个月后,BMD 随着骨代谢指标下降而升高,且恢复效果良好;绝经前中年女性甲亢患者BMD 也随着骨代谢指标下降而升高, 但恢复效果次于青年患者。 围绝经及绝经10 年中年女性患者治疗结束后骨代谢指标相应下降, 但是无法降至绝经前水平。 老年女性甲亢患者经碘131 治疗后骨代谢指标降低, 但BMD 较治疗前只是略有回升。 分析原因可能为,人体骨骼生长发育在20 岁之前, 形成大于吸收为正钙期;20~40 岁骨形成与吸收大致相等[16],且形成并维持骨峰值量,为零钙平衡期;随着年龄增长,钙摄入与吸收减少,骨形成小于吸收,为慢钙平衡期。 甲亢患伴低骨量患者经碘131 治疗后,一定程度上降低了骨代谢率,但是并未从根本上增强成骨细胞活性, 因此中老年患者无法显著改善低骨量状态。
对于碘131 治疗能否改善甲亢患者低骨量情况,除考虑年龄因素,还应考虑性别因素。 因为女性骨代谢生理特点为, 在围绝经期及之后10 年,骨代谢处于高转换状态[17],而当年龄大于60 岁以后的老年阶段, 成骨细胞与破骨细胞均处于低活性状态,因此老年女性虽然多伴有骨质疏松,但是其类型属于骨代谢低转换型。 对于围绝经期及绝经10 年的中年女性甲亢患者,甲亢本身导致的病理性骨代谢, 及高骨转换率与生理性的高骨转换相叠加,从而加剧了骨量流失。 而采用碘131 治疗仅扭转病理性高骨转换状况,但患者生理性高骨状态并未得到有效控制,因此BMD 未得到显著改善。
综上所述,甲亢患者采用单一碘131 治疗,对其骨代谢指标及骨密度的影响与患者年龄有一定关系, 且中老年女性甲亢患者仅给与碘131 治疗对其BMD 恢复效果有限,临床需要对其骨质疏松及低骨量给与积极治疗。

