MicRNA-126 与肝癌细胞增殖、凋亡的关系研究
李宁,崔中锋,李琤
(河南省传染病医院,河南 郑州 450000)
肝癌是世界上第五大最常见的癌症, 也是全球第三大与癌症相关的死亡原因[1]。 尽管近年来在肝癌诊断和治疗方面取得了不错的进展, 但肝癌患者长期预后仍然很差, 晚期肝癌患者5 年生存率低于5%[2]。 证据表明,肝内复发和转移是影响肝癌患者预后不良的危险因素[3]。 但肝癌复发和转移的分子机制尚未完全阐明。 肝癌发生和发展与包括microRNAs 在内的多种基因有关。 microRNA 是一类长度为21~25 个核苷酸的内源性小RNA,可在转录后水平或翻译水平上负调控基因表达,从而参与调控细胞增殖、凋亡、迁移和侵袭等多种细胞生物学过程[4]。研究显示,micRNA-126 在胃癌[5]、肺癌[6]、前列腺癌[7]等多种肿瘤中下调表达,可能发挥抑制肿瘤发生和发展的作用。 亦有文献报道,micRNA-126 在肝癌组织中的表达显著低于癌旁组织和正常组织, 且micRNA-126 低表达是影响肝癌患者预后不良的独立因素[8]。但有关micRNA-126 影响肝癌细胞生物学功能作用的报道较少。本研究旨在分析探讨micRNA-126 对肝癌细胞增殖、凋亡的影响及其相关机制,现详细报告如下。
1 材料与方法
1.1 动物和细胞株 16 只BALB/c 裸鼠(4~5 周龄)购买自上海斯莱克实验动物有限公司,体质量16~22 g,实验动物合格证号:SYXK(沪)2019-0008,人肝 癌 细 胞 株HepG2、MHCC97-L、PLC、Huh7 以 及人肝细胞株L02 购买自中国科学院上海细胞库,micRNA-126 mimics 和micRNA-126 NC 均购买自上海吉玛制药技术有限公司。
1.2 试剂和仪器 胎牛血清、 胰蛋白酶消化液、DMEM 培养基、青霉素-链霉素溶液(批号或货号分别为:SV30184.02、J160030、AB216496、SV30010。美国Hyclone 公司);MTT、二甲基亚砜(批号或货号分别为:303H0523、D8371。北京索莱宝科技有限公司);转染试剂Lipofectamine 3000(批号或货号:L3000-015。 美国Invitrogen 公司);蛋白酶抑制剂(批号或货号:P7626。 美国Sigma 公司);膜联蛋白V-异硫氰酸荧光素 (Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒(批号或货号:A211-01。南京诺唯赞生物科技有限公司);PrimeScriptTM RT reagent 试剂盒 (批号或货号:RR037A。 日本Takara 公司);LightCycler 480 SYBR Green I Master 试剂盒 (批号或货号:4887352001。 Roche 公司);RIPA 裂解液、BCA 蛋白定量试剂盒 (批号或货号分别:R0010、PC0020。北京索莱宝科技有限公司);ECL 化学发光试剂盒(批号或货号:P0018M。杭州碧云天生物技术研究所); 羊抗PIK3R2、PI3K、PDK1、AKT、p-PI3K、p-PDK1、p-AKT、GAPDH抗体 (批号或货号分别为:PA5-101022、MA1-74183、MA5 -15797、MA5 -14916、PA5 -104853、PA5-104700、44-621G、MA5-15738-D680,Thermo Fisher 公司); 辣根过氧化酶标记二抗 (批号或货号:bs-40296G。 北京博奥森生物技术有限公司);CO2 细胞培养箱(型号:HF151UV。 上海力新仪器有限公司);紫外分光光度计(型号:Q5000。 美国Quawell 公司);流式细胞仪(型号:FACScanto II。美国BectonDickinson 公司); 实时荧光定量PCR仪 (型号:FTC-3000。 上海枫岭生物技术有限公司);蛋白印迹电泳仪(型号:Power PacTM HC。 美国Bio-Rad 公司)。
1.3 方法
1.3.1 细胞培养 将人肝癌细胞株HepG2、MHCC97-L、PLC、Huh7 和人肝细胞株L02 置于含有10%胎牛血清的DMEM 培养基中于37 ℃、5%的CO2 细胞培养箱中进行培养,每1~2 d 传代一次。
1.3.2 总RNA 提取、逆转录以及RT-PCR 检测 收集对数生长期的人肝癌细胞株HepG2、MHCC97-L、PLC、Huh7 和人肝细胞株L02,加入1 mL Trizol 溶液,上下颠倒混匀,并以1∶1 比例加入氯仿,再加入500 μL 提前预冷异丙醇,提取总RNA。 于260 nm和280 nm 处测定吸光度, 并使用PrimeScriptTM RT reagent 试剂盒将RNA 逆转录成cDNA。 将所得cDNA 稀释5~50 倍进行RT-PCR 反应(反应体系:上游、下游引物0.5 μL,SYBR GREEN 0.3 μL,2×Taq Master Mix 10.0 μL,cDNA 1.0 μL, 加 无RNase 水至20.0 μL。 反应程序:95 ℃、5 min,预变性;95 ℃、10 s,变性,60 ℃、20 s,复性,72 ℃、15 s,延伸,40 个循坏;72 ℃、5 min 延伸, 以U6 为内参基因,引物序列:F:5‘- CTTAGTTGCGTTACACCCTT TCTTG-3’,R:5‘-CTGTCACCTTCACCGTTCCAGT TT-3’, 引物由上海吉玛制药技术有限公司合成,实验重复三次, 目的基因micRNA-126 mRNA 相对表达水平采用2-△△Ct法进行计算。
1.3.3 细胞转染 当HepG2、MHCC97-L 细胞密度长至80%~90%时,弃液,并使用PBS 磷酸缓冲液冲洗;加入0.25%胰蛋白酶消化液进行消化,收集细胞混合液,1 000 rpm 离心5 min;弃液,加入新鲜完全培养基重悬细胞,以每孔1×105个细胞接种至6 孔细胞板中, 置于37 ℃、5%的CO2细胞培养箱中进行培养。 第二天,观察细胞生长状态良好,用移液枪轻轻吸走培养液, 加入不含胎牛血清的DMEM 培养基,分别转染micRNA-126 mimics(micRNA-126 mimics 组)和micRNA-126 NC(micRNA-126 NC 组),control 组不转染任何序列, 置于37 ℃、5%的CO2细胞培养箱中培养4 h;用移液枪轻轻吸走培养液, 并加入含有10%胎牛血清的DMEM 培养基,放回CO2细胞培养箱中继续培养。
1.3.4 MTT 检测肝癌细胞增殖能力 分别取5×103个HepG2、MHCC97-L 细胞接种至96 孔细胞板中,设置6 个复孔,培养至细胞贴壁开始转染micRNA-126 mimics 和micRNA-126 NC。 同时设置空白对照组, 置于37 ℃、5%的CO2细胞培养箱中培养,于24 h、48 h、72 h 以及96 h 时进行MTT 检测,具体操作为:分别于24 h、48 h、72 h 以及96 h时用移液枪轻轻吸走培养液, 加入100 μl 新鲜DMEM 培养基+10 μL MTT 混合液 (浓度为5 mg/mL),置于37 ℃、5%的CO2细胞培养箱中培养4 h;用移液枪轻轻吸走培养液,并加入150 μL 二甲基亚砜,避光静置10 min,于450 nm 处测定吸光度。
1.3.5 流式细胞仪检测肝癌细胞凋亡能力 分别取生长至80%~90%的HepG2、MHCC97-L 细胞接种至6 孔细胞板中,设置6 个复孔,当细胞生长至密度为80%~90%时进行转染,操作同1.3.3;转染48 h,弃液,PBS 冲洗, 加入0.25%胰蛋白酶消化液消化细胞,收集细胞混合液并离心,调整细胞密度为1×105个细胞,PBS 冲洗两次;各组细胞分别加入500 μL Binding Buffer, 吹打混匀; 再分别加入5 μL Annexin V-FITC、5 μL PI,避光孵育15 min;取1×106个细胞,采用流式细胞仪检测细胞凋亡率。
1.3.6 RT-PCR 检测转染前后micRNA-126 表达水平转染48 h,取对数生长期细胞提取总RNA,检测各组micRNA-126 表达水平,具体操作同1.3.2。
1.3.7Western blot检测凋亡相关蛋白表达 转染48 h,取各组对数生长期细胞,加入1 mL 蛋白裂解液(蛋白酶抑制剂:RIPA 裂解液=1∶1),置于冰上裂解30 min,12 000 rpm 离心5 min, 取上清转移至新的离心管中,测定蛋白浓度。 配制分离胶和浓缩胶,取40 μg 蛋白样品进行SDS-PAGE 电泳,设置初始电压为80 V,大约电泳30 min,见待溴酚蓝指示带到达分离胶时,调整电压为120 V,继续电泳2 h,直至溴酚蓝指示带电泳至分离胶底部。根据目的分子条带切取凝胶, 并准备相应大小的硝酸纤维素膜,使用“三明治”夹转膜,设置恒定电流200 mA,时间为1.5 h。 使用TBST 配制的5%脱脂奶粉溶液室温封闭2 h,再分别加入一抗(PIK3R2、PI3K、PDK1、AKT、p -PI3K、p -PDK1、p -AKT、GAPDH)4℃孵育过夜,然后加入二抗孵育2 h;在避光条件下混匀ECL 化学发光液A 液和B 液,使用移液枪均匀地滴加至硝酸纤维素膜上,静置5 min,曝光显影,并置于显影仪中拍照,采用凝胶图象处理系统(Gel-Pro-Analyzer)软件测定各蛋白灰度值,目的蛋白相对表达水平=目的蛋白灰度值/内参蛋白灰度值。
1.3.8 裸鼠成瘤实验 16 只BALB/c 裸鼠随机分为过表达组和阴性对照组,转染micRNA-126 mimics和micRNA-126 NC 的HepG2 细胞培养48 h,经0.25%胰蛋白酶消化液消化, 制成细胞密度为1×1013个/L 的细胞悬液, 取100 μL 分别从两组裸鼠腋下注射,每组各8 只,每周测量裸鼠皮下肿瘤体积,计算公式为体积=[(肿瘤最长径×肿瘤最短径)]2×0.5,观察6 周后处死小鼠,称重。
1.3.9 生物信息学预测 采用miRwalk2.0(http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/)网站预测micRNA-126 可能的作用靶点。
1.3.10 micRNA-126 与PIK3R2 的靶向关系验证采用荧光素酶实验进一步验证micRNA-126 与PIK3R2 的靶向关系, 体外合成含micRNA-126 与PIK3R2 3’ UTR 碱基互补区域的DNA 片段(WT)及含该位点突变体的DNA 片段(MUT),并克隆至双荧光素酶启动子载体, 将质粒转染到micRNA-126 细胞和mimics 细胞,培养48 h,采用荧光素酶检测试剂盒检测荧光素酶活性。
1.4 统计学方法 数据分析处理应用SPSS 20.0 统计学软件进行,计量资料实验结果采用(±s)表示,多组组间数据对比首先进行正态性检验和方差齐性检验, 方差齐性采用单因素方差分析(one-way ANOVA),多组两两对比采用LSD 法,P<0.05,为差异有统计学意义。
2 结果
2.1 RT-PCR 检测micRNA-126 在肝癌细胞中的表达 通过检测micRNA-126 在人肝癌细胞株HepG2、MHCC97-L、PLC、Huh7 以 及 人 肝 细 胞 株L02 中的表达,micRNA-126 在人肝癌细胞株HepG2、MHCC97-L、PLC、Huh7 中的表达水平显著低于人肝细胞株L02 中的表达水平, 差异有统计学意义(P<0.05)。 见图1。

图1 micRNA-126 在人肝癌细胞和人肝细胞中的表达水平
2.2 RT-PCR 检测转染前后micRNA-126 表达水平的变化 RT-PCR 检测结果显示,micRNA-126 mimics 组HepG2、MHCC97-L 细胞中micRNA-126表达水平显著高于control 组和micRNA-126 NC组,差异有统计学意义(P<0.05)。 见图2。

图2 转染mimics 后HepG2、MHCC97-L细胞中micRNA-126 表达水平
2.3 MTT 法检测过表达micRNA-126 对肝癌细胞增殖的影响 MTT 法检测结果显示,在24 h、48 h、72 h 以及96 h 时,micRNA-126 mimics 组HepG2、MHCC97-L 细胞增殖率均显著高低于control 组和micRNA-126 NC 组,差异有统计学意义(F=12.167,F=6.771,F=17.073,F=38.671;F=17.182,F=18.590,F=12.604,F=32.876,P<0.05)。 见图3。
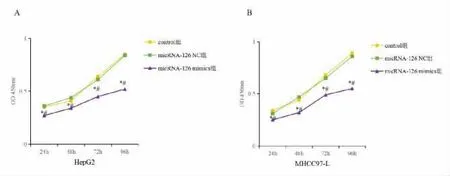
图3 MTT 法检测过表达micRNA-126对肝癌细胞增殖能力的影响
2.4 流式细胞术检测过表达micRNA-126 对肝癌细胞凋亡的影响 流式细胞术检测结果显示,micRNA-126 mimics 组HepG2、MHCC97-L 细 胞 凋亡率均显著高于control 组和micRNA-126 NC 组,差异有统计学意义(P<0.05)。 见图4。
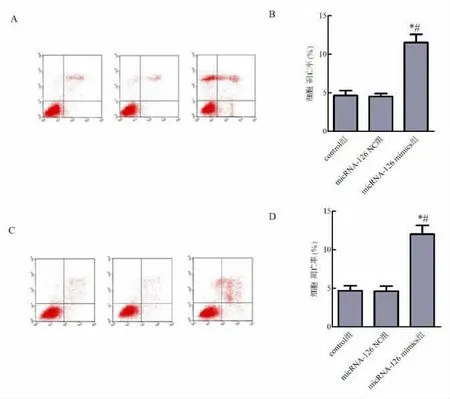
图4 过表达micRNA-126 对肝癌细胞凋亡的影响
2.5 过表达micRNA-126 对裸鼠移植瘤生长的影响 过表达组裸鼠肿瘤体积显著小于阴性对照组,差异有统计学意义(P<0.05)。 见图5。
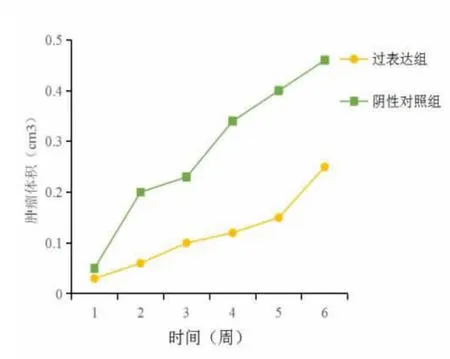
图5 裸鼠皮下成瘤模型肿瘤体积变化
2.6 micRNA-126 靶向抑制PIK3R2 蛋白表达并调控PI3K/PDK1/AKT 信号通路 micRNA-126 mimics 组PIK3R2、p-PI3K/PI3K、p-PDK1/PDK1、p-AKT/AKT 蛋白表达水平显著低于control 组和micRNA-126 NC 组(P<0.05)。 见图6。
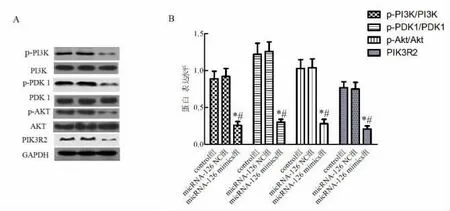
图6 Western blot 检测PIK3R2、PI3K、PDK1、AKT、p-PI3K、p-PDK1、p-AKT 蛋白表达
2.7 肝癌细胞中PIK3R2 是micRNA-126 的靶基因 通过生物信息学预测工具 (miRwalk2.0 网站)发现,PIK3R2 是micRNA-126 的潜在靶点,micRNA-126 与PIK3R2 3’ UTR 区域碱基互补,PIK3R2为肝癌细胞中micRNA-126 的靶基因。 见图7。

图7 生物信息学预测PIK3R2 为micRNA-126 的靶基因
2.8 micRNA-126 与PIK3R2 的靶向关系 与转染WT 荧光素酶质粒mimic NC 组相比, 共转染WT荧光素酶质粒micRNA-126 mimic 组荧光素酶活性显著降低(P<0.05),而转染MUT 荧光素酶质粒mimic NC 组和共转染MUT 荧光素酶质粒micRNA-126 mimic 组荧光素酶活性比较, 差异无统计学 意 义 (P>0.05),micRNA-126 可 靶 向 负 调 控PIK3R2。 见图8。

图8 荧光素酶实验验证micRNA-126 与PIK3R2 的靶向关系
3 讨论
各种microRNAs 在肝癌中的发病机制中发挥着重要的作用,microRNAs 可通过调控其靶基因参与肝癌发生和发展。 MicroRNA-23a 可抑制肝癌细胞MHCC97H 细胞生长和增殖, 并通过下调KIAP诱导MHCC97H 细胞凋亡[9]。 Liu 等[10]证明microRNA-222 抑制剂靶向BBC3 抑制肝癌细胞增殖、迁移和侵袭, 并抑制肝癌细胞凋亡。 Yu 等[11]发现miR-195 通过靶向YAP 来抑制肝癌细胞转移和上皮间充质转换。故microRNA 可能作为预测肝癌进展的新型生物标志物。
大量研究表明,micRNA-126 可能是多种肿瘤患者的调节因子和预后生物标志物[12-15]。 Nie 等[16]文献报道指出, 与癌旁正常组织相比,micRNA-126 在食管鳞状细胞癌组织中表达显著降低,EC109 细胞中micRNA-126 过表达可抑制细胞增殖和迁移。 过表达micRNA-126 可抑制宫颈癌细胞迁移和侵袭, 并可能通过调节PI3K/PDK1/AKT途径诱导HeLa 细胞凋亡[17]。 Zhang 等[18]研究也表明,micRNA-126 在卵巢癌中显著下调,micRNA-126 下调表达提示患者预后不良,其表达恢复则可明显抑制卵巢癌细胞增殖、侵袭和迁移,其可能与调节表皮生长因子样结构域7 以及ERK/MAPK 信号通路和上皮间充质转换有关。 本研究结果显示,肝癌细胞中micRNA-126 表达水平显著下调,与既往报道结果一致[19]。本研究中体外实验结果发现,micRNA-126 过表达可显著抑制肝癌细胞HepG2、MHCC97-L 细胞增殖,促进细胞凋亡,提示micRNA-126 可能是通过抑制肝癌细胞增殖和促进肝癌细胞凋亡影响肝癌发生和发展, 从而在肝癌细胞中发挥抑癌功能。 同时,裸鼠皮下成瘤模型实验结果显示,micRNA-126 过表达可明显抑制裸鼠皮下肿瘤生长, 进一步证明micRNA-126 在肝癌中起着抑癌作用。 彭吉祥等[20]也认为,micRNA-126过表达可抑制肝癌细胞HepG2 细胞增殖、 迁移和侵袭能力,促进细胞凋亡,并抑制裸鼠皮下成瘤模型肿瘤生长。 故micRNA-126 可能是调控肝癌发生和发展的重要影响因素。
PIK3R2 编 码PI3K 蛋 白,PI3K/Akt 信 号 通 路是与细胞生长密切相关的通路之一[21]。 PI3K 是由调控亚基(P85α、P85β、P85γ)和催化亚基(P110)组成的复合物,其产物PIP2 和PIP3 均是细胞内重要的第二信使,并在细胞增殖、凋亡以及代谢过程中发挥着重要作用[22]。 PI3K 被激活后,可使得细胞膜上的肌醇磷酸化,进而产生PIP3,PIP3 则与Akt 结合并使其活化, 活化的Akt 可调控细胞色素C 以及凋亡因子的释放,最终抑制细胞凋亡[23]。 本研究通过生物信息学预测分析micRNA-126 可能的靶基因, 结果显示,micRNA-126 与PIK3R2 3’ UTR区域碱基互补,PIK3R2 为肝癌细胞中micRNA-126 的靶基因。 进一步荧光素酶实验验证发现,micRNA-126 能够抑制野生型PIK3R2 细胞活性,且并不抑制突变型PIK3R2 细胞活性,提示micRNA-126 可靶向负调控PIK3R2 表达。Western blot检测结果显示,micRNA-126 mimics 组PIK3R2、p-PI3K/PI3K、p-PDK1/PDK1、p-AKT/AKT 蛋白表达水平显著低于control 组和micRNA-126 NC 组。提示micRNA-126 可能是通过与PIK3R2 mRNA 3’UTR 区域结合, 诱导PIK3R2 基因mRNA 序列降解, 从而抑制PIK3R2 蛋白合成, 从而抑制PI3K/PDK1/AKT 信号通路,最终促进肝癌细胞凋亡。 具体而言,一方面micRNA-126 通过作用于PI3K 抑制PDK1,使得AKT 磷酸化,进一步激活下游信号通路中GSK 3β、cyclinD 1、p70S6K 和S6, 最终调控细胞增殖; 另一方面micRNA-126 通过作用于PI3K 抑制PDK1, 使得AKT 磷酸化, 从而抑制Bad、Bcl-xL、Bax 以及激活Caspase-3/7, 最终促进细胞凋亡[24]。 Wu 等[25]研究也发现,micRNA-126 通过靶向PIK3R2 抑制骨肉瘤细胞增殖。 除此之外,有报道[26]指出,PLK-4 也可能是micRNA-126 的靶基因,miRNA-126/PLK-4 轴以及ATR/CHEK 1 通路的激活是肝癌发生和发展的关键,PLK-4/ATR/CHEK 1 通路可能是肝癌治疗的潜在靶点。 总而言之, 这些研究为进一步理解肝癌发生和发展的机制提供了依据, 但micRNA-126 影响肝癌细胞生物学功能作用有待继续深入研究。
综上所述, 肝癌细胞中micRNA-126 下调表达,过表达micRNA-126 可抑制肝癌细胞增殖,促进肝癌凋亡,抑制裸鼠皮下成瘤模型肿瘤生长,肝癌细胞中PIK3R2 是micRNA-126 的潜在靶基因,micRNA-126 可能靶向负调控PIK3R2 表达, 抑制肝癌细胞增殖及促进其凋亡, 可为进一步研究PIK3R2 在肝癌中的作用奠定理论基础,对开发肝癌治疗新药具有一定指导意义。

