五加五味软胶囊研制与质量评价
赵俊毅,陈鹰翔,韩继鹏,曲中原,邹 翔*
(1.哈尔滨商业大学 药物工程技术研究中心,哈尔滨 150076;2.哈尔滨商业大学 药学院,哈尔滨 150076)
东北道地药材刺五加(Acanthopanaxsenticosus)具有益气健脾,补肾安神的功效[1-2],临床上常用于改善原发性睡眠障碍[3].五味子(Schisandrachinensis)具有收敛固涩,益气生津,补肾宁心的功效,常用于心悸失眠、自汗盗汗等症[1-2].二者合用对心脾两虚、脾肾不足所致的心神不宁、失眠多梦、健忘、倦怠乏力、食欲不振等症状具有很好的疗效[3-9].两味药物不是单纯药物成分的累加,而是起到协同作用[10-11].
五味子和刺五加均为卫健委公布的可用于保健食品的中药,广泛应用于保健食品领域.目前市场上以刺五加和五味子为原料开发的产品有复方刺五加糖浆、刺五加脑灵液或五加五味口服液等,均为以粗制浸膏为原料制备的传统剂型.本研究在课题组前期研究的基础上明确了刺五加和五味子的健脾补肾,宁心安神药效物质基础分别为刺五加总苷和五味子总木脂素.本文以两个有效部位为原料,研制方便携带,用量小,疗效高的新型中药制剂软胶囊[12-14],为亚健康人群改善睡眠质量提供新的保健用药选择.
1 试剂与仪器
1.1 实验试剂
刺五加和五味子饮片购于哈尔滨市三棵树药材市场,经哈尔滨商业大学曲中原教授鉴定分别为五加科植物刺五加Acanthopanaxsenticosus(Rupr.et Maxim.)Harms的干燥根和木兰科植物五味子Schisandrachinensis(Turcz.)Baill.的干燥成熟果实.刺五加总苷以紫丁香苷计含总苷的量为16.3%.五味子总木脂素以五味子醇甲计含木脂素量为18.1%,均为本实验室制备.
紫丁香苷对照品 中国食品药品检定研究院;五味子醇甲对照品 成都曼思特生物科技有限公司;五味子甲素对照品 成都曼思特生物科技有限公司;五味子乙素对照品 成都曼思特生物科技有限公司;吐温-80 天津市大茂化学试剂厂;蜂蜡 上海华灵康复器械厂;明胶 河南博洋生物科技有限公司;大豆油 九三粮油工业有限公司;尼泊金乙酯 天津市北辰方正试剂有限公司;甘油 国药集团化学试剂有限公司;胃蛋白酶 上海化学试剂有限公司;甲醇色谱 天津科特试剂有限公司;其余试剂均为分析纯.
1.2 实验仪器
PTX-FA110型分析天平 上海诺科仪器仪表有限公司;DHG-9140A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;JLR-50型软胶囊机 北京中天精蓝科技有限公司;DB-2型数显不锈钢电热板 金坛市城东新瑞仪器厂;JMR-50型胶体磨 上海台驰轻工装备有限公司;U3000型高效液相色谱仪 赛默飞世尔科技公司.
2 实验方法
2.1 刺五加总苷的制备
取刺五加粉末,粉碎过40目筛,以料液比1∶8 g/mL、60%乙醇加热回流提取3次、每次提取1 h,合并滤液,减压浓缩后冻干,将所得干膏以AB-8型大孔树脂,0.5 g/mL的样品溶液,上样量为1∶5.3,上样速度为2 BV·h-1,5倍柱体积乙醇洗脱,洗脱剂乙醇质量分数为55%,富集纯化制得刺五加总苷[15].
2.2 五味子总木脂素的制备
取五味子粉末,粉碎过40目筛,以料液比为1∶12 g/mL、85%乙醇加热回流提取3次、每次提取1 h,合并滤液,减压浓缩后冻干,将所得干膏以AB-8型大孔树脂,1.5 mg/mL的样品溶液,上样量为1∶7,上样速度为2 BV·h-1,8倍柱体积乙醇洗脱,洗脱剂乙醇质量分数为95%,富集纯化制得五味子总木脂素.
2.3 五加五味软胶囊制备工艺
依据现代软胶囊制备技术,以豆油为基质,按一定比例加入刺五加总苷、五味子总木脂素、助悬剂(蜂蜡)、助溶剂(吐温-80)、及其他辅料;按一定的囊壳配比和工艺条件(进料口温度,转速比,晾晒干燥时间)下制得五加五味软胶囊.
2.4 五加五味软胶囊单因素实验设计
结合复方刺五加糖浆处方[16]及刺五加总苷和五味子总木脂素的得率,预计每日服用本品6粒药量,确定刺五加总苷在处方比例为5.4%,五味子总木脂素在处方比例为14.9%.以基质、药粉粒度、助悬剂、助溶剂、其他辅料为单因素进行试验,筛选五加五味软胶囊最佳处方.
2.4.1 软胶囊的基质种类筛选
取3份过100目筛的刺五加总苷粉末各1 g,分别加到20 mL的豆油、玉米油、花生油中,搅拌均匀后,倒入3只完全相同的试管中,且倒入体积相同,静置,每隔一段时间,观察并记录试管中混悬液的沉降体积比、沉降面情况、颗粒分布情况.
2.4.2 药物粉末粉碎粒度的筛选
取过50目筛药材粉末、过80目筛的药材粉末、过100目筛的药材粉末各1 g,分别加入20 mL筛选出的基质中,搅拌均匀,在3只完全相同的试管中,倒入相同体积的混悬液,静置,观察并记录每支试管中混悬液颗粒沉降速度的快慢情况和混悬液的完全沉降所需要的时间.
2.4.3 软胶囊助悬剂用量的筛选
为提高混悬液体系稳定性,选取蜂蜡作为软胶囊内容物的助悬剂,并筛选其用量[17].取4只小烧杯,各加入筛选出的基质20 mL,分别加入0%、2%、4%、6%的蜂蜡,水浴加热溶化,室温下放冷,加入粉碎粒度筛选完成的刺五加总苷粉末1 g,搅拌均匀,将体积相同的混悬液,分别倒入3只完全相同的试管,静置,观察并记录每只试管中,混悬液体系开始沉降分层所需的时间长短.
2.4.4 软胶囊助溶剂用量的筛选
为了增强药物粉末在混悬液中的稳定性,选取吐温-80作为助溶剂,并筛选用量[18].取3只小烧杯,各加入筛选出的基质20 mL、蜂蜡,水浴加热溶化,室温下冷却,加入粉碎粒度筛选完成的刺五加总苷粉末1 g,分别加入用量为0%、0.5%、1%的吐温-80,搅拌均匀,将体积相同的混悬液分别倒入3只完全相同的试管,静置,观察并记录每只试管中,混悬液开始发生沉降分层所需的时间及颗粒的分布情况.
2.4.5 软胶囊内容物中其他辅料的筛选
考虑到软胶囊的囊壳容易脱水老化的问题,加入1,2-丙二醇和水,缓解其脱水老化,考察其相应的用量.
2.4.6 软胶囊囊壳配比及溶胶时间的筛选
分别取比例为明胶∶甘油∶纯化水=1∶0.3∶1、1∶0.35∶1、1∶0.4∶1在溶胶罐中,于60 ℃进行溶胶处理,静置不同时间,压制囊皮,观察其状态,如有无气泡、囊皮的韧性,延展性是否良好等,制成软胶囊后,在各组中另外随机取6粒,室温放置8 h,观察软胶囊的柔韧度,另各组随机取6粒,在人工胃液中测试崩解时间[19-20].
2.5 正交试验设计对软胶囊制备工艺进行筛选
选择软胶囊机的进料口温度、转速比(主转速与左/右胶轮转速比)和晾晒干燥时间作为考察的3因素,每个因素考察相应的3个水平,设计L9(34)正交实验,具体因素和水平见表1;考察标准为软胶囊的收率和轧囊现象,权重系数各占0.5,见表2.

表1 因素水平表

表2 软胶囊制备工艺评价指标Table 2 Evaluation index of soft capsule preparation process
2.6 验证试验
按照处方加入刺五加总苷粉末与五味子总木脂素及辅料等根据上述所得制备工艺进行验证.制备3个批次,每批随机取3粒,以平均装量,平均崩解时限,性状外观进行验证性实验.
2.7 五加五味软胶囊指标的测定
2.7.1 性状鉴别
依据软胶囊制备工艺评价指标中的轧囊现象,对其进行相关描述.
2.7.2 装量差异
随机选取五加五味软胶囊10粒,精密称定,剪开软胶囊,取出内容物,用乙醚将囊壳洗净并挥干.称定软胶囊壳的质量,计算软胶囊每粒的装量及平均装量,差异限度在±10%以内,均应符合《中国药典规定》[1].
2.7.3 崩解时限
按照《中国药典(2020年)》四部通则0921软胶囊中崩解时限相关规定,随机选取五加五味软胶囊6粒,放置于人工胃液中,应于60 min内全部崩解.如有1粒不能完全崩解,应另取6粒复试,均应符合《中国药典规定》[1].
2.7.4 软胶囊中含紫丁香苷量测定
精密量取紫丁香苷对照品制成质量浓度为0.4 mg/mL的储备液,过0.45 μm微孔滤膜后,作为对照品溶液备用.取1粒本品内容物,用甲醇溶解于25 mL容量瓶中,超声溶解后,定容至刻度线,采用0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液.
色谱条件为:流动相甲醇-水(20∶80),甲醇流速1 mL·min-1,检测波长265 nm,检测时间为30 min,柱温为常温,进样量10 μL.以对照品溶液绘制标准曲线,得到回归方程为Y=40 333 807X+118 371(R2= 0.999 8),紫丁香苷在0.036~0.72 mg/mL范围内和峰面积值呈良好的线性关系.通过供试品溶液对含量测定的方法学进行考察,结果显示仪器的精密度良好(n=6,RSD为 0.41%),供试品溶液在24 h 内稳定(n=6,RSD为 0.47%),试验的重复性良好(n=6,RSD为 0.53%),平均回收率为(98.88±1.15)%,(n=6,RSD为1.28%),测定结果准确.
2.7.5 软胶囊中含五味子醇甲、甲素、乙素量测定
精密量取五味子醇甲、五味子甲素、五味子乙素制成混合对照品溶液,五味子醇甲质量浓度为1.2 mg/mL,五味子甲素质量浓度为0.4 mg/mL,五味乙素质量浓度为0.4 mg/mL的储备液,过0.45 μm 微孔滤膜,作为对照品溶液备用.取1粒本品内容物,用甲醇溶解于25 mL容量瓶中,超声溶解后,定容至刻度线,采用0.45 μm 微孔滤膜过滤,取续滤液作为供试品溶液.色谱条件为流动相甲醇-水梯度洗脱:0~10 min,70%甲醇,10~12 min,70%~75%甲醇,12~32 min,75%~85%甲醇,32~35 min,85%~100%甲醇流速1 mL·min-1,检测波长250 nm,检测时间为35 min,柱温常温,进样量10 μL.而后以对照品溶液绘制标准曲线,五味子醇甲回归方程为Y=332.46X- 0.466 4(r= 0.999 9),五味子醇甲在0.06~1.2 mg/mL范围内和峰面积值呈良好的线性关系.五味子甲素回归方程为:Y=442.33X+ 2.66(R2= 0.999 7),五味子甲素在0.02~0.4 mg/mL范围内和峰面积值呈良好的线性关系.五味子乙素回归方程:Y=250.77X+ 0.650 7(R2=0.999 8),五味子乙素在0.02~0.4 mg/mL范围内和峰面积值呈良好的线性关系.通过供试品溶液对含量测定的方法学进行考察,结果显示仪器的精密度良好,五味子醇甲、五味子甲素、五味子乙素的RSD值分别为0.99%(n=6)、0.71%(n=6)、0.56%(n=6);供试品溶液在24 h内稳定,五味子醇甲、五味子甲素、五味子乙素的RSD值分别为0.78%(n=6)、0.56%(n=6)、0.95%(n=6);试验的重复性良好,五味子醇甲、五味子甲素、五味子乙素的RSD值分别为0.44%(n=6)、0.56%(n=6)、0.76%(n=6);五味子醇甲、五味子甲素、五味子乙素的回收率分别为(98.2±1.39)%,(n=6,RSD=1.55%)、(98.9±0.87)%,(n=6,RSD=0.97%)、(98.9±1.04)%,(n=6,RSD=1.15%),测定结果准确.
2.8 数据处理
实验数据均为3次重复实验结果的平均值,结果表示为平均值±标准差.采用SPSS 19.0 进行正交试验数据处理
3 结果与分析
3.1 单因素试验优化结果
3.1.1 软胶囊的基质种类筛选结果
综合经济效益,采用豆油作为软胶囊内容物的基质,实验筛选结果见表3.

表3 不同基质实验结果
3.1.2 药物粉末粉碎粒度筛选结果
结果见表4.由实验结果可以看出,粉碎粒度越小,沉降速度越慢,发生沉降的时间也增长,根据相关的药厂生产经验,确定药物粉末粒度为过100目筛.
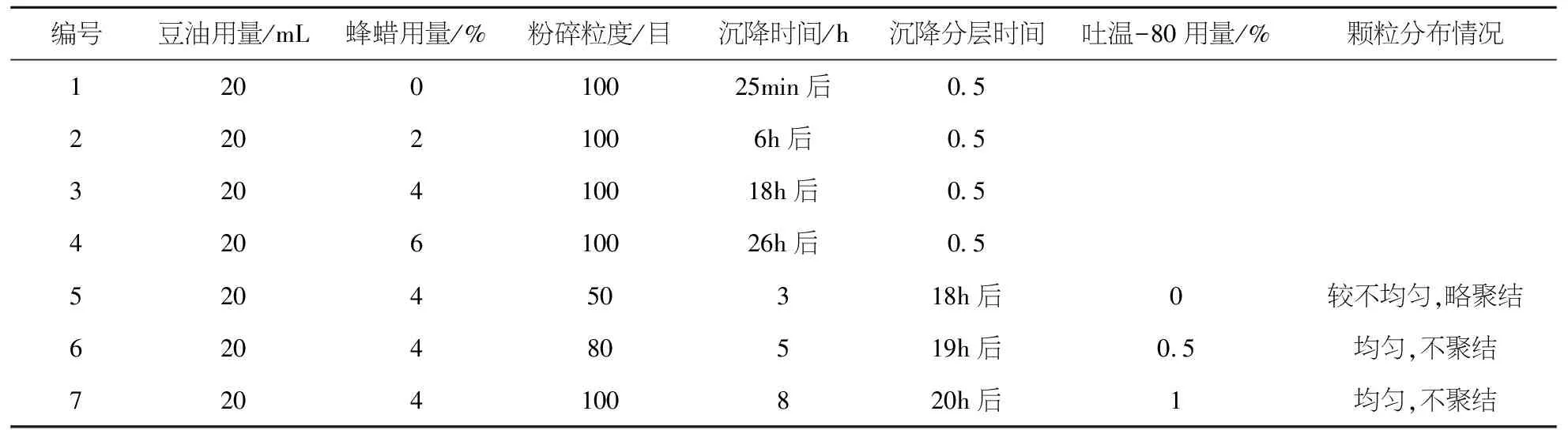
表4 单因素实验结果Table 4 Results of single factor experiments
3.1.3 软胶囊助悬剂用量筛选结果
结果见表4.混悬液的稳定性情况随着蜂蜡用量的增加而有所改善,同时混悬液沉降分层时间也随之升高.当用量为4%以上的时候,可以避免内容物的沉降,故确定蜂蜡的用量为4%.
3.1.4 软胶囊助溶剂用量筛选结果
结果见表4.吐温-80对混悬液的沉降速度影响不大,但加入了吐温-80的混悬液颗粒分布情况较空白组好,故确定加入的吐温-80用量为0.5%.
3.1.5 胶囊内容物中其他辅料筛选结果
考虑到软胶囊的囊壳容易脱水老化的问题,选择在软胶囊内容物中加入1,2-丙二醇和水,缓解其脱水老化,同时参考相关文献及药厂生产经验[21],确定1,2-丙二醇的用量为1%,水的用量为10%.在内容物中加入0.3%的尼泊金乙酯,充当防腐剂.
3.1.6 软胶囊囊壳配比及溶胶时间筛选结
结果见表5.由表5数据可知,不同配比的囊材对软胶囊的崩解时间影响不大,当选用的囊壳配比为明胶∶甘油∶纯化水=1.0∶0.35∶1.0时,囊皮性能最好,韧性及延展性较好,溶胶罐保温静置时间达到24 h以上,囊皮中几乎无气泡,不会对软胶囊造成渗漏等现象,故选用囊壳配比为明胶∶甘油∶纯化水=1.0∶0.35∶1.0,静置24 h.

表5 囊壳配比结果Table 5 Capsule ratio results
3.2 正交试验设计对软胶囊制备工艺进行筛选
五加五味软胶囊制备工艺的筛选结果见表6.由表7方差分析结果可知,在9个实验组中,各因素对评分指标影响的主次顺序为B> C >A,指标最优的组合为A1B2C3,即软胶囊进料口温度为50 ℃,转速比为1.75∶1,晾晒干燥时间为6 h.

表6 正交实验结果Table 6 Orthogonal test results
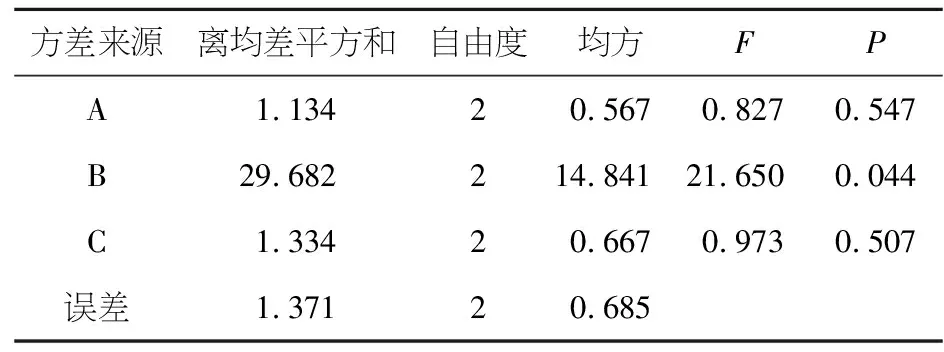
表7 方差分析结果Table 7 Analysis of variance results
3.3 验证试验
验证实验结果见表8.按正交实验优选的最佳制备工艺制得的软胶囊外观及总评分均较好.平均崩解时间18 min,平均装量0.45 g,性状外观及弹性较好,硬度适中,个别渗漏.说明该工艺稳定准确.

表8 验证实验结果Table 8 Validation test results
3.4 五加五味软胶囊的质量评价
3.4.1 性状鉴别
通过肉眼观察,发现制得的五加五味软胶囊的囊壳呈现淡黄色,内容物呈现黄色,软胶囊颗粒均完整光洁,无黏结、变形、渗漏,少数有囊壳破损的现象.性状鉴别结果良好.
3.4.2 装量差异
实验结果表明3批软胶囊装量差异限度在±10%,符合中国药典(2020年)四部通则0103软胶囊中规定装量差异规定.结果见表9.

表9 装量差异和崩解时间结果Table 9 Load discrepancy and disintegration time results
3.4.3 崩解时限
实验结果表明随机取得的6粒五加五味软胶囊,都在1小时内全部崩解,符合《中国药典(2020年)》四部通则0921软胶囊中崩解时限规定,结果见表9.
3.4.4 高效液相色谱法测定五加五味胶囊中含有效物质量
1)软胶囊中含紫丁香苷量测定
由图1可以看出,五加五味软胶囊供试品中紫丁香苷分离度好,阴性对照溶液无干扰,测得3批五加五味软胶囊含紫丁香苷量为(1.418±0.008)mg/g.根据含量限度确定软胶囊中含紫丁香苷的量不得低于1.13 mg/g.

图1 紫丁香苷测定Figure 1 Syringin content determination
2)软胶囊中含五味子醇甲、甲素、乙素量测定
由图2可以看出,五加五味软胶囊供试品中五味子醇甲,五味子甲素,五味子乙素分离度良好,阴性对照溶液无干扰,测得五加五味软胶囊中含五味子醇甲的量为(3.66±0.03)mg/g,含五味子甲素的量为(0.56±0.01)mg/g,含五味子乙素的量为(1.67±0.01)mg/g.根据含量限度建议含五味子醇甲、五味子甲素和五味子乙素的量分别不得低于2.93、0.45 mg/g和1.33 mg/g.

图2 含五味子醇甲、甲素、乙素量测定Figure 2 Determination of alcohols A, A, and B in Schisandrae Fructus
4 结 论
五加五味软胶囊的最佳处方为以豆油作为五加五味软胶囊内容物的基质,药物粉末粒度为过100目筛,助悬剂蜂蜡的用量为4%.助溶剂吐温-80用量为0.5%.囊壳配比为明胶∶甘油∶纯化水=1.0∶0.35∶1.0,静置24 h.软胶囊制备工艺条件为进料口温度为50 ℃,转速比为1.75∶1,晾晒干燥时间6 h.最佳工艺条件制备下的软胶囊囊壳呈现淡黄色,内容物呈现黄色,软胶囊颗粒均完整光洁,无黏结、变形、渗漏,少数有囊壳破损的现象.经试验工艺优化后制得的五加五味软胶囊其外观性状、重量差异、含量、崩解时限显示该法制得的五加五味软胶囊质量比较稳定.对3批软胶囊中含有的五味子醇甲、五味子甲素、五味子乙素和紫丁香苷质量进行测定,确定了含量下限.五加五味软胶囊制备工艺简单可行,质量稳定可控.

