成人型卵巢颗粒细胞瘤合并促黄体生成素升高1例及文献复习
王玉净,付子洁,庞超,张媛,李晓冬*
(1.河北医科大学第一医院妇科,石家庄 050030;2.河北医科大学第一医院病理科,石家庄 050030;3.河北医科大学第二医院妇科,石家庄 050061)
病例资料
患者,女,38岁,G7P2A5。2022年2月7日因“继发性闭经伴左卵巢肿物1年余”就诊于河北医科大学第一医院妇科。
既往月经规律,7 d/28 d,量中,无痛经。2020年11月患者因个人意愿于当地县医院行早期人工流产术。早孕期超声曾提示左卵巢小囊肿(具体不详)。流产后患者月经一直未复潮,2021年1月当地医生嘱患者给予口服黄体酮胶囊200 mg/d,连用10 d治疗,停药后未见阴道出血,改为口服戊酸雌二醇+黄体酮胶囊人工周期治疗,停药后有阴道出血。2021年3月23日(撤退性出血第2天)查基础生殖激素:黄体生成素(LH)25.22 U/L,卵泡刺激素(FSH)3.05 U/L,雌二醇(E2)、孕酮(P)、睾酮(T)和催乳素(PRL)正常。2021年5月12日复查基础生殖激素六项,结果提示LH 31.81 U/L,FSH 3.1 U/L(表1),当地医生考虑为多囊卵巢综合征(PCOS),给予屈螺酮炔雌醇片(Ⅱ)治疗3月,服药期间有月经来潮。2021年8月30日停用屈螺酮炔雌醇片(Ⅱ)复查LH 4.24 U/L,阴道超声提示左侧卵巢囊肿(囊肿大小2.8 cm×1.1 cm),此后未再用药,定期复查超声,发现左卵巢囊肿在3个月内逐渐增大至5.1 cm×2.9 cm。停药后继发性闭经反复,行人工周期治疗后有撤退性出血。肿瘤标志物AFP、CEA、CA125、CA199、CA153及激素HCG水平均正常。2021年11月5日查激素显示 LH 37.44 U/L,T 2.95 nmol/L,FSH、E2和 PRL水平均正常(表1)。

表1 患者手术前、后的基础生殖激素水平
2022年2月7日就诊于本院,考虑患者左卵巢囊肿较前明显增大,建议手术,但患者拒绝手术治疗。复查超声:子宫正常大小,子宫内膜厚0.48 cm,左卵巢内见一直径大小约6.8 cm无回声区,有光滑完整包膜,右卵巢和双输卵管未见异常。妇科检查可触及左附件区一肿物,直径大小6~7 cm,边界清楚、活动好、无触痛,抗苗勒管激素(AMH)13.18 ng/ml。与患者沟通后,患者同意腹腔镜探查术。
2022年2月10日全麻下行腹腔镜下探查,术中见:盆腹腔内无腹水,子宫正常大小,外观正常,左侧卵巢增大呈球形,直径约7 cm,表面光滑,呈囊实性,左输卵管及右侧附件未见明显异常。因考虑为左卵巢肿瘤,行左附件切除术,标本袋取出标本。术后切开左侧卵巢组织,内见部分淡黄色液体及糟脆组织。术后病理结果示(左卵巢)成人型颗粒细胞瘤(adult-type granulosa cell tumor,AGCT),囊性变(图1)。2022年3月18日北京大学附属第三医院会诊病理切片结果:(左卵巢囊肿)成人型颗粒细胞瘤,伴囊性变;(左输卵管)输卵管粘膜慢性炎症。免疫组化结果:FOXL2(+),NTPKpan(-)。分子病理结果:测序—FOXL2突变(检出错义突变),FISH-12号染色体计数(-)。术后完善全身PET-CT结果未见异常。最后诊断为左卵巢成人型颗粒细胞瘤IA期。
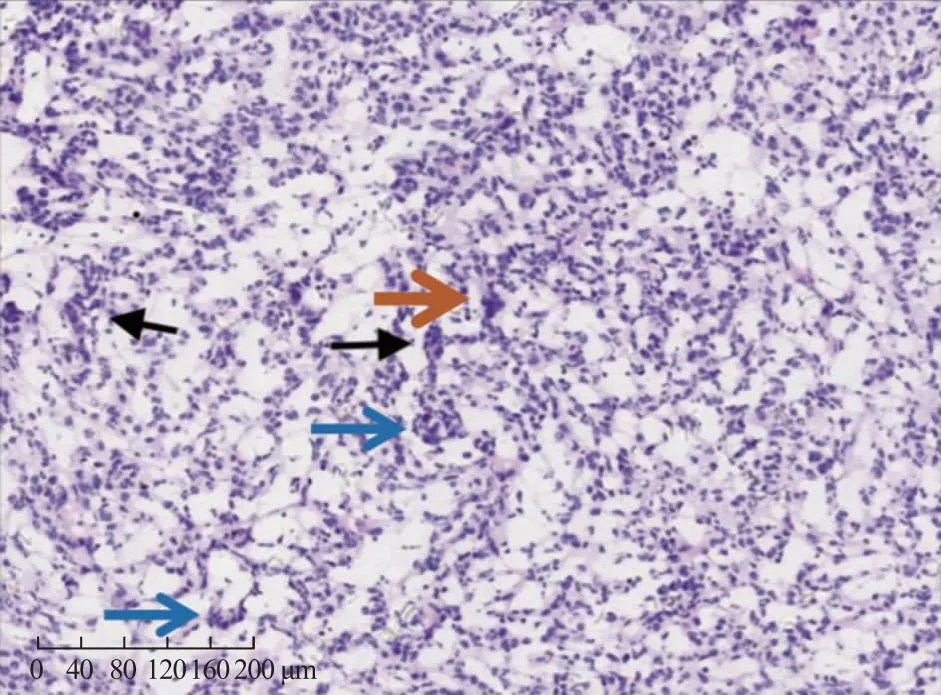
肿瘤细胞生长方式多样,呈弥漫、片状,可见小梁(黑色箭头所指示)、岛状(蓝色箭头所指示);肿瘤细胞体积较小,呈立方或卵圆形,均匀一致;胞浆稀少、淡染、胞界不清;核染色浅,轮廓不规则,可见核沟(橙色箭头所指示);细胞异型性小,核分裂象少见。图1 手术切除卵巢组织的病理染色结果(HE染色×200)
患者术后3 d查血清抑制素B(inhibin B,INH-B)187.64 pg/ml(参考区间11~111 pg/ml)、AMH 4.43 ng/ml,3周月经自行来潮,后月经规律,6~7 d/28 d,月经量适中,无痛经。2022年4月28日复查生殖激素水平(表1)、AMH 2.6 ng/ml。2022年6月8日查INH-B 19.10 pg/ml。患者术后半年意外怀孕,要求行人工流产术终止妊娠。后定期随访至今,无复发迹象。
病例警示
一、成人型卵巢颗粒细胞瘤(AGCT)的诊断要点
1.临床表现:AGCT属于性索间质肿瘤,是最常见的卵巢功能性肿瘤,以分泌雌激素为主,临床表现包括异常子宫出血、月经不规则、绝经后出血、子宫内膜增厚等高雌激素相关症状[1]。好发于围绝经期女性,诊断年龄多在50到54岁之间[2]。不足3%的AGCT患者可分泌雄激素,引发多毛、闭经、痤疮和声音低沉等高雄激素相关症状[3]。另有一类以LH增高的AGCT,正如本文报道的病例特点,国内外文献均有个案报到[4-8],发病年龄为育龄期女性,常见症状为继发性闭经,LH值升高范围25.3~47.9 U/L,FSH正常或降低,E2正常或下降,T正常或升高,可伴有INH-B或AMH升高。
目前AGCT中LH升高的机制尚不清楚。免疫组织化学已证实肿瘤细胞中LH染色阴性[7]。有学者提出假设[7]:肿瘤细胞可能产生某种因子,以刺激腺垂体分泌大量LH;口服避孕药或GnRH治疗后LH会降至正常,这也侧面证实AGCT患者的LH过多分泌受下丘脑-垂体控制。
2.超声表现:卵巢颗粒细胞瘤(ovarian granulosa cell tumor,OGCT)超声表现呈多样性,主要包括以下3种类型[9-10]:(1)实性,为低回声结节或团块,占20.8%~35.7%;(2)囊实性,表现多发小囊性变区域分散在实性团块中,此型为AGCTs的典型超声表现,占比达50%~66.7%;(3)囊性,可为单房或多房,约占12.5%~14.3%。
部分AGCT的超声仅表现为小囊肿,不易与生理性卵泡囊肿区别。国外Boyraz等[11]分析80例单纯囊性卵巢颗粒细胞的临床病理特点,发现约25%囊性AGCT有雄激素表现,这是区别卵泡囊肿的重要特征。妇科超声对OGCT的检出率为71.4%~96%,诊断的准确率不高,约17%~35.7%[9-10]。核磁共振检测对GCT诊断的准确性相对较高(特异性和灵敏度分别为94.1%、95%)[12]。
3.肿瘤标志物:临床常用的上皮性肿瘤标志物如CA125、HE4、CEA、CA199等对AGCT的诊断缺乏特异性[13]。鉴于AGCT起源于卵巢卵泡的颗粒细胞,具有与颗粒细胞相似生物活性,分泌雌二醇、INH-A/B和AMH是其更重要的特征。国外有学者研究证实,AGCT中HE4和CA125水平较低,INH-B是区分AGCT与上皮性卵巢癌和子宫内膜癌的最准确的血清标志物[14]。INH-B 诊断卵巢颗粒细胞瘤的灵敏度及特异性分别高达 92%及100%,AMH则为100%及83%,两者联合应用时诊断效能有所提高[13]。本病例因术后才明确诊断,故欠缺术前化验结果,但术后早期INH-B仍提示偏高,而后期降至正常,也符合AGCT的特点。
4.病理诊断:目前AGCT诊断的标准是基于免疫组织化学辅助的组织病理学[1]。显微镜下颗粒细胞排列呈多种方式,高分化AGCT表现为微滤泡型、小梁型、岛型、管型和空心管型,其中微滤泡型具有花环样Call-Exner小体;低分化AGCT表现为波浪状或回状型,即弥漫型(肉瘤样型)。颗粒细胞体积小,圆形或卵圆形,染色质淡染,可见核沟(咖啡豆样核)[2]。
有时,卵巢幼年型颗粒细胞瘤(juvenile-type granulosa cell tumor,JGCT)和其他一些肿瘤与AGCT具有相似的组织病理学特征,难以鉴别,因此需要分子病理检查的帮助。FOXL2 是一种编码对颗粒细胞生长发育至关重要的转录因子的基因,有研究发现FOXL2、C134W突变是颗粒细胞肿瘤发生的关键驱动因子[15]。2009年Shah等[16]首次发现,FOXL2 突变在AGCT中的检出率97%(86/89),而在JGCT的检出率仅10%(1/10)。本例患者经FOXL2突变检测为阳性,支持AGCT的诊断。
二、AGCT的治疗与预后
AGCT患者的治疗以手术为主。依据2018年欧洲肿瘤内科学会(ESMO)[17]和2023年美国NCCN指南[18],局限于卵巢的FIGO Ⅰ期患者,可行保留生育功能手术,即保留子宫和对侧附件;Ⅱ期及以上患者,行全子宫及双附件切除的全面分期手术,术后需辅助化疗。对IA期患者手术管理的选择,两个指南不同之处在于:ESMO指南推荐保留生育功能手术,对患者年龄和是否有生育需求无要求;而2023 NCCN指南要求年轻患者在有生育需求前提下选择保留生育功能手术。
我国孙恒子等[19]对早期AGCT复发相关因素分析的研究结果表明:手术方式(单纯肿瘤剥除、患侧附件切除、全子宫及双附件切除、分期手术)对患者总复发率、远近期复发率没有显著差异。所以,IA期患者选择单纯患侧附件切除术是可以接受的。本例患者术中仅行患侧附件切除,术后全身PET-CT未见异常,最后诊断为IA期,无复发高危因素,且患者38岁尚年轻,未追加全面分期手术。
AGCT为低度恶性卵巢肿瘤,总体预后相对好。但AGCT患者有晚期复发特点,20年后复发风险增高[20],血清INH-B、AMH可作为肿瘤标志物长期随访,利于监测复发。
三、与继发性闭经-高LH血症相关的肿瘤
1.卵巢肿瘤:引起绝经前女性继发性闭经的原因除了PCOS、下丘脑性闭经和卵巢早衰外,还有功能性卵巢肿瘤,以性索间质肿瘤为代表,其中单纯或混合性间质肿瘤[21]以分泌雄激素为主要特征。患者除继发闭经外,往往伴有显著的高雄体征,如多毛、脱发、喉结、阴蒂增大、声音变低沉等,辨识度很高[22]。而卵巢颗粒细胞属于单纯性索肿瘤,以分泌雌、孕激素为主,患者往往没有外观的异常,仅表现为异常子宫出血等。而以分泌抑制素为主的颗粒细胞瘤[23],抑制FSH的合成和分泌,FSH减少又会影响卵泡的生长发育,导致E2分泌减少,则以继发性闭经为临床表现。少部分AGCT患者出现LH升高,如前所述机制尚不清楚。有学者提出雌激素可能是LH的有效调节因子,低雌激素状态下,抑制素B对LH并不完全抑制[24]。分泌抑制素的卵巢肿瘤还有卵泡膜细胞瘤及纤维瘤的报道[24-25]。
PCOS也可以伴有雄激素升高和LH水平升高,可能机制是垂体对GnRH敏感性增加,分泌过量LH,进而刺激卵巢间质、卵泡膜细胞产生过量雄激素[26]。PCOS血清睾酮水平通常不超过正常范围上限的2倍,非肥胖型PCOS患者多伴有LH/FSH比值≥2[27]。陈颖等[28]研究显示,PCOS患者血清睾酮水平2.29±0.76 nmol/L,LH水平13.0±6.1 U/L,LH/FSH比值2.00±0.94。PCOS患者的血清睾酮和LH水平在服用短效口服避孕药后通常可降至正常范围,而典型的肿瘤性高雄激素血症,睾酮升高的幅度更大,且不受复方口服避孕药(combined oral contraceptives,COC)或GnRHa药物抑制,是鉴别诊断中的重要特点。
2.功能性促性腺激素腺瘤:功能性促性腺激素腺瘤(functional gonadotrophadenomas,FGAs)是一种罕见的垂体良性肿瘤。女性FGAs好发于绝经前,可分为FSH分泌型和LH分泌型。FSH分泌型约占91.7%~92.3%,主要症状是月经失调/闭经、自发性卵巢过度刺激综合征(OHSS)、不孕、溢乳;生殖激素检测:FSH、E2、PRL升高,LH 降低,FSH/LH值明显升高。LH分泌型约占7.7%~8.3%,主要症状是不孕,不会发生OHSS,生殖激素:LH升高,FSH和E2不升高[29]。垂体MRI检查可明确是否有垂体占位性病变。针对FGAs的治疗以手术切除垂体肿瘤为主[30]。
专家点评
本例为育龄期女性,首发症状为继发性闭经,生殖激素水平特点是E2和T正常,而LH明显升高,初期超声显示子宫内膜不厚,左卵巢内小囊肿,曾按PCOS予以COC药物治疗,用药期间有撤退性出血,而且LH能降至正常范围,如果不是发现卵巢囊肿逐渐增大,具有手术指征,可能还会延迟诊断。从临床表现、药物反应来看,其实很难与PCOS相鉴别,LH受COC调控抑制下降,停药后反复其实也符合PCOS的特点,而非典型肿瘤的特征。但过高的LH水平还是应该引起临床医生关注的。另一方面,短期内迅速增大的卵巢占位,达到手术指征,仍是应该积极探查,明确诊断的,尤其是在腹腔镜广泛应用的现时代,姑息等待并不具有优势。
通过对伴有LH升高的AGCT的文献复习,帮助我们对此类相对少见的病变更加了解,增加了新的经验,有利于日后对相似病例的鉴别诊断,也许以后我们可以根据继发性闭经-高LH血症-卵巢囊性占位,术前即能考虑到AGCT的可能性,并积极开展核磁共振检查和血清抑制素B、AMH水平的检测以达到的早期诊断的水平,进而有利于为患者制定更全面的手术方案。故愿与同道分享。

