靶向代谢组学联合16SrRNA 基因测序分析地黄炮制前后对肾阴虚证大鼠肠道菌群的影响
叶雪珂,单国顺,付郁,史辑,余意,梁明,姚娓[1.大连医科大学附属第二医院,辽宁大连 116023;2.大连医科大学中西医结合学院/研究院,辽宁大连 116044;3.辽宁中医药大学药学院,辽宁大连 116600;4.国家中医药管理局中药炮制工艺原理重点研究室,辽宁大连 116600;.无限极(中国)有限公司,广东广州 10663]
地黄为玄参科植物地黄RehmanniaglutinosaLibosch.的新鲜或干燥块根,始载于《神农本草经》,被列为上品[1-2]。作为“生熟异用”的典型代表,生地黄炮制成熟地黄后,其性味由甘、寒转为甘、微温,功效由清热凉血、养阴生津转为补血滋阴、益精填髓,被广泛应用于血虚诸证以及肝肾阴虚的诸多症候[3-4]。其中,肾阴虚证是一种由神经内分泌失调引起的代谢性疾病,其发病机制主要是下丘脑-垂体-靶腺轴(肾上腺、甲状腺、性腺)的多层次功能障碍[5]。研究[6-7]发现,肾阴虚证与肠道菌群代谢紊乱密切相关。地黄中富含环烯醚萜类、苯乙醇苷类、黄酮类及糖类等化学成分[8]。研究[9]发现,地黄在炮制过程中环烯醚萜苷及苯乙醇苷类成分的含量会逐渐降低,多糖和低聚糖还会不同程度水解成还原性寡糖。而植物寡糖可以通过促进双歧杆菌、乳酸杆菌增殖以及短链脂肪酸释放,从而调节肠道微生态,维持机体内环境稳定,从而缓解肾阴虚症状[10-12]。故推测地黄炮制前后对肾阴虚证的治疗作用可能与其对肠道菌群的调节作用有关。因此,本研究拟从肠道菌群角度出发,结合靶向代谢组学和16SrRNA 基因测序技术,探讨生、熟地黄对肾阴虚证大鼠的治疗机制,并对地黄“生熟异用”的炮制机理进行阐释。
1 材料与方法
1.1 动物SD 雄性大鼠,SPF 级,体质量(180±20)g,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号:SCXK(辽)2020-0002,动物质量合格证号:210726211101236656。本实验经过辽宁中医药大学动物伦理委员会审批,批文号:2022YS(DW)-041-03。
1.2 药物及试剂生地黄(产地:河南,批号:D2009038)、熟地黄(产地:河南,批号:2009037),均购自四川新荷花中药饮片股份有限公司。益生菌干粉制剂,南京同仁堂药业有限公司,批号:G30130221;地塞米松磷酸钠注射液,山西石药银湖制药有限公司,批号:H14022567;环磷酸腺苷(cAMP)试剂盒、环磷酸鸟苷(cGMP)试剂盒、促肾上腺皮质激素释放激素(CRH)试剂盒、促肾上腺激素释放激素(ACTH)试剂盒、皮质酮(CORT)试剂盒,均购自上海科兴生物科技有限公司,批号分别为:21121342N、21121345N、21121343N、21121336N、21121344N;粪便DNA抽提试剂盒,美国QIAGEN公司,货号:47014;乙酸(Acetic acid,CAS:64-19-7)、丙酸(Propionic acid,CAS:79-09-4)、丁酸(Butyric acid,CAS:107-92-6)、异丁酸(Isobutyric acid,CAS:79-31-2)、戊酸(Valeric acid,CAS:109-52-4)、异戊酸(Isovaleric acid,CAS:503-74-2)、己酸(Caproic acid,CAS:142-62-1)、4-甲基戊酸(4-Methylvaleric acid,CAS:646-07-1),均购自上海源叶生物科技有限公司,批号分别为:A21D11L136236、 YY2008052、 M30D11K136125、M30D11K136123、M30D11K136122、M29D11K136116、M30D11K136124、Y11M8C35742;磷酸(色谱纯),天津大茂化学试剂厂,批号:20190212。
1.3 主要仪器7890B-5977B 型气相色谱串联质谱联用仪(配有7697A 型顶空进样器、MassHunter Workstation B.07.00 型工作站),美国Agilent 公司;ELx800 型酶标仪,美国Bio-Tek 公司;Gene Amp®9700型PCR仪,美国Applied Biosystems 公司;Miseq高通量二代测序仪,美国Illumina 公司;DYY-6C 型电泳仪,北京六一仪器厂;QuantiFluor-ST 蓝色荧光定量系统,美国Promega 公司;BX53 型生物显微镜,日本Olympus公司。
1.4 模型复制、分组及给药SD大鼠适应性喂养1周后,随机分为空白组、模型组、益生菌组、熟地黄高/中/低剂量组、生地黄高/中/低剂量组,每组9 只。参考相关研究[13-14]进行肾阴虚证动物模型复制,除空白组外,其余各组大鼠均肌肉注射地塞米松磷酸钠注射液(0.35 mg·kg-1),每日1次,持续21 d,每日测量大鼠体质量。
于造模第7 天开始灌胃给药,每日1 次,连续给药14 d。依据临床生、熟地黄常用剂量30 g 为高剂量、15 g 为中剂量、7.5 g 为低剂量,以体表面积折算大鼠给药剂量,生、熟地黄高/中/低剂量组分别给予生、熟地黄水煎液3.5、1.75、0.875 g·kg-1灌胃;按照临床每日3 g给药剂量折算益生菌组给予益生菌溶液0.35 g·kg-1灌胃;空白组及模型组大鼠给予相同体积生理盐水灌胃。
1.5 取材末次给药后,抓取各组大鼠悬空后仰,保持头高位,按压腹部促进排便,直接用2 mL 消毒离心管接取粪便1~2 粒,-80 ℃下保存。留便后大鼠采用20%乌拉坦麻醉,腹主动脉取血5 mL,4 ℃下放置30 min 后,低温条件下以3 000 r·min-1(离心半径=13.5 cm)离心15 min,分离血清,-80 ℃下保存,备用。同时摘取各组大鼠肾上腺组织,以10%福尔马林溶液固定。
1.6 肾上腺组织病理学观察取各组固定后的大鼠肾上腺组织,经脱水、透明、包埋后制备切片(4 μm);切片经二甲苯脱蜡、苏木素-伊红(HE)染色、乙醇梯度脱水、二甲苯透明、中性树胶封片后,在光学显微镜下观察肾上腺组织病理变化。
1.7 大鼠血清生化指标检测取“1.5”项下大鼠血清,严格按照ELISA试剂盒说明书步骤操作,检测各组大鼠血清中的cAMP、cGMP、CRH、ACTH、CORT水平。
1.8 肠道微生物群的组成分析将大鼠粪便在液氮中研碎,以总DNA 快速提取试剂盒提取肠内容物中的肠道菌群总DNA,并利用1%琼脂糖凝胶电泳检测抽提基因组DNA 的纯度及浓度。选取细菌16SrRNA 基因的高度可变的V4 区(长度约280 bp)进行PCR 扩增,每个样本重复3 次;将同一样本的PCR 产物混合后,用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(美国AXYGEN 公司)切胶回收PCR产物,2%琼脂糖电泳检测纯度。参照电泳初步定量结果,将PCR 产物通过QuantiFluorTM-ST 蓝色荧光定量系统进行检测定量,然后按照每个样本的测序量要求,进行相应比例的混合,构建Miseq 文库并进行测序。Miseq 测序得到PE reads,首先根据overlap 关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行操作单元分类(OUT)聚类分析和物种分类学分析。基于OTU 分析结果,对各个样本进行多种α 多样性指数分析,以及对测序深度进行检测;基于分类学信息,在各个分类水平上进行群落结构的统计分析及16S 基因功能预测。然后进行一系列统计学分析及可视化分析,并根据分析结果探讨不同干预对模型动物肠道菌群结构及功能的影响。
1.9 粪便中短链脂肪酸含量测定精密称取各组大鼠粪便100 mg 于20 mL 顶空进样瓶中,加入50 μL 0.2% H3PO4溶液,内含4-甲基戊酸内标溶液(0.668 mg·mL-1),迅速密封,供上机测试。进样条件:顶空进样器样品瓶加热温度:80 ℃;定量环加热温度:140 ℃;传输线加热温度:160 ℃;GC 循环时间:45 min;加热时间:20 min;平衡时间:10 min;加压时间:0.15 min;进样时间:0.5 min。
色谱条件:色谱柱为Agilent DB-WAX(DB-1MS)毛细管柱(30 m×0.25 mm,0.25 μm);进样方式:不分流;进样口温度:250 ℃;离子源温度:230 ℃;传输线温度:250 ℃;四极杆温度:150 ℃。程序升温:起始温度60 ℃;然后以30 ℃·min-1升温至120 ℃;以5 ℃·min-1升温至140 ℃,维持1 min;然后以10 ℃·min-1升温至150 ℃,维持1 min;再以5 ℃·min-1升温至160 ℃,维持1 min;最后以35 ℃·min-1升温至230 ℃;然后运行温度230 ℃,维持5 min。载气为氦气,载气流速:1.0 mL·min-1。
质谱条件:电子轰击离子源(EI);电子能量70 eV;溶剂延时4.5 min;扫描方式为全扫描(SCAN)和选择离子监测(SIM)模式;扫描范围:30~200m/z。7种短链脂肪酸及内标的质谱参数见表1。
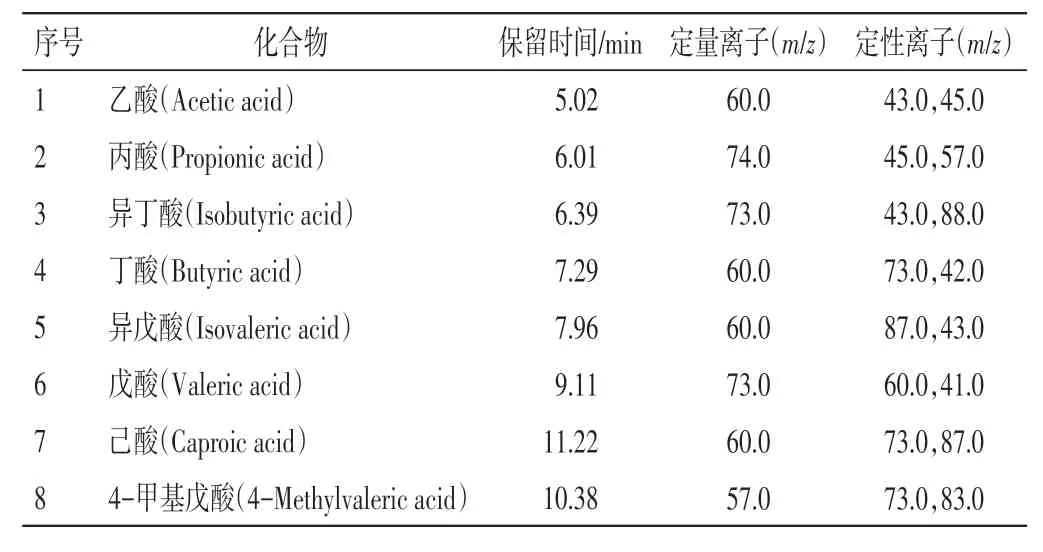
表1 7 种短链脂肪酸及内标的质谱参数Table 1 Mass spectrometry parameters of 7 short chain fatty acids and internal standards
1.10 统计学处理方法采用SPSS 20.0统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD检验;以P<0.05为差异有统计学意义。
2 结果
2.1 生、熟地黄对肾阴虚大鼠一般状态及体质量的影响结果见表2。与空白组比较,模型组大鼠形体消瘦、大便干结、小便发黄、自主活动增加、饮食减少、易被激惹、反应活跃,第7、14、21天体质量明显下降(P<0.05,P<0.01)。与模型组比较,熟地黄给药组大鼠第21 天的体质量均明显增加(P<0.05,P<0.01),而生地黄给药组大鼠体质量变化不明显(P>0.05)。
表2 生、熟地黄对肾阴虚大鼠体质量的影响(±s,n=9)Table 2 Effect of Rehmanniae Radix and Rehmanniae Radix Praeparata on body mass of rats with kidney yin deficiency syndrome(±s,n=9)
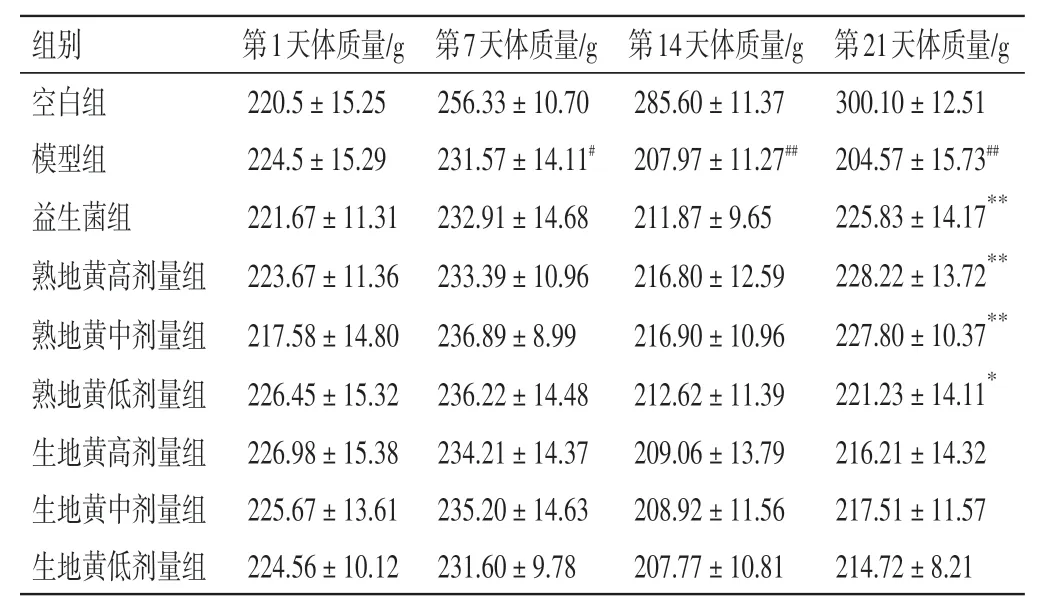
表2 生、熟地黄对肾阴虚大鼠体质量的影响(±s,n=9)Table 2 Effect of Rehmanniae Radix and Rehmanniae Radix Praeparata on body mass of rats with kidney yin deficiency syndrome(±s,n=9)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
第21天体质量/g 300.10±12.51 204.57±15.73##225.83±14.17**228.22±13.72**227.80±10.37**221.23±14.11*216.21±14.32 217.51±11.57 214.72±8.21组别空白组模型组益生菌组熟地黄高剂量组熟地黄中剂量组熟地黄低剂量组生地黄高剂量组生地黄中剂量组生地黄低剂量组第1天体质量/g 220.5±15.25 224.5±15.29 221.67±11.31 223.67±11.36 217.58±14.80 226.45±15.32 226.98±15.38 225.67±13.61 224.56±10.12第7天体质量/g 256.33±10.70 231.57±14.11#232.91±14.68 233.39±10.96 236.89±8.99 236.22±14.48 234.21±14.37 235.20±14.63 231.60±9.78第14天体质量/g 285.60±11.37 207.97±11.27##211.87±9.65 216.80±12.59 216.90±10.96 212.62±11.39 209.06±13.79 208.92±11.56 207.77±10.81
2.2 生、熟地黄对肾阴虚大鼠血清中相关生化指标的影响结果见表3。与空白组比较,模型组大鼠血清中cAMP、CRH、ACTH、CORT 含量及cAMP/cGMP比值均显著升高(P<0.01),cGMP 含量显著降低(P<0.01)。与模型组比较,熟地黄给药组大鼠血清中cAMP、CRH、ACTH、CORT 含量及cAMP/cGMP比值均明显降低(P<0.05,P<0.01),cGMP 含量明显升高(P<0.05,P<0.01);生地黄高剂量组大鼠血清中CRH、CORT 含量明显降低(P<0.01),生地黄中剂量组大鼠血清中ACTH含量明显降低(P<0.05)。
表3 生、熟地黄对肾阴虚大鼠血清中cAMP、cGMP、CRH、ACTH、CORT 含量的影响(±s,n=6)Table 3 Effects of Rehmanniae Radix and Rehmanniae Radix Praeparata on the contents of cAMP,cGMP,CRH,ACTH and CORT in serum of rats with kidney yin deficiency syndrome(±s,n=6)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
CORT/(ng·mL-1)7.58±0.49**12.11±1.07##7.85±0.91**8.04±0.81**9.25±1.16**10.35±0.61*9.55±0.81**11.73±0.83 12.06±0.52组别空白组模型组益生菌组熟地黄高剂量组熟地黄中剂量组熟地黄低剂量组生地黄高剂量组生地黄中剂量组生地黄低剂量组cAMP/(nmol·L-1)3.13±1.59**6.41±0.16##4.36±1.39*4.87±0.84*4.36±1.02*5.41±0.93 5.96±0.76 7.48±0.45 6.56±1.17 cGMP/(nmol·L-1)12.52±1.66**7.69±0.82##10.91±1.14*11.31±1.71**11.10±1.74**10.50±0.78*10.28±0.87 10.50±2.40 7.95±1.87 cAMP/cGMP 0.25±0.12**0.81±0.06##0.41±0.16**0.43±0.13**0.39±0.07**0.51±0.07*0.59±0.12 0.75±0.22 0.85±0.17 CRH/(pg·mL-1)26.70±3.84**66.67±7.29##35.30±4.11**39.48±6.36**43.40±6.61**53.84±6.38**51.86±6.08**60.42±1.91 68.93±2.18 ACTH/(pg·mL-1)44.82±5.79**74.59±2.35##45.64±2.67**45.85±5.75**55.87±7.37**59.15±8.85**65.51±3.68 64.43±3.80*69.58±6.43
2.3 生、熟地黄对肾阴虚大鼠肾上腺组织病理变化的影响结果见图1。空白组大鼠肾上腺皮质球状带、束状带、网状带结构清晰;模型组大鼠肾上腺皮质变薄,皮质各层边界不清;各给药组大鼠肾上腺皮质结构均有所改善,尤其熟地黄给药组大鼠肾上腺皮质各层增厚明显,改善作用优于生地黄组。
2.4 生、熟地黄对肾阴虚大鼠肠道菌群的影响
2.4.1物种注释及评估 各组样本通过测序并经质控过滤后共获得1 163 792 条有效序列,平均单个样本产生32 328 条有效序列,在97%相似度水平下对序列进行聚类,共发现1 141 种OTUs。在一定范围内,稀疏曲线随着序列采样数量的增加而趋于平坦(见图2-A),说明本研究中每个样本的测序量充分。同时,物种累计曲线结果显示其趋于平缓,此时群落中的OTU 总数将不再随着新样本的加入而显著增加(见图2-B)。结果表明,当前测序深度已接近饱和,所获得数据可以用于分析。
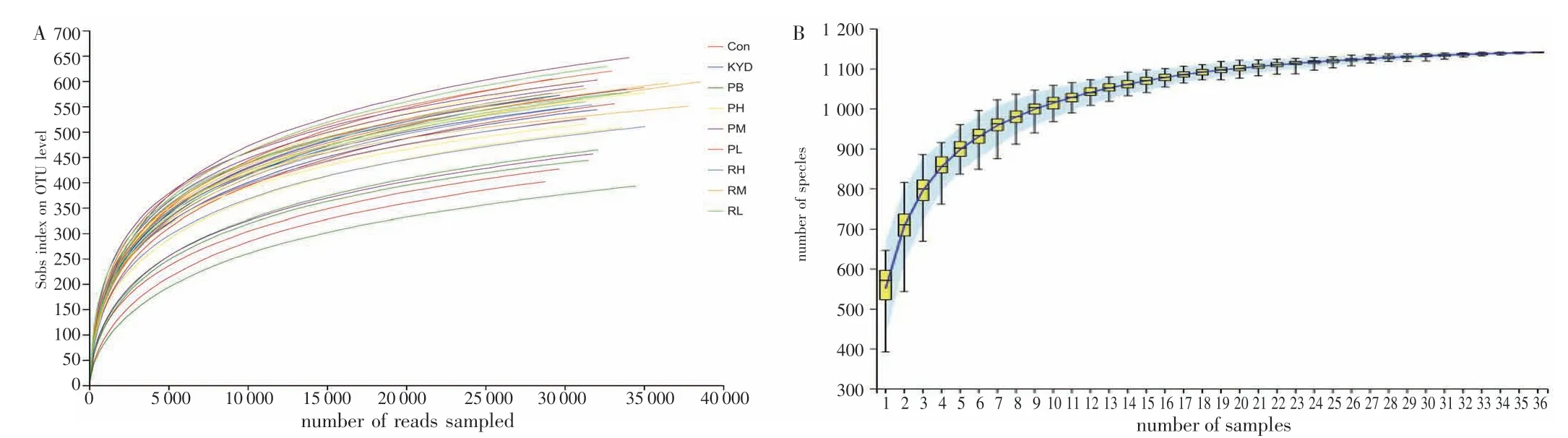
图2 各组样本的稀疏曲线图(A)与物种累计曲线图(B)Figure 2 Sparse curve(A)and species accumulation curve(B)of each group of samples
2.4.2α 及β 多样性分析 通过对肠道菌群α 多样性分析后,可得到丰度指数(Sobs、Ace、Chao)、多样性指数(Shannon、Simpson)及覆盖度指数(Coverage),结果见表4。与空白组比较,各组间Coverage 指数的差异无统计学意义(P>0.05),各组覆盖度良好;模型组丰度指数(Sobs、Ace、Chao)、多样性指数(Shannon)显著升高(P<0.01),Simpson 指数显著降低(P<0.01)。与模型组比较,熟地黄中、高剂量组的Sobs 指数明显降低(P<0.05),熟地黄给药组及生地黄高剂量组的Chao 指数显著降低(P<0.05,P<0.01),熟地黄高剂量组的Simpson指数明显升高(P<0.05)。结果表明,模型组大鼠肠道微生物群落丰富度明显增高,微生物群落多样性的变化趋势与丰富度变化大致相同;各给药组的肠道微生物群落丰富度均有不同程度的降低,其中熟地黄中、高剂量组下降趋势最为明显,作用优于生地黄组。
表4 生、熟地黄对肾阴虚大鼠肠道菌群α 多样性的影响(±s,n=4)Table 4 Effect of Rehmanniae Radix and Rehmanniae Radix Praeparata on α diversity of gut microbiota in rats with kidney yin deficiency syndrome(±s,n=4)

表4 生、熟地黄对肾阴虚大鼠肠道菌群α 多样性的影响(±s,n=4)Table 4 Effect of Rehmanniae Radix and Rehmanniae Radix Praeparata on α diversity of gut microbiota in rats with kidney yin deficiency syndrome(±s,n=4)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
Coverage指数0.995 67 0.995 96 0.996 34 0.996 24 0.996 07 0.996 11 0.996 16 0.996 31 0.996 04组别空白组模型组益生菌组熟地黄高剂量组熟地黄中剂量组熟地黄低剂量组生地黄高剂量组生地黄中剂量组生地黄低剂量组Sobs指数413.50±17.68 578.00±8.49##453.50±14.85**511.50±4.95*517.00±10.61*559.67±30.35 596.00±8.48 577.00±24.02 571.00±10.44 Ace指数525.50±28.47 694.15±11.01##519.91±21.72**616.31±0.38 615.52±1.71 648.31±13.15 702.51±11.97 712.46±15.46 683.18±19.35 Chao指数524.63±20.46 708.02±24.01##527.06±6.05**614.65±0.38**618.17±1.32**654.55±12.07*620.32±6.50**685.70±18.47 683.01±19.81 Shannon指数2.82±0.25 4.12±0.12##3.13±0.25**3.75±0.21 3.85±0.24 4.19±0.10 4.01±0.05 4.01±0.08 4.04±0.13 Simpson指数0.127±0.021 0.043±0.006##0.121±0.011**0.078±0.020*0.063±0.008 0.063±0.003 0.067±0.011 0.047±0.005 0.047±0.001
β 多样性分析的重点是比较不同样品(空白组、模型组、熟地黄高剂量组、生地黄高剂量组)间肠道微生物群的多样性。通过主坐标分析(PCoA)显示,空白组和模型组的肠道微生物组成分布明显分开,模型组与生地黄高剂量组关系密切,见图3-A。同时,采用UPGMA 聚类分析方法判断样品间物种组成的相似性,样本距离越近、分支越短说明2 个样本的物种组成越相似。结果显示,空白组和模型组的物种差异显著,而生地黄高剂量组与模型组更为相似(见图3-B)。
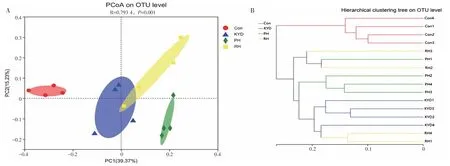
图3 各组样本的PCoA 分析图(A)与样本层级聚类分析图(B)Figure 3 PCoA analysis chart(A)and sample hierarchy cluster analysis chart(B)of each group of samples
综合分析,生地黄对肾阴虚大鼠肠道微生物群落丰富度和多样性的改变较小,而熟地黄作用相对更加明显,说明熟地黄可以更好地维持肾阴虚大鼠肠道微生物群落丰富度和多样性的稳定。
2.4.3群落组成分析 基于门水平的群落组成分析显示(见图4-A),各组大鼠肠道菌群均由Firmicutes(厚壁菌门)、Bacteroidota(拟杆菌门)、Actinobacteriota(放线菌门)及其他组成;厚壁菌门和拟杆菌门占全部样品总数90%以上,在各组大鼠肠道菌群中占绝对优势地位;但不同组之间存在显著差异。与空白组比较,模型组大鼠粪便中的厚壁菌门丰度显著降低,拟杆菌门、放线菌门的丰度显著升高;与模型组比较,益生菌组和熟地黄高剂量组的菌群丰度恢复趋势与空白组更加相近,显示其对菌群比例的调节作用最佳。
基于属水平的群落组成分析显示(见图4-B),各组都具有特定的菌属,且相同菌属的丰度也不一致。方差分析结果显示,乳杆菌属(Lactobacillus)、norank_f__Muribaculaceae 的变化最为显著。与空白组比较,模型组大鼠粪便中乳杆菌属的丰度显著降低(P<0.01),norank_f__Muribaculaceae 的丰度显著升高(P<0.01)。与模型组比较,各给药组的乳酸菌丰度均有所上升,其中益生菌组显著升高(P<0.01);norank_f__Muribaculaceae丰度均有所下降,其中益生菌组及熟地黄中、高剂量组显著降低(P<0.01),效果明显优于生地黄组(见图4-C、图4-D)。
采用LEfSe 分析法,以LDA 得分≥3 为筛选标准,比较各组大鼠肠道菌群丰度在各物种分类水平上的差异,得到多级物种层级聚类树图,结果见图5。空白组共鉴定出9 个细菌类群,其中g__Lactobacillus、o__Lactobacillales、f__Lactobacillaceae、c__Bacilli 和p__Fimicutes 的相对占比丰度较高,为优势菌群。随着肾阴虚证的发生,c__Bacteroidia、p__Bacteroidota、o__Bacteroidales、f__Muribaculaceae、g__norank_f__Muribaculaceae 等13 个分类群在模型组中显著富集。益生菌组有3个分类群;熟地黄中、低剂量组分别有5个和6个分类群;生地黄高剂量组则无分类群;生地黄中剂量组有2个分类群;生地黄低剂量组有11 个分类群,其中f__Prevotellaceae 的相对丰度占比较高。

图5 各组大鼠肠道菌群LEfSe 分析Figure 5 LEfSe analysis of gut microbiota in each group of rats
2.4.4功能预测分析 利用PICRUSt 软件对测序所得的OTU 丰度表进行标准化,并对OTU 进行COG(Clusters of Orthologous Groups)功能注释,获得OTU在COG 功能水平的注释信息及各功能在不同样本中的丰度信息。整体而言,所有样本的COG 相关功能主要集中在能量代谢与物质转运方面(见图6-A),这与肾阴虚的发病机制密切相关。空白组、模型组、益生菌组、熟地黄高剂量组、生地黄高剂量组的COG 功能主要集中于氨基酸转运与代谢,碳水化合物转运与代谢,翻译、核糖体结构与生物发生,复制、重组和修复等方面,见图6-B。各功能在不同组间的丰度信息不同,这可能是由于肠道菌群失调导致的差异,而该差异可能进一步影响肠道内环境,加重肠道菌群紊乱。
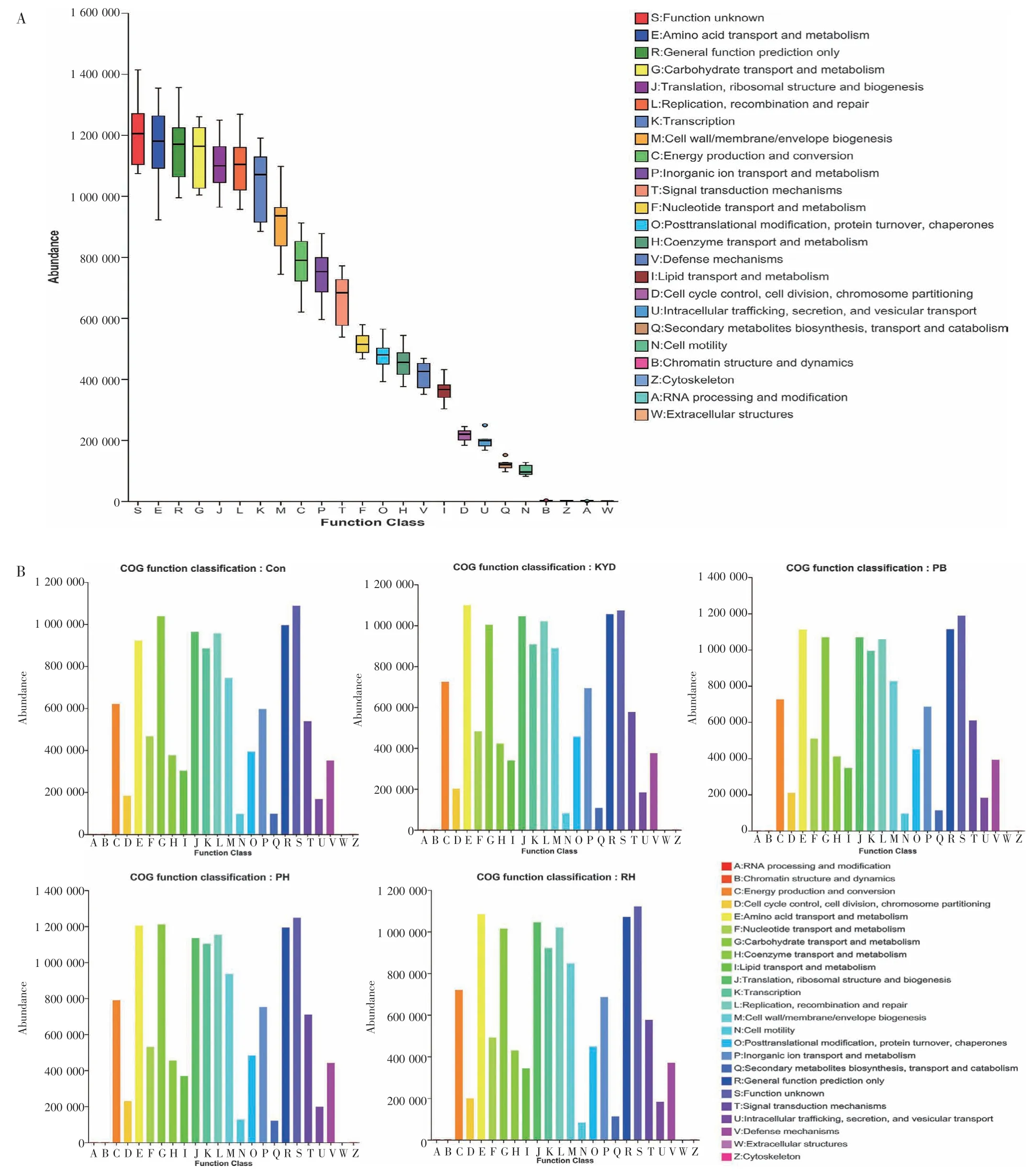
图6 全体样本的COG 功能分类统计图(A)与各组样本的COG 功能分类统计图(B)Figure 6 The COG functional classification statistical chart for all samples(A)and the COG functional classification statistical chart for each group of samples(B)
2.5 生、熟地黄对肾阴虚大鼠粪便中短链脂肪酸的影响通过靶向代谢组学分析大鼠粪便样品中的短链脂肪酸的含量,结果见表5。与空白组比较,模型组大鼠粪便中的乙酸、丁酸、丙酸、已酸水平明显降低(P<0.05,P<0.01),异丁酸水平明显上升(P<0.01)。与模型组比较,益生菌组及熟地黄低、中、高剂量组大鼠粪便中的乙酸、丁酸、丙酸水平明显升高(P<0.05,P<0.01),异丁酸水平明显降低(P<0.05,P<0.01);生地黄给药组的上述指标虽然有所改善,但差异无统计学意义(P>0.05)。
表5 生、熟地黄对肾阴虚大鼠粪便中短链脂肪酸含量的影响(±s,n=9)Table 5 Effect of Rehmanniae Radix and Rehmanniae Radix Praeparata on short chain fatty acid content in feces of rats with kidney yin deficiency syndrome(±s,n=9)
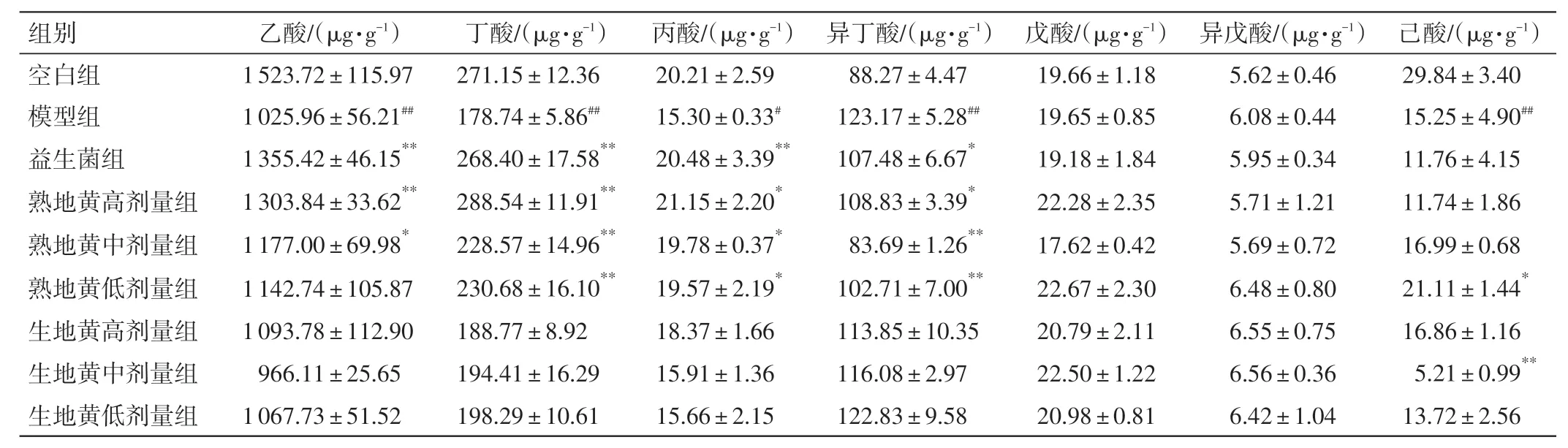
表5 生、熟地黄对肾阴虚大鼠粪便中短链脂肪酸含量的影响(±s,n=9)Table 5 Effect of Rehmanniae Radix and Rehmanniae Radix Praeparata on short chain fatty acid content in feces of rats with kidney yin deficiency syndrome(±s,n=9)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
己酸/(μg·g-1)29.84±3.40 15.25±4.90##11.76±4.15 11.74±1.86 16.99±0.68 21.11±1.44*16.86±1.16 5.21±0.99**13.72±2.56组别空白组模型组益生菌组熟地黄高剂量组熟地黄中剂量组熟地黄低剂量组生地黄高剂量组生地黄中剂量组生地黄低剂量组乙酸/(μg·g-1)1 523.72±115.97 1 025.96±56.21##1 355.42±46.15**1 303.84±33.62**1 177.00±69.98*1 142.74±105.87 1 093.78±112.90 966.11±25.65 1 067.73±51.52丁酸/(μg·g-1)271.15±12.36 178.74±5.86##268.40±17.58**288.54±11.91**228.57±14.96**230.68±16.10**188.77±8.92 194.41±16.29 198.29±10.61丙酸/(μg·g-1)20.21±2.59 15.30±0.33#20.48±3.39**21.15±2.20*19.78±0.37*19.57±2.19*18.37±1.66 15.91±1.36 15.66±2.15异丁酸/(μg·g-1)88.27±4.47 123.17±5.28##107.48±6.67*108.83±3.39*83.69±1.26**102.71±7.00**113.85±10.35 116.08±2.97 122.83±9.58戊酸/(μg·g-1)19.66±1.18 19.65±0.85 19.18±1.84 22.28±2.35 17.62±0.42 22.67±2.30 20.79±2.11 22.50±1.22 20.98±0.81异戊酸/(μg·g-1)5.62±0.46 6.08±0.44 5.95±0.34 5.71±1.21 5.69±0.72 6.48±0.80 6.55±0.75 6.56±0.36 6.42±1.04
3 讨论
肾上腺皮质激素造模法是目前公认的肾阴虚证造模方法之一[14]。从中医学角度来说,生理剂量下的糖皮质激素具有“少火生气”之意,而过量使用后则容易导致“阳胜耗阴”,使阴精内敛、无法滋养机体,最终造成肾阴亏虚或阴虚火旺[15]。cAMP、cGMP是细胞内参与能量代谢的重要调节物质[16]。研究[17]表明,肾阴虚患者血清中cAMP 水平升高,cGMP 水平降低,同时cAMP/cGMP 比值也显著升高。此外,下丘脑-垂体-肾上腺(HPA)轴作为调节机体中枢神经系统、内分泌系统、能量代谢的重要枢纽,肾阴虚证患者多表现为HPA 轴功能亢进[18]。血清中CRH、ACTH、CORT 水平的变化是HPA 轴的重要指征[19]。因此,本研究将血清cAMP、cGMP、cAMP/cGMP、CRH、ACTH、CORT 水平作为判断肾阴虚模型复制成功的客观指标。研究结果表明,持续肌肉注射地塞米松磷酸钠注射液(0.35 mg·kg-1)后,大鼠出现形体消瘦、大便干结、小便发黄、自主活动增加等肾阴虚症状,且血清cAMP、cAMP/cGMP、CRH、ACTH、CORT 水平均显著升高,cGMP 水平显著降低,表明肾阴虚大鼠模型复制成功。
本研究结果发现,益生菌对肾阴虚大鼠的HPA轴也具有一定的改善,与相关研究[20]报道益生菌可以通过神经免疫调节和HPA 轴改善宿主的神经、代谢、激素和免疫信号通路一致。研究[21]表明,肠道菌群及其代谢物可以直接或间接参与机体的能量代谢与物质转运,影响宿主的生长、发育,与中医理论中肾为先天之本,主司生长发育,调控脏腑气化的论述异曲同工。在一定程度上,肠道菌群的功能与中医的“肾”相一致,有研究[22]发现,慢性肾炎患者肠道菌群紊乱,主要表现为病原菌中肠球菌、肠杆菌的丰度升高,而益生菌中的乳酸杆菌、双歧杆菌的丰度降低。因此,推测肠道菌群失衡是肾阴虚的病理基础,肾阴虚时肠道菌群及其代谢产物发生紊乱。因此,本研究通过16SrRNA 测序和靶向代谢组学方法探讨了地黄炮制前后对肾阴虚证大鼠肠道菌群组成结构的影响。
首先,通过α及β多样性分析可知,肾阴虚大鼠的肠道微生物群落丰富度、多样性升高,说明肾阴虚时肠道菌群的稳定性受到了影响,由此导致肠道菌群结构发生了改变。在生、熟地黄干预后,微生物群落丰富度和多样性均有不同程度的降低,其中熟地黄组的变化较生地黄组更为明显,说明熟地黄可以更好地维持肠道微生物群落丰富度和多样性的稳定。
其次,在门水平上模型组大鼠肠道中的厚壁菌门丰度显著降低,拟杆菌门和放线菌门的丰度显著升高。研究[23]发现,厚壁菌门和拟杆菌门的比例失调与能量代谢相关。在属水平上模型组大鼠肠道中的乳杆菌属丰度显著降低。厚壁菌门作为机体最大的一类细菌群,在维持宿主免疫系统稳态上发挥重要作用,其中乳酸杆菌属属于厚壁菌门,是最常用的益生菌[24],它可以产生乙酸盐、乳酸盐和抗菌物质,从而影响内分泌系统和能量代谢稳态,以防止病原体干扰机体健康[25-26]。通过靶向代谢组学分析各组大鼠粪便中的短链脂肪酸(SCFAs)含量发现,模型组大鼠的乙酸、丁酸、丙酸水平显著降低,与厚壁菌门和乳酸杆菌属丰度呈正相关。短链脂肪酸作为肠道菌群的代谢产物,主要由肠道内的双歧杆菌、乳酸杆菌等有益菌发酵膳食纤维后产生,其中乙酸盐、丙酸盐、丁酸盐占短链脂肪酸总含量的95%以上[27]。乙酸盐可以调节肠道pH值,维持肠道菌群稳定性,并阻止致病菌的侵入;乙酸还有助于滋养肠道中产生丁酸的细菌,促进肠道有益菌群的多样性。丁酸则主要由厚壁菌门产生,它可以为结肠细胞提供能量,同时具有保持肠壁完整性的重要功能。而丙酸与乙酸的功能具有相似性。由此可见,肾阴虚时大鼠的肠道菌群紊乱影响了短链脂肪酸的产生,进一步加剧了肠道菌群的紊乱,而给予益生菌及熟地黄干预后,大鼠粪便中的乙酸、丁酸、丙酸、异丁酸水平得到明显恢复。
最后,通过COG 功能分析结果发现,肾阴虚大鼠的肠道菌群显著影响氨基酸转运与代谢,以及碳水化合物转运与代谢等,主要与能量代谢及物质转运方面密切相关,这与肾阴虚证的发病机制有关。而生、熟地黄均能一定程度改善肾阴虚大鼠的症状及肠道菌群比例,且熟地黄的调节作用显著优于生地黄,这可能与地黄经炮制后主要化学成分发生改变有关。研究[22]证实,肠道菌群介导的生物转化作用可促进熟地黄所含糖苷类物质在肠道的降解和吸收。同时,熟地黄中的糖类物质可促进肠道有益菌双歧杆菌和乳酸杆菌的生长,并对肠杆菌和肠球菌等有害菌的生长具有抑制作用[28]。因此,地黄经炮制后对肾阴虚证大鼠治疗作用的增强可能与其对肠道菌群的调节作用有关。因此,后续将对熟地黄发挥滋阴益肾作用的具体物质基础进行更深入的研究,以期揭示地黄炮制增效的科学内涵。

