消炎退热颗粒清热抗炎作用的网络药理学分析及其主要成分的含量测定
王冠楠,王宏进,苑楠楠,针涛,王佳雪,孙立新(. 沈阳药科大学,辽宁本溪 7004;2. 辽宁省食品检验检测院,辽宁沈阳 068)
消炎退热颗粒收录于2020 年版《中国药典》一部,是由大青叶、蒲公英、紫花地丁、甘草制成的复方制剂[1],主要用于感冒发热、上呼吸道感染、咽喉肿痛及各种疮疖肿痛[2]。方中君药大青叶有清热解毒、凉血消斑的功效,是消炎退热颗粒发挥疗效的重要物质基础;臣药蒲公英能够解毒消肿、利尿通淋,可增强大青叶清热解毒的功效;佐药紫花地丁清热解毒、凉血消肿,可以协调君臣二药;使药甘草具有清热解毒、调和诸药的作用。研究[3-7]发现,消炎退热颗粒具有显著的清热解毒作用,但其作用机制尚不明确。网络药理学是基于公共数据库,以“网络靶标”为核心,能够对“成分-靶点-疾病”网络进行多层次分析,广泛应用于中药活性化合物的作用机制研究[8-12];分子对接技术是通过计算机模拟化合物与靶蛋白的相互作用,预测两者间的亲和力和结合方式,常被应用于设计和筛选活性化合物,是药物开发过程中重要的手段[13-14]。
目前网络药理学相关的中药药效物质研究大多数是基于口服生物利用度和药物相似性等预测性参数进行筛选,而药物发挥药效的前提是进入血液循环。因此,以口服后吸收入血成分作为药效物质进行网络药理学研究更加准确。本课题组前期试验结果显示,以UPLC-Q-Exactive MS 技术分析口服消炎退热颗粒后的血清样品,共鉴定出88 个入血成分,其中75 个原型成分,包括萜类化合物5 个、黄酮类化合物5 个、有机酸类化合物32 个、苯丙素类化合物14个和其他类型化合物19个;代谢产物13个,主要为甘草苷、甘草素、秦皮乙素及咖啡酸的代谢产物。在此基础上,本研究以网络药理学筛选消炎退热颗粒的有效成分和核心靶点,并利用分子对接的方法进行验证,同时建立UPLC-MS/MS(超高效液相色谱-质谱联用)方法分析其主要活性成分含量,以期为消炎退热颗粒的药理学研究及质量控制提供参考。
1 材料
1.1 仪器Acquity 超高效液相色谱仪、Micromass Quattro Micro API 质谱仪和Masslynx V4.1色谱工作站(美国Waters公司);JF1004万分之一电子天平(余姚市金诺天平仪器有限公司);BT25S 十万分之一电子天平(赛多利斯科学仪器北京有限公司);XK96-A快速混匀器(江苏新康医疗器械有限公司);BKQ-100型超声波清洗器(昆山市超声仪器有限公司);L530型台式高速离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 药品及试剂绿原酸(批号:B20782)、咖啡酸(批号:B20660)、异甘草素(批号:B21525)、甘草素(批号:B20416)、甘草苷(批号:B20414)、甘草酸(批号:B20417)、秦皮乙素(批号:B20991)、靛玉红(批号:B20298),质量分数均大于98%,上海源叶生物科技有限公司。甲醇、乙腈(色谱纯,美国Fisher公司);甲酸、甲酸铵(色谱纯,天津市大茂化学试剂厂);纯化水(杭州娃哈哈集团有限公司)。16 批消炎退热颗粒,来自A、B 两药企。A 厂样品批号:ZGA1801、ZBA2002、ZEA2001、ZEA2003、ZBA2001、ZCA1901、ZHA1901(编号:A1~A7),B 厂样品批号:19012、190806、200310、200313、190807、200224、200304、190407、190904(编号:B1~B9)。
1.3 主要软件及数据库CTD 数据库(https://ctdbase.org/);Pubchem 数据库(https://pubchem.ncbi.nlm.nih.gov/search/);String 网站(https://string-db.org/);Cytoscape 3.9.1 软件;SwissTargetPrediction 数据库(http://www.swisstargetprediction.ch /);微生信网站(http://www.bioinformatics.com.cn/);RCSB PDB 数据库(https://www.rcsb.org/);David 6.8 数据库(https://david.ncifcrf.gov/);Maestro 11.8软件(美国Schrodinger公司)。
2 方法与结果
2.1 网络药理学与分子对接研究
2.1.1消炎退热颗粒入血成分的靶点收集 通过UPLC-Q-Exactive MS 技术测定口服消炎退热颗粒后的血清样品,共鉴定出88个入血成分,见表1。通过Pubchem 数据库查询所鉴定化合物的SMILES,上传到SwissTargetPrediction 数据库,设置属性为“Homo sapiens”,获得化合物的相应靶点。

表1 消炎退热颗粒的入血化学成分Table 1 Ingredients absorked in the blood of Xiaoyan Tuire Granules
2.1.2药物成分和疾病靶点的筛选 利用SwissTarget-Prediction 数据库检索到消炎退热颗粒的成分靶点共813 个。采用“fever”和“inflammation”为关键词,检索CTD 数据库,获得发热和炎症疾病相关靶点47 410个。去除重复靶点,以inference score≥150.07为筛选条件,最终得到疾病靶点2 746 个。应用Venny 2.1 取入血成分靶点和疾病相关靶点的交集,获得405个共同靶点。见图1。
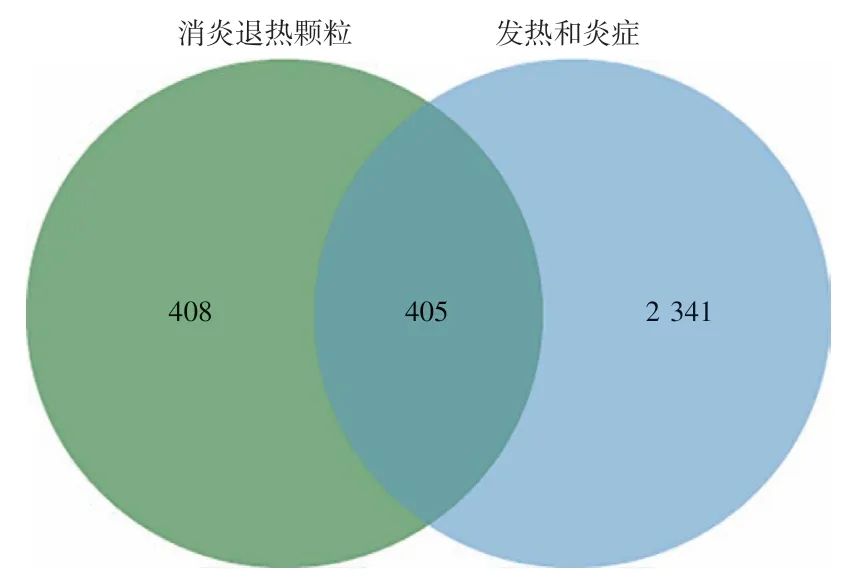
图1 消炎退热颗粒的成分-疾病交集靶点Figure 1 Intersection targets of components of Xiaoyan Tuire Granules-disease
2.1.3成分-靶点网络的构建 将上述交集靶点导入Cytoscape 3.9.1 软件构建成分-靶点互作网络。见图2。应用软件中“Network Analyzer”功能进行网络分析,以网络中连接度值(Degree值)为指标筛选出消炎退热颗粒入血成分中潜在的活性成分。该网络包含483 个节点和1 563 条边。以Degree 值大于2 倍中位数筛选出甘草素、甘草次酸、阿魏酸、秦皮乙素、异甘草素、东莨菪素、靛玉红、咖啡酸、绿原酸、甘草酸、甘草苷、紫檀素、大马酮、7-乙酰氧基-2-甲基异黄酮、苯乙基内酰脲、谷氨酰酪氨酸等16个重要成分。
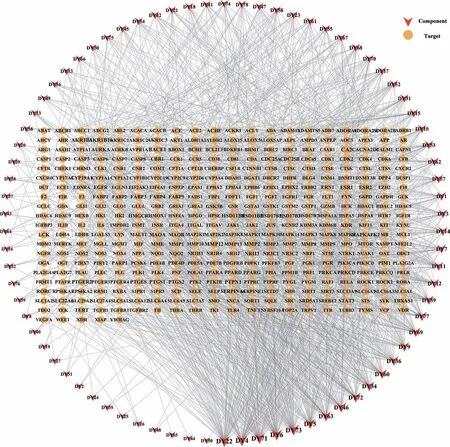
图2 消炎退热颗粒的成分-疾病靶点网络图Figure 2 The network of components of Xiaoyan Tuire Granules-disease targets
2.1.4蛋白相互作用(PPI)网络的构建与核心靶点的筛选 将交集靶点导入String 11.5 数据库,选择Multiple proteins、Homo sapiens,设置相互作用阈值(medium confidence>0.9)及隐藏游离节点后进行PPI网络的构建,得到PPI 网络图。见图3。将结果导入Cytoscape 3.9.1 软件,并通过CytoHubba 插件中的Degree 算法进行分析,获得评分前10 位的靶点。见图4。结果显示,丝氨酸/苏氨酸蛋白激酶1(AKT1)、肿瘤坏死因子(TNF)和白细胞介素6(IL-6)等靶点为核心靶点。

图3 消炎退热颗粒的成分-疾病交集靶点的PPI 网络Figure 3 PPI network of intersection targets for components of Xiaoyan Tuire Granules-disease

图4 消炎退热颗粒的核心靶点的PPI 网络(前10 位)Figure 4 PPI network of core targets of Xiaoyan Tuire Granules(top 10)
2.1.5GO功能与KEGG通路富集分析 将筛选的核心靶点导入David数据库,限定物种为“Homo sapiens”,进行基因本体生物学过程(gene-ontology biology process,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。以P<0.01为筛选条件,选取有代表性的GO富集和KEGG通路。其中,GO富集共筛选出83 个条目,生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)条目分别为76、3、4 条。导入微生信网站作图,其中展示生物过程前10条目(见图5)。细胞凋亡信号通路(apoptotic signaling pathway)、丝裂原活化蛋白激酶级联途径(MAPK cascade)等对BP 影响较大;大分子复合物(macromolecular complex)、膜筏(membrane raft)和细胞外间隙(extracellular space)等对CC 影响较大;细胞因子活性(cytokine activity)、相同蛋白结合(identical protein binding)、酶结合(enzyme binding)和一氧化氮合酶调节剂活性(nitricoxide synthase regulator activity)对MF 影响较大。KEGG 通路富集分析筛选出72 个KEGG 富集条目,根据P值筛选出前16 条密切相关的通路。见表2。结果显示,人巨细胞病毒感染信号通路(Human cytomegalovirus infection)、 TNF 信号通路(TNF signaling pathway)和MAPK 信号通路(MAPK signaling pathway)等为主要的富集通路。

表2 消炎退热颗粒与炎症和发热密切相关的信号通路(前16 条)Table 2 Pathways closely associated with fever and inflammation for Xiaoyan Tuire Granules(top 16)
2.1.6构建成分-靶点-通路网络 将消炎退热颗粒的关键成分、核心靶点和信号通路导入Cytoscape 3.9.1软件构建成分-靶点-通路网络图,用其插件“Network analyzer”功能进行网络分析。将关键成分、核心靶点和信号通路导入Cytoscape 软件构建成分-靶点-通路网络图。见图6。网络图包含98 个节点和354条边。以节点Degree值大小为指标,16个化合物Degree 值差异不大,均可能是消炎退热颗粒的关键成分;72条作用通路Degree值范围为3~8,其中AGE-RAGE 信号通路(AGE-RAGE signaling pathway,Degree=8)、阿尔茨海默病信号通路(Alzheimer disease,Degree=8)、丝裂原活化蛋白激酶信号通路(MAPK signaling pathway, Degree=7)、 癌症信号通路(Pathways in cancer,Degree=7)、人巨细胞病毒感染(Human cytomegalovirus infection,Degree=7)、沙门氏菌感染(Salmonella infection,Degree=7)的连接度高于其他信号通路,可能为消炎退热颗粒的关键信号通路。
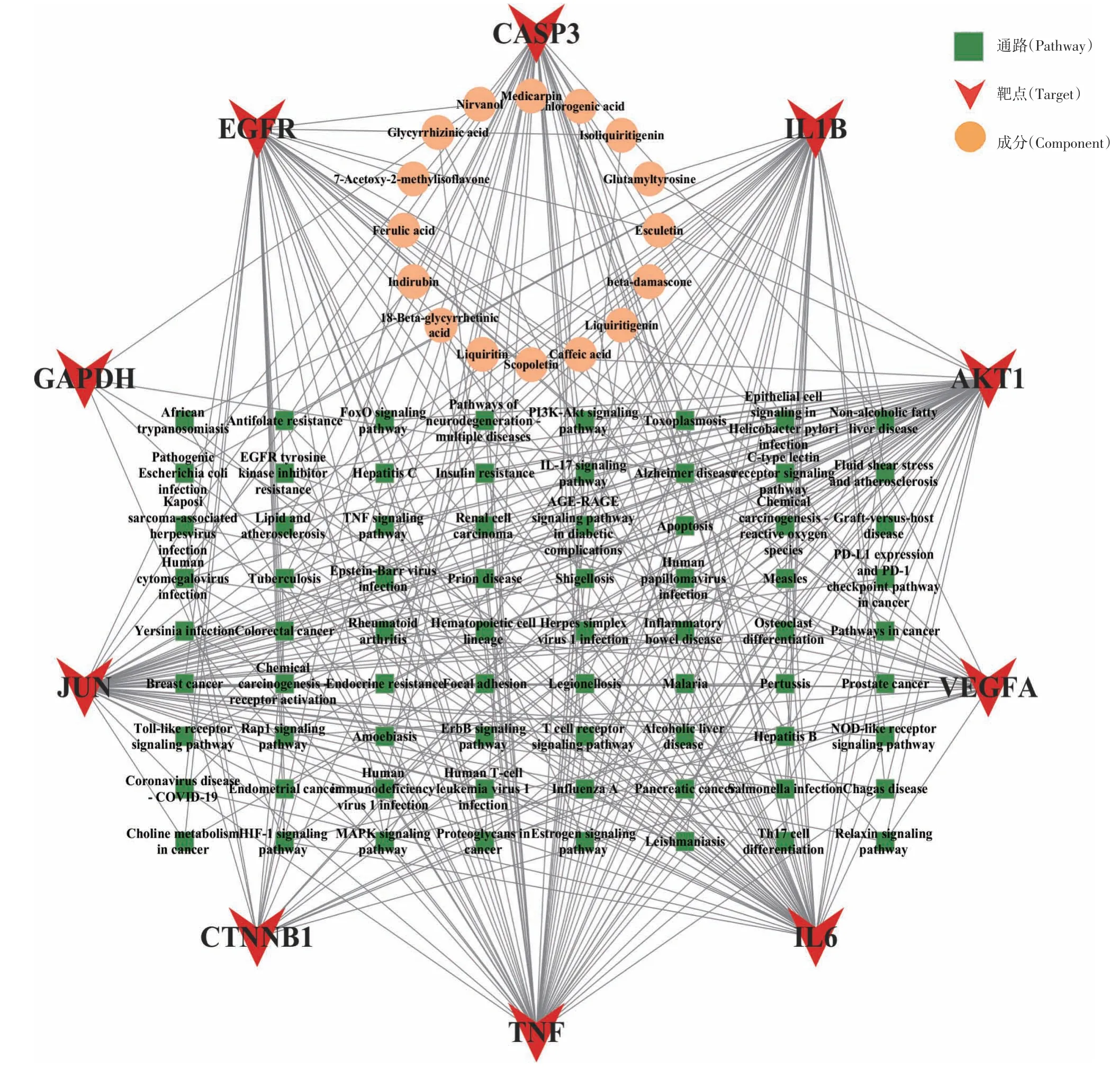
图6 消炎退热颗粒的主要活性成分-核心靶点-信号通路网络图Figure 6 The "active components-core targets-signaling pathways" network diagram of Xiaoyan Tuire Granules
2.1.7分子对接 将筛选出的活性成分与核心靶点对应的阳性药进行分子对接,预测蛋白-分子相互作用的结合能。其中,化合物的mol2 文件来自PubChem数据库,从PDB 数据库获取蛋白晶体结构,并导入Maestro 11.8 软件。蛋白大分子先后通过Protein preparation wizard 模块、Sample water orientations、OPLS3e 模块进行优化,并以原始配体小分子为中心,生成大小为25 Å×25 Å×25 Å 的对接盒子文件。在LigPre 模块中进行化合物优化,生成pH 值(7.0±2.0)下的离子化状态,加氢、去盐,合成互变异构体,选择“XP”超精密对接,并由Glide中“docking score”打分函数对对接结果进行评价。结果见图7。16个成分与关键靶点结合能均小于0 kJ·mol-1,表明药物分子与靶蛋白的相互作用稳定。进一步可视化分析结果显示,各化合物均能够与对应的靶点通过氢键形成稳定结合。见图8。咖啡酸、绿原酸和甘草苷可与AKT1 相互作用,作用于其残基赖氨酸(LYS)179、天冬氨酸(ASP)292、丙氨酸(ALA)230 和精氨酸(ARG)4。秦皮乙素、靛玉红、苯乙基内酰脲和异甘草素可与TNF 相互作用,作用于其残基亮氨酸(LEU)172、亮氨酸(LEU)168、天冬酰胺(ASN)119、天冬酰胺(ASN)171 和天冬氨酸(ASP)158。甘草素、大马酮、7-乙酰氧基-2-甲基异黄酮、东莨菪素和紫檀素可与EGFR相互结合,作用于其残基赖氨酸(LYS)745、天冬氨酸(ASP)855、苏氨酸(THR)854、异亮氨酸(ILE)759和半胱氨酸(CYS)775。甘草次酸、阿魏酸、甘草酸和谷氨酰酪氨酸可与CASP3相互作用,作用于其残基赖氨酸(LYS)210、天冬酰胺(ASN)208、丝氨酸(SER)209、丝氨酸(SER)65、精氨酸(ARG)64和精氨酸(ARG)207。

图7 消炎退热颗粒主要活性成分与核心靶点分子对接的评分热图Figure 7 Scoring heat map of main active important components and key targets of Xiaoyan Tuire Granules

图8 消炎退热颗粒主要活性成分与核心靶点的模拟对接图Figure 8 Simulated docking diagram of main active components and core targets of Xiaoyan Tuire Granules
2.2 消炎退热颗粒的含量测定
2.2.1色谱与质谱条件 色谱条件:色谱柱为ACQUITY UPLC®BEH C18柱(2.1 mm×100 mm,1.7 μm);柱温:40 ℃;流速:0.25 mL·min-1;流动相:0.1%甲酸乙腈(A)-0.1%甲酸-5 mmol·L-1甲酸铵(B),梯度洗脱(0~1.0 min,15% A;1.0~3.0 min,15%~40%A;3.0~11.0 min,40%A;11.0~11.1 min,40%~15%A);进样室温度:4 ℃;进样量:10 μL。
质谱条件:离子源为电喷雾离子化源(ESI 源);检测模式:正负离子扫描模式;检测方式:多反应离子监测(MRM);离子源温度为120 ℃;脱溶剂温度为300 ℃;离子源电压为3.5 kV。8种成分的质谱分析条件参数见表3。

表3 8 种化合物的质谱条件参数Table 3 Mass spectrometric parameters of 8 compounds
2.2.2溶液的配制 均在避光下操作。
2.2.2.1 供试品溶液制备 取消炎退热颗粒,研细,取粉末约0.2 g,精密称定,置具塞锥形瓶中。精密加入甲醇2.0 mL,密塞,称定质量。超声提取20 min(250 W,40 kHz),放冷。再称定质量,用甲醇补足损失的质量。摇匀,取上清液用0.22 μm 滤膜滤过,弃去初滤液,续滤液为供试品溶液。
2.2.2.2 对照品溶液制备 取靛玉红、异甘草素、甘草苷、甘草素、甘草酸、咖啡酸、绿原酸和秦皮乙素适量,除靛玉红加三氯甲烷2.0 mL 溶解外,其余均加甲醇配制成单一成分的对照品储备液;精密量取各对照品储备液适量,加甲醇分别配制成上述成分的混合对照品储备液Ⅰ和混合对照品储备液Ⅱ,其浓度见表4。
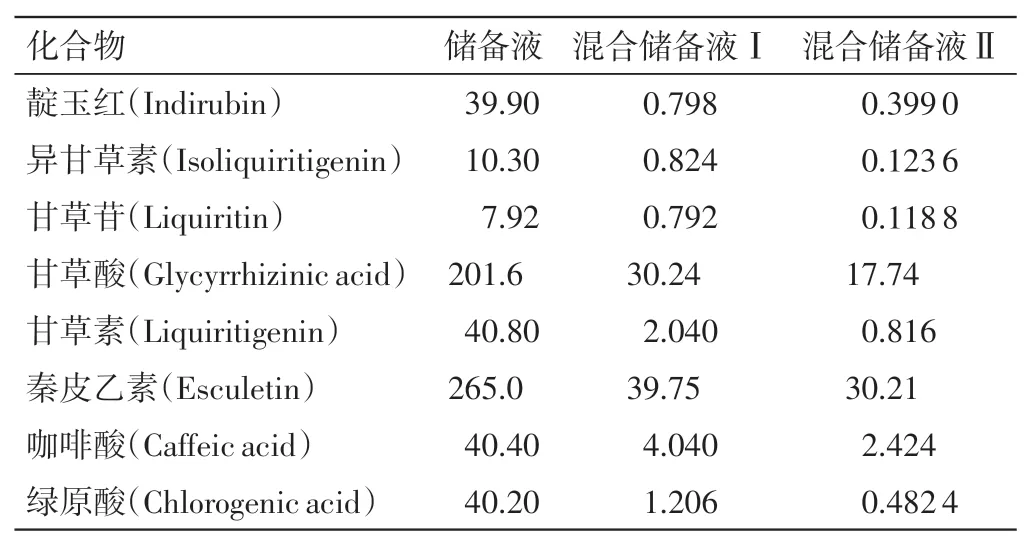
表4 各对照品及混合对照品储备液质量浓度(μg·mL-1)Table 4 The comantration of each reference substance and mixed standard solutions(μg·mL-1)
2.2.3专属性 分别取空白溶剂(甲醇)、供试品溶液以及混合对照品溶液(为“2.2.2.2”项下混合对照品储备液Ⅰ稀释10 倍),按“2.2.1”项下进样分析。见图9。结果表明该方法专属性良好,提取溶剂不干扰8种成分的含量测定。
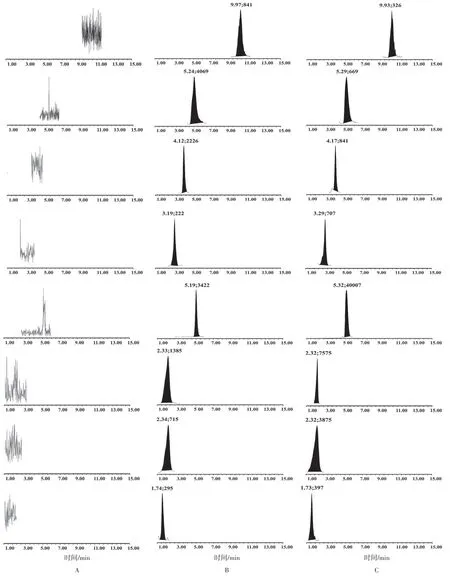
图9 消炎退热颗粒中8 种化合物的质谱图Figure 9 UPLC-MS/MS chromatograms of 8 compounds in Xiaoyan Tuire Granules
2.2.4线性与范围 分别精密量取“2.2.2.2”项下混合对照品储备液Ⅰ1.0、3.0、5.0、7.0、9.0 mL,置10 mL棕色量瓶中,用甲醇稀释至刻度,摇匀,即得系列浓度的混合对照品溶液。分别取上述溶液进样分析,以对照品溶液的浓度(X,μg·mL-1)为横坐标,峰面积(Y)为纵坐标,进行线性回归,得各化合物的回归方程。结果见表5。

表5 8 种化合物的线性关系考察结果Table 5 The results of linear relationships test of 8 components
2.2.5检测限和定量限 精密吸取单一对照品储备液适量,按“2.2.1”项下进样分析,不断稀释已知浓度的对照品溶液,以信噪比为3∶1 和10∶1 分别计算检出限(LOD)和定量限(LOQ)。结果见表5。
2.2.6精密度 精密吸取“2.2.2.2”项下混合对照品储备液Ⅱ,按上述检测条件进样分析,连续进样6 次,记录各峰面积。结果靛玉红、异甘草素、甘草素、甘草酸、甘草苷、秦皮乙素、咖啡酸、绿原酸峰面积的RSD 分别为4.8%、4.7%、4.6%、4.2%、4.2%、5.0%、5.0%、4.5%,表明该方法精密度良好。
2.2.7重复性称取消炎退热颗粒(批号:200304)共6份,每份约0.2 g,精密称定,按“2.2.2.1”项下平行制备6份供试品溶液,依法分别测定。结果靛玉红、异甘草素、甘草素、甘草酸、甘草苷、秦皮乙素、咖啡酸、绿原酸峰面积的RSD 分别为3.0%、4.4%、5.2%、5.5%、4.1%、2.4%、4.1%、4.7%,结果表明该方法重复性较好。
2.2.8稳定性 取消炎退热颗粒(批号:200304)供试品溶液,室温放置,按上述检测条件分别于0、4、6 和12 h 进样分析。结果靛玉红、异甘草素、甘草素、甘草酸、甘草苷、秦皮乙素、咖啡酸、绿原酸峰面积的RSD 分别为2.7%、2.8%、2.7%、2.8%、2.9%、1.8%、3.4%、2.4%,结果表明供试品溶液在室温下12 h内稳定。
2.2.9准确度 取已知含量(批号:200304)的消炎退热颗粒6份,每份约0.1 g,精密称定,置具塞锥形瓶中,分别加入精密量取的混合对照品储备液Ⅱ1.0 mL,按“2.2.2.1”项下方制备供试品溶液,平行制备6份,进样分析。结果靛玉红、异甘草素、甘草素、甘草酸、甘草苷、秦皮乙素、咖啡酸和绿原酸的平均加样回收率分别为92.8%、90.5%、93.6%、93.7%、95.7%、97.8%、93.1%和92.9%,RSD 分别为2.8%、2.1%、4.3%、4.2%、4.8%、4.3%、2.2%和5.3%,表明该方法准确度良好。
2.2.10耐用性 取消炎退热颗粒(批号:200304)供试品溶液,对“2.2.1”项下色谱条件中的流速(0.20、0.25、0.30 mL·min-1)、柱温(38、40、42 ℃)、甲酸体积分数(0.09%、0.10%、0.11%)等参数进行调整后,测定样品含量,以考察本方法的耐用性。结果显示,不同条件下进样测定,各成分峰面积的RSD均小于3.5%,表明该方法耐用性良好。
2.2.11样品的含量测定 取16 批消炎退热颗粒,按“2.2.2.1”项下方法制备供试品溶液,并按“2.2.1”项下进样分析,记录峰面积,并计算出8种成分的含量,结果见表6。8 种成分中以秦皮乙素的含量为最高,平均含量为208.69 μg·g-1;甘草酸次之,为113.85 μg·g-1;咖啡酸和甘草苷的平均含量为16.25和7.34 μg·g-1;而靛玉红、甘草素、异甘草素和绿原酸的含量相对较低,平均含量仅为1.67、1.66、2.20、3.32 μg·g-1。进一步对2个厂家样品中8种成分平均含量进行方差分析。结果显示,咖啡酸、甘草酸和秦皮乙素的含量无显著性差异(P>0.05),而靛玉红、甘草素、异甘草素、甘草苷和绿原酸的含量有显著性差异(P<0.01,P<0.05)。
表6 16 批消炎退热颗粒中8 种化合物的含量测定结果(±s,μg·g-1;n=3)Table 6 Contents of 8 analytes in 16 batches of Xiaoyan Tuire Granules(±s,μg·g-1;n=3)
注:两厂家8种成分含量比较,**P<0.01,*P<0.05
绿原酸3.47±0.38 5.58±0.86 3.74±0.28 3.69±0.47 4.00±0.30 3.64±0.56 4.90±0.09 2.27±0.10 2.43±0.13 3.80±0.33 2.61±0.30 1.99±0.05 2.46±0.12 2.83±0.49 3.20±0.32 2.55±0.16 4.15±0.73 2.68±0.51**编号A1 A2 A3 A4 A5 A6 A7 B1 B2 B3 B4 B5 B6 B7 B8 B9 A1~A7 B1~B9靛玉红1.04±0.04 1.24±0.07 1.28±0.08 1.39±0.06 1.13±0.04 1.75±0.18 1.19±0.02 2.03±0.14 0.94±0.06 2.76±0.06 1.69±0.15 1.20±0.12 1.64±0.06 3.41±0.18 2.62±0.61 1.47±0.09 1.29±0.21 1.97±0.76*异甘草素3.85±0.27 1.83±0.19 5.61±0.19 2.22±0.06 4.14±0.23 1.89±0.09 4.33±0.13 1.24±0.17 1.23±0.10 1.51±0.01 1.34±0.25 1.24±0.10 0.99±0.10 1.29±0.06 1.31±0.21 1.20±0.04 3.41±1.34 1.26±0.13**甘草苷2.31±0.08 1.18±0.03 5.84±0.29 1.51±0.05 3.65±0.45 1.44±0.07 2.60±0.15 0.87±0.07 0.89±0.04 0.97±0.02 0.86±0.08 0.81±0.05 0.80±0.02 0.84±0.06 0.90±0.03 1.01±0.04 2.65±1.52 0.88±0.07**甘草酸104.99±13.19 112.74±0.86 138.32±4.16 113.50±4.86 134.47±10.61 96.79±2.31 141.11±3.90 100.30±12.13 101.90±2.64 139.20±4.79 119.23±15.03 85.48±22.61 96.87±0.18 101.89±19.73 129.03±3.21 105.83±2.72 120.27±16.25 108.86±16.00甘草素6.79±0.55 10.09±0.61 10.01±0.35 9.10±0.05 9.49±0.84 9.77±0.23 9.35±0.83 5.80±0.78 5.64±0.43 6.81±0.53 6.48±0.97 4.30±0.24 5.45±0.11 5.10±0.44 6.57±1.09 6.70±0.60 9.23±1.05 5.87±0.80**秦皮乙素152.35±7.34 187.17±16.08 219.28±4.52 168.85±0.65 271.80±20.26 181.58±6.61 194.01±9.21 209.68±3.43 197.93±3.90 262.31±5.89 205.47±14.27 207.37±10.75 232.93±4.56 255.99±9.11 217.56±11.09 174.81±2.22 196.43±36.29 218.23±26.32咖啡酸15.55±0.83 17.14±1.67 12.92±0.59 8.60±0.12 12.02±1.43 15.21±1.70 22.44±1.90 16.67±1.85 11.31±0.55 26.94±1.15 17.79±3.21 11.69±0.24 14.02±0.92 21.00±2.84 20.21±1.55 16.61±0.49 14.84±4.04 17.36±4.65
3 讨论
3.1 网络药理学及分子对接研究本研究从消炎退热颗粒中筛选出16个潜在的有效成分,并获得10个相应的核心靶点。其中咖啡酸能够清除由中性粒细胞和巨噬细胞产生的氧自由基,降低促炎症因子的表达[15];甘草酸可通过抑制IL-18 的生成,下调基质金属蛋白酶(MMP-9)的含量,从而发挥抗炎活性[16];甘草素能够抑制蛋白激酶(AKT),降低炎症反应,起到细胞保护作用[17];异甘草素可降低巨噬细胞中前列腺素PGE2 和NO 的生成,以发挥抗炎作用;甘草苷可抑制髓过氧化物酶(MPO)活性,抑制细胞间黏附因子1(ICAM-1)的表达,降低组织炎性损伤[18];靛玉红能够显著降低脂多糖(LPS)诱导的RAW264.7 炎症细胞模型IL-6、TNF-α 的浓度,具有显著的体外抗炎作用[19];秦皮乙素能够降低NO 的分泌,调节血管收缩,减轻组织器官的炎性损伤[20];绿原酸能够螯合金属离子和清除自由基,调控丝裂原活化蛋白激酶(MAPK)/ERK/c-Jun 氨基末端激酶信号通路来降低组织的炎症反应[21]。
靶点筛选结果显示,AKT1、TNF、IL6、JUN、IL1β、CASP3、EGFR、VEGFA、CTNNB1、GAPDH与核心成分的连接度值较高,推测可能是消炎退热颗粒发挥作用的核心靶点。其中AKT1在调节细胞生长、增殖及糖代谢的过程中起着重要作用。同时,能调节AKT1的表达以影响下游靶点,从而改善炎症反应[22];TNF、IL-1β、IL-6 为典型的促炎细胞因子,能够对炎症和免疫调节起促进作用,增强炎症反应程度[23]。TNF不仅直接促进炎症基因表达,还能间接地促使细胞死亡、诱导炎症免疫反应;IL-1β可诱导多种促炎介质,如细胞因子和趋化因子,加重炎症反应;IL-6 可促进炎症部位单核细胞和巨噬细胞的募集,诱导炎症介质过度表达,促进效应细胞产生炎症因子,进一步加剧炎症反应;JUN蛋白家族是炎症中最重要的转录激活因子,可通过促进巨噬细胞中促炎基因的转录从而增加促炎细胞因子的表达[24];EGFR、CASP3、VEGFA、CTNNB1 和GAPDH基因均参与细胞增殖、凋亡、分化、黏附和迁移等生理过程,在炎症进程中发挥重要的作用[25-27]。
本研究进一步对消炎退热颗粒的关键靶点进行GO 功能和KEGG 通路富集分析,结果发现关键靶点主要富集于炎症信号通路,如人巨细胞病毒(HCMV)通路、MAPK 信号通路、缺氧诱导因子1(HIF-1)信号通路、Toll 样受体(TLR)信号通路和TNF 信号通路等。其中MAPK 信号通路是最常见的炎症信号通路,MAPKs 是丝氨酸/苏氨酸残基的蛋白激酶,是细胞膜表面受体与基因表达的重要信号调节酶[28];HCMV感染可促进患儿TLR4/p38 MAPK 信号通路激活,加重肝细胞炎症反应和损伤,抑制该靶点能产生良好抗炎效果[29];HIF-1α/BNIP3/Beclin-1 通路是线粒体自噬的激活通路,存在于线粒体外膜、细胞质、内质网膜、核膜,是线粒体自噬的重要调控蛋白,激活HIF-1通路能有效降低炎症水平[30]; TLR介导的先天性免疫系统失调是炎症机制的核心参与者,TLR信号转导通路的激活会诱导机体防御的相关基因,包括炎症细胞因子、趋化因子和抗原提呈分子,调节TLR能够平衡机体免疫功能,改善炎症水平[31]。
通过分子对接研究进一步验证发现16 个成分与关键靶点均有良好的亲和力,可能为潜在的活性成分。可视化分析结果显示,各化合物均能够与对应的靶点通过氢键形成稳定结合,预测消炎退热颗粒可能通过多成分、多靶点发挥药效作用。
3.2 含量测定研究本研究建立了UPLC-MS/MS法测定上述网络药理学筛选出的消炎退热颗粒清热抗炎的潜在活性成分。由于甘草次酸、阿魏酸、东莨菪素、紫檀素、大马酮、7-乙酰氧基-2-甲基异黄酮、苯乙基内酰脲、谷氨酰-酪氨酸等成分在样品中含量较低未能检出,因此仅对靛玉红、异甘草素、甘草素、甘草酸、甘草苷、秦皮乙素、咖啡酸、绿原酸8 种成分进行含量测定。
本研究应用超声提取法,考察了提取溶剂[甲醇、70%甲醇、50%甲醇、乙酸乙酯-甲醇(1∶1)、乙酸乙酯]、料液比(1∶1、1∶2、1∶5、1∶10 和1∶15)、超声时间(15、20 、30 min),确定最佳提取条件为料液比1∶10,用甲醇超声提取20 min。在色谱条件优化过程中,分别考察了乙腈-水、甲醇-水、0.1%甲酸乙腈-0.1%甲酸、0.1%甲酸乙腈-0.1%甲酸-5 mmol·L-1甲酸铵和0.1%甲酸乙腈-0.1%甲酸-10 mmol·L-1甲酸铵作为流动相,其中甲醇-水和0.1%甲酸乙腈-0.1%甲酸-10 mmol·L-1甲酸铵作为流动相时,色谱柱压力较大,不适合批量进样;乙腈-水和0.1%甲酸乙腈-0.1%甲酸作为流动相时,靛玉红的峰形拖尾严重;以0.1%甲酸乙腈-0.1%甲酸-5 mmol·L-1甲酸铵作为流动相时,各成分峰形较好。含量测定结果显示,靛玉红、异甘草素、甘草素、甘草酸、甘草苷、秦皮乙素、咖啡酸和绿原酸在各个批次的消炎退热颗粒中均能检出并定量。其中2个厂家的消炎退热颗粒中秦皮乙素的平均含量分别达到218.23 和196.43 μg·g-1,含量远远高于2020 年版《中国药典》中秦皮乙素的规定(每袋不得少于0.3 mg)。同时方差分析结果显示,两个厂家的样品中靛玉红、甘草素、异甘草素、甘草苷和绿原酸的含量有显著性差异。
综上所述,本研究基于网络药理学方法及分子对接技术,发现消炎退热颗粒入血成分中潜在的16 种活性成分及其可能干预的关键靶点和信号通路,建立了UPLC-MS/MS 法测定其中的8 种活性成分的含量,并应用该分析方法对市售16 个批次的消炎退热颗粒进行测定。该方法准确、简便,能够实现对消炎退热颗粒中多成分的定量分析,可为其进一步的机理研究及质量控制提供参考依据。

