化瘀明目方含药血清对高糖诱导的HRMECs 功能紊乱模型血管形成的作用及机制研究
马孝秋,左韬,马贤德,赵磊(. 辽宁中医药大学第二临床学院,辽宁沈阳 0000;.辽宁中医药大学附属第二医院,辽宁沈阳 0000;. 辽宁中医药大学教学实验中心,辽宁沈阳 0000)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最严重的微血管病变之一,是造成糖尿病患者视功能损害和丧失的主要原因。2017 年我国一项横跨6 省的流行病学调查结果显示,在参与研究的13 473 位糖尿病患者中,4 591 人确诊糖尿病视网膜病变,患病率高达34.08%[1-2]。高血糖是影响糖尿病并发症的重要因素之一,持续高血糖状态促使视网膜微血管内皮细胞无序地增殖、迁移,导致正常血管失衡和病理性视网膜新生血管形成(retinal neovascularization,RNV),引起严重的视功能障碍[3-4]。因此,抑制高糖环境下视网膜微血管内皮细胞的功能异常,有益于改善糖尿病视网膜病变。
化瘀明目方是辽宁中医药大学附属第二医院左韬教授在临床诊治眼病过程中探索积累所得,前期临床研究[5]显示化瘀明目方(Huayu Mingmu Recipe,HMR)能够改善眼底状态,减少视网膜出血斑、微血管瘤,具有较好临床疗效。本研究旨在实验探究化瘀明目方对高糖诱导下人视网膜微血管内皮细胞(Human retinal microvascular endothelial cells,HRMECs)血管形成的抑制作用及可能作用机制。
1 材料与方法
1.1 细胞及动物HRMECs(生长代数:P4),购于通派(上海)生物科技有限公司,用ECM 完全培养基(10% FBS+1% ECGS+1% P/S)培养,培养条件为37 ℃、5% CO2,待细胞密度约80%时,加胰酶替代物消化传代,ECM 完全培养基终止消化。传代比例1∶2,取30代内对数生长期细胞开展实验。
SPF 级健康6 周龄雄性Sprague Dawley 大鼠,40 只,体质量180~220 g,购于辽宁长生生物技术股份有限公司,动物质量合格证号:210726221101160082,动物生产许可证号:SCXK(辽)2020-0001。本实验经辽宁中医药大学实验动物伦理委员会同意,实验动物伦理审查编号:21000042022044。
1.2 药物及试剂化瘀明目方组成:生地黄、黄芪、丹参、墨旱莲、生蒲黄、茯苓、牡丹皮、莪术、虎杖、蝉蜕、山楂,配比为2∶2∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶1,颗粒剂由江阴天江药业有限公司提供并鉴定,批号分别为:2111075101、2301090101、2112061101、2112164101、21097274、21102061、 21091961、 210816221、 2204034101、21090191、2201266101。内皮细胞专用培养基(ECM),美国ScienCell 公司,批号:1001;胎牛血清(FBS),乌拉圭Lonsera 公司,批号:S711-001S;胰酶替代物(TrypleEMExpress),美国Gibco 公司,批号:12605-010;磷酸盐缓冲液(PBS),美国HyClone公司,批号:SH30256.01;8.0 μm 孔径聚碳酸酯膜Transwell 小室、Matrigel 基底胶,美国Corning 公司,批号分别为:3422、356234;Anti-FactorⅧ抗体、Anti-CD31 抗体、Anti-CD34 抗体,北京博奥森生物技术有限公司,批号分别为:bs-2974R、bs-0195R、bs-8996R;Anti-VEGFA 抗体、Anti-VEGF Receptor 2 抗体、山羊抗兔IgG/FITC,美国abcam 公司,批号分别为:ab51745、ab39638、ab6717;山羊抗兔IgG/辣根酶标记,北京中杉金桥生物技术有限公司,批号:ZB-2301;Anti-beta Actin 抗体、CCK-8试剂盒、DAPI 染色液、PIPA 裂解液、PMSF、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶快速配制试剂盒、超敏ECL 发光试剂盒,上海碧云天生物技术有限公司,批号分别为:AF5003、C0038、C1005、P0013B、ST506、P0012、P0012AC、P0018S;TritonX-100,北京鼎国昌盛生物技术有限公司,批号:DH351-4;抗荧光衰减封片剂,北京索莱宝科技有限公司,批号:S2100;RNA提取试剂盒、逆转录试剂盒、PCR 试剂,日本TaKaRa 公司,批号分别为:9109、RR047A、RR820A。
1.3 主要仪器371型二氧化碳培养箱,德国Memmert公司;HFsafe-1200LC生物安全柜,上海力申科学仪器有限公司;HSA-2 冷冻水浴恒温振荡器,常州国宇仪器制造有限公司;MDF-U32V 超低温冰箱,日本SANYO公司;L500-A离心机,湘仪离心机仪器公司;CENTRIFUGE C 4-12 高速离心机,法国JOUAN SA 公司;DM2000 荧光倒置生物显微镜,德国Leica公司;Multiskan MK3 酶标仪,赛默飞世尔(上海)仪器有限公司;EPS 200 电泳仪、HE-120 电泳转移槽、4200SF 凝胶成像分析系统,上海天能科技有限公司;ABI StepOne Real-time PCR系统,美国Thermo Fisher Scientific 公司;AL104 精密电子天平,梅特勒-托利多仪器(上海)有限公司。
1.4 含药血清制备SD 大鼠40 只按随机数字表法分为空白对照组,化瘀明目方低、中、高剂量组,每组10只。临床上成人每日服药剂量为2.92 g·kg-1,参照《药理实验方法学》折算方法,大鼠灌胃剂量为成人的6.36倍,得大鼠每日灌胃等效剂量为18.57 g·kg-1。化瘀明目方低、中、高剂量组分别按9.29、18.57、37.14 g·kg-1剂量灌胃化瘀明目方颗粒的蒸馏水冲液;空白对照组予等体积生理盐水灌胃,每只2 mL,连续灌胃7 d,1日2次。末次灌胃1 h后,3%戊巴比妥钠腹腔注射麻醉大鼠,腹主动脉取血,促凝管静置2 h,配平后离心机离心(离心半径14 cm,3 000 r·min-1、10 min),收集上清液,56 ℃水浴灭活30 min,0.22 μm滤器除菌,-20 ℃冰箱储存备用。
1.5 CCK-8 实验
1.5.1CCK-8法检测化瘀明目方含药血清毒性、筛选最佳体积分数 ①空白对照孔:ECM 完全培养基;②正常对照孔:ECM 完全培养基+HRMECs;③实验孔:取化瘀明目方低、中、高剂量含药血清,分别制备含药血清体积分数为5%、10%、15%、20%的ECM 含药血清培养基(含药血清培养基=ECM 完全培养基+含药血清)。ECM 完全培养基制备HRMECs 单细胞悬液,96 孔板接种细胞悬液1×104个/孔,每孔100 μL。待细胞贴壁完全,吸尽培养基,加ECM 不完全培养基饥饿24 h,更换含药血清培养基干预细胞24 h;④24 h 时每孔加10 μL CCK-8 工作液,孵育2 h 后,酶标仪测吸光度(A450 nm)值。每组设3个复孔。
1.5.2CCK-8法检测不同浓度葡萄糖对HRMECs 存活的影响 ①空白对照孔:ECM 完全培养基(自含5.5 mmol·L-1葡萄糖);②正常对照孔:ECM 完全培养基+HRMECs;③实验孔:14.5、19.5、24.5、29.5 mmol·L-1的D-葡萄糖+ECM 完全培养基+HRMECs。HRMECs 按“1.5.1”项下种板后饥饿24 h,按分组条件干预细胞24、48、72 h后,CCK-8法检测。每组设3个复孔。
1.6 正式实验分组根据前两次CCK-8实验结果进行正式实验分组,将HRMECs 分为:①正常对照组(ECM完全培养基+10%空白血清);②甘露醇对照组(19.5 mmol·L-1甘露醇+ECM完全培养基+10%空白血清);③模型组(19.5 mmol·L-1D-葡萄糖+ECM完全培养基+10%空白血清);④化瘀明目方低剂量组(19.5 mmol·L-1D-葡萄糖+ECM完全培养基+10%低剂量含药血清);⑤化瘀明目方中剂量组(19.5 mmol·L-1D-葡萄糖+ECM 完全培养基+10%中剂量含药血清);⑥化瘀明目方高剂量组(19.5 mmol·L-1D-葡萄糖+ECM完全培养基+10%高剂量含药血清)。
1.7 细胞克隆实验取对数生长期HRMECs制备单细胞悬液,以200 个/皿的细胞密度接种于60 mm 培养皿中,每皿5 mL,培养24 h 细胞贴壁后弃原培养基,按分组条件进行干预,培养5 d至肉眼可见细胞克隆时终止培养。PBS清洗3次,4%多聚甲醛室温固定30 min。结晶紫染色20 min,细胞集落计数。每组设3个复孔。
1.8 Transwell 迁移实验无血清ECM 培养基制备HRMECs单细胞悬液,调整细胞悬液浓度为1×105个/mL,向Transwell小室的上室加单细胞悬液200 μL/孔,按分组培养条件不同,向24 孔板内加不同条件培养液700 μL/孔。将小室对应安置到24孔板内,培养箱培养24 h。吸尽小室内培养液,用棉拭子将上室未迁移细胞轻轻擦除。PBS清洗3次,4%多聚甲醛室温固定30 min。结晶紫染色20 min,倒置显微镜下观察采集图像,计算迁移细胞数。每组设3个复孔。
1.9 管腔形成实验实验开始前于4 ℃冰箱内融化Matrigel 基底胶,并且预冷96 孔板和100 μL 枪头。96 孔板每孔加入100 μL 基底胶(操作要求于冰上进行,动作应缓慢以免产生气泡),随后移入37 ℃培养箱固化30 min,按照分组将HRMECs 与不同条件培养液一起接种到凝固的基底胶上,每孔50 μL(3×104个/孔)。培养箱培养24 h 后于倒置显微镜下观察采集图像,使用ImageJ 软件“血管生成分析”工具评估管腔结构长度。每组设3个复孔。
1.10 免疫荧光法检测Factor Ⅷ、CD31、CD34、VEGFA、VEGFR2 阳性表达取对数生长期HRMECs 接种细胞爬片,当载玻片细胞生长至70%时,各组细胞按分组条件分别处理24 h,4%多聚甲醛室温固定30 min,0.1% TritonX-100 室温渗透20 min,37 ℃恒温水浴箱内5% BSA 封闭1 h。放入湿盒内并加Factor Ⅷ(1∶200)、CD31(1∶400)、CD34(1∶200)、VEGFA(1∶200)、VEGFR2(1∶200)抗体4 ℃冰箱过夜;次日PBS清洗6次,滴加荧光标记的山羊抗兔IgG/FITC,37 ℃孵育1 h,PBS清洗6次;10 μg·mL-1DAPI避光染色细胞核20 min,PBS清洗3次;抗荧光衰减封片剂封片。暗室内荧光显微镜观察Factor Ⅷ、 CD31、 CD34、 VEGFA、VEGFR2在各组细胞中的表达和分布情况。
1.11 Western Blot 法检测VEGFA、VEGFR2 蛋白表达收集各组培养液干预24 h后的HRMECs,冰浴中使用裂解缓冲液(蛋白酶抑制剂PMSF∶细胞裂解液RIPA=1∶100)充分裂解细胞60 min 提取细胞蛋白,离心机离心(离心半径10 cm,12 000 r·min-1,10 min,4 ℃)提取上清;BCA 试剂盒蛋白定量,蛋白变性,SDS 聚丙烯酰胺凝胶电泳(SDS-PAGE)分离目标蛋白,转印至PVDF 膜;5% BSA 摇床封闭1 h;分别加β-actin(1∶2 000)、VEGFA(1∶2 000)、VEGFR2(1∶1 000),放入4 ℃冰箱孵育过夜;次日TBST 缓冲液洗膜6 次,5 min/次;加山羊抗兔IgG/辣根酶标记(1∶2 000)室温孵育2 h,TBST 缓冲液洗膜6 次,5 min/次;使用ECL 超敏发光液显影蛋白条带,采集图像,ImageJ 软件半定量分析条带灰度,以β-actin 为内参,计算各组目的蛋白的相对表达量。
1.12 RT-PCR 法检测Factor Ⅷ、CD31、CD34、VEGFA、VEGFR2 mRNA 表达收集各组培养液干预24 h 后的HRMECs,依据Trizol 说明书提取细胞总RNA,计算RNA 浓度,参照逆转录试剂盒说明书配制逆转录反应体系,PCR 仪37 ℃孵育15 min、85 ℃反应5 s,逆转录合成cDNA;建立PCR 反应体系,扩增条件:95 ℃预变性30 s,95 ℃PCR 反应5 s,60 ℃退火34 s,共循环40 次。最后熔解条件:95 ℃、15 s,60 ℃、60 s,95 ℃、15 s,完成扩增。以β-actin 为内参,2-△△CT法计算mRNA 相对表达水平,引物序列见表1。引物由大连TaKaRa公司合成。

表1 引物序列Table 1 Primer sequences
1.13 统计学处理方法数据分析使用SPSS 26.0 软件,对样本进行正态性检验,服从正态分布者用均数±标准差(±s)进行描述。多组间差异比较,对样本进行方差齐性检验,方差齐采用单因素方差分析(单因素ANOVA 检验),并用Bonferroni 法进行事后检验。P<0.05为差异有统计学意义。
2 结果
2.1 CCK-8 实验结果
2.1.1不同体积分数化瘀明目方含药血清对HRMECs毒性的影响 结果见表2。含药血清体积分数5%组与10%组的各组间差异均无统计学意义(P>0.05);15%组与20%组的抑制系数均明显大于10%组(P<0.05),差异有统计学意义,说明对细胞生存活性有较大影响。故本实验选取含药血清10%体积分数为干预措施。
表2 不同体积分数含药血清对HRMECs 毒性的影响(n=3,±s)Table 2 Effects of different volume fractions of drug-containing serum on the toxicity of HRMECs(n=3,±s)
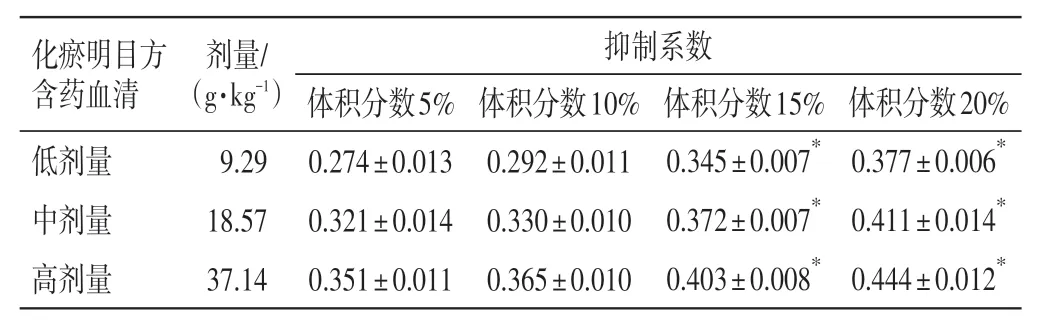
表2 不同体积分数含药血清对HRMECs 毒性的影响(n=3,±s)Table 2 Effects of different volume fractions of drug-containing serum on the toxicity of HRMECs(n=3,±s)
注:细胞抑制率=[(正常对照孔-实验孔)/(正常对照孔-空白对照孔)]×100%;抑制系数=抑制率/100%。与同剂量体积分数10%组比,*P<0.05
化瘀明目方含药血清低剂量中剂量高剂量剂量/(g·kg-1)9.29 18.57 37.14抑制系数体积分数20%0.377±0.006*0.411±0.014*0.444±0.012*体积分数5%0.274±0.013 0.321±0.014 0.351±0.011体积分数10%0.292±0.011 0.330±0.010 0.365±0.010体积分数15%0.345±0.007*0.372±0.007*0.403±0.008*
2.1.2不同糖浓度对HRMECs 存活的影响 见表3。各时间段培养基内总体糖浓度≤25 mmol·L-1时,HRMECs 呈促生长趋势(P<0.05);随着糖浓度的增加,HRMECs 出现生长抑制(P<0.05),差异均有统计学意义。故本实验选取25 mmol·L-1总体糖浓度干预HRMECs,以复制高糖下HRMECs功能紊乱模型。
表3 不同糖浓度对HRMECs 存活的影响(n=3,±s)Table 3 Effects of different sugar concentrations on the survival of HRMECs(n=3,±s)
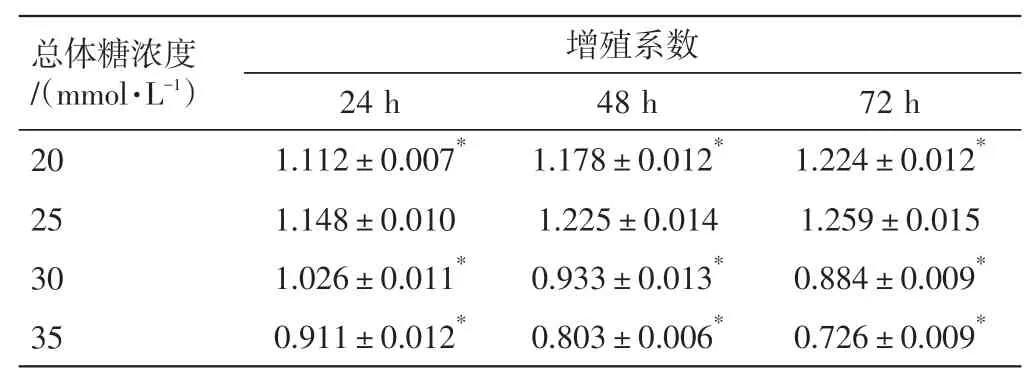
表3 不同糖浓度对HRMECs 存活的影响(n=3,±s)Table 3 Effects of different sugar concentrations on the survival of HRMECs(n=3,±s)
注:细胞增殖率=[(实验孔-正常对照孔)/(正常对照孔-空白对照孔)]×100%;增殖系数=增殖率/100%。与25 mmol·L-1组比,*P<0.05
总体糖浓度/(mmol·L-1)20 25 30 35增殖系数72 h 1.224±0.012*1.259±0.015 0.884±0.009*0.726±0.009*24 h 1.112±0.007*1.148±0.010 1.026±0.011*0.911±0.012*48 h 1.178±0.012*1.225±0.014 0.933±0.013*0.803±0.006*
2.2 化瘀明目方含药血清对HRMECs 克隆形成能力的影响结果见图1、表4。甘露醇对照组与正常对照组细胞集落数的差异无统计学意义(P>0.05);与正常对照组比较,模型组细胞集落数明显增加(P<0.01)。与模型组比较,化瘀明目方低、中、高剂量组细胞集落数明显减少(P<0.05,P<0.01)。
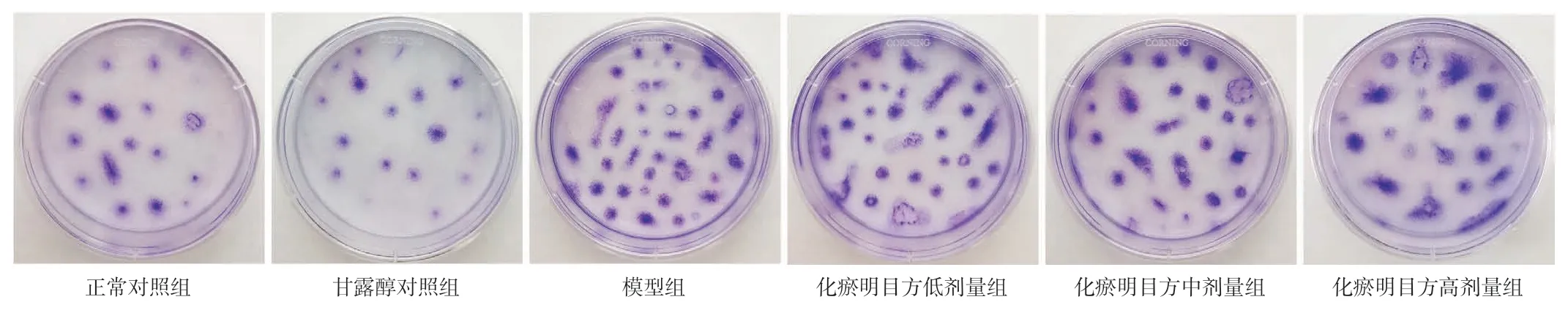
图1 各组HRMECs 克隆形成情况Figure 1 Clonogenic experiment result of HRMECs of each group
表4 化瘀明目方含药血清对HRMECs 克隆形成能力的影响(n=3,±s)Table 4 Effects of Huayu Mingmu Recipe(HMR)-containing serum on the colony formation ability of HRMECs(n=3,±s)
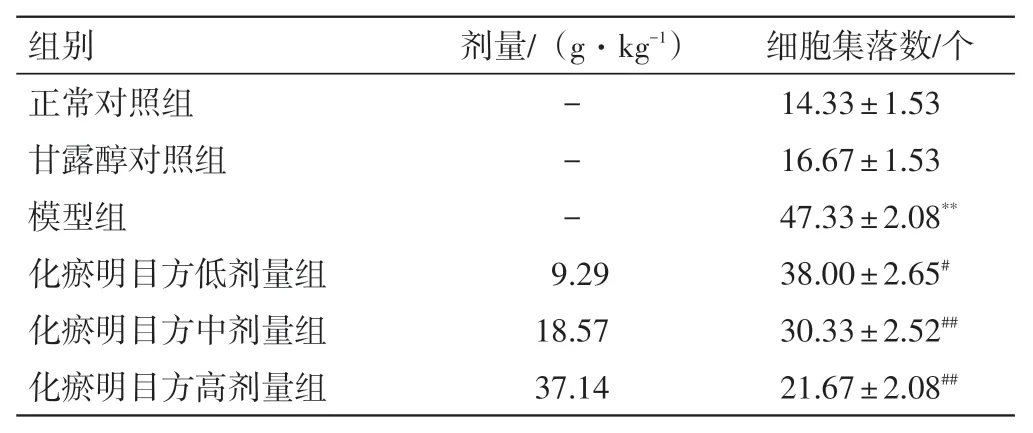
表4 化瘀明目方含药血清对HRMECs 克隆形成能力的影响(n=3,±s)Table 4 Effects of Huayu Mingmu Recipe(HMR)-containing serum on the colony formation ability of HRMECs(n=3,±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
细胞集落数/个14.33±1.53 16.67±1.53 47.33±2.08**38.00±2.65#30.33±2.52##21.67±2.08##组别正常对照组甘露醇对照组模型组化瘀明目方低剂量组化瘀明目方中剂量组化瘀明目方高剂量组剂量/(g·kg-1)---9.29 18.57 37.14
2.3 化瘀明目方含药血清对HRMECs 迁移能力的影响结果见图2、表5。甘露醇对照组与正常对照组迁移细胞数的差异无统计学意义(P>0.05);与正常对照组比较,模型组迁移细胞数明显增多(P<0.01)。与模型组比较,化瘀明目方低、中、高剂量组迁移细胞数明显减少(P<0.01)
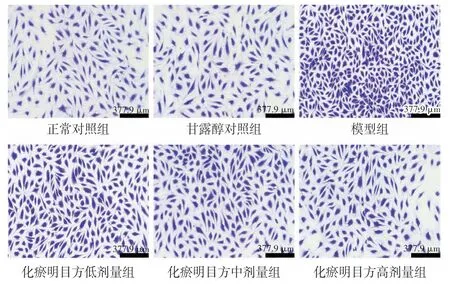
图2 HRMECs 迁移实验结果(×100)Figure 2 Results of HRMECs transwell experiment(×100)
表5 化瘀明目方含药血清对HRMECs 迁移能力的影响(n=3,±s)Table 5 Effects of HMR-containing serum on the migration ability of HRMECs(n=3,±s)
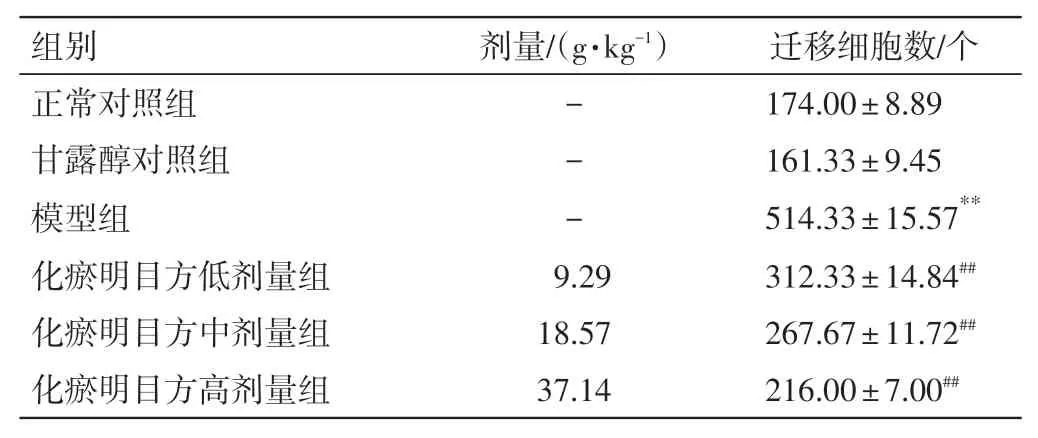
表5 化瘀明目方含药血清对HRMECs 迁移能力的影响(n=3,±s)Table 5 Effects of HMR-containing serum on the migration ability of HRMECs(n=3,±s)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
迁移细胞数/个174.00±8.89 161.33±9.45 514.33±15.57**312.33±14.84##267.67±11.72##216.00±7.00##组别正常对照组甘露醇对照组模型组化瘀明目方低剂量组化瘀明目方中剂量组化瘀明目方高剂量组剂量/(g·kg-1)---9.29 18.57 37.14
2.4 化瘀明目方含药血清对HRMECs 管腔形成能力的影响结果见图3、表6。甘露醇对照组与正常对照组血管分支节点、管腔总长度、血管形成数的差异无统计学意义(P>0.05);与正常对照组比较,模型组血管分支节点、管腔总长度、血管形成数均明显增加(P<0.01)。与模型组比较,化瘀明目方低、中、高剂量组的血管分支数、管腔总长度、血管形成数均明显减少(P<0.05,P<0.01)。
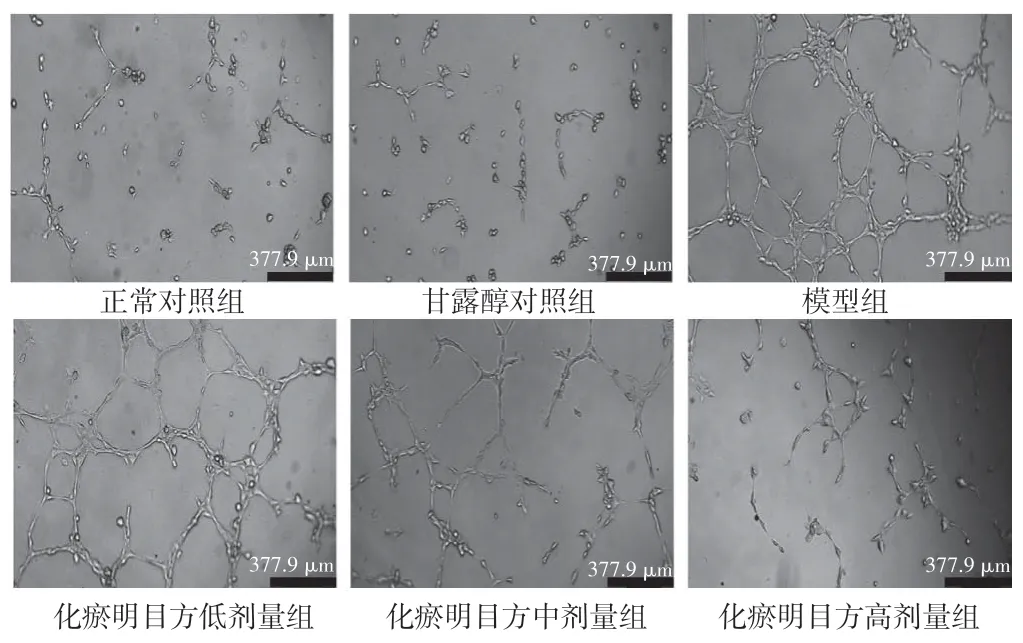
图3 HRMECs 管腔形成结果(×50)Figure 3 Results of HRMECs Angiogenesis(×50)
表6 化瘀明目方含药血清对HRMECs 管腔形成能力的影响(n=3,±s)Table 6 Effects of HMR-containing serum on the tube formation ability of HRMECs(n=3,±s)
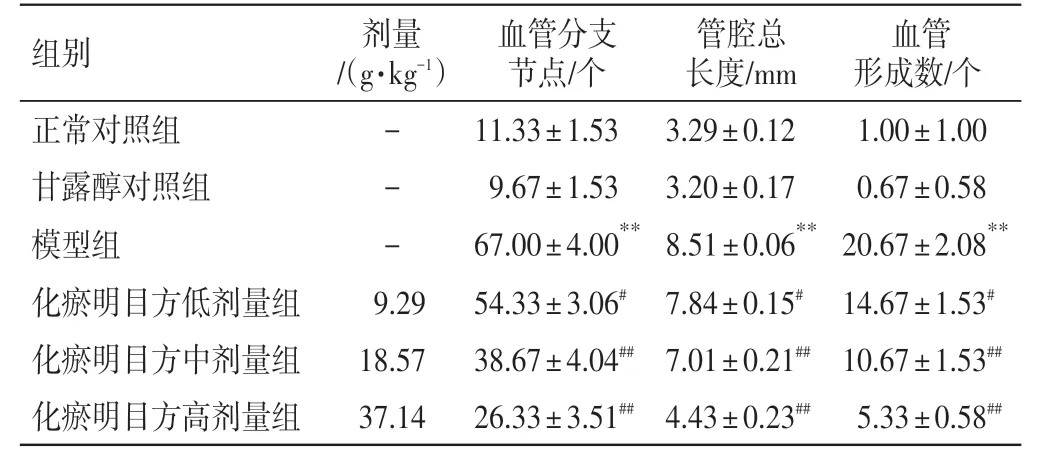
表6 化瘀明目方含药血清对HRMECs 管腔形成能力的影响(n=3,±s)Table 6 Effects of HMR-containing serum on the tube formation ability of HRMECs(n=3,±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
血管形成数/个1.00±1.00 0.67±0.58 20.67±2.08**14.67±1.53#10.67±1.53##5.33±0.58##组别正常对照组甘露醇对照组模型组化瘀明目方低剂量组化瘀明目方中剂量组化瘀明目方高剂量组剂量/(g·kg-1)---9.29 18.57 37.14血管分支节点/个11.33±1.53 9.67±1.53 67.00±4.00**54.33±3.06#38.67±4.04##26.33±3.51##管腔总长度/mm 3.29±0.12 3.20±0.17 8.51±0.06**7.84±0.15#7.01±0.21##4.43±0.23##
2.5 化瘀明目方含药血清对FactorⅧ、CD31、CD34、VEGFA、VEGFR2 阳性细胞数的影响结果见图4、表7。甘露醇对照组与正常对照组FactorⅧ、CD31、CD34、VEGFA 及VEGFR2 阳性细胞数的差异均无统计学意义(P>0.05);与正常对照组比较,模型组FactorⅧ、CD31、CD34、VEGFA 及VEGFR2 的阳性细胞数均明显增加(P<0.01)。与模型组比较,化瘀明目方低、中、高剂量组的Factor Ⅷ、CD31、CD34、VEGFA 及VEGFR2 阳性细胞数均明显减少(P<0.05,P<0.01)。

图4 HRMECs 免疫荧光染色结果(×100)Figure 4 Results of immunofluorescence staining of HRMECs(×100)
表7 化瘀明目方含药血清对血管生成相关因子及VEGFA、VEGFR2 阳性细胞数表达的影响(n=6,±s)Table 7 Effects of HMR-containing serum on the expressions of the angiogenesis related factors,VEGFA and VEGFR2 positive cells(n=6,±s)
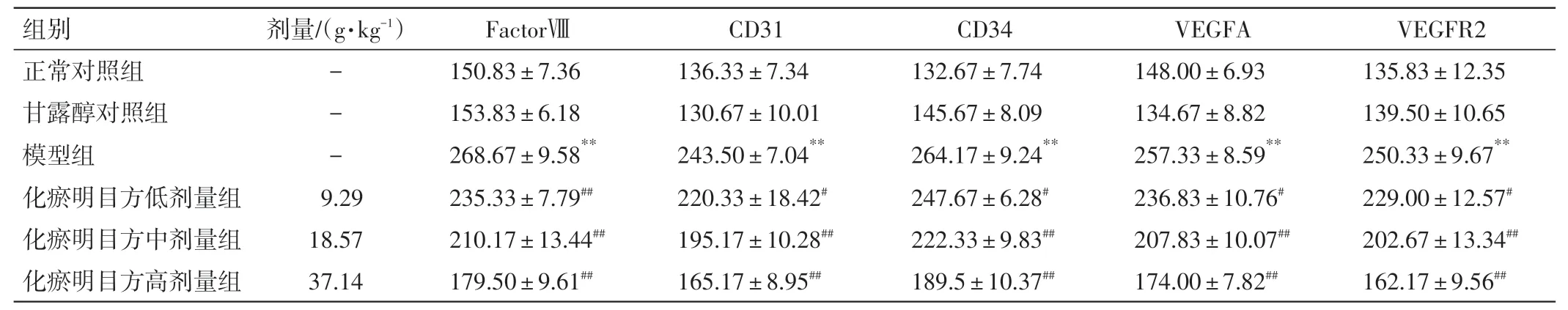
表7 化瘀明目方含药血清对血管生成相关因子及VEGFA、VEGFR2 阳性细胞数表达的影响(n=6,±s)Table 7 Effects of HMR-containing serum on the expressions of the angiogenesis related factors,VEGFA and VEGFR2 positive cells(n=6,±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
VEGFR2 135.83±12.35 139.50±10.65 250.33±9.67**229.00±12.57#202.67±13.34##162.17±9.56##组别正常对照组甘露醇对照组模型组化瘀明目方低剂量组化瘀明目方中剂量组化瘀明目方高剂量组剂量/(g·kg-1)---9.29 18.57 37.14 FactorⅧ150.83±7.36 153.83±6.18 268.67±9.58**235.33±7.79##210.17±13.44##179.50±9.61##CD31 136.33±7.34 130.67±10.01 243.50±7.04**220.33±18.42#195.17±10.28##165.17±8.95##CD34 132.67±7.74 145.67±8.09 264.17±9.24**247.67±6.28#222.33±9.83##189.5±10.37##VEGFA 148.00±6.93 134.67±8.82 257.33±8.59**236.83±10.76#207.83±10.07##174.00±7.82##
2.6 化瘀明目方含药血清对VEGFA、VEGFR2 蛋白表达水平的影响结果见图5、表8。甘露醇对照组与正常对照组细胞VEGFA、VEGFR2 蛋白相对表达量的差异均无统计学意义(P>0.05);与正常对照组比较,模型组VEGFA、VEGFR2 蛋白相对表达量明显升高(P<0.01)。与模型组比较,化瘀明目方低、中、高剂量组VEGFA、VEGFR2 蛋白相对表达量均明显降低(P<0.01)。

图5 HRMECs 免疫印迹实验结果Figure 5 Results of Western Blot of HRMECs
表8 化瘀明目方含药血清对VEGFA、VEGFR2 蛋白相对表达水平的影响(n=6,±s)Table 8 Effects of HMR containing serum on the relative protein expression of VEGFA and VEGFR2(n=6,±s)
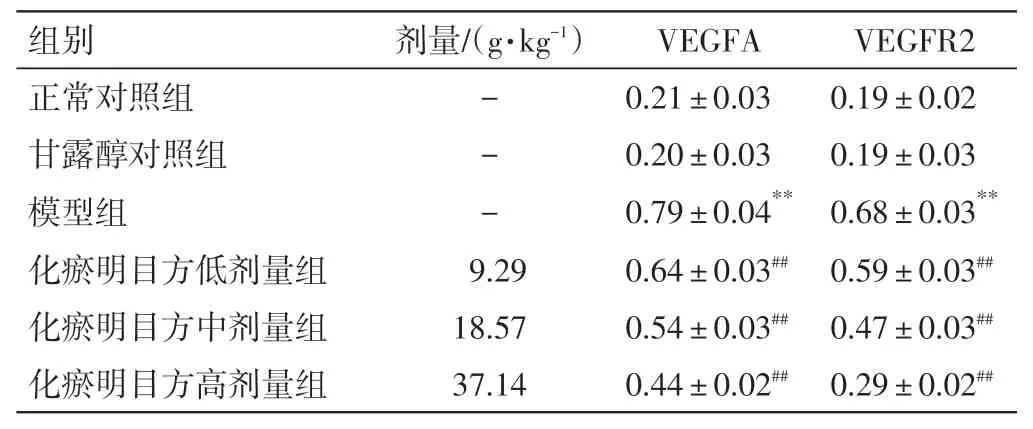
表8 化瘀明目方含药血清对VEGFA、VEGFR2 蛋白相对表达水平的影响(n=6,±s)Table 8 Effects of HMR containing serum on the relative protein expression of VEGFA and VEGFR2(n=6,±s)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
剂量/(g·kg-1)VEGFR2 0.19±0.02 0.19±0.03 0.68±0.03**0.59±0.03##0.47±0.03##0.29±0.02##组别正常对照组甘露醇对照组模型组化瘀明目方低剂量组化瘀明目方中剂量组化瘀明目方高剂量组---9.29 18.57 37.14 VEGFA 0.21±0.03 0.20±0.03 0.79±0.04**0.64±0.03##0.54±0.03##0.44±0.02##
2.7 化瘀明目方含药血清对FactorⅧ、CD31、CD34、VEGFA、VEGFR2 mRNA 表达水平的影响结果见图6、表9。甘露醇对照组与正常对照组FactorⅧ、CD31、CD34、VEGFA及VEGFR2 mRNA表达水平的差异均无统计学意义(P>0.05);与正常对照组比较,模型组Factor Ⅷ、CD31、CD34、VEGFA 及VEGFR2 mRNA 表达水平均明显增加(P<0.01)。与模型组比较,化瘀明目方低、中、高剂量组FactorⅧ、CD31、CD34、VEGFA及VEGFR2 mRNA表达水平均明显降低(P<0.05,P<0.01)。
图6 各基因溶解曲线及扩增曲线Figure 6 Dissolution and amplification curves of each gene
表9 化瘀明目方含药血清对血管生成相关因子及VEGFA、VEGFR2 mRNA 表达水平的影响(n=6,±s)Table 9 Effects of HMR-containing serum on the mRNA expressions of angiogenesis related factors,VEGFA and VEGFR2(n=6,±s)
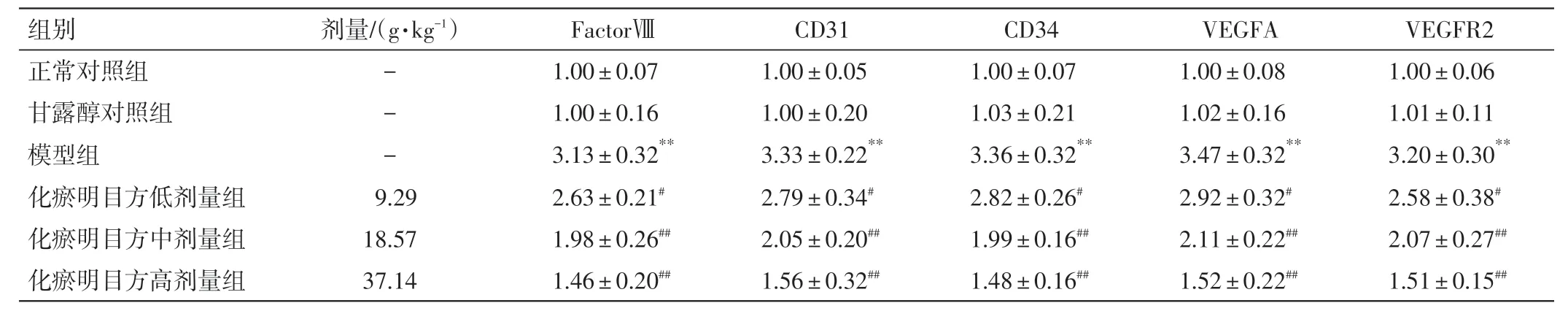
表9 化瘀明目方含药血清对血管生成相关因子及VEGFA、VEGFR2 mRNA 表达水平的影响(n=6,±s)Table 9 Effects of HMR-containing serum on the mRNA expressions of angiogenesis related factors,VEGFA and VEGFR2(n=6,±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
VEGFR2 1.00±0.06 1.01±0.11 3.20±0.30**2.58±0.38#2.07±0.27##1.51±0.15##组别正常对照组甘露醇对照组模型组化瘀明目方低剂量组化瘀明目方中剂量组化瘀明目方高剂量组剂量/(g·kg-1)---9.29 18.57 37.14 FactorⅧ1.00±0.07 1.00±0.16 3.13±0.32**2.63±0.21#1.98±0.26##1.46±0.20##CD31 1.00±0.05 1.00±0.20 3.33±0.22**2.79±0.34#2.05±0.20##1.56±0.32##CD34 1.00±0.07 1.03±0.21 3.36±0.32**2.82±0.26#1.99±0.16##1.48±0.16##VEGFA 1.00±0.08 1.02±0.16 3.47±0.32**2.92±0.32#2.11±0.22##1.52±0.22##
3 讨论
糖尿病视网膜病变是由糖尿病导致的机体代谢紊乱从而引发的视网膜血管和神经的损伤,是导致成年工作人口可预防性失明的主要原因。一个纳入了59 项大样本人群调查研究的荟萃分析显示全球糖尿病患者中糖尿病视网膜病变患病率22.27% ,截止到2045 年,全球成人的糖尿病视网膜病变患病人数将由2020 年的1.031 2 亿上升至1.605 亿,随着全球糖尿病发病率的逐年攀升,糖尿病视网膜病变现已成为世界范围的公共卫生问题[6-7]。根据糖尿病视网膜病变程度,分为非增殖性糖尿病视网膜病变((nonproliferative diabetic retinopathy,NPDR)和增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)两大类,新生血管是PDR 的标志性病理改变。视网膜毛细血管主要由血管内皮细胞和周细胞组成,二者与包绕在外的Müller 细胞共同构成了血-视网膜内屏障(inner blood-retinal barrier,iBRB),糖尿病视网膜病变病理过程中,持续高血糖引起周细胞选择性丢失,iBRB 受损,导致内皮细胞增生,基底膜增厚,进而引发管腔狭窄和血流动力学改变,最终促使视网膜缺血、缺氧和新生血管形成等糖尿病视网膜病变后期特征改变[8-9]。
祖国医学认为糖尿病视网膜病变属于“暴盲”“视瞻昏渺”等疾病范畴,主要病机为气阴两虚夹瘀。化瘀明目方是本研究组左韬教授在临床诊治眼病过程中探索积累所得,方中生地黄、黄芪为君;丹参、墨旱莲、蒲黄、丹皮、茯苓为臣;莪术、虎杖、蝉蜕为佐;山楂为使;全方共奏益气养阴、化瘀明目之效。现代药理学研究表明生地黄活性成分多糖能够改善胰岛β 细胞功能、调节糖代谢紊乱[10];黄芪甲苷能够保护糖尿病血管内皮细胞改善糖尿病视网膜病变,抑制高糖条件下Müller细胞的VEGF生成[11-13];丹参能改善糖尿病血管内皮细胞功能、降低血管阻塞风险,可用作治疗糖尿病血管病的潜在辅助药物[14];丹参酮ⅡA作为丹参脂溶性活性成分代表可以抗血管生成,改善糖尿病大鼠视网膜的形态学性能,抑制糖尿病视网膜病变[15];墨旱莲石油醚提取物可以降低糖尿病大鼠血糖、血脂含量[16];蒲黄提取物能够改善糖尿病视网膜组织病变,下调血管内皮生长因子(vascular endothelial growth factor,VEGF)、VEGFR2、Ang-1 和b-FGF 表达,改善糖尿病视网膜病变[17-18];丹皮的主要活性成分丹皮酚及其他活性成分均具有降糖作用,丹皮酚可保护血管内皮细胞,对糖尿病并发症也有所改善[19];茯苓胞外多糖能促进肝糖原合成,加快葡萄糖消耗,还可明显抑制α-葡萄糖苷酶活性,与其它药配伍可明显降低空腹血糖,是一种潜在的天然降糖药[20-22]。
FactorⅧ、CD31、CD34 是血管内皮细胞特异性标记物,可用以衡量血管新生,其中FactorⅧ因子是血管内皮细胞鉴定的金指标[23-24],CD34 是主导内皮依赖性血管形成的重要因子。研究[25-27]表明FactorⅧ与CD34联合可区分新生血管的活跃度,CD31具有调控内皮细胞迁移、参与构建新生血管等功能,是微血管形成的良好标记物。相关实验研究[28]表明糖尿病小鼠视网膜CD31阳性微血管数较正常小鼠增多。本研究结果显示25.0 mmol·L-1高糖能够刺激HRMECs的FactorⅧ、CD31、CD34 蛋白及mRNA 表达水平升高,化瘀明目方含药血清对高糖刺激下血管生成相关细胞因子的异常表达具有抑制作用,且呈现出剂量依赖性。
VEGF 具有诱导特性和强渗透性,能够特异性刺激血管内皮细胞增生,增加血管通透性,促进血管新生,其家族成员VEGFA 被认为是PDR诊断及治疗的新靶点[29-30]。VEGFR2 是VEGF 在改善血管通透性、促血管生成过程中的主要介质,VEGFA 与VEGFR2 特异性结合能够启动VEGFA/VEGFR2 信号通路,促进血管内皮细胞的增殖、迁移,加快糖尿病视网膜病变进程[31]。本研究于体外成功复制了高糖下HRMECs 功能紊乱模型模拟糖尿病视网膜病变病理环境,这与文哲瑶、李宏丽、石颖等[32-34]的研究结果相一致。本研究结果显示25.0 mmol·L-1高糖能够促进HRMECs 细胞VEGFA、VEGFR2 蛋白及mRNA表达水平升高,促进HRMECs 增殖、迁移及管腔形成,化瘀明目方含药血清对此具有抑制作用,且呈现出剂量依赖性。本研究使用与高糖同等浓度的甘露醇作为对照,各项实验结果与空白对照组差异均无统计学意义,排除了高浓度葡萄糖的渗透压因素。
综上,本研究显示,化瘀明目方含药血清能够抑制高糖诱导的HRMECs 的增殖、迁移和管腔形成,最终预防或减少视网膜新生血管的形成,延缓糖尿病视网膜病变病程进展,其机制可能与VEGFA/VEGFR2信号通路有关。今后将继续深入探索下游信号通路及相关靶点,完善化瘀明目方在防治糖尿病视网膜病变中的作用机制,以期为临床治疗提供理论依据。

