泡核桃青果贮藏期间生理指标响应
梁 美,王纪辉,胡伯凯,刘亚娜,耿阳阳,张时馨,曾亚军,何佳丽,杨 光
(1.贵州省核桃研究所,贵州 贵阳 550005)(2.贵州省林业科学研究院,贵州 贵阳 550005)(3.贵州阳光食品有限公司,贵州 毕节 551600)
核桃(Juglans regia L.)是胡桃科、核桃属的植物,其核仁内含有多种营养物质[1],其中以人体所必需的不饱和脂肪酸[2-3]、六大营养素[4]最为丰富. 核桃通常进入市场的方式主要以带壳或去壳的干果为主[5-6],但核桃采摘后对其进行干燥的过程会引起核仁中部分营养物质因高温氧化而产生劣变[7]. 近年以来,鲜食核桃因未经干燥,避免了在干燥过程中的营养成分流失[8],加之鲜食核桃香甜的口感[9]、独特的风味而备受推崇[10],目前在我国的核桃主要产区已形成了一定规模的消费市场[11]. 泡核桃为贵州本地的优良农家品种,具有一定的抗病和耐湿热性,在贵州本地种植范围较广,市场推崇度较高,尤以贵州省赫章县核桃市场认可度较高. 此外,贵州地区因其独特的地理环境和气候造就了贵州当地鲜食泡核桃特有的香甜口感,在西南地区备受欢迎,尤其是在中高档餐厅作为一道独特的美味佳肴很受消费者喜爱. 然而鲜食核桃水分含量较高,冷藏虽然可抑制部分酶的活性,但鲜食核桃的呼吸作用仍在进行[12]. 因此,了解和掌握鲜食核桃冷藏过程中的各生理指标的响应变化,对于预测鲜食核桃冷藏过程中的品质变化至关重要[13-14]. 所以对采后泡核桃青果冷藏过程中的生理指标响应变化进行探究十分必要,也可以为民间泡核桃青果较为基本的贮藏保鲜提供数据参考[15-16]. 鉴于此,本研究以贵州本地乡间泡核桃青果为试材,跟踪分析泡核桃青果在低温自然裸露环境下的氧化状态,探究泡核桃青果在3~4 ℃ 冷藏过程中的果实生理响应变化,基于相关性揭示各生理生化指标间的协同和拮抗作用,依据主成分分析较为科学合理地阐释各生理生化指标与泡核桃青果品质的相关密切程度.
1 材料与方法
1.1 实验材料
以核桃青果皮颜色略黄且尚未开裂为标准进行采收,泡核桃青果采自贵州省赫章县财神镇某农家果园,约九成熟,选择大小较为一致、青皮无损伤、未褐变及无病虫害的果实. 采后立即将核桃青果运至贵州省核桃研究所冷库中降温备用.
1.2 主要仪器与设备
L5S型紫外可见分光光度计(上海仪电分析仪器有限公司);3-18R台式高速冷冻离心机(湖南可成仪器设备有限公司);多功能酶标仪(BIOTEK).
1.3 实验方法
1.3.1 实验设计
以贮藏温度3~4 ℃、相对湿度85%~90%进行核桃青果贮藏实验. 每次取10个核桃青果,取出核仁装入自封袋置于-80 ℃超低温冰箱中保存样品备用,定期对核桃青果的生理指标进行分析测定.
1.3.2 指标测定
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、脂氧合酶(LOX)、多酚氧化酶(PPO)活性测定及丙二醛(MDA)、可溶性蛋白、还原糖、VE、类黄酮、植物总酚(TP)含量测定均采用试剂盒(购自苏州科铭生物技术有限公司). 每个指标值进行3次生物学重复,取其平均值.
1.4 数据分析
以Excel 2007进行数据处理与整理,通过Origin 9.1进行图形绘制,以SPSS19.0软件对所得的试验数据进行Duncan多重比较,以SPSS19.0软件中的分析-降维-因子分析进行主成分分析.
2 结果与分析
2.1 冷藏期间核桃青果超氧化物歧化酶(SOD)和过氧化物酶(POD)活性变化
由图1可知,随着贮藏时间的延长SOD活性呈现先升高又逐渐下降的趋势变化. 在10 d时SOD活性达到较高为[(858.38±27.41)U/g 鲜重],70 d时SOD活性较低仅为[(594.44±7.52)U/g 鲜重]. 0~10 d期间SOD活性升高,10~70 d期间SOD活性逐渐降低,在10~30 d时SOD活性下降幅度达10.51%(P<0.05). 在30~40 d时SOD活性下降幅度较大,降低26.47%(P<0.05). 在40~70 d时SOD活性下降幅度较为不明显,降低3.32%(P>0.05).

图1 冷藏期间超氧化物歧化酶(SOD)和过氧化物酶(POD)活性变化
由图1可知,随着贮藏时间延长POD活性整体上呈现先升高后逐渐下降趋势变化. 在10 d时POD活性达到较高为[(142.70±4.29)U/g 鲜重],0 d时POD活性较低仅为[(92.65±1.50)U/g 鲜重]. 0~10 d和20~30 d期间POD活性升高,POD活性增加幅度分别为54.02%(P<0.05)、5.89%(P>0.05). 10~20 d和30~70 d期间POD活性逐渐降低,POD活性下降幅度分别为10.12%(P<0.05)、31.32%(P<0.05).
2.2 冷藏期间核桃青果过氧化氢酶(CAT)和脂氧合酶(LOX)活性变化
由图2可知,随着贮藏时间的延长CAT活性呈现“W”的趋势变化. 在40 d时CAT活性达到较高为[(809.12±43.20)nmol·(min·g)-1鲜重],20 d时CAT活性较低为[(306.56±11.80)nmol·(min·g)-1鲜重]. 0~30 d和40~55 d期间CAT活性下降;30~40 d和55~70 d时CAT活性升高. 在0~30 d时CAT活性下降幅度达73.57%(P<0.05). 在40~55 d时CAT活性下降幅度较大,降低77.00%(P<0.05). 在30~40 d时CAT活性升高幅度较大,增加159.17%(P<0.05). 在55~70 d时CAT活性升高19.20%(P<0.05).

图2 冷藏期间过氧化氢酶(CAT)和脂氧合酶(LOX)活性变化
由图2可知,随着贮藏时间的延长LOX活性呈现类似“W”的趋势变化. 在20 d时LOX活性达到较高为[(161.74±4.05)U/g 鲜重],10 d时LOX活性较低为[(92.23±5.50)U/g 鲜重]. 0~10 d和20~40 d、55~70 d期间LOX活性下降;10~20 d和40~55 d期间LOX活性升高. 在0~10 d时LOX活性下降幅度较大,降幅达69.90%(P<0.05). 在20~40 d时LOX活性降低62.62%(P<0.05). 贮藏时间在55~70 d期间时LOX活性降低6.32%(P>0.05). 在10~20 d时LOX活性升高幅度较大,为75.37%(P<0.05). 在40~55 d时LOX活性升高35.00%(P<0.05).
2.3 冷藏期间核桃青果丙二醛(MDA)和可溶性蛋白(SP)含量变化
由图3可知,随着贮藏时间的延长MDA含量呈现逐渐增加的趋势变化. 在0~20 d时MDA含量增加速率较慢,20 d时的MDA含量较0 d增加8.11%(P>0.05);20~30 d时MDA含量增加速率较快,30 d时的MDA含量较20 d增加13.21%(P<0.05). 30~55 d时MDA含量增加速率较慢,55 d时的MDA含量较30 d增加4.18%(P>0.05);55~70 d时MDA含量增加速率较快,70 d时的MDA含量较55 d增加5.53%(P<0.05).

图3 冷藏期间丙二醛(MDA)和可溶性蛋白(SP)含量变化
由图3可知,随着贮藏时间的延长SP含量表现为先下降又逐渐增加的趋势变化. 0~10 d时SP含量下降,0 d时的SP含量较10 d降低14.62%(P<0.05);10~30 d时SP含量增加速率较快,30 d时的SP含量较10 d、20 d时分别增加28.05%、11.02%,20 d时的SP含量较10 d增加15.34%,此时10 d、20 d、30 d时的SP含量两两之间均达到显著性差异水平. 30~55 d时SP含量增加速率较小,55 d时的SP含量较 30 d 增加2.69%,此时30 d、40 d、55 d时的SP含量差异性均不显著(P>0.05);55~70 d时SP含量增加速率较快,70 d时的SP含量较55 d增加24.27%(P<0.05).
2.4 冷藏期间核桃青果还原糖(RS)和VE含量变化
由图4可知,随着贮藏时间的延长RS含量表现为先增加又逐渐下降的趋势变化. 在低温贮藏期为10 d时的RS含量较高为[(69.39±2.34)mg/g 鲜重],70 d时的RS含量较低为[(50.93±0.78)mg/g 鲜重]. 0~10 d时RS含量升高,10 d时的RS含量较0 d增加9.45%(P<0.05). 在10~70 d时RS含量逐渐下降,其中在10~20 d时RS含量下降速率较快,10 d时的RS含量较20 d降低13.53%(P<0.05);20~40 d 时RS含量下降速率较小,20 d时的RS含量较40 d降低6.61%(P<0.05);40~70 d时RS含量下降速率也较为缓慢,40 d时的RS含量较70 d降低12.57%(P<0.05).
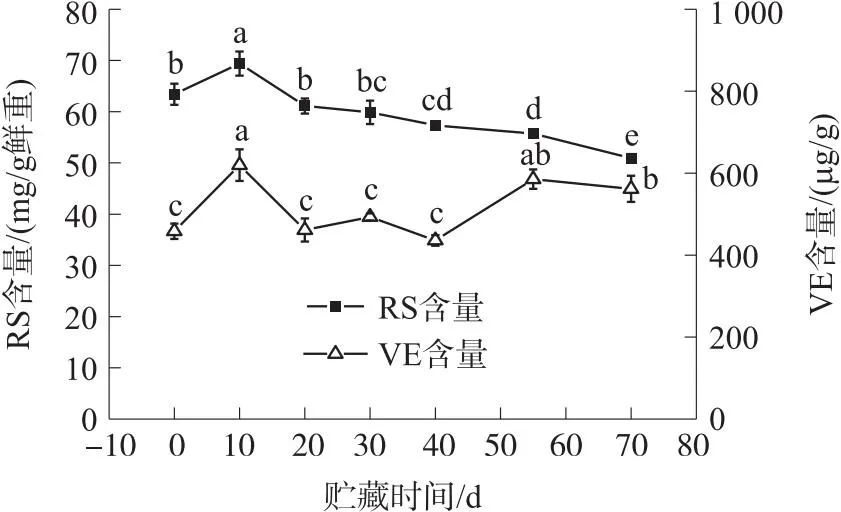
图4 冷藏期间还原糖(RS)和VE含量变化
由图4可知,随着贮藏时间的延长VE含量呈波浪形的趋势变化. 在低温贮藏期为10 d时的VE含量较高为[(619.47±38.46)μg/g],40 d时的VE含量较低为[(435.84±12.97)μg/g];0~10 d、20~30 d、40~55 d时VE含量升高,10 d时的VE含量较0 d增加35.20%(P<0.05),30 d时的VE含量较20 d增加6.95%(P>0.05),55 d时的VE含量较40 d增加34.29%(P<0.05). 在10~20 d时VE含量下降速率较快,10 d时的VE含量较20 d降低34.32%(P<0.05);30~40 d时VE含量下降速率较慢,30 d时的VE含量较40 d降低13.17%(P>0.05);55~70 d时VE含量下降速率也较为缓慢,55 d时的VE含量较70 d降低4.20%(P>0.05).
2.5 冷藏期间核桃青果类黄酮、总酚(TP)含量和多酚氧化酶(PPO)活性变化
由图5可知,随着贮藏时间的延长类黄酮含量呈“N”形的趋势变化. 在贮藏70 d时的类黄酮含量较高为[(3.99±0.06)mg/g 干重],20 d时的类黄酮含量较低为[(1.50±0.04)mg/g 干重];0~10 d、20~70 d时类黄酮含量升高,10 d时的类黄酮含量较0 d增加8.51%(P>0.05). 20~40 d时类黄酮含量增速较快,40 d时类黄酮含量较20 d增加56.00%(P<0.05). 40~55 d时类黄酮含量增速较慢,55 d时类黄酮含量较40 d增加14.10%(P<0.05). 55~70 d时类黄酮含量增速也较快,70 d时类黄酮含量较55 d增加49.44%(P<0.05). 在10~20 d时类黄酮含量下降速率较快,20 d时的类黄酮含量较10 d降低70.00%(P<0.05).
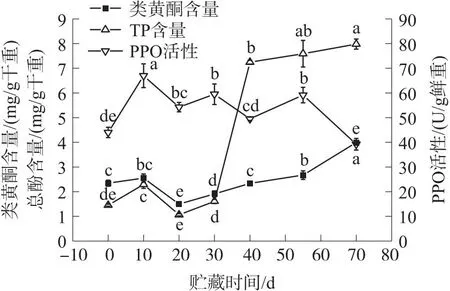
图5 冷藏期间类黄酮、总酚(TP)含量和多酚氧化酶(PPO)活性变化
由图5可知,随着贮藏时间的延长TP含量呈“N”形的趋势变化. 在整个低温贮藏期间70 d时的TP含量较高为[(7.98±0.21)mg/g 干重],20 d时的TP含量较低为[(1.06±0.05)mg/g 干重];0~10 d、20~70 d 时TP含量升高,10 d时的TP含量较0 d增加57.93%(P<0.05). 20~30 d时TP含量增速较慢,30 d时TP含量较20 d增加51.89%(P<0.05). 30~40 d时TP含量增加迅速,40 d时的TP含量是30 d的4.50倍(P<0.05). 40~70 d时TP含量增速变慢,70 d时TP含量较40 d增加10.07%(P<0.05),但70 d时TP含量与55 d的TP含量、55 d时TP含量与40 d的TP含量均未达到显著性差异水平(P>0.05). 在10~20 d 时TP含量下降速率较快,20 d时的TP含量较10 d降低116.04%(P<0.05).
由图5可知,随着贮藏时间的延长PPO活性呈现波浪形的趋势变化. 在10 d时PPO活性达到较高为[(66.97±4.81)U/g 鲜重],70 d时PPO活性较低为[(39.22±2.33)U/g 鲜重]. 0~10 d和20~30 d、40~55 d期间PPO活性升高;10~20 d和30~40 d、55~70 d 期间PPO活性下降. 在0~10 d时PPO活性升高幅度较大,增幅达52.17%(P<0.05). 在20~30 d时PPO活性升高9.66%(P>0.05). 在40~55 d期间PPO活性升高19.45%(P<0.05). 在10~20 d时PPO活性下降幅度为23.45%(P<0.05). 在30~40 d时PPO活性下降幅度为20.13%(P<0.05). 在55~70 d时PPO活性下降幅度较大,降低50.82%(P<0.05).
2.6 各生理指标间相关性分析
由图6可知,贮藏时间与SOD、RS呈现出极显著性负相关关系(r=-0.91、-0.90,P<0.01),表明随着贮藏时间的延长SOD的活性变弱,尤其是在贮藏后期SOD清除核桃青果因呼吸代谢产生的自由基和活性氧的能力降低,核桃青果后期腐烂、霉变程度加剧. 此外,核桃青果采摘后失去光合作用,糖类化合物的合成不能进行,但贮藏期间青果的呼吸作用仍在进行,致使之前通过光合作用合成的糖类逐渐被消耗. 贮藏时间与TP呈显著性正相关(r=0.87,P<0.05),贮藏时间与MDA、SP则呈极显著性正相关关系(r=0.94、0.89,P<0.01),说明随着贮藏时间的延长,核桃青果果仁中的总酚含量在逐渐积累,果仁中的其它物质被氧化或者转化为酚类物质. 在贮藏过程中核桃青果逐渐失去水分,致使细胞在水分胁迫的情况将细胞组织中的游离氨基酸迅速合成可溶性蛋白以提高细胞的保水能力. 核桃青果采摘后,虽然部分有益酶仍在发挥作用来维持果实的生理代谢平衡,然而果实的膜脂过氧化仍在发生,果实中自由基和活性氧的积累引起细胞膜脂过氧化,生成丙二醛,核桃青果逐渐衰老;SOD与MDA、SP呈显著性负相关关系(r=-0.84、-0.83,P<0.05),SOD与TP呈极显著性负相关关系(r=-0.96,P<0.01),表明当果实在受到外界不良环境的胁迫时,细胞组织内的SOD首先发挥作用,以此来清除组织内因代谢失衡而产生的自由基和活性氧来维持机体代谢平衡,随着贮藏时间延长,果实失水加剧,SOD活性下降,贮藏后期主要以合成的可溶性蛋白来维持果实的代谢. 核桃青果采摘后机体代谢处于平衡的边缘,自由基和活性氧的代谢处于失衡状态,自由基作用于脂质发生过氧化反应,氧化终产物为丙二醛. 青果失水加剧引起多酚氧化酶活性降低,细胞组织内多酚物质的氧化中断,加之其它物质的氧化及转化引起总酚含量增加. 此外,SOD与RS呈极显著性正相关关系(r=0.89,P<0.01),说明随着核桃青果失水加剧,SOD的活性下降,机体代谢的失衡导致青果的呼吸作用加强,进一步来维持机体代谢,从而引起细胞组织内原有积累的还原糖被逐渐消耗;POD与PPO呈显著性正相关(r=0.78,P<0.05),说明随着贮藏时间的延长,青果逐渐失去水分,致使POD和PPO的活性降低;MDA与SP、TP呈现出极显著性正相关、显著性正相关(r=0.89,P<0.01、0.79,P<0.05),MDA与RS呈显著性负相关(r=-0.85,P<0.05),表明青果采摘后受到外界环境的胁迫,自由基和活性氧代谢失去平衡,引起膜脂过氧化发生,引起丙二醛含量增加. 此外,青果为减缓水分丧失,加速了游离氨基酸进一步合成可溶性蛋白,因为机体失水加剧,细胞组织内其它物质逐渐被氧化生成多酚物质,加之多酚氧化酶活性下降致使总酚含量增加. 由于机体自由基、活性氧的生成及清除处于失衡状态,青果为使这种状态发生逆转,呼吸作用增强,引起还原糖消耗量逐渐增加;SP与RS呈极显著性负相关(r=-0.95,P<0.01),RS与TP呈显著性负相关(r=-0.76,P<0.05),说明青果在低温贮藏过程中,因受到外界环境的胁迫,体内游离氨基酸合成可溶性蛋白的速度加快,而青果为维持机体代谢的平衡,加强了呼吸作用. 青果一方面受到外界环境的胁迫,另一方面又受到细胞内自由基和活性氧代谢失衡的威胁,最终引起多酚氧化酶活性降低,总酚含量增加.

图6 各指标间的Pearson相关系数
3 讨论

本研究发现RS含量在贮藏过程中呈现升高-下降的趋势变化,究其原因可能是核桃青果在采摘后失去了光合作用,但在贮藏过程中其呼吸作用仍在进行,为了维持植物体代谢平衡,植物体内大分子物质分解成小分子物质以此来进行呼吸作用,因此,在贮藏初期RS含量表现为增加,SP含量则表现为下降. 在贮藏10~70 d时RS含量呈下降趋势,而SP含量则逐渐增加,原因可能是随着贮藏时间延长,植物体内之前合成的还原糖被逐渐消耗,而此时核桃青果处于外界不良环境的胁迫中,为维持机体代谢稳定将体内的游离氨基酸逐步合成可溶性蛋白以对抗外界不良环境的胁迫[27].
核桃青果果仁中因含有类黄酮和总酚物质,在一定程度上可抑制果仁褐变的发生[28]. 本研究发现,在贮藏时间为0~10 d和20~70 d时类黄酮和总酚含量均呈现增加的趋势变化,而在10~20 d时类黄酮和总酚含量均呈现下降的趋势变化,原因可能是贮藏初期酚类物质合成速率高于氧化速率. 贮藏后期类黄酮和总酚含量逐渐增加,一方面可能是POD和PPO活性逐渐变弱,不能进一步将多酚类物质氧化,另一方面可能是因为核桃青果逐渐霉变、腐烂,微生物大量繁殖,果仁中的大分子物质在酶及微生物的作用下逐渐被降解转化为酚类物质[29]. 核桃青果果仁中含有一定量的酚类物质,食用后可提高机体的抗氧化能力及缓解部分炎症[30].
4 结论
低温保存有利于延长核桃青果的贮藏时间,SOD、POD、CAT通过协同效应共同维持植物体内活性氧和自由基代谢平衡. 此外,各生理生化指标之间存在协同、拮抗作用,能较好的维持果实品质. 后期可从一级反应动力学角度出发来预测和模拟鲜食核桃品质变化.
——徐州市青果小作家基地简介

